Raymundo Cervantes-Barriga a, Joaquín Arroyo-Cabrales b, Alejandro H. Marín-Leyva a, Javier Ponce-Saavedra c, Florent Rivals d, e y Tiberio C. Monterrubio-Ricof, *
a Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Biología, Laboratorio de Paleontología, Edif. R Planta baja, Ciudad Universitaria, Francisco J. Múgica s/n, Col. Felícitas del Río, 58030 Morelia, Michoacán, México
b Instituto Nacional de Antropología e Historia, Subdirección de laboratorio y Apoyo Académico, Laboratorio de Arqueozoología “M. en C. Ticul Álvarez Solórzano”, Moneda Núm. 16, Col. Centro, 06060 Ciudad de México, México
c Universidad Michoacana de San Nicolás de Hidalgo, Laboratorio de Entomología “Biol. Sócrates Cisneros Paz”, Edificio B4 2° piso, Ciudad Universitaria, Francisco J. Múgica s/n, Col. Felícitas del Río, 58030 Morelia, Michoacán, México
d Institut Català de Paleoecologia Humana i Evolució Social, Zona Educacional 4, Campus Sescelades URV (Edifici W3), 43007 Tarragona, España
e Universitat Rovira i Virgili, Departamentd’Història i Història de l’Art, Avinguda 35 de Catalunya 35, 43002 Tarragona, España
f Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Biología, Laboratorio de Vertebrados Terrestres Prioritarios, Edificio “R” 2° Piso, Ciudad Universitaria, Francisco J. Múgica s/n, Col. Felícitas del Río, 58030 Morelia, Michoacán, México
*Autor para correspondencia: tmonter2002@yahoo.com.mx (T.C. Monterrubio-Rico)
Recibido: 22 enero 2024; aceptado: 30 enero 2025
Resumen
Los roedores en México representan 49% de los mamíferos y aunque se asume que las perturbaciones no los afectan en comparación con los mamíferos de mayor tamaño, los estudios al respecto son escasos. Se analizó la comunidad de pequeños roedores en los hábitats terrestres de la cuenca de Cuitzeo, los cuales experimentan distintos grados de antropización. Se recolectaron roedores en pastizal-huizache, matorral-pastizal y bosque de pino-encino durante un año, y se caracterizó la estructura de la comunidad vegetal de cada sitio. Se registraron 17 especies de las familias Cricetidae (15), Heteromyidae (1) y Muridae (1). La riqueza y diversidad especifica fue mayor en el pastizal (H´ = 2.43) y menor en el matorral (H´ = 1.02). Sin embargo, la abundancia fue mayor en el matorral (N = 47) y la menor en el pastizal (N = 21). En época invernal se registró mayor riqueza específica (12) y abundancia (N = 62). Los resultados permiten comprender la dinámica estacional de las comunidades de pequeños roedores en escenarios de perturbación de los hábitats naturales. La cuenca de Cuitzeo todavía alberga una riqueza destacable y se constituye en una región para la conservación de pequeños mamíferos.
Palabras clave: Ensamble de roedores; Diversidad; Hábitat; Estacionalidad
Spatial and seasonal analysis of small rodent communities in the Cuitzeo basin
Abstract
Rodents in México represent 49% of the mammals, and although it’s assumed that they are less affected by disturbance in comparison to the larger-sized mammals, studies on the topic are scarce. We analyzed the small rodent communities in the terrestrial habitats of the Cuitzeo basin, which are experiencing different degrees of anthropogenic disturbance. Rodents were collected in the grassland-huizache, scrub-grassland, and pine-oak forest over a year, and the vegetation community structure was characterized at each sampling site. Seventeen species were identified from the following families: Cricetidae (15), Heteromyidae (1), and Muridae (1). Specific richness and diversity were highest in the grassland (H´ = 2.43) and lowest in the scrub (H´ = 1.02). However, the abundance was highest in the scrub (N = 47) and lowest in the grassland (N = 21). The highest specific richness was recorded during the winter (12) as well as abundance (N = 62). The results increase our understanding of the seasonal dynamic of the small rodent communities in scenarios of habitat disturbance. The Cuitzeo basin still harbors noteworthy richness and constitutes a region for small mammal community conservation.
Keywords: Rodent assemblage; Diversity; Habitat; Seasonality
Introducción
Las cuencas, como parte de las regiones naturales y libres de la división política del estado, permiten una adecuada comprensión de la diversidad que se presenta (Aguilar et al., 2010). La cuenca de Cuitzeo al noroeste de Michoacán presenta el segundo lago más grande en el interior de México y junto con sus humedales crea un mosaico de hábitats en la región. Históricamente, esta cuenca presentó cobertura de 12 asociaciones vegetales: 6 categorías en sistemas boscosos (bosque de encino, bosque de pino, bosque de pino-encino, bosque de cedro, bosque de oyamel y bosque mesófilo de montaña), 3 tipos de vegetación no boscoso (mezquital, matorral subtropical y pastizal) y 3 asociados a humedales y cuerpos de aguas (bosque de galería, tular y carrizal) (Madrigal y Guridi, 2009). Sin embargo, la pérdida de vegetación en la cuenca ha aumentado y en la actualidad 55% de la superficie presenta zonas agropecuarias y asentamientos humanos (Bravo et al., 2008; Correa et al., 2014; INEGI, 2023). Con respecto a la fauna, se ha registrado riqueza importante en diversos grupos como insectos y arácnidos (Ponce y Quijano, 2010), peces (Medina y Ortega, 2010), anfibios y reptiles (García y Flores, 2010), aves (Pérez et al., 2002; Villaseñor y Villaseñor, 2010), y más recientemente de mamíferos (Monterrubio et al., 2019); destacando en este último grupo los roedores por su alta riqueza específica.
Por su relevancia ecológica al formar la base de redes tróficas y por sus servicios ambientales como la depredación de semillas, así como rasgos de sus historias de vida como sus altas tasas de natalidad, variación y tolerancia en sus distribuciones y, en general, una notable adaptación a modificaciones al ambiente (Ceballos y Oliva, 2005), hace de los roedores un taxón que permite estudiar cómo varía la estructura local de sus comunidades en función de las características estructurales de la vegetación donde habitan. El entendimiento de estos procesos es fundamental para examinar la respuesta en los ensambles y comunidades de mamíferos ante el escenario cambiante de la cuenca de Cuitzeo, región considerada prioritaria para la conservación de biodiversidad, que experimenta alto impacto humano y efectos del cambio climático (Aguilar et al., 2010; Hernández et al., 2023).
En algunos estados de México como Durango, por ejemplo, Villanueva et al. (2017) evidenciaron cómo 6 especies se asocian a un gradiente de vegetación que va desde zonas boscosas hasta áreas de matorral y pastizal. Peromyscus difficilis y Sigmodon ochrognathus se asociaron con mayor frecuencia a bosques, en cambio P. boylii y P. pectoralis a zonas áridas. Por su parte, P. hooperi y Neotoma leucodon resultaron más tolerantes y se presentan a lo largo del gradiente. En Veracruz se estudió el gradiente de borde al interior de un bosque mesófilo de montaña para observar la zonación por parte de 9 especies de roedores y 1 marsupial. Aunque la riqueza específica fue similar a lo largo de los sitios de estudio, se observó que la distribución es significativa con relación a las tallas, roedores de tallas similares se evitan y roedores de diferentes tallas coexistían en los mismos sitios muestreados (González et al., 2012).
Por otro lado, la distribución y el uso del hábitat por los pequeños roedores también ocurre a nivel específico, ya sea por edad o por sexo. Neotomodon alstoni, por ejemplo, se ha estudiado en 5 hábitats del Ajusco (zacatonal, pradera, bosque, ecotono bosque-zacatonal y ecotono bosque-pradera) y se demostró que las hembras prefieren el zacatonal, y los machos los bosques y ecotonos; las hembras buscan sitios de mejor calidad que los machos y estos últimos muestran patrones de distribución más en relación con la densidad de hembras que con la calidad del microhábitat (Rojas et al., 2012).
Para Michoacán, un análisis sobre la distribución de 48 especies de roedores en las regiones fisiográficas del estado registró que cada región muestra diferencias significativas en relación con la abundancia de roedores, siendo el Cinturón Volcánico Transmexicano el de mayor diversidad, seguida del Altiplano Mexicano, destacándose que las 2 provincias son las de mayor diversidad, a pesar del alto número de asentamientos humanos en ellas (Sánchez et al., 2005).
El objetivo general del presente estudio fue evaluar la riqueza y diversidad de roedores en 3 hábitats: pastizal, matorral subtropical y bosque de pino-encino en la cuenca de Cuitzeo, examinando su variación entre épocas del año, además de caracterizar la vegetación de los hábitats.
Materiales y métodos
La cuenca de Cuitzeo se ubica principalmente en el centro-norte de Michoacán, compartiendo una porción menor del extremo norte de la cuenca con el estado de Guanajuato. Se sitúa en un intervalo de elevación de 1,750 a 2,359 m snm y presenta 3,675 km² de superficie (Bravo et al., 2008). Actualmente, 6% de su superficie es ocupada por asentamientos humanos y 8% por cuerpos de agua. Los campos de cultivo, pastos inducidos y plantaciones forestales representan 51%. Los tipos de vegetación de la cuenca seleccionados en este estudio representan 1% para pastizales naturales, 14% matorrales y 20% bosques abiertos y cerrados (Correa et al., 2014). La cuenca presente clima templado en 3 subgrupos: semifrío (en partes altas de las montañas del sur), semicálido (a los alrededores del lago de Cuitzeo) y subhúmedo (en la mayor parte de la cuenca). La temperatura media anual va de los 14 a los 17 °C y en las partes altas de la cuenca puede ser de 10 °C. La precipitación en las partes altas oscila entre 1,200 a 1,500 mm; en la parte media y baja entre 800 y 1,000 mm (INEGI, 2023).
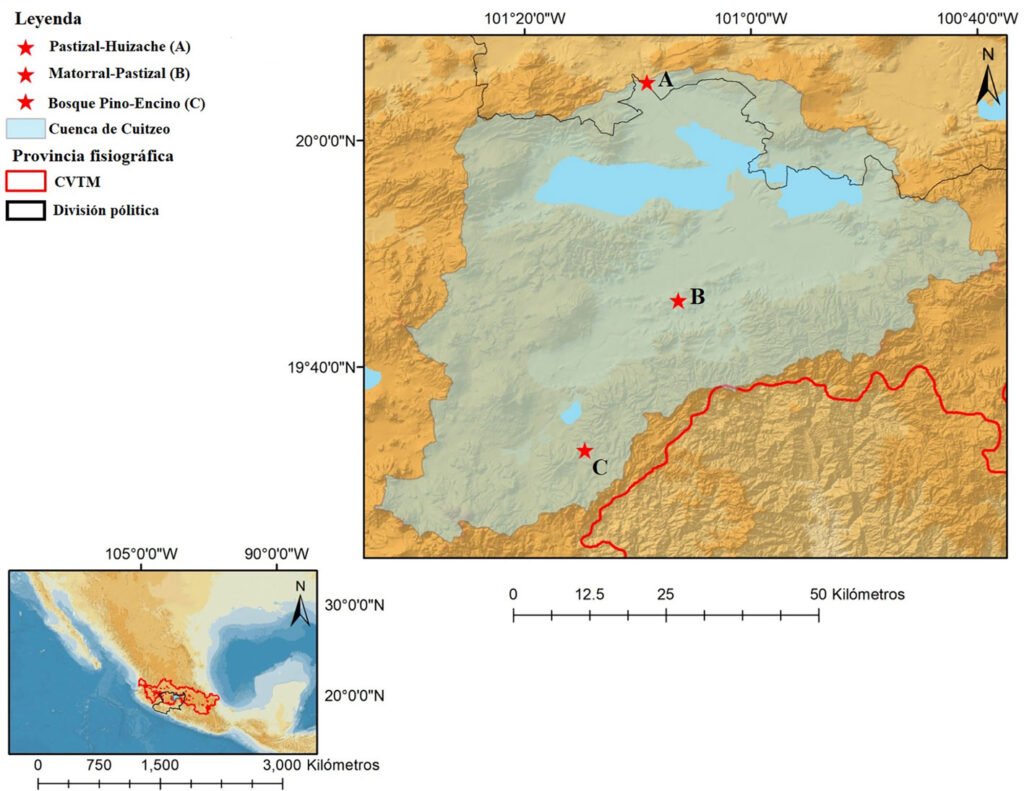
Los sitios seleccionados para el muestreo fueron: al norte, el área a menor elevación, donde predomina el pastizal, el sitio se conoce como “La Cinta” (1,838 m snm). A elevación intermedia y en el centro de la cuenca, el sitio “Misión del Valle”, localizado en una zona suburbana con vegetación que presenta ecotonos de extensos matorrales y pastizales (1,896 m snm), y al sur, un sitio de bosque con vegetación de pino-encino conocido como “La Planta” (2,132 m snm) (fig. 1).
De acuerdo con información de temperatura y precipitación de localidades cercanas a las de este estudio, las temperaturas más altas en la región se presentan principalmente en los meses de abril y mayo (temporada de secas); mientras que los meses con mayores precipitaciones (temporada de húmedas) se concentran en julio, agosto y septiembre. El resto del año presenta bajas temperaturas y precipitaciones (temporada de secas frías) (Carlón y Mendoza, 2007).
Se efectuaron 4 salidas de campo durante un ciclo anual, las 3 primeras en 2021 y la última en 2022. Los roedores se capturaron con trampas Sherman. El primer muestreo (secas) inició del 30 de abril al 11 de mayo con esfuerzo de 60 trampas (540 noches/trampa), sin embargo, dada la baja captura se decidió aumentar un día más de recolecta en las siguientes temporadas. El segundo muestreo (lluvias) fue del 30 de agosto al 13 de septiembre con un esfuerzo 720 noches/trampa. Durante la temporada de secas frías se llevaron a cabo 2 salidas; una posterior a la temporada de lluvias (post-lluvias) durante el 26 de noviembre a 10 de diciembre con 70 trampas (840 noches/trampa), no obstante, las capturas aun seguían siendo pocas por lo que se hizo un último muestreo (secas frías), del 27 de enero al 10 de febrero de 2022 con 90 trampas (1,068 noches/trampa) con el fin de lograr tener un inventario más completo. El esfuerzo total acumulado en el estudio fue de 3,168 noches/trampa. La dispersión espacial del sistema de trampeo incluyó líneas de trampas con separación de 10 m, las cuales se colocaron antes de la puesta del sol y se revisaron al día siguiente por la mañana. El cebo consistió de una mezcla de maíz triturado y esencia de vainilla, el cual se encapsuló en una rejilla metálica de 3 cm³ colocada dentro de la trampa. Los roedores capturados se sacrificaron con pentobarbital sódico, siguiendo los lineamientos de la Sociedad Americana de Mamíferos (Sikes, 2016) y las recomendaciones convencionales de recolección de datos sugeridas por Romero et al. (2007).
Los resultados presentados en este artículo forman parte de un proyecto en el que también se analiza la alimentación y su efecto sobre la dentición de los roedores, por lo que fue necesario sacrificar a los ejemplares. Los roedores recolectados se depositaron para resguardo en el Laboratorio de Mastozoología de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), donde como parte de su identificación se comparó con ejemplares existentes en la colección, además del uso de claves (Godinez y Guerrero, 2014; Mammal Diversity Database, 2024; Núñez y Pastrana, 1990). Se utilizó el catálogo nomenclatural de Ramírez et al. (2014) y se atendieron las modificaciones recientes para Peromyscus maniculatus (ahora P. labecula), P. boylii (ahora P. kilpatricki) y P. melanophrys (ahora P. zamorae) (Bradley et al., 2017, 2019; López et al., 2019). La recolecta científica se efectuó al amparo del permiso especial clave SGPA/DGVS/02243/22.
La caracterización de la vegetación se hizo en el estrato herbáceo mediante 5 cuadrantes de 5 m², cada cuadrante con 5 unidades de muestreo de 1 m² (25 unidades en total, por cada sitio y para cada estación), distribuidas en arreglo “5 de oros”, una en el centro y las demás en las esquinas (Senasica, 2024). Se identificaron familias y géneros, y se registró su abundancia y cobertura horizontal en porcentaje. La determinación taxonómica de las plantas se limitó a género debido al estado fenológico de las plantas en algunas estaciones, se utilizó el término morfotipo para las plantas solo identificadas hasta familia.
Para la vegetación se describió la estructura general en los niveles taxonómicos de familia y género para cada sitio y época del año incluyendo composición y abundancias.
Para los roedores se analizó la riqueza y abundancia para cada localidad, época de recolecta y para todo el año. Para evaluar la relación entre la riqueza de especies en función del esfuerzo de muestreo, se elaboraron curvas de rarefacción para cada sitio que permitieron estimar la eficiencia del muestreo utilizando el acumulado por individuos (Chao et al., 2014, 2016). Posteriormente, se estimó la completitud del muestreo a través de las estimaciones no paramétricas de riqueza de Chao 2 y bootstrap. Se elaboraron curvas de rango-abundancia para describir las relaciones de abundancia entre las especies y determinar las dominancias para cada localidad y época del año.
Se calcularon los índices de diversidad de Shannon-Wiener (H´) y dominancia Simpson (D), tanto por sitio de estudio como por temporada. Se utilizó la prueba de t modificada por Hutchenson (1970) para probar las diferencias estadísticas, se incluyó además el cálculo de los límites de confianza (LC) a 95% por el método de percentiles. Para calcular la equitatividad de las especies se usó el índice de equitatividad de Pielou (J). Para conocer el grado de semejanza entre comunidades se usó el índice de similitud de Jaccard para composición de especies y el índice de Bray-Curtis para considerar la abundancia en la comparación (Magurran, 2004).
Con el fin de evaluar posibles diferencias en la composición de especies en relación con los hábitats, se aplicó un análisis de las similitudes entre comunidades (Anosim), con 10,000 permutaciones y disimilitud de Bray-Curtis. Todos los análisis antes mencionados se hicieron con el Software Past 4.12 (Hamer et al., 2001).
Resultados
La comunidad vegetal durante un ciclo anual se caracterizó por presentar 31 familias y 105 géneros de plantas en una muestra de 15,060 individuos del estrato herbáceo, de los que 51% correspondió a la asociación pastizal-huizache. El 39% se registró para matorral-pastizal y 10% en pino-encino.
En la asociación pastizal-huizache predominó la familia Poaceae, con abundancia relativa (AR) de 80% y cobertura horizontal relativa (CH) de 86%. Destacan los géneros Chloris (AR = 44%; CH = 51%), Paspalum (AR = 12%; CH = 3%) y Distichlis (AR = 9%; CH = 22%), esas proporciones fueron constantes durante todo el año. En el estrato arbóreo destaca el huizache (Vachellia sp.).
Tabla 1
Especies registradas y sus abundancias (absoluta y relativa = tasas de captura) en 3 asociaciones vegetales de la cuenca de Cuitzeo en un ciclo de muestreo anual. S = Secas; H = húmedas; PLL = posterior a lluvias; SF = secas frías.
| Especie | Pastizal-huizache (1,838 m snm) | Matorral-pastizal (1,896 m snm) | Pino-encino (2,132 m snm) | Subtotales (tasa de captura) | |||||||||
| Heteromys irroratus | 0 | 2 | 0 | 0 | 0 | 1 | 0 | 7 | 0 | 0 | 0 | 0 | 10 (0.31) |
| Baiomys taylori | 0 | 1 | 0 | 3 | 1 | 1 | 3 | 28 | 0 | 0 | 0 | 0 | 37 (1.16) |
| Baiomys musculus | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (0.063) |
| Sigmodon hispidus | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (0.063) |
| Sigmodon mascotensis | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1(0.031) |
| Oligoryzomys fulvescens | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 2 (0.063) |
| Peromyscus labecula | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1(0.031) |
| Peromyscus melanotis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1(0.031) |
| Peromyscus difficilis | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 4 | 5 | 12 (0.37) |
| Peromyscus hylocetes | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 (0.063) |
| Peromyscus kilpatricki | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 4 (0.12) |
| Peromyscus pectoralis | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (0.063) |
| Peromyscus gratus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 1 | 4 (0.12) |
| Peromyscus zamorae | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 2 (0.063) |
| Reithrodontomys sumichrasti | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 5 | 6 (0.18) |
| Reithrodontomys fulvescens | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 2 (0.063) |
| Mus musculus | 0 | 3 | 1 | 1 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 8 (0.25) |
| Submuestra por sitio (%) | 21 (21.4) | 47 (47.9) | 30 (30.6) | 98 (100%) | |||||||||
| Riqueza de especies por sitio | 11 | 6 | 10 | 17 | |||||||||
| Tasa de captura/área | 1.98 | 4.45 | 2.84 | 3.09 | |||||||||
| Especies exclusivas por sitio | 3 | 0 | 5 | 8 |
Tabla 2
Parámetros de riqueza, abundancia (en paréntesis) y tasa de captura de la comunidad de roedores en 3 asociaciones vegetales en función a la época.
| Secas | Húmedas | Posterior a lluvias | Secas frías | |
| Pastizal-huizache | 1-(1)-0.56 | 6-(10)-4.1 | 1-(1)-0.3 | 6-(9)-2.5 |
| Matorral-pastizal | 3-(4)-2.2 | 2-(2)-0.83 | 2-(4)-1.4 | 4-(37)-10.4 |
| Pino-encino | 2-(2)-1.1 | 1-(1)-0.42 | 5-(11)-3.9 | 6-(16)-4.5 |
| Esfuerzo de muestreo/trampas-noche | 540 | 720 | 840 | 1,068 |
| Especies | 5 | 6 | 7 | 12 |
| Especies exclusivas | 1 | 1 | 2 | 6 |
| Sub muestra estacional (%) | 7 (7.1) | 13 (13.2) | 16 (16.3) | 62 (63.2) |
| Tasas de captura general/estación | 1.30 | 1.81 | 1.90 | 5.81 |
El matorral-pastizal está integrado proporcionalmente por las familias Asteraceae (18%), Poaceae (16%), Fabaceae (14%) y Euphorbiaceae (11%). Difiere del pastizal al presentar variación estacional en la estructura y composición de las plantas en el año. Por ejemplo, en secas Lolium presentó la mayor abundancia y cobertura horizontal (AR = 43%; CH = 32%); en temporada húmeda Marina (AR = 29%; CH = 21%), Euphorbia (AR = 22%; CH = 13%) y Adenophyllum (AR = 20%; CH = 19%); en la temporada posterior a lluvias Simsia (AR = 20%; CH = 20%) y Eragrostis (AR = 16%; CH = 16%), y en secas frías, una especie de gramínea (AR = 42%; CH = 55%), que por su fenología no pudo ser identificada. También se presentaron elementos aislados de Opuntia.
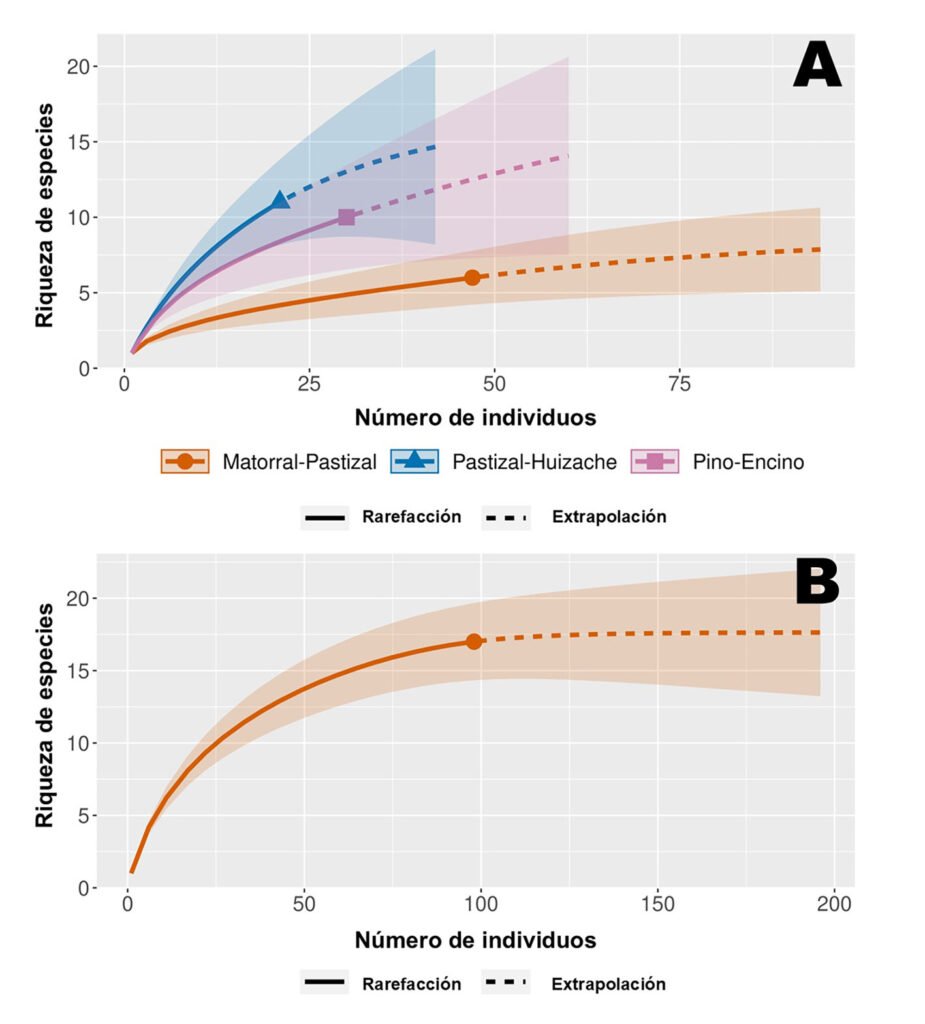
Figura 2. A, Curvas de rarefacción de riqueza de especies en función de las abundancias de roedores en sitios de colecta; B, curva de rarefacción con riqueza de especies en función abundancias de roedores colectadas durante el ciclo anual en los 3 sitios.
La vegetación en el área de pino-encino se caracterizó en el estrato arbóreo por la presencia de Pinus y Quercus. El estrato herbáceo se caracterizó por el predominio de las familias Poaceae, Rosaceae, Asteraceae, Oxiladaceae, Fabaceae, Anacardiaceae, Pteridaceae y Cyperaceae con 78% de la muestra total. El género Rubus (AR = 29%; CH = 13%) predominó en secas, mientras que en húmedas fue Oxalis (AR = 31%; CH = 9%) y Centella (AR = 19%; CH = 17%); en la temporada post-lluvias (AR = 19%; CH = 11%) y secas frías (AR = 27%; CH = 13%) fueron macollos de gramíneas que carecían de espiga por lo que no se identificaron, posiblemente del género Microstegium (apéndice 1).
La muestra de roedores capturados incluyó 98 individuos. Los ejemplares se identificaron como 16 especies nativas y Mus musculus (introducida), pertenecientes a 7 géneros en las familias Cricetidae (15), Heteromyidae (1) y Muridae (1) (tabla 1).
Con base en la curva de rarefacción, se interpreta el esfuerzo de muestreo como suficiente en registrar la riqueza esperada de los 3 sitios; con una cobertura de la muestra de 93% en matorral-pastizal, 83% en el bosque de pino-encino y 72% en pastizal-huizache (fig. 2A). A nivel regional, según los estimadores Chao 2 y bootstrap, la riqueza se espera entre 18-19 especies, solo 2 por encima de la riqueza observada, lo que permite asumir un muestreo de inventario de especies de roedores para la zona suficientemente completo, y que se corrobora con una cobertura de muestra total de 97% en la curva de rarefacción (fig. 2B). Siendo en el pastizal-huizache y en el bosque de pino-encino donde existe mayor oportunidad de registrar otras especies.
La mayor riqueza de especies se observó en el pastizal-huizache, seguido de la asociación de pino-encino y la asociación matorral-pastizal, y en este mismo orden las abundancias se comportaron de menor a mayor (tabla 1; fig. 3A). En relación con la temporada de recolecta, la riqueza y abundancia en secas es en la que se obtuvo la menor cantidad de ejemplares. Posteriormente, se incrementó el éxito de captura para las temporadas siguientes hasta llegar a secas frías (tabla 2); sumando los datos de riqueza y abundancia de las 3 comunidades se observa un incremento en la complejidad (fig. 3B). En las temporadas invernales (secas frías) se destaca la mayor abundancia y tasas de captura de todo el estudio, particularmente en el matorral-pastizal. También se registró la mayor riqueza de especies (n = 12), la mayor abundancia absoluta (62 individuos) y la mayor tasa de captura de 5.8/100 trampas-noche (tabla 2).
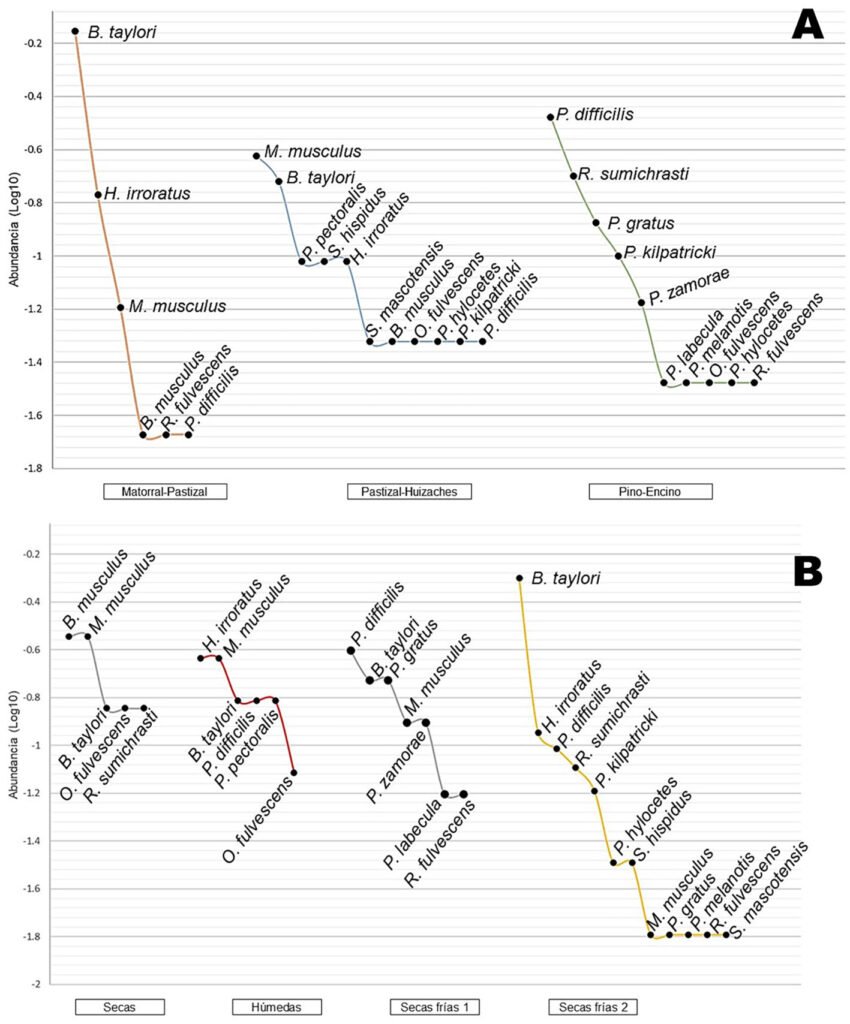
Figura 3. A, Curvas de rango-abundancia entre los sitios de estudio; B, curvas de rango-abundancia entre las temporadas del año de estudio sumando los 3 hábitats.
Baiomys taylori fue la especie más abundante, representó 33% del total de individuos recolectados, con los valores más altos en la temporada de secas frías, se presentó durante todo el año principalmente en matorral-pastizal (n = 33), seguido de pastizal-huizache (n = 4). La especie que resultó con mayor abundancia en el hábitat de pastizal-huizache fue Mus musculus, que también se registró en matorral-pastizal y presente durante todo el año. Para el bosque de pino-encino las especies con más individuos fueron Peromyscus difficilis y Reithrodontomys sumichrasti, la primera se encontró todo el año exceptuando en secas, además destaca por ser la única registrada para las 3 localidades. Por el contrario, las especies Peromyscus labecula, Peromyscus melanotis, y Sigmodon mascotensis, estuvieron representadas por solo 1 individuo; mientras que Baiomys musculus, Oligoryzomys fulvescens, Peromyscus hylocetes, Peromyscus zamorae, Peromyscus pectoralis, Reithrodontomys fulvescens y Sigmodon hispidus contaron con 2 ejemplares, estas especies en conjunto representan 59% de la riqueza total del estudio (fig. 3; tabla 1).
Tabla 3
Valores con el índice de diversidad de Shannon-Wiener (H´), índice dominancia de Simpson (D) e índice de equidad de Pielou (J) para la comunidad de roedores de la cuenca de Cuitzeo. Prueba de t modificada por Hutchenson H´/D para diferencias significativas (*).
| Prueba de t modificada por Hutchenson | ||||||
| H´ | D | J | Matorral-pastizal | Pastizal-huizache | Pino-encino | |
| Matorral-pastizal | 0.97 | 0.52 | 0.54 | D = 3.8822E-05* | D = 0.00042* | |
| Pastizal-huizache | 2.19 | 0.13 | 0.91 | H´ = 3.035E-06* | D = 0.3657 | |
| Pino-encino | 1.93 | 0.18 | 0.84 | H´ = 6.886E-05* | H´ = 0.276 |
Mediante el índice de diversidad de Shannon-Wiener (H´) y la equitatividad de Pielou (J), con límites de confianza (LC) de 95%, se concluye que el hábitat que presentó mayor diversidad y equitatividad en la comunidad de pequeños roedores fue el pastizal-huizache con H´ = 2.19 (LC = 1.69-2.29) y J = 0.91 (LC = 0.81-0.96), en cambio matorral-pastizal fue poco diverso con H´ = 0.97 (LC = 0.66-1.22) y su equitatividad fue las más baja con J = 0.54 (LC = 0.42-0.70); el bosque de pino-encino presento una diversidad de H´ = 1.93 (LC = 1.68-2.13) y J = 0.84 (LC = 0.74-0.92). La prueba de t modificada por Hutchenson no muestra diferencias significativas entre pastizal-huizache y pino-encino, pero sí entre matorral-pastizal con respecto a las otras 2 comunidades. Este efecto también se observa con el cálculo de los límites de confianza en donde solamente en pastizal-huizache y pino-encino existe traslape tanto en H´ como en J. En relación con la temporada de recolecta y como se observa en la tabla 1, en algunos casos solo se capturaron 1 o 2 ejemplares por sitio y temporada, por tanto, conocer la diversidad de los sitios en función de las temporadas no es posible. Aun así, si se toma la sumatoria de los 3 hábitats por época de recolecta se observa poca variación de la diversidad: secas, H´ = 1.55 (LC = 0.79-1.55); húmedas H´ = 1.73 (LC = 1.26-1.73); post lluvias, H´ = 1.84 (LC = 1.35-1.87) y finalmente secas frías, H´ = 1.75 (LC = 1.41-1.99), sin diferencias significativas entre temporadas del año y traslape de los intervalos de confianza en todos los casos.
Por su parte, con el índice de dominancia de Simpson (D) el valor más alto se registró en matorral-pastizal con D = 0.52 y su dominancia con la especie B. taylori es diferente a los otros 2 sitios, en donde no se observaron especies dominantes (tabla 3).
De acuerdo con el índice de similitud de Jaccard para la composición de la comunidad de roedores, el matorral-pastizal y pastizal-huizaches presentan mayor similitud, a diferencia de la comparación entre matorral-pastizal y bosque pino-encino con menor similitud; considerando las abundancias, este patrón se repite según el índice de Bray-Curtis (tabla 4). Con el análisis de similitud entre comunidades (Anosim) se estima diferencias significativas (R = 0.35; p = 0.008) en la composición y abundancia entre los hábitats matorral-pastizal y bosque de pino-encino (p = 0.030) (fig. 4).
Tabla 4
Índice de similitud de Jaccard (ISJ) y Bray-Curtis (BC) para la comunidad de roedores en las 3 asociaciones vegetales examinadas de la cuenca de Cuitzeo.
| Matorral-pastizal | Pastizal-huizache | Pino-encino | |
| Matorral-pastizal | 1 | BC = 0.32 | BC = 0.05 |
| Pastizal-huizache | ISJ = 0.41 | 1 | BC = 0.15 |
| Pino-encino | ISJ = 0.14 | ISJ = 0.23 | 1 |
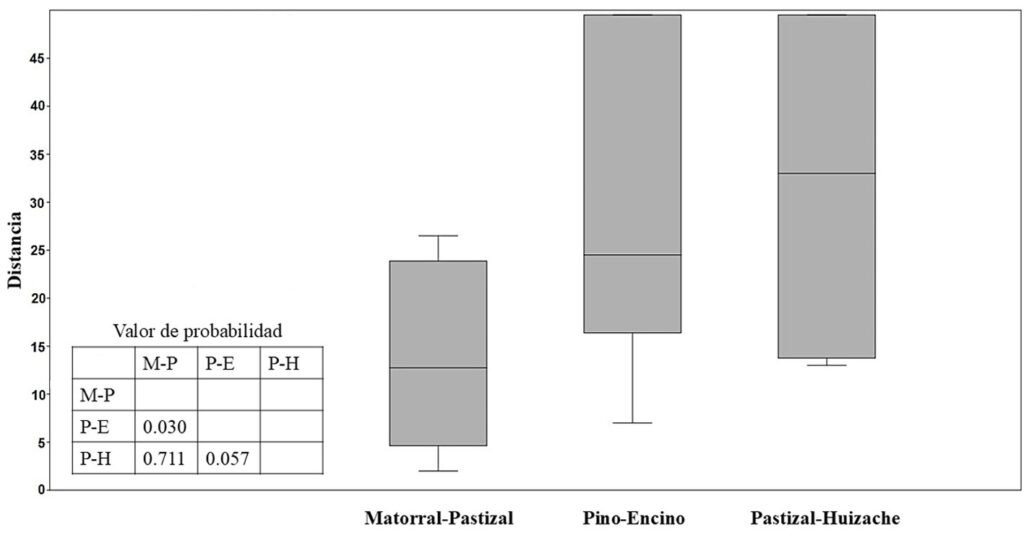
Figura 4. Boxplot y valores de probabilidad del análisis de similitudes (Anosim) entre las 3 asociaciones vegetales para la comunidad de roedores en de la cuenca de Cuitzeo (R = 0.35; p = 0.008). M-P = Matorral-pastizal, P-E = bosque de pino-encino y P-H = pastizal-huizache.
Discusión
Los resultados obtenidos ofrecen 4 aspectos emergentes: riqueza de especies, baja abundancia general, mayores abundancias invernales y baja similitud relativa entre los ambientes muestreados. Recientemente, se evaluó la mastofauna que habita en la cuenca de Cuitzeo. En total se registraron 68 especies de mamíferos, con 28 del orden Rodentia, que representaron 54% de las especies registradas en Michoacán (Monterrubio et al., 2019). Con el presente trabajo se suman al registro de Rodentia para la región a B. musculus, P. pectoralis y O. fulvescens, especies que están presentes en otras áreas del eje Neovolcánico y el bajío (Sánchez et al., 2005), pero que no habían sido registradas para la cuenca. Al incluir estos nuevos registros para la cuenca, en esta zona se presenta 60% de las especies de roedores documentadas para Michoacán (Monterrubio et al., 2014). Otro aspecto notable, es que el esfuerzo de muestreo desarrollado proporcionó el registro del mayor número de especies (16) en cualquier estudio efectuado para la cuenca (Apéndice 2). Esta riqueza sobresale también en el contexto nacional, ya que los intervalos de riqueza específica reportados suelen estar entre 5 y 18 especies (Apéndice 3), generalmente se observan valores bajos en áreas pequeñas y aumentan cuando el estudio es a escala regional.
En contraste, fue sorpresiva la baja abundancia general, con solo 98 registros, en comparación con otros estudios de diferentes regiones del país, en los que con esfuerzos entre 455 y 28,242 noches/trampa se obtienen capturas superiores a 100 individuos (Apéndice 3). Una razón probable de la baja abundancia para la mayoría de especies puede ser la disminución de las precipitaciones en la región. Con base en los datos históricos y comparando con los últimos años, se ha experimentado sequía en algunas partes de la cuenca (Hernández et al., 2023), para lo que probablemente hayan respondido las poblaciones de roedores con menor reproducción o migración. Otra evidencia es la cifra de capturas del muestreo de la temporada de secas frías (fig. 3B) y posterior a la época de lluvia de la cuenca, dado que se registró un incremento notable en el número de capturas, tanto en riqueza específica como en abundancia. Este fenómeno es similar al observado en otros estudios (Flores y Vázquez, 2016; Zaragoza et al., 2022). El aumento poblacional en esta época ocurrió para B. taylori, P. difficilis y H. irroratus; en las primeras 2 especies ya se ha registrado aumento en densidades poblacionales en temporadas frías del año (Eshelman y Cameron, 1987; Fernández et al., 2010), mientras que el aumento de H. irroratus, según antecedentes, se reporta de agosto a noviembre (Dowler y Genoways, 1978).
El índice de diversidad no muestra variación significativa entre épocas del año, esto podría indicar que la diversidad es explicada en mayor medida por el hábitat y que genera niveles importantes de estabilidad reflejada en los valores de equitatividad obtenidos (entre 0.57 y 1), lo cual también sugieren Luévano et al. (2008), particularmente en zonas de matorrales.
Las 3 comunidades de roedores examinadas muestran en general baja similitud, y parece observarse una posible influencia de la estratificación de la vegetación. En general, a mayor complejidad estructural de la vegetación con presencia del estrato arbóreo, se observa mayor riqueza de especies. Este patrón se presentó para el pastizal-huizache y el bosque de pino-encino en donde no existió diferencia significativa de diversidad y tampoco hubo traslape de intervalos de confianza. En cambio, la abundancia de roedores fue mayor en el matorral-pastizal y en el pino-encino, en ambos hábitats se observa mayor riqueza de la vegetación a nivel herbáceo. El patrón de aumento en las abundancias para ambientes de mayor heterogeneidad también lo encontraron Morales et al. (2019) y contrasta con la homogeneidad del estrato herbáceo y baja densidad de roedores registrada para el pastizal-huizache de este estudio. Todavía no es clara la relación entre la estructura de la comunidad de roedores y la conectividad de los hábitats. La dinámica de la cuenca de Cuitzeo implica un aumento de la colonización humana y más actividades agropecuarias en las últimas décadas (Escamilla y Aguilar, 2010). Dicha expansión ha degradado y fragmentado los hábitats originarios, hasta llegar a tener 6% con asentamientos humanos y 50% de la cuenca destinado a zonas de cultivo y pastoreo (INEGI, 2023). Con este panorama, es posible que la estructura y composición de las comunidades de pequeños roedores observada puede deberse al grado de aislamiento diferenciado entre los distintos hábitats. Los pastizales presentan conectividad con los extensos cultivos, permitiendo la cohesión espacial de algunas especies, mientras que las zonas de matorral y arbóreas presentan índices muy bajos de conectividad (Correa et al., 2014). El aislamiento en estos hábitats, principalmente matorrales, puede disminuir a los depredadores, lo que se ve reflejado en el aumento de poblaciones de roedores más generalistas y menor riqueza especifica (Young et al., 2015); este proceso puede estar presente en el sitio de matorral-pastizal. Aunque en el caso de las zonas montañosas de la cuenca con bosques, todavía parece existir mayor conectividad y esta se ve reflejada en la riqueza de la mastofauna (Monterrubio et al., 2019).
El pastizal-huizache se extendía originalmente en forma extensa (López et al., 2010), ahora es un ambiente con elevada fragmentación y es quizás uno de los hábitats más amenazados por el elevado establecimiento de asentamientos humanos y campos de cultivo. Sin embargo, la diversidad de roedores observada en este hábitat parece todavía estar explicada por la vegetación más que por la antropización vecina. Los 3 géneros de plantas herbáceas más representativos de la zona (Chloris, Distichlis y Panicum) son gramíneas no invasivas y componentes de la vegetación original (Herrera y Pámanes, 2010). Peromyscus pectoralis, Sigmodon hispidus y S. mascotensis resultaron exclusivas a esta localidad entre los 3 hábitats estudiados, y parecen coincidir con ambientes en que se han registrado regularmente, que incluyen aridez relativa, pastizales y ambientes rocosos (Baccus et al., 2009; Fleharty y Olson, 1969; Martínez et al., 2017). En hábitats similares la exclusividad reportada suele ser de 1 a 2 especies (Cimé et al., 2010; Elizalde et al., 2014; Hernández et al., 2012), lo cual coincide con lo registrado en este trabajo. Además, la cercanía con sembradíos parece proveer de alimento, lo que facilita la coexistencia entre especies, ya que los roedores también consumen materiales de los cultivos, como se ha documentado en plantaciones de caña (Peña et al., 2009).
Para el matorral-pastizal, la baja diversidad de roedores podría explicarse en parte por la poca conectividad y por la biología de la comunidad vegetal, ya que los géneros más abundantes están asociados con ambientes alterados. En temporada seca el género herbáceo Lolium (Poaceae), especie introducida en México (Herrera y Pámanes, 2010), fue la más abundante y fue en esta temporada cuando se recolectaron pocos roedores (n = 4), 2 de los cuales fueron M. musculus, especie que puede considerarse indicadora de deterioro del hábitat. En relación con las plantas de temporadas restantes del año, son géneros nativos con distribución principalmente en matorrales como Marina (M. cf. nutans) y Adenophyllum, y junto con Euphorbia (E. cf. dentata), Simsia (S. cf. foetida) y Eragrostis (E. cf. intermedia), pero crecen en afinidad a lugares ruderales con tendencia a disturbios (Rzedowski y Rzedowski, 2005). En los recorridos de campo se observaron asentamientos humanos e infraestructura inconclusa, indicativa de la expansión de la mancha urbana, así como fauna doméstica, perros principalmente, caminando en búsqueda de alimento entre la vegetación.
El registro de B. taylori, especie que se conoce con una mayor densidad de individuos distribuyéndose en matorrales y zonas áridas (Packard, 1960), coincidió con el hábitat de recolecta. Este cricétido junto con H. irroratus podrían ilustrar su resiliencia a los ambientes perturbados, tendencia que se ha reportado para mamíferos de tallas pequeñas, particularmente en roedores y murciélagos (Dirzo et al., 2014), aunque también pudiesen ser evidencia de que el hábitat de matorral-pastizal en la región experimenta un proceso de homogeneización de la comunidad de roedores.
Por su parte, el bosque de pino-encino (La Planta) solo se diferencia con el pastizal-huizache por tener una especie menos (la invasora M. musculus); pero en índices cuantitativos la similitud fue baja. Este hábitat, donde cobertura y dominancia de biomasa vegetal corresponden a Pinus y Quercus (Gómez-Tagle et al., 2015), no se recolectaron especies de roedores introducidas. O. fulvescens, R. sumichrasti y las especies del género Peromyscus se reportan en bosques conservados y áreas con corrientes de agua cercanas (Fernández et al., 2010; Spencer y Cameron, 1982), lo cual coincide en lo general con este estudio. Sin embargo, aunque parece un espacio conservado por la estructura de su comunidad de roedores y su flora, también presenta cambio en el uso de suelo en los alrededores, principalmente por expansión del cultivo del aguacate y arándano. Aquí se presentaron 5 especies exclusivas, y coincide con lo registrado en otros estudios en ambientes semejantes en los que la exclusividad de especies va de 1-4 (Flores y Vázquez, 2016; Mendoza y Horváth, 2013; Villanueva, et al., 2017; Zalapa et al., 2012).
Es importante continuar con muestreos con el fin de conocer mejor la dinámica estacional y espacial de las poblaciones de roedores en los distintos ambientes, ya que cada hábitat difiere de nivel de fragmentación y extensión en la cuenca, sobre todo en esta región considerada de importancia para la conservación de la biodiversidad en todos los niveles (Aguilar et al., 2010). Finalmente, en el centro de México desaparecen rápidamente los hábitats naturales, es urgente utilizar la información generada por múltiples inventarios para la priorización y establecimiento de áreas a restaurar y para conservar espacios representativos de todos los hábitats, especialmente donde habitan especies endémicas como lo es Peromyscus ensinki (Bradley et al., 2021). En la cuenca debe estudiarse el grado de tolerancia que especies listadas en categorías de riesgo tienen a la perturbación y como coexisten con especies introducidas, anticipando y examinando los riesgos potenciales de enfermedades zoonóticas, sin olvidar que el bienestar económico no puede lograrse en un entorno sin servicios ambientales y biodiversidad (Villafán et al., 2021; Young et al., 2014).
Referencias
Aguilar, V., Kolb, M., Koleff, P. y Urquiza-Haas, T. (2010). Las cuencas de México y su biodiversidad: una visión integral de las prioridades de conservación. En H. Cotler, A. Garrido, N. Luna, C. Enríquez y M. L. Cuevas (Eds.), Las cuencas hidrográficas de México. Diagnóstico y priorización (pp. 142–151). Ciudad de México: Instituto Nacional de Ecología.
Aragón, E. E., Garza, A. y Cervantes, F. A. (2009). Estructura y organización de los ensambles de roedores de un bosque de la Sierra Madre Occidental, Durango, México. Revista Chilena de Historia Natural, 82, 523–542. http://dx.doi.org/10.4067/S0716-078X2009000400007
Baccus, J. T., Hardwick, J. M., Huffman, D. G. y Kainer, M. A. (2009). Seasonal trophic ecology of the white-ankled mouse, Peromyscus pectoralis (Rodentia: Muridae) in central Texas. Texas Journal of Science, 61, 97–118.
Barragán, F., Lorenzo, C., Morón, A., Briones, M. A. y López, S. (2010). Bat and rodent diversity in a fragmented landscape on the Isthmus of Tehuantepec, Oaxaca, México. Tropical Conservation Science, 3, 1–16. https://doi.org/10.
1177/194008291000300101
Bradley, R. D., Francis, J. Q., Platt, R. N., Soniat, T. J., Álvarez, D. y Lindsey, L. L. (2019). Mitochondrial DNA sequence data indicate evidence for multiple species within Peromyscus maniculatus. Lubbock, TX: Museum of Texas Tech University.
Bradley, R. D., Ordóñez, N., Ceballos, G., Rogers, D. S. y Schmidly, D. J. (2017). A new species in the Peromyscus boylii species group (Cricetidae: Neotominae) from Michoacán, México. Journal of Mammalogy, 98, 154–165. https://doi.org/10.1093/jmammal/gyw160
Bradley, R. D., Ordóñez, N., Thompson, C. W., Wright, E. A., Ceballos, G., Kilpatrick, C. W. et al. (2021). Two new species of Peromyscus (Cricetidae: Neotominae) from the Transverse Volcanic Belt of México. Journal of Mammalogy, 103, 255–274. https://doi.org/10.1093/jmammal/gyab128
Bravo-Espinosa, M., García-Oliva, F., Ríos-Patrón, E., Mendoza-Cantú, M. E., Barrera-Camacho, G., López-Granados, E. et al. (2008). La cuenca del lago de Cuitzeo: problemática, perspectivas y retos hacia su desarrollo sostenible. Morelia Michoacán, México: Consejo Estatal de Ciencia y Tecnología de Michoacán (COECYT). https://doi.org/10.22201/ciga.9789707035782p.2008
Carlón, T. y Mendoza, M. (2007). Análisis hidrometeorológico de las estaciones de la cuenca del lago de Cuitzeo. Investigaciones Geográficas, Boletín del Instituto de Geografía, UNAM, 63, 56–76. https://doi.org/10.14350/rig.29910
Castro, A., Salame, A., Vergara, J., Castillo, A. y Ramírez, J. (2008). Fluctuaciones de micromamíferos terrestres en bosques templados aledaños a la Ciudad de México, Distrito Federal. En C. Lorenzo, E. Espinoza y J. Ortega (Eds.), Avances en el estudio de los mamíferos de México II (pp. 391–410). San Cristóbal de las Casas, Chiapas: Asociación Mexicana de Mastozoología.
Ceballos, G. y Oliva, G. (2005). Los mamíferos silvestres de México. México D.F.: Conabio/ Fondo de Cultura Económica.
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K. et al. (2014). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84, 45–67. https://doi.org/10.1890/13-0133.1al/gyw160
Chao, A., Ma, K. H. y Hsieh, T. C. (2016) iNEXT (iNterpolation and EXTrapolation) Online: Software for interpolation and extrapolation of species diversity. Program and user’s guide. http://chao.stat.nthu.edu.tw/wordpress/software_download/inext-online/
Cimé, J. A., Hernández, S. F., Barrientos, R. C. y Castro, A. A. (2010). Diversidad de pequeños roedores en una selva baja caducifolia del noreste de Yucatán, México. Therya, 1, 23–39. https://doi.org/10.12933/therya-10-2
Correa, C. A., Mendoza, M. E. y López, E. (2014). Análisis del cambio en la conectividad estructural del paisaje (1975-2008) de la cuenca de Cuitzeo, Michoacán, México. Revista de Geografía Norte Grande, 59, 7–23. http://dx.doi.org/10.4067/S0718-34022014000300002
Dirzo, R., Young, H. S., Galetti, M., Ceballos, G., Isaac, N. J. B. y Collen, B. (2014). Defaunation in the Anthropocene. Science, 345, 401–406. https://www.science.org/doi/10.1126/science.1251817
Dowler, R. C. y Genoways, H. H. (1978). Liomys irroratus. Mammalian Species, 82, 1–6. https://doi.org/10.2307/3503813
Elizalde, C., López, J. C., Hernández, L., Laundré, J. W., Cervantes, F. A., Morales-Mejía, F. M. et al. (2014). Registro de presencia y actividades de algunos mamíferos en el Desierto Chihuahuense, México. Therya, 5, 793–816. https://doi.org/10.12933/therya-14-252
Escamilla, I. y Aguilar, G. (2010). Urbanización. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.), Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 160–163). México D.F.: UNAM/ UMSNH.
Eshelman, B. D. y Cameron, G. N. (1987). Baiomys taylori. Mammalian Species, 285, 1–7. https://doi.org/10.2307/3503776
Fernández, J. A., García-Campusano, F. y Hafner, M. S. (2010). Peromyscus difficilis (Rodentia: Cricetidae). Mammalian Species, 42, 220–229. https://doi.org/10.1644/867.1
Fleharty, E. D. y Olson, L. E. (1969). Summer food habits of Microtus ochrogaster and Sigmodon hispidus. Journal of Mammalogy, 50, 475–486. https://doi.org/10.2307/1378774
Flores, R. y Vázquez, G. (2016). Influence of vegetation type and season on rodent assemblage in a mexican temperate forest mosaic. Therya, 7, 357–369. https://doi.org/10.12933/therya-16-390
García, U. O. y Flores, O. A. (2010). Biodiversidad: anfibios y reptiles. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.), Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 94–95). México D.F.: UNAM/ UMSNH.
García, C., Romero, M. L. y Sánchez C. (2002). Comparison of rodent communities in sites with different degrees of disturbance in deciduous forest of southeastern Morelos, México. Acta Zoológica Mexicana, 85, 153–168. https://doi.org/10.21829/azm.2002.85851819
Gloria-Tapia, G., López, C., González, A. y Hernández, S. F. (2012). Diversidad de roedores y su relación con la heterogeneidad ambiental en la cuenca del río Nazas, Durango, México. En F. A. Cervantes y C. Ballesteros (Eds.), Estudio sobre la biología de roedores silvestres mexicanos (pp. 59–70). México D.F.: Instituto de Biología, UNAM.
Godinez, E. y Guerrero, S. (2014). Los roedores de Jalisco, México: clave de determinación. Therya, 5, 633–678. https://doi.org/10.12933/therya-14-212
Gómez-Tagle, A., Gómez-Tagle, A. F., Ávila, J. A. y Bruijnzeel, L. (2015). Partición de la precipitación en un bosque tropical montano de pino-encino en el centro de México. Bosque, 36, 505–518. https://doi.org/10.4067/S0717-92002015000300017
González, A., Rodríguez, N. V. y Marín, G. (2012). Composición del ensamble de pequeños mamíferos del borde de un bosque mesófilo de montaña en Veracruz, México. En F. A. Cervantes y C. Ballesteros (Eds.), Estudio sobre la biología de roedores silvestres mexicanos (pp. 85–96). México D.F.: Instituto de Biología, UNAM.
Hamer, Q., Harper, D. A. T. y Ryan, P. D. (2001). PasT: Paleontological Statistics Software Package for Education and Data Analysis. Paleontologia Electronica, 4, 1–9.
Hernández, S. F., Cimé, J. A., Medina, S. y Durán C. M. (2012). Parámetros poblacionales del ratón yucateco Peromyscus yucatanicus de una selva baja caducifolia del norte de Yucatán, México. En F. A. Cervantes y C. Ballesteros. (Eds.), Estudio sobre la biología de roedores silvestres mexicanos (pp. 151–164). México D.F.: Instituto de Biología, UNAM
Hernández, L., Laundré, J. W., González, A., López, J. y Grajales, K. M. (2011). Tale of two metrics: density and biomass in a desert rodent community. Journal of Mammalogy, 94, 840–851. https://doi.org/10.1644/10-MAMM-A-175.1
Hernández, A., Ortiz, C. F. y Alcaraz, J. V. (2023). El riesgo agrícola ante el cambio climático en la región de Cuitzeo del estado de Michoacán, México. Acta Universitaria Multidisciplinary Scientific Journal, 33, 1–19. https://doi.org/10.15174/au.2023.3763
Herrera, Y. y Pámanes, D. S. (2010). Guía de pastos de Zacatecas. Durango, Durango, México: IPN/ Conabio.
Hutchenson, K. (1970). A test for comparing diversities base on the Shannon formula. Journal of Theoretical Biology, 29, 151–154.
INEGI (Instituto Nacional de Estadística, Geografía e Informática). (2023). Anuario de estadística por entidad federativa. https://www.inegi.org.mx/contenidos/productos/prod_serv/contenidos/espanol/bvinegi/productos/nueva_estruc/889463906353.pdf
López, C., García, D. F., López, J. C. y Elizalde, C. (2019). Multiple lines of evidence reveal a composite of species in the plateau mouse, Peromyscus melanophrys (Rodentia Cricetidae). Journal of Mammalogy, 100, 1583–1598. https://doi.org/10.1093/jmammal/gyz106
López, E., Mendoza, M. E. y Bocco, G. (2010). Cobertura vegetal y uso del terreno. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.), Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 52–57). México D.F.: UNAM/ UMSNH.
Luévano, J., Mellink, E., Riojas, M. E. y Flores, J. L. (2008). Comunidades de roedores nocturnos en un ecotono de matorrales micrófilos y zacatal gipsófilo en San Luis Potosí, México. Revista Mexicana de Biodiversidad, 79, 197–203. https://doi.org/10.22201/ib.20078706e.2008.001.528
Madrigal, X. y Guridi, L. L. (2009). Especies arbóreas en riesgo de la cuenca de Cuitzeo, Michoacán y Guanajuato, México. Morelia: Universidad Michoacana de San Nicolás de Hidalgo.
Magurran, A. E. (2004). Measuring biological diversity. Reino Unido: Blackwell Science Ltd.
Mammal Diversity Database. (2024). Explore current mammalian taxonomy. Recuperado el 16 de junio, 2024 de: https://www.mammaldiversity.org/taxa.html
Martínez, S. T., Schnell, G. D., Sánchez, C. y Romero, M L. (2017). Sigmodon mascotensis (Rodentia: Cricetidae). Mammalian Species, 49, 109–118. https://doi.org/10.1093/mspecies/sex013
Medina, M. y Ortega, J. M. (2010). Biodiversidad: peces. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.),
Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 90–93). México D.F.: UNAM/ UMSNH.
Mendoza, V. H. y Horváth, A. (2013). Roedores y murciélagos en la zona cafetalera del volcán Tacaná, Chiapas, México. Therya, 4, 409–423. https://doi.org/10.12933/therya-13-116
Monroy, O., Zarco, M. M., Ramírez, J. y Ulises Aguilera, U. (2011). Diversidad de mamíferos de la Reserva Natural Sierra Nanchititla, México. Revista Mexicana de Biodiversidad, 82, 237–248. https://doi.org/10.22201/ib.20078706e.2011.1.377
Monterrubio, T. C., Charre, J. F., Colín, C. Z. y León, L. (2014). Los mamíferos del estado de Michoacán. Revista Mexicana de Mastozoología Nueva Época, 4, 1–17. https://doi.org/10.22201/ie.20074484e.2014.4.2.193
Monterrubio, T. C., Guido, D., Alanís, L., León, L. y Medellín, J. F. (2019). Mamíferos silvestres de la cuenca de Cuitzeo, México. Acta Universitaria Multidisciplinary Scientific Journal, 29, 1–15. https://doi.org/10.15174/au.2019.1892
Morales, S. P., Álvarez, M. Y., Zamora, M. E., Dirzo, R., Oyama, K. y Ávila, L. D. (2019). Rodent community responses to vegetation and landscape changes in early successional stages of tropical dry forest. Forest Ecology and Management,
433, 633–644. https://doi.org/10.1016/j.foreco.2018.11.037
Núñez, A. y Pastrana, G. (1990). Los roedores michoacanos: manual de identificación. Morelia, Michoacán: Coordinación de la investigación científica, Universidad Michoacana de San Nicolás de Hidalgo.
Packard, R. L. (1960). Speciation an evolution of pygmy mice, genus Baiomys. University of Kansas Publications, Museum of Natural History, 9, 579–670. https://doi.org/10.5962/bhl.part.6498
Peña, J. L., López, J., Alarcón, B., Vargas, M., Vázquez, I. y Landeros, C. (2009). Composición de la dieta de Sigmodon hispidus (Rodentia: Cricetidae) en caña de azúcar. Mastozoología Neotropical, 16, 365–378.
Pérez-Arteaga, A., Gaston, K. J. y Kershaw, M. (2002). Undesignated sites in Mexico qualifying as wetlands of international importance. Biological Conservation, 107, 47–57. https://doi.org/10.1016/S0006-3207(02)00043-5
Pérez, M. y Santos, A. (2010). Movements and capture-recapture data analysis of the vesper rat (Nyctomys sumichrasti: Rodentia, Muridae) in a tropical forest in northeastern Oaxaca, México. Acta Zoológica Mexicana, 26, 627–638. https://doi.org/10.21829/azm.2010.263804
Ponce, J. y Quijano, A. F. (2010). Biodiversidad: insectos y arácnidos. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.), Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 82–84). México D.F.: UNAM/ UMSNH.
Ramírez, J., González, N., Gardner, A. L. y Arroyo, J. (2014). List of recent land mammals of México. Lubbock, TX: Museum of Texas Tech University.
Rojas, A., Aguilar, M., Sánchez, C. y Noguera, O. (2012). Uso del espacio y dinámica poblacional del ratón de los volcanes (Neotomodon alstoni) en el Cerro del Ajusco, Distrito Federal, México. En F. A. Cervantes y C. Ballesteros (Eds.), Estudio sobre la biología de roedores silvestres mexicanos (pp. 211–224). México D.F.: Instituto de Biología, UNAM.
Romero, M. L., Sánchez, C., García, C. y Owen, R. (2007). Mamíferos pequeños. Manual de técnicas de captura, preparación preservación y estudio. México D.F.: UNAM.
Ruán, I., Manson, R. H. e Íñiguez, L. I. (2008). Respuesta al borde en poblaciones de pequeños mamíferos en remanentes de bosque mesófilo de montaña del centro de Veracruz. En C. Lorenzo, E. Espinoza y J. Ortega (Eds.), Avances en el estudio de los mamíferos de México II (pp. 511–530). San Cristóbal de las Casas, Chiapas: Asociación Mexicana de Mastozoología.
Rzedowski, G. y Rzedowski, J. (2005). Flora fanerogámica del valle de México. Pátzcuaro, Michoacán: Instituto de Ecología, A.C./ Conabio.
Sánchez, C., García, C. y Romero, M. L. (2005). Distribución y diversidad de roedores del estado de Michoacán, y su asociación con las provincias fisiográficas. En V. Sánchez y R. A. Medellín (Eds). Contribuciones mastozoológicas en homenaje a Bernardo Villa (pp. 451–460). México D.F.: Instituto de Biología; Instituto de Ecología, UNAM/ Conabio.
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010. Protección ambiental – Especies nativas de México de flora y fauna silvestres – Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio – Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección, México.
Senasica (Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria). (2024). Manual de muestreo programa de vigilancia epidemiológica fitosanitaria. https://www.gob.mx/cms/uploads/attachment/file/895962/MANUAL_DE_MUESTREO_2024.pdf
Sikes, R. S. (2016). 2016 Guidelines of the American Society of Mammalogists for the use of wild mammals in research and education. Journal of Mammalogy, 97, 663–688. https://doi.org/10.1093/jmammal/gyw078
Spencer, S. R. y Cameron, G. N. (1982). Reithrodontomys fulvescens. Mammalian Species, 174, 1–7. https://doi.org/10.2307/3503795
Vázquez, L. B., Medellín, R. A. y Camerón, G. N. (2000). Population and community ecology of small rodents in montane forest of western México. Journal of Mammalogy, 81, 77–85. https://doi.org/10.1644/1545-1542(2000)081<0077:PACEOS>2.0.CO;2
Villafán, K. B., Arellanes, Y., López, R. y Ayala, D. A. (2021). Situación socioambiental en el lago de Cuitzeo, Michoacán (México), desde la responsabilidad social. Economía, Sociedad y Territorio, 21, 599–629. https://doi.org/10.22136/est20211694
Villanueva, A. I., Delgado, D. A., Heynes, S. A., Ruacho, L. y López, C. (2017). Habitat selection by rodents at the transition between the Sierra Madre Occidental and the Mexican Plateau, México. Journal of Mammalogy, 98, 293–301. https://doi.org/10.1093/jmammal/gyw173
Villaseñor-Gómez, L. E. y Villaseñor-Gómez, F. J. (2010). Biodiversidad: avifauna. En S. Cram, L. Galicia, I. Israde, C. López y B. Ávila (Eds.), Atlas de la cuenca del lago de Cuitzeo: análisis de su geografía y entorno socioambiental (pp. 96–99). México D.F.: UNAM/ UMSNH.
Young, H. S., Dirzo, R., Helgen, K. M., McCauley, D. J., Billeter, S. A., Kosoy, M. Y. et al. (2014). Declines in large wildlife increase landscape-level prevalence of rodent-borne disease in Africa. Proceedings of the National Academy of Sciences, 111, 7036–7041. https://doi.org/10.1073/pnas.1404958111
Young, H. S., McCauley, D. J., Dirzo, R., Goheen, J. R., Agwanda, B., Brook, C. et al. (2015). Context-dependent effects of large-wildlife declines on small-mammal communities in central Kenya. Ecological Applications, 25, 348–360. https://doi.org/10.1890/14-0995.1
Zalapa, S. S, Guerrero, S., Badii, M. H. y Cervantes F. A. (2012). Variación espacial del ensamble de pequeños mamíferos de tres áreas de bosque tropical subcaducifolio en la costa norte de Jalisco, México. En F. A. Cervantes y C. Ballesteros (Eds.), Estudio sobre la biología de roedores silvestres mexicanos (pp. 117–126). México D.F.: Instituto de Biología, UNAM.
Zaragoza, E. P., Rodríguez, N. V., Hernández, S. F., León, L. S. y González, M. C. (2022). Abundance, microhabitat and feeding of Peromyscus yucatanicus and Peromyscus mexicanus in the Mexican tropics. Therya, 12, 129–142. https://doi.org/10.12933/therya-22-1189