Relationship of the establishment of Dendroctonus adjunctus and Arceuthobium vaginatum with the structure of a Pinus hartwegii forest in Nevado de Colima, Mexico
Angel Rolando Endara-Agramont *, Rebeca Dennise Varo-Rodríguez, José Jonathan Aguirre-Zúñiga, Claudia Guadalupe Enríquez-Sánchez y Alma Abigail Luna-Gil
Universidad Autónoma del Estado de México, Instituto de Ciencias Agropecuarias y Rurales “El Cerrillo Piedras Blancas”, 50000 Toluca, Estado de México, México
*Autor de correspondencia: arendaraa@uaemex.mx (A.R. Endara-Agramont)
Recibido: 6 mayo 2024; aceptado: 29 julio 2025
Resumen
Las poblaciones de Pinus hartwegii se establecen por encima de 3,500 m snm, en torno a las montañas más altas del país, una de ellas es el Parque Nacional Volcán Nevado de Colima, mismo que está afectado por Arceuthobium vaginatum y Dendroctonus adjunctus. El objetivo de la investigación fue determinar el daño provocado por ambos patógenos sobre la estructura y regeneración del bosque de P. hartwegii. Para ello, se instalaron 384 unidades de muestreo (UM de 1,000 m2 cada uno), donde se registró información dasonómica asociada a niveles de infestación de muérdagos y descortezadores. De acuerdo con los resultados obtenidos, 20% del bosque se encuentra infestado por muérdago y descortezador. Además, se presenta la eliminación del dosel dominante y reducción de árboles sanos > 40 DN en los sitios afectados. Por lo anterior, se concluye que los altos niveles de infestación de D. adjunctus y la superficie infestada por A. vaginatum afectan la estructura del bosque y, por tanto, comprometen el establecimiento de la regeneración natural, siendo la ladera oeste en torno al volcán la más afectada.
Palabras clave: Muérdago; Descortezador; Pinus hartwegii; Alta montaña; Estrato arbóreo
Abstract
The populations of Pinus hartwegii are established above 3,500 m asl, around the highest mountains in the country, one of them is the Nevado de Colima Volcano National Park, which is affected by Arceuthobium vaginatum and Dendroctonus adjunctus. The objective of the research was to determine the damage caused by both pathogens on the structure and regeneration of the P. hartwegii forest. To this, 384 sampling units were installed (MU of 1,000 m2 each), where forest information associated with mistletoe and bark beetle infestation levels was recorded. According to the results obtained, 20% are attacked by mistletoe and bark beetle. In addition, the elimination of the dominant canopy and reduction of healthy trees > 40 DN is presented in the affected sites. From the above, it is concluded that the high levels of infestation of D. adjunctus and the surface infested by A. vaginatum affect the structure of the forest and, therefore, compromise the establishment of natural regeneration, with the western slope around the volcano the most affected.
Keywords: Mistletoe; Bark beetle; Pinus hartwegii; High mountain; Tree stratum
Introducción
Los bosques templados de México cubren 15% de la superficie forestal, distribuidos en 5 regiones: Península de Baja California, Sierra Madre Occidental, Sierra Madre Oriental, Sierra Madre del Sur y el Sistema Volcánico Transmexicano (SVTM) (Sánchez-González, 2008). Se encuentran en un rango altitudinal de 1,800 a 4,000 m snm, donde se establecen más de 60 especies del género Pinus (Farjon et al., 1997; Styles, 1993) y hasta 8 especies del género Abies (Gernandt y Pérez-de la Rosa, 2014; Villaseñor, 2016).
En Jalisco convergen la Sierra Madre Occidental y el Sistema Volcánico Transmexicano, donde se establecen 34 especies de coníferas (Gernandt y Pérez-de la Rosa, 2014), es una de las entidades con mayor diversidad forestal. Sin embargo, para el periodo 2012-2021 se reportaron 345 notificaciones de saneamiento, lo que representa una superficie total de 54,157.70 ha, en 7,347.02 de ellas, las notificaciones se levantaron por insectos descortezadores y en 33,064.31 por plantas parásitas. El Parque Nacional Volcán Nevado de Colima abarca 2 de las principales regiones afectadas (Tuxpan y Zapotlán el Grande), cuenta con bosques de Pinus hartwegii y Abies religiosa (Sivicoff, 2022).
Las poblaciones de Pinus hartwegii se establecen sobre 3,500 m snm, en las laderas de los edificios volcánicos más altos del país (Endara et al., 2013). Estos bosques se ven afectados por plantas parásitas del género Arceuthobium (Endara-Agramont et al., 2022; Sáenz et al., 2020) e insectos descortezadores del género Dendroctonus (Endara et al., 2023).
México concentra la mayor diversidad de especies del género Arceuthobium (23) (Villaseñor, 2016); las afectaciones por plantas parásitas predisponen a los árboles al ingreso de descortezadores (Ferrenberg, 2020; Mathiasen, 2019), debido a la pérdida de vigor y reducción en el crecimiento de los árboles parasitados (Cibrián-Tovar et al., 1995) y, posteriormente, facilitando el ingreso de hongos ambrosiales que conducen a la muerte del hospedero (Farrell et al., 2001). En rodales de pino con múltiples agentes de perturbación (Dendroctonus ponderosa y Arceuthobium vaginatum subs. cryptopodum) se encontraron bajos porcentajes de copas vivas y una predisposición a la acumulación de combustible (Klutsch et al., 2014). Por su parte, en poblaciones de Pinus contorta con historiales de mortalidad en más de 70% del dosel causado por descortezador, se concluye que el manejo de los individuos muertos propicia la regeneración hasta 4 veces mayor que en rodales no tratados (Collins et al., 2011). Este escenario, podría influir negativamente en la combinación de muérdagos y descortezadores en la zona de estudio, puesto que la regeneración restante puede ser infectada por el muérdago.
México alberga 13 especies del género Dendroctonus (Armendáriz-Toledano y Zúñiga, 2017), que afectan, al menos, a 20 especies de coníferas de los géneros Pinus, Pseudotsuga, Abies y Cupressus (Cibrián-Tovar et al., 1995; Salinas-Moreno et al., 2004). La función de los descortezadores en ecosistemas naturales es inducir el recambio de especies vegetales a través de la infestación de árboles viejos o estresados hasta causarles la muerte, para posteriormente dar paso a nueva generación del componente arbóreo y, con ello, permitir el establecimiento de individuos con mejores condiciones de competitividad (Christiansen y Bakke, 1988).
Uno de los controles poblacionales de los descortezadores son las temperaturas invernales, que ayudan a mantener bajas las poblaciones de las larvas y a retrasar el desarrollo de los adultos (Raffa et al., 2008); sin embargo, en las últimas décadas el aumento de la temperatura en verano está acelerando el desarrollo de los adultos, al incrementar su capacidad reproductiva y fecundidad, lo que implica una mayor cantidad de generaciones de descortezadores al año (Lombardero et al., 2000; Sáenz et al., 2020).
El Parque Nacional Volcán Nevado de Colima (PNVNC) reporta la presencia de insectos descortezadores en sus bosques de pino desde 1963 (Conanp, 2006). De la misma manera, Arceuthobium vaginatum afecta 14% de la superficie de los bosques de pino establecidos por encima de 3,500 m snm. (Endara et al., 2023). Por lo anterior, el objetivo de la investigación fue determinar el daño provocado por el descortezador y el muérdago enano sobre la estructura y regeneración del bosque de P. hartwegii del Nevado de Colima.
Materiales y métodos
El PNVNC fue decretado en 1936 y cuenta con una superficie de 6,554 ha, alcanza una altitud de 4,270 m snm (fig. 1). El tipo de clima es semifrío con verano fresco corto, subhúmedo con precipitaciones en verano C (w2)(w)(x´)c(e). Los tipos de suelo más importantes son regosol, andosol, litosol y en menor escala, cambisol. En el límite altitudinal superior arbóreo se establece una población de Pinus hartwegii asociado con el zacatonal alpino (3,500-4,100 m snm), entre 3,300 y 3,500 se distribuyen los bosques de Alnus jorullensis y Abies religiosa, mientras que el bosque mesófilo de montaña entre 3,000 y 3,300 m snm. Estos ecosistemas albergan aproximadamente 172 especies de plantas vasculares,124 de mamíferos y 117 de aves (Conanp, 2006).
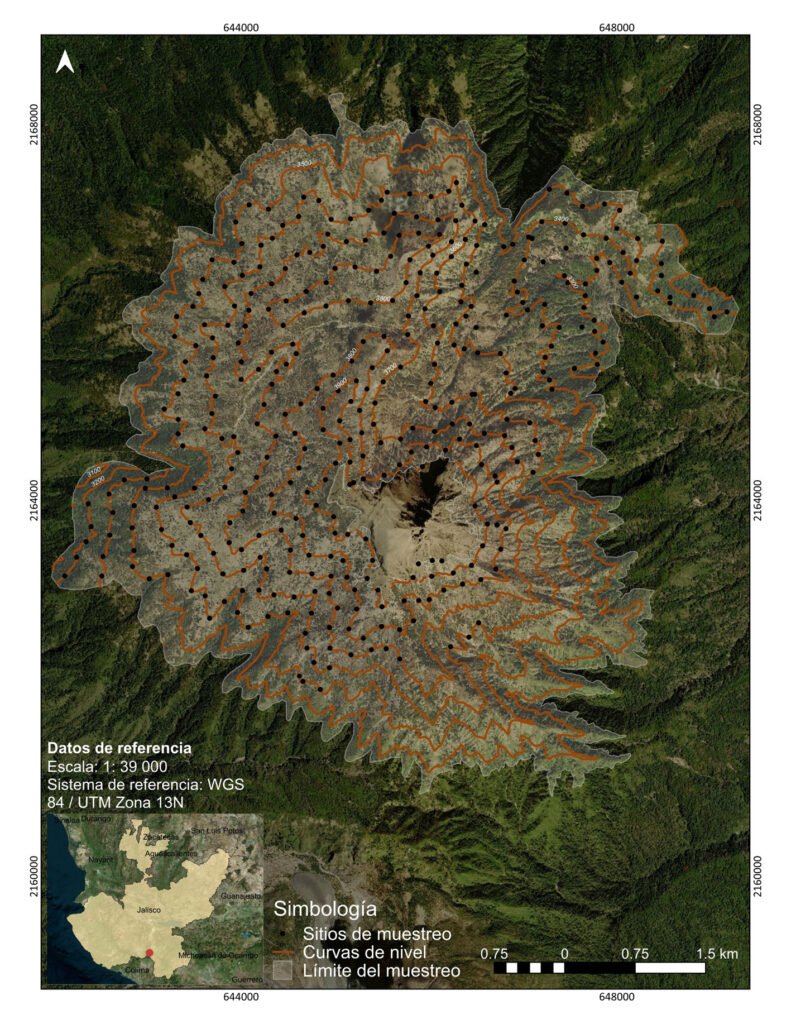
Se establecieron 384 unidades de muestreo (UM) temporales en 3,086 ha del bosque de P. hartwegii del Parque Nacional Nevado de Colima, Jalisco, México. Los sitios se instalaron por encima de 3,500 m snm y hasta 3,900 m snm. Para ello se utilizó la intensidad mínima de muestreo del inventario forestal de reconocimiento, esto permitió dar la representatividad a la superficie muestreada; posteriormente, se adaptó el método de transectos, utilizando las curvas de nivel como líneas de acceso al bosque (Dauber, 1995); sobre cada línea se instalaron las UM con una equidistancia de 300 m y una separación altitudinal de 100 m, esto debido a la variación climática asociada a la altitud (Mayer y Ott, 1991).
Cada UM abarca una superficie de 0.1 ha (17.86 m de radio), en el levantamiento de información del sitio como altitud, pendiente y exposición se utilizaron instrumentos de precisión (brújula Suunto Tandem y GPS Garmin Rino 700). El registro de la regeneración (< 2.5 cm de DN), juveniles (≥ 2.5 < 7.5 de DN) y fustales (≥ 7.5 cm de DN) permitió cuantificar al arbolado (DN y altura total) y clasificar sus niveles de infestación por muérdagos enanos (Hawksworth, 1983) e insectos descortezadores (Billings y Espino, 2005).
Con base en la NOM-019, se determinó la presencia de descortezadores (< a 3 árboles con presencia de grumos blandos) y brotes (≥ a 3 árboles con presencia de grumos blandos) en cada UM (DOF, 2018). Para determinar la especie de descortezador se observaron la presencia de grumos de coloración transparente a blanca en la corteza de los árboles infestados, donde se realizaron colectas manuales de individuos adultos y se preservaron en alcohol etílico al 70% (Macías et al., 2004). Posteriormente, se llevaron a laboratorio y se observaron bajo un microscopio estereoscopio LEICA y un óptico MOTIC (40X) para su identificación utilizando las claves taxonómicas de Wood (1982) y Cibrián-Tovar et al. (1995), además de la observación de la varilla seminal (Lanier et al., 1988; Perusquía, 1978). En arbolado con presencia de muérdago enano se colectaron muestras botánicas, las cuales fueron prensadas y llevadas al herbario de la Facultad de Ciencias Agrícolas de la Universidad Autónoma del Estado de México, donde se identificaron mediante claves taxonómicas (Rzedowski y Calderón, 2011).
La información de sitios e individuos permitió generar valores numéricos por sitios (sanos e infestados), así como niveles de infestación (bajo, medio y alto); estos datos se visualizaron en el software ArcGIS ver.10.8, donde se utilizó la extensión para la interpolación de datos del vecino natural (Sibson, 1982), con ello se generaron mapas temáticos para la distribución espacial ambos patógenos. La densidad del arbolado se traduce en la sumatoria de individuos juveniles y fustales sanos (DN ≥ 7.5), así como el número de árboles muertos en pie por hectárea, para ello, se consideraron los rangos propuestos por Endara et al. (2013) y Rojas et al. (2019): denso (≥ 336 ind./ha), semidenso (< 336 ≥ 150 ind./ha) y fragmentado (< 150 ≥ 20 ind./ha).
La estructura horizontal se determinó mediante la agrupación de los individuos por categoría diamétrica, iniciando en la categoría de 10 (≥ 7.5 < 12.4 cm DN). Para la estimación de los estratos arbóreos (estructura vertical) se agruparon a todos los juveniles y fustales con sus alturas totales, los cuales se sometieron a una prueba de Anova para identificar diferencias mínimas significativas en el paquete estadístico MINITAB Release 12.21. (Endara et al., 2013). Para determinar el efecto de la afectación de muérdagos y descortezadores, se separaron los sitios sanos de los infestados (presencia de muérdago y descortezador) y así compararlos. Se cuantificó todo el renuevo clasificándolo en plántulas (< 30 cm de altura), brinzales (≥ 30 cm < 1.5 m de altura) y latizales (≥ 1.5 m de altura < 2.5 cm DN); a este grupo se sumaron los juveniles, ya que todavía son altamente vulnerables a incendios forestales y aún no garantizan su establecimiento en el bosque.
Resultados
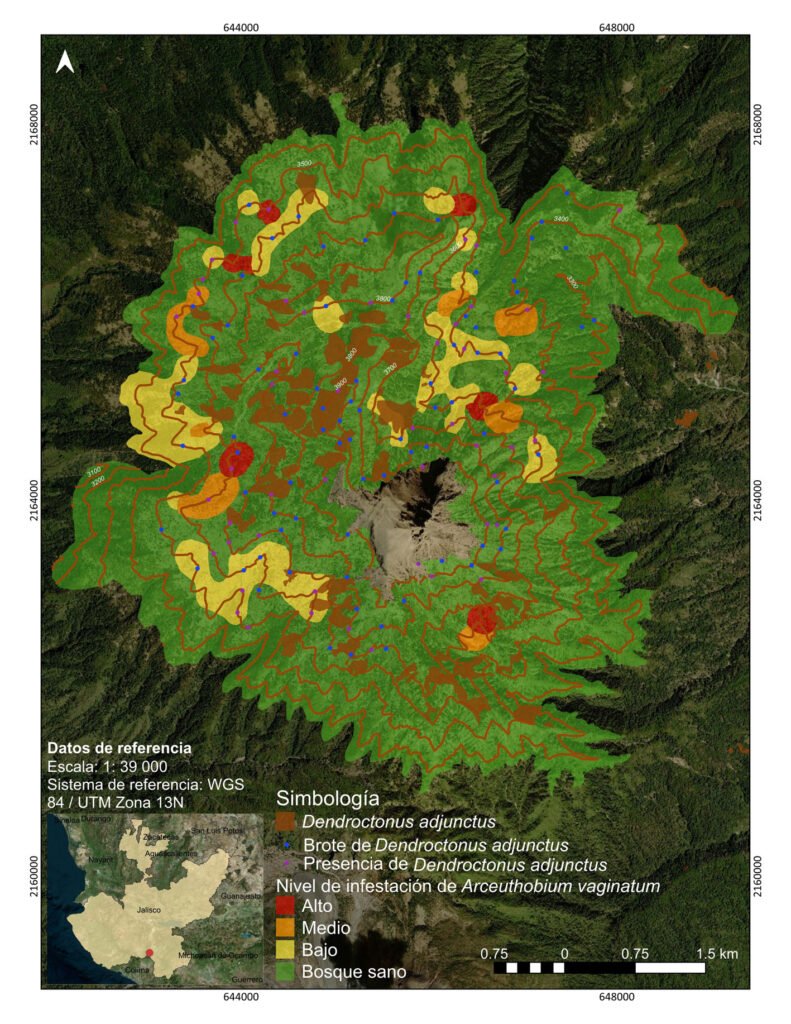
El trabajo en laboratorio permitió identificar al escarabajo de los pinos de montaña Dendroctonus adjunctus (fig. 2) afectando al pino de las alturas (P. hartwegii), mismo que ha sido reportado en esta ANP desde 1963 (Conanp, 2006). En esta investigación se determinó que 24% de los sitios presentan brotes activos (52 sitios) y 15% solo con presencia (32 sitios).
Las colectas de material botánico permitieron identificar a la especie de muérdago enano Arceuthobium vaginatum, que para el PNVNC ya había sido reportado por Ruiz (1994) y Endara et al. (2023) y cubre una superficie de 417 ha (14%), mientras que el descortezador abarca 209 ha (7%), ambos parecen tener un patrón de distribución similar, ya que más de 70% de la superficie se concentra en la ladera oeste en torno al Volcán Nevado de Colima (fig. 3). Respecto a la altitud, tanto el muérdago como el descortezador están distribuidos desde 3,500 y hasta 3,900 m snm, el descortezador en polígonos grandes y continuos, el muérdago en parches más dispersos (de arbolado juvenil y con niveles de infestación: bajo 298 ha, medio 79 ha y alto 39 ha).

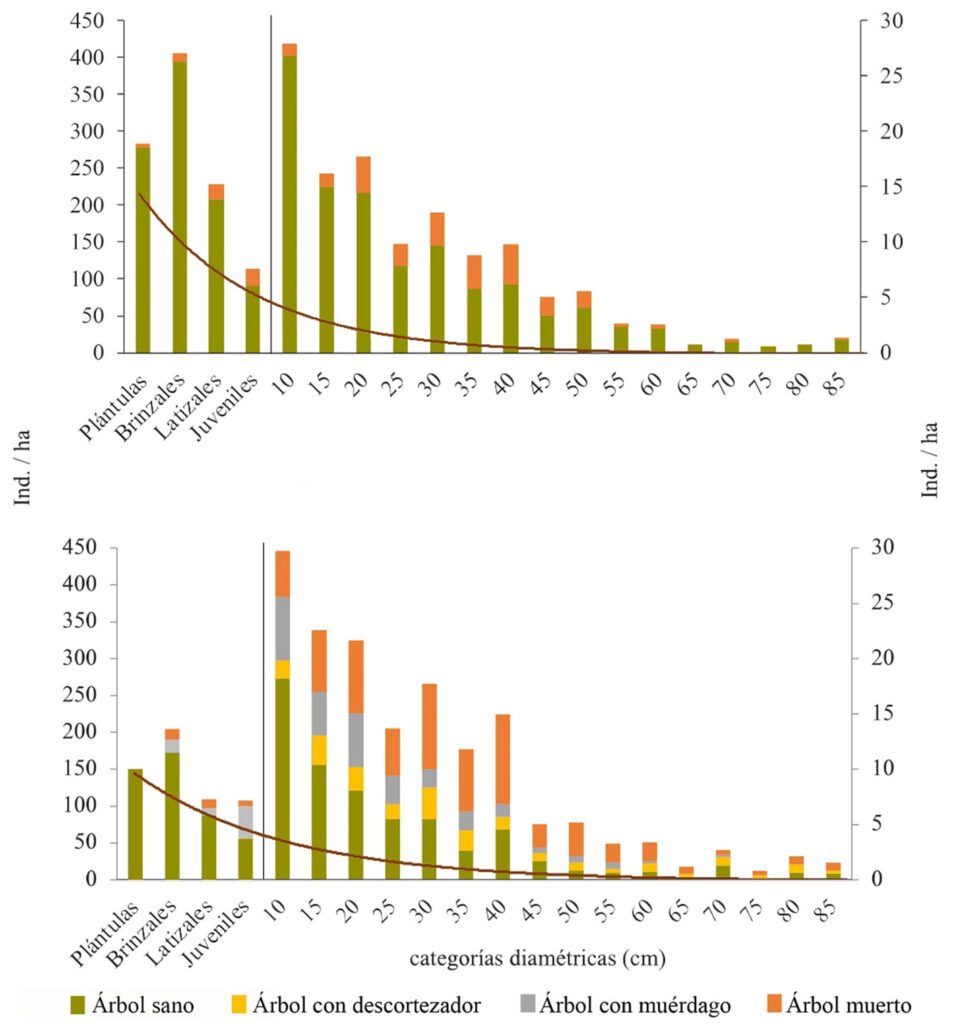
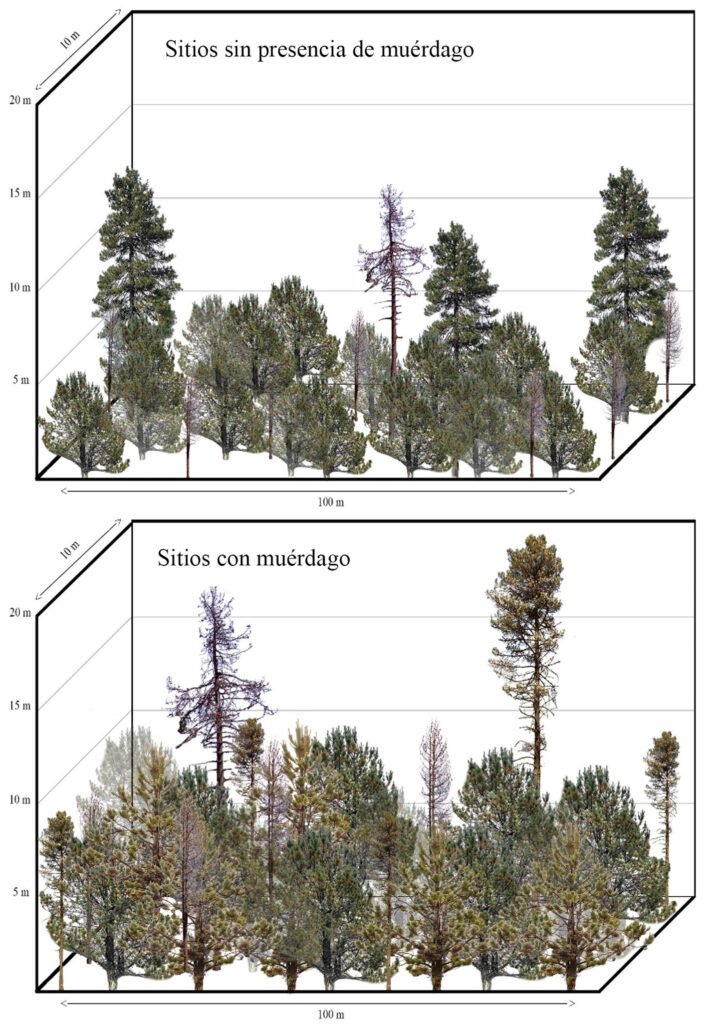
La distribución de la estructura horizontal muestra una marcada diferencia entre los sitios con y sin muérdago y descortezador; en primer lugar, es notoria la reducción del número de árboles sanos, provocada por el establecimiento, tanto de muérdago como de descortezador, misma que se refleja en 48% menos en las categorías de regeneración y 59% menos en arbolado adulto (categorías 10-85 cm); en segundo lugar, la ausencia de arbolado con potencial semillero (> 35 cm) puede comprometer el establecimiento de la regeneración natural de la especie (fig. 4).
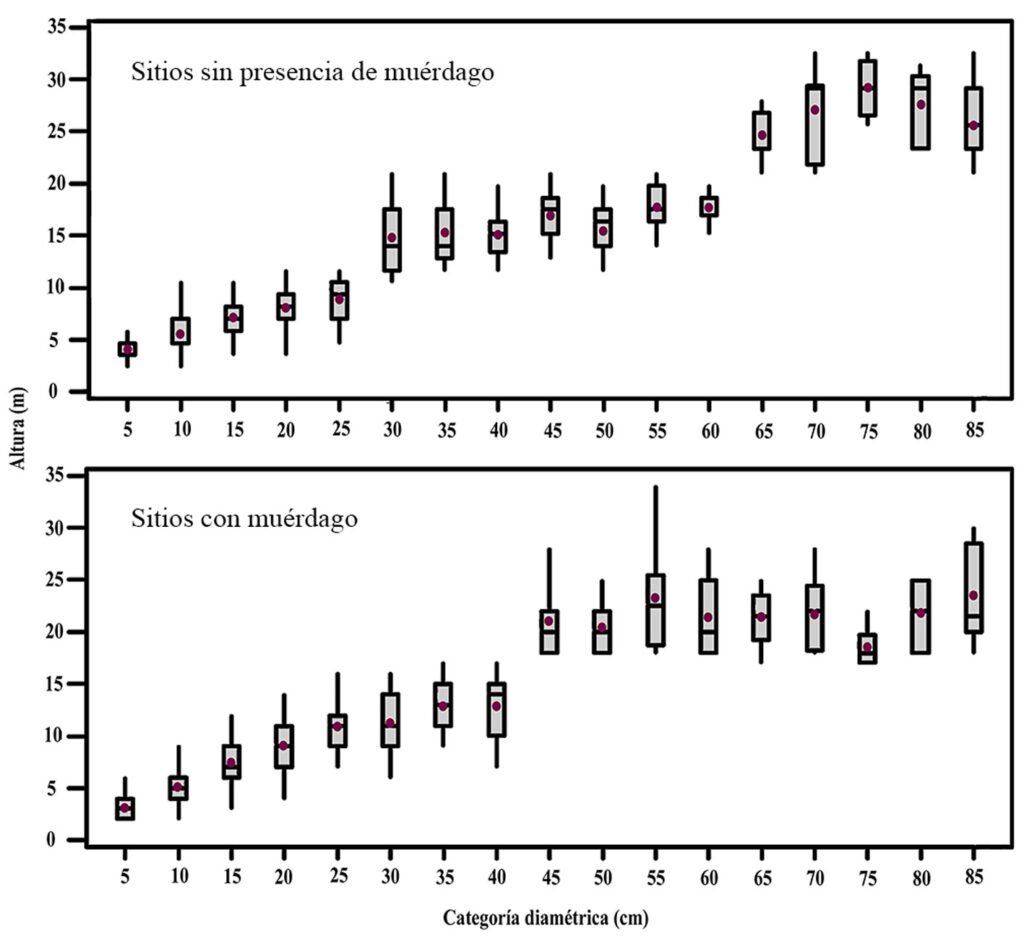
El Anova utilizado para conocer la distribución del arbolado agrupado por sus alturas en sitios sanos e infestados muestra la presencia de 3 estratos bien diferenciados en el bosque sin infestaciones y solo 2 en el bosque infestado (fig. 5); esto atribuido a la mortalidad de arbolado adulto en zonas con brotes activos de descortezador.
La representación gráfica del estrato arbóreo muestra que, el bosque sin infestación, pese a presentar 3 estratos en el análisis estadístico, el número de árboles del estrato superior no es representativo (4 ind./ha-1), ya que al graficar un bosque de 1,000 m2, éste desaparece, atribuido a la baja densidad de estos bosques (236 ind./ha-1). Por otra parte, los bosques infestados presentan una densidad mayor (263 ind./ha-1), esto se explica por la preferencia del descortezador por arbolado adulto, mismos que conforman los bosques densos del parque nacional (fig. 6).
Discusión
El descortezador de los pinos de montaña (Dendroctonus adjunctus) se distribuye en el centro de México sobre los principales sistemas montañosos (García-Navarrete et al., 2021), donde su impacto es mayor (Pérez-Miranda et al., 2021). La presencia de los escarabajos descortezadores de montaña está directamente relacionada con el establecimiento de muérdagos enanos; Endara et al. (2023) reportaron que más de 50% de los árboles enfermos en el Monte Tláloc y Nevado de Toluca presentan la sinergia de ambos patógenos. En el presente estudio, se reporta que 14% de la superficie del bosque de pino (Pinus hartwegii) está afectado por Arceuthobium vaginatum y 7% por D. adjunctus. En términos de superficie, el Nevado de Colima es la única montaña donde se pudo cuantificar la superficie infestada por descortezadores debido a la afectación en parches pequeños de bosques densos de arbolado adulto, esto parece favorecer su dispersión gradual hacia los árboles sanos en torno a los sitios de arbolado muerto en pie con brotes activos hacia los bordes. Al respecto, Cuellar et al. (2013) y Ruiz-González et al. (2018), reportan que, a mayor densidad de arbolado, aumenta el riesgo de la infestación por descortezadores del género Dendroctonus; esto concuerda con lo encontrado en este estudio, ya que los bosques densos son los que presentan mayor cantidad de arbolado muerto por descortezador. En contraste, Sosa et al. (2018) señalan que las altas densidades del arbolado no parecen ser los sitios favoritos para el escarabajo, aunque esto pueda deberse a que dicho estudio no se realizó en sitios de condición de infestación masiva.
Lo anterior, aunado a que la presencia de Dendroctonus, es mayor en diámetros más grandes (Vázquez-Ochoa et al., 2022), provoca la reducción del número de árboles semilleros y, por lo tanto, puede comprometer el establecimiento de la regeneración natural. Por un lado, el descortezador está causando mortalidad en arbolado adulto (muchos de ellos semilleros), por el otro, el muérdago está atacando arbolado juvenil, esta combinación crea condiciones que puede contribuir a una mayor vulnerabilidad de los bosques (Aguirre et al., 2024), además de afectar en gran medida al establecimiento de la regeneración natural, ya que se ha registrado que la infección de muérdago enano reduce el éxito reproductivo del árbol y, a su vez, disminuye el reclutamiento (Queijeiro-Bolaños y Cano-Santana, 2015).
Dado que la homogeneidad en estructura y edad de los bosques son determinantes para la incidencia de insectos descortezadores (Raffa et al., 2008), la afectación de arbolado adulto y juvenil altera la distribución de la estructura vertical del bosque y ocasiona la desaparición del dosel dominante, ésto incrementa la vulnerabilidad de estos bosques ante incendios forestales y estrés de calor (Quintero-Gradilla et al., 2019), ya que no cuentan con un estrato superior bien definido, que cumple la función de dar sombra a los estratos medio e inferior. Además, dicho estrato protege a los árboles jóvenes de eventos climáticos como huracanes con rachas de viento de alta intensidad.
El clima es otra variable importante que limita la dispersión de los descortezadores, principalmente en la temporada de invierno (García-Navarrete et al., 2021). Sin embargo, las temperaturas en las zonas altas del país están incrementando (Sáenz et al., 2020), dados estos escenarios climáticos futuros, D. adjunctus probablemente alcanzará sitios altitudinales superiores (Estrada-Contreras et al., 2022). En el presente estudio, el escarabajo descortezador alcanza 3,900 m snm, mientras que, Salinas-Moreno et al. (2010) reportaron a D. adjunctus en intervalo de 3,100 y 3,500 m snm. Al mismo tiempo, el hospedero también migrará altitudinalmente, pues las zonas bajas del parque prácticamente carecen de arbolado adulto del pino de las alturas, esto probablemente debido a que el incremento actual del clima está reduciendo el vigor de P. hartwegii en las partes bajas, provocada por las altas temperaturas (Gallardo-Salazar et al., 2023).
Las poblaciones del insecto descortezador han aumentado en años recientes, especialmente en la zona norte y centro de su distribución (Vázquez-Ochoa et al., 2022), además, los mayores brotes de descortezadores en México han ocurrido en el Eje Neovolcánico Transversal (del-Val y Sáenz-Romero, 2017). En este sentido y dado que, D. adjunctus presenta un comportamiento agresivo de colonización (Armendáriz-Toledano et al., 2018), produce alta mortalidad de pino, por lo que es necesario incorporar medidas de prevención para reducir sus afectaciones, principalmente sobre arbolado semillero y juvenil, y así disminuir los daños y cambios en la dinámica y estructura de los bosques.
El bosque de Pinus hartwegii del Parque Nacional Volcán Nevado de Colima está siendo afectado por Arceuthobium vaginatum y Dendroctonus adjunctus. La ladera oeste en torno al volcán Nevado de Colima es la más afectada, por un lado, el descortezador se distribuye en los bosques densos de arbolado adulto entre 3,600 y 3,800 m snm; mientras que el muérdago se establece en bosques fragmentados de arbolado juvenil entre 3,500 y 3,600 m snm, con pendientes ligeras y mayor exposición al sol. En ambos casos, los niveles de infestación afectan la estructura y comprometen la regeneración natural de P. hartwegii.
El 20% de la superficie muestreada presenta el establecimiento de uno u otro patógeno, por lo que, es necesario dar seguimiento a la dinámica de estas poblaciones, ya que pueden alterar el equilibrio natural de este ecosistema, principalmente en términos de estructura y regeneración del bosque.
Agradecimientos
A los directivos del Parque Nacional Nevado de Colima y a la Conanp por su aprobación para la realización del estudio. Un agradecimiento especial al Grupo de Alta Montaña, quienes nos apoyaron en el trabajo de campo. Este estudio fue financiado por el proyecto Conacyt-Conafor/A3-S-130105.
Referencias
Aguirre, Z. J., Heredia, B. R., Franco, M. S, Fredericksen, T. S. y Endara, A. A. (2014). Occurrence and effect of dwarf mistletoe (Arceuthobium globosum and A. vaginatum) in high-elevation forests in México. Trees, Forests and People, 18, 100706. https://doi.org/10.1016/j.tfp.2024.100706.
Armendáriz-Toledano, F. y Zúñiga, G. (2017). Illustrated key to species of genus Dendroctonus (Coleoptera: Curculionidae) occurring in Mexico and Central America. Journal of Insect Science, 17, 34. https://doi.org/10.1093/jisesa/iex009
Armendáriz-Toledano, F., Zúñiga, G., García-Román, J., Valerio-Mendoza, O. y García-Navarrete, P. G. (2018). Guía ilustrada para identificar a las especies del género Dendroctonus presentes en México y Centroamérica. Ciudad de México: Red Temática de Salud Forestal/ Consejo Nacional de Ciencia y Tecnología/ Instituto Politécnico Nacional.
Billings, R. F. y Espino, V. (2005). El gorgojo descortezador del pino (Dendroctonus frontalis) en Centroamérica: cómo reconocer, prevenir y controlar plagas. Texas, USA: Texas Forest Service Publication.
Chávez-Salcedo, L. F., Queijeiro-Bolaños, M. E., López-Gómez, V., Cano-Santana, Z., Mejía-Recamier, B. E. y Mojica-Guzmán, A. (2018). Contrasting arthropod communities associated with dwarf mistletoes Arceuthobium globosum and A. vaginatum and their host Pinus hartwegii. Journal of Forestry Research, 29, 1351–1364. https://doi.org/10.1007/s11676-017-0544-y
Christiansen, E. y Bakke, A. (1988). The spruce bark beetle of Eurasia. En A. Berryman (Ed.), Dynamics of forest insect populations: patterns, causes, implications (pp. 479–503). Boston, MA: Springer US. https://doi.org/10.1007/978-1-4899-0789-9_23
Cibrián-Tovar, D., Méndez-Montiel, J. T., Campos-Bolaños, R., Tates III, H. O. y Flores-Lara, J. E. (1995). Insectos forestales de México. México D.F.: Universidad Autónoma Chapingo.
Collins, B. J., Rhoades, C. C., Hubbard, R. M. y Battaglia, M. A. (2011). Tree regeneration and future stand development after bark beetle infestation and harvesting in Colorado lodgepole pine stands, Forest Ecology and Management, 261, 2168–2175. https://doi.org/10.1016/j.foreco.2011.03.016
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2006). Programa de Conservación y Manejo Parque Nacional Volcán Nevado de Colima. México: Comisión Nacional de Áreas Naturales Protegidas.
Cuéllar-Rodríguez, G., Equihua-Martínez, A., Villa-Castillo, J., Estrada-Venegas, E. G., Méndez-Montiel, T. y Romero-Nápoles, J. (2013). Análisis espacio-temporal de los bosques de Pinus cembroides Zucc. atacados por Dendroctonus mexicanus Hopkins. Revista Mexicana de Ciencias Forestales, 4, 42–49. https://doi.org/10.29298/rmcf.v4i17.419
Dauber, E. (1995). Guía práctica y teórica para el diseño de un inventario forestal de reconocimiento. Santa Cruz. BOLFOR.
del-Val, E. y Sáenz-Romero, C. (2017). Insectos descortezadores (Coleoptera: Curculionidae) y cambio climático: problemática actual y perspectivas en los bosques templados. TIP. Revista Especializada en Ciencias Químico-Biológicas, 20, 53–60. https://doi.org/10.1016/j.recqb.2017.04.006
DOF (Diario Oficial de la Federación). (2018). NORMA OFICIAL MEXICANA NOM-019-SEMARNAT-2017 lineamientos técnicos para la prevención, combate y control de insectos descortezadores. México D.F.
Endara, A. R., Calderón-Contreras, R., Nava-Bernal, G. y Franco, S. (2013). Analysis of fragmentation processes in high-mountain forests of the Centre of Mexico. American Journal of Plant Sciences, 4, 697–704. https://doi.org/10.4236/ajps.2013.43A088
Endara, A. R., Heredia, R. L., García, L. A., Luna, A. A. y Aguirre, J. J. (2023). Distribución espacial del descortezador Dendroctonus adjunctus Blandford, 1897 (Coleoptera: Curculionidae, Scolytinae) en dos bosques de alta montaña del centro de México. Acta Zoológica Mexicana, 39, e3911. https://doi.org/10.21829/azm.2023.3912569
Endara-Agramont, A. R., Heredia-Bodadilla R. L., García-Almaraz, L. A., Luna-Gil, A. A., Franco-Mass, S. y Cibrián-Llanderal, V. D. (2022). Factores asociados con la distribución espacial de muérdagos enanos en dos poblaciones de Pinus hartwegii del centro de México. Revista Mexicana de Biodiversidad, 93, e935008. https://doi.org/10.22201/ib.20078706e.2022.93.5008
Estrada-Contreras, I., Ruiz-Montiel, C., Ibarra-Zavaleta, S. P., Sánchez-Velásquez, L. R., Hoyos-Rivera, G. J., Cristóbal-Salas, A. et al. (2022). Predicting distribution overlaps between Dendroctonus adjunctus Blandford 1897 and six Pinus species in Mexico under global climate change. Canadian Journal of Forest Research, 52, 1201–1211. https://doi.org/10.1139/cjfr-2022-0022
Farjon, A., de la Rosa, J. A. P. y Styles, B. T. (1997). A field guide to the pines of Mexico and Central America. Kew, Reino Unido: Royal Botanic Gardens.
Farrell, B. D., Sequerira, A. S., O’Meara, B. C., Normark, B. B., Chung, J. H. y Jordal, B. H. (2001). The evolution of agriculture in beetles (Curculionidae Scolytinae and Platypodinae). Evolution, 55, 2011–2027. https://doi.org/10.1111/j.0014-3820.2001.tb01318.x
Ferrenberg, S. (2020). Dwarf mistletoe infection interacts with tree growth rate to produce opposing direct and indirect effects on resin duct defenses in lodgepole pine. Forests, 11, 222. https://doi.org/10.3390/f11020222
Gallardo-Salazar, J. L., Lindig-Cisneros, R. A., López-Toledo, L., Endara-Agramont, A. R., Blanco-García, A. y Sáenz-Romero, C. (2023). Analysis of the vigor of Pinus hartwegii Lindl. along an altitudinal gradient using uav multispectral images: evidence of forest decline possibly associated with climatic change. Forests, 14, 1176. https://doi.org/10.3390/f14061176
García-Navarrete, P. G., Soria-Ortiz, G. J. y González-Salazar, C. (2021). Interacciones potenciales parásito-hospedero entre el escarabajo Dendroctonus (Coleoptera: Scolytidae) y Pinus (Pinaceae) en México. Revista de Biología Tropical, 69, 1004–1022. https://doi.org/10.15517/rbt.v69i3.45910
Gernandt, D. S. y Pérez-de la Rosa, J. A. (2014). Biodiversidad de Pinophyta (coníferas) en México. Revista Mexicana de Biodiversidad, 85 (Suplem.), S126–S133. https://doi.org/10.7550/rmb.32195
Hawksworth, F. (1983). Mistletoes as forest parasites. En M. Calder y P. Bernhardt (Eds.), The biology of mistletoes (pp. 320–329). Nueva York: Academic Press.
Klutsch, J. G., Beam, R. D., Jacobi, W. R. y Negrón, J. F. (2014). Bark beetles and dwarf mistletoe interact to alter downed woody material, canopy structure, and stand characteristics in northern Colorado ponderosa pine, Forest Ecology and Management, 315, 63–71. https://doi.org/10.1016/j.foreco.2013.12.024
Lanier, G. N., Hendrichs, J. P. y Flores, J. E. (1988). Biosystematics of the Dendroctonus frontalis (Coleoptera: Scolytidae) complex. Annals of the Entomological Society of America, 81, 403–418. https://doi.org/10.1093/aesa/81.3.403
Lombardero, M. J., Ayres, M. P., Lorio Jr., P. L. y Ruel, J. J. (2002). Environmental effects on constitutive and inducible resin defenses of Pinus taeda. Ecology Letters, 3, 329–339. https://doi.org/10.1046/j.1461-0248.2000.00163.x
Macías, S. J., Domínguez, A. N., López, J. C. y Mérida, R. A. (2004). Monitoreo de descortezadores y sus depredadores mediante el uso de semioquímicos. Manual operativo. Tapachula, Chiapas, México: ECOSUR/ Conafor/ Comisión Nacional de Áreas Naturales Protegidas/ USDA Forest Service.
Martínez, S. M., Madrigal, H. S., Vázquez, C. I., Velasco, B. E., Morales, N. C. y Villareal, G. F. (2015). Efecto de Arceuthobium vaginatum (Willd.) Presl. subsp. vaginatum en Pinus hartwegii Lindl. en Colima. Revista Mexicana de Ciencias Forestales, 6, 44–55. https://doi.org/10.29298/rmcf.v6i29.215
Martínez-Martínez, N., Ramírez-Dávila, J. F., Lara-Vázquez, F. y Figueroa-Figueroa, D. K. (2021). Distribución espacial de muérdago enano en la Reserva de la Biosfera Mariposa Monarca. Colombia Forestal, 22, 65–81. https://doi.org/10.14483/2256201X.17163
Mathiasen, R. L. (2019). Susceptibility of red fir and white fir to fir dwarf mistletoe (Arceuthobium abietiunum) in California. Forest Pathology, 2019, e12516. https://doi.org/10.1111/efp.12516
Mayer, H. y Ott, E. (1991). Gebirgswaldabau-Schutzwaldpflege: ein waldbauulicher Beitrag zur Landschaftsokologie und zum Umweltschutz (Silviculture in mountain forest-management of protection forest: a silvicultural contribution to landscape ecology and environmental protection). 2a Ed. Gustav Fischer, Stuttgart.
Pérez-Miranda, R., González-Hernández, A., Velasco-Bautista, E., Romero-Sánchez, M. E., Arriola-Padilla, V. J., Acosta-Mireles, M. et al. (2021). Análisis temporal de la distribución de Dendroctonus mexicanus Hopkins (1905) en México (2009-2018). Revista Mexicana de Ciencias Forestales, 12, 27–55. https://doi.org/10.29298/rmcf.v12i67.1079
Perusquía, O. J. (1978). The pine bark beetles, Dendroctonus spp.: taxonomy and distribution. Boletín Técnico Núm. 55. México D.F.: Instituto de Investigaciones Forestales, Secretaría de Agricultura y Recursos Hidráulicos.
Queijeiro-Bolaños, M. E. y Cano-Santana, Z. (2015). Dinámica temporal de la infestación por muérdago enano (Arceuthobium globosum y A. vaginatum) en Zoquiapan (Parque Nacional Iztaccíhuatl Popocatépetl), México. CienciaUAT, 9, 6–14. https://doi.org/10.29059/cienciauat.v9i2.705
Queijeiro-Bolaños, M., Cano-Santana, Z. y García-Guzmán, G. (2014). Incidence, severity, and aggregation patterns of two sympatric dwarf mistletoe species (Arceuthobium spp.) in Central Mexico. European Journal of Forest Research, 133, 297–306. https://doi.org/10.1007/s10342-013-0762-6
Quintero-Gradilla, S. D., Jardel-Peláez, E. J., Cuevas-Guzmán, R., García-Oliva, F. y Martínez-Yrizar, A. (2019). Cambio postincendio en la estructura y composición del estrato arbóreo y carga de combustibles en un bosque de Pinus douglasiana de México. Madera y Bosques, 25, 1–14. https://doi.org/10.21829/myb.2019.2531888
Raffa, K. F., Aukema, B. H., Bentz, B. J., Carroll, A. L., Hicke, J. A., Turner, M. G. et al. (2008). Cross-scale drivers of natural disturbances prone to anthropogenic amplification: the dynamics of bark beetle eruptions. BioScience, 58, 501–517. https://doi.org/10.1641/B580607
Rojas-García, F., Fredericksen, T.S., Vazquez-Lozada, S. y Endara-Agramont, A. R. (2019). Impact of timber harvesting on carbon storage in montane forests of central Mexico. New Forests, 50, 1043–1061. https://doi.org/10.1007/s11056-019-09714-z
Ruiz, M. M. A. (1994). Estudio taxonómico de los muérdagos (Loranthaceae) del Nevado de Colima y Volcán de Fuego, Jalisco-Colima, México (Tesis). División de Ciencias Biológicas y Ambientales, CUCBA. Universidad de Guadalajara, México.
Ruiz-González, C. G., Méndez-González, J., Cambrón-Sandoval, H., García-Aranda, A., Montoya-Jiménez, C. y Sosa-Díaz, L. (2018). Distribución altitudinal y estacional de Dendroctonus adjunctus Blandford y Dendroctonus brevicomis Leconte en Coahuila, México. Revista Fitotec-
nia Mexicana, 41, 519–526. https://doi.org/10.35196/rfm.2018.4-A.519-526
Rzedowski, J. y Calderón, R. C. (2011). Flora del bajío y de regiones adyacentes. VISCACEAE, Fascículo 170. Instituto de Ecología, A.C. Centro Regional del Bajío, Pátzcuaro, Mich.
Sáenz-Romero, C., Mendoza-Maya, E., Gómez-Pineda, E., Blanco-García, A., Endara-Agramont, A., Lindig-Cisneros, R. et al. (2020). Recent evidence of Mexican temperate forest decline and the need for ex situ conservation, assisted migration, and translocation of species ensembles as adaptive management to face projected climatic change impacts in a megadiverse country. Canadian Journal of Forest Research, 50, 843–854. https://doi.org/10.1139/cjfr-2019-0329
Salinas-Moreno, Y., Mendoza, G. M., Barrios, M. A., Cisneros, R., Macías-Sámano, J. y Zúñiga, G. (2004). Areography of the genus Dendroctonus (Coleoptera: Curculionidae: Scolytinae) in Mexico. Journal of Biogeography, 31, 1163–1177. https://doi.org/10.1111/j.1365-2699.2004.01110.x
Salinas-Moreno, Y., Vargas, C. F., Zúñiga, G. J., Ager, A. y Hayes, J. L. (2010) Atlas de distribución geográfica de los descortezadores del género Dendroctonus (Curculionidae: Scolytinae) en México. Ciudad de México: Instituto Politécnico Nacional/ Comisión Nacional Forestal.
Sánchez-González, A. (2008). Una visión actual de la diversidad y distribución de los pinos de México. Madera y Bosques, 14, 107120. https://doi.org/10.21829/myb.2008.1411222
Sibson, R. (1982). A brief description of natural neighbor interpolation. En John Wiley y Sons (Eds.), Interpolating multivariate data (pp. 21–36). Nueva York.
Sivicoff (2022). Programa operativo estatal de sanidad forestal para el estado de Jalisco. Zapopan, Jalisco. Comité Técnico Estatal de Sanidad Forestal Jalisco, Comisión Nacional Forestal.
Sosa, D. L., Méndez, G. J., García, A. M., Cambrón, S. V., Villarreal, Q. J., Ruiz, G. C. et al. (2018). Distribución potencial de barrenadores, defoliadores, descortezadores y muérdagos en bosques de coníferas de México. Revista Mexicana de Ciencias Forestales, 9, 187–208. https://doi.org/10.29298/rmcf.v9i47.159
Styles, B. T. (1993). Genus Pinus: a Mexican purview. (pp. 397-420). En T. P. Ramamoorthy y A. Lot (Eds.), Biological diversity of Mexico: origins and distribution (pp. 397–420). New York: Oxford University Press.
Vázquez-Ochoa, M. F., Sánchez-Velásquez, L. F., Hernández-Vargas, G., Ibarra-Zavaleta, S. P., Ruiz-Montiel, C. y Pineda-López, M. (2022). La presencia de Dendroctonus es diferente entre especies de pinos y sus diámetros en la región del Parque Nacional Cofre de Perote, México. Revista Mexicana de Biodiversidad, 93, e934048. https://doi.org/10.22201/ib.20078706e.2022.93.4048
Villaseñor, J. L. (2016). Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017
Wood, D. L. (1982). The role of pheromones, kairomones, and allomones in the host selection and colonization behavior of bark beetles. Annual Review of Entomology, 27, 411–446. https://doi.org/10.1146/annurev.en.27.010182.002211




