Librado Sosa-Díaz, José René Valdez-Lazalde *, Gregorio Ángeles-Pérez, Héctor Manuel de los Santos-Posadas y Lauro López-Mata
Colegio de Postgraduados, Campus Montecillo, Km. 36.5 Carr. México-Texcoco, 56264 Montecillo, Estado de México, México
*Autor para correspondencia: valdez@colpos.mx (J.R. Valdez-Lazalde)
Recibido: 10 de junio 2023; aceptado: 22 febrero 2024
Resumen
La identificación de centros de diversificación es útil para planear la conservación del germoplasma de las especies. El objetivo del estudio fue determinar las localidades que actuaron como centros de diversificación del género Pinus en México e identificar las zonas con mayor riqueza de especies de pino en la actualidad. Se construyó una base de datos de presencia (BDO) y registros fósiles (RF) para el género. A partir de ésta, se creó una malla de ~ 10 × 10 km y se determinaron centros de riqueza (CRP), centros de riqueza genética (CRG) y centros de alta diversidad (CAD) para Pinus. La coincidencia espacial de CRG, CAD y RF permitió sugerir posibles centros de diversificación de pinos (CDP). Se calculó un valor de importancia para cada CRP con base en parámetros de endemismo, rareza y riqueza de especies de pino. Se identificaron 16 CRP y 5 CDP. Los 3 CRP de mayor importancia en el país se ubican en zonas de Durango-Chihuahua (1), Coahuila-Nuevo León (2) y colindancias entre Jalisco-Zacatecas-Nayarit (3).
Palabras clave: Alta diversidad; Distribución de especies; Endemismo; Riqueza genética
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Richness areas and probable diversification centers of Pinus in Mexico
Abstract
Identifying centers of diversification is useful for species germplasm conservation planning. The study objective was to determine the localities that acted as centers of diversification of the Pinus genus in Mexico and to identify current areas with the highest pine species richness. An occurrence database (BDO) and fossil records (RF) were built for the species. From this, a mesh of ~10 × 10 km was created and Centers of Pine Richness (CRP), Centers of Genetic Richness (CRG) and Centers of High Diversity (CAD) were determined. The spatial coincidence of CRG, CAD and RF allowed us to suggest possible Centers of Pine Diversification (CDP). An importance value was calculated for each CRP based on parameters of endemism, rarity, and species richness. 16 CRP and 5 CDP were identified. The 3 most important CRPs in the country are located in areas of Durango-Chihuahua (1), Coahuila-Nuevo León (2) and the boundaries between Jalisco-Zacatecas-Nayarit (3).
Keywords: High diversity; Species distribution; Endemism; Genetic richness
Introducción
El género Pinus (Pinaceae) es el grupo de coníferas más exitoso en la actualidad (Farjon, 1996), ha colonizado y domina un gran número de ambientes en el hemisferio norte, particularmente de México (Keeley, 2012; Rueda et al., 2017). Esta diversidad de pinos mexicana ha sido documentada suficientemente en revisiones generales (Farjon, 1996; Gernandt y Pérez-de la Rosa, 2014; Sáenz-Ceja et al., 2022), monografías y listados florísticos (Farjon y Filer, 2013; Sánchez-González, 2008; Villaseñor, 2016). México es también considerado un centro secundario de diversificación de Pinus (Gernandt y Pérez-de la Rosa, 2014; Millar, 1999). Sin embargo, la evidencia de la ubicación geográfica de dichos eventos es escasa.
Un centro de diversificación secundario puede entenderse como aquella región en la que un linaje ancestral dio origen a nuevas especies o nuevos linajes de especies (Millar, 1993). La identificación de centros de diversificación es útil para la conservación del germoplasma original de las especies y para estudiar los mecanismos de selección de plantas para uso humano (Fortuny-Fernández et al., 2017) y, por lo tanto, para la toma de decisiones asociadas a la planeación de acciones y políticas para la conservación y uso de la biodiversidad (Cruz-Cárdenas et al., 2013; Riemann y Exequiel, 2007). Una vez identificado el centro de diversificación de una especie o género, es relevante medir sus parámetros de riqueza y endemismo para posibilitar su monitoreo a mediano y largo plazo (Cruz-Cárdenas et al., 2013).
Existen diversas métricas para cuantificar la riqueza biológica. Algunas de uso común son los índices de riqueza, diversidad, dominancia, complementariedad, etc. Para espacios geográficos amplios se han diseñado técnicas como el análisis de punto a cuadrícula (Hijmans et al., 2012), un enfoque ampliamente aplicado al estudio de la flora mexicana (Contreras-Medina y Luna-Vega, 2007; Cruz-Cárdenas et al., 2013; Estrada-Sánchez et al., 2019; González-Espinosa et al., 2004; Ramos-Dorantes et al., 2017; Salinas-Rodríguez et al., 2018; Villaseñor et al., 2006). Sin embargo, la combinación de medidas de diversidad y el análisis de cuadrículas para predecir la riqueza y diversidad en el espacio geográfico de especies de importancia económica y ecológica, como los pinos, ha sido poco abordado en México y el mundo.
Lo descrito anteriormente destaca la importancia de comprender los aspectos históricos y biogeográficos actuales de especies de alto valor económico como los pinos. Esta investigación contribuye a responder preguntas relevantes para México como: ¿dónde se encuentran las áreas de mayor riqueza de Pinus? ¿dónde se ubican los centros probables de diversificación de Pinus? ¿cuáles son las áreas geográficas de mayor importancia para el género? todas enmarcadas en la hipótesis: ¿es posible identificar centros de diversificación del género Pinus en México, en función de la riqueza genética, alta diversidad y registros fósiles? Los objetivos del estudio fueron: identificar las áreas de mayor riqueza de Pinus, determinar las zonas más probables de diversificación de Pinus y generar un valor de importancia basado en criterios de riqueza, endemismo y rareza de pinos para las principales áreas de riqueza del género en México.
Materiales y métodos
En este estudio, la riqueza de especies se interpreta como el conteo de especies registradas en un sitio (Magurran, 1988). La riqueza genética refiere al grado de variación del material genético entre poblaciones de una especie; se consideró como centro de riqueza genética aquellas regiones donde se concentra la mayor cantidad de poblaciones, asumiendo que las regiones con mayor número de poblaciones serán genéticamente más diversas (Conabio, 2007). Los centros de alta diversidad se entienden como aquellos sitios con valores altos de un índice de diversidad biológica. El concepto de endemismo se aplica como un indicador de restricción en la distribución geográfica de las especies.
La figura 1 esquematiza el flujo de trabajo realizado para alcanzar los objetivos del presente estudio. Los párrafos precedentes detallan los procedimientos realizados en cada una de las etapas del análisis.
Se construyó una base de registros fósiles y datos de presencia (BDO) de especies de Pinus que se distribuyen de forma natural en México. Se consultaron fuentes de datos especializadas como Global Biodiversity Information Facility (www.gbif.org/), Sistema Nacional de Información sobre Biodiversidad de México (www.snib.mx/), Red Mundial sobre Información sobre Biodiversidad (http://www.conabio.gob.mx), SEINet (www.swbiodiversity.org)
y revisión de literatura científica mediante motores de búsqueda web (e.g., Google Scholar, Springer, Scopus; con juegos de palabras: “especie”, “latitud”, “longitud”, “coordenadas”, “Pinus”, “México”) en idioma español
e inglés.
Posteriormente, se depuró la BDO eliminando datos sin coordenadas, mal georreferenciados y duplicados (de una especie) en pixeles de 1 km2. Se consideraron como válidas las entidades taxonómicas definidas en publicaciones recientes (Buck et al., 2020, 2023; Farjon, 2018; Montes et al., 2019, 2022; Pérez-de la Rosa & Gernandt, 2017; Willyard et al., 2017, 2021) y se consultaron sitios especializados (http://www.worldfloraonline.org/, https://powo.science.kew.org/) para asignar nombres intraespecíficos a cada especie. Adicionalmente, la BDO se filtró con base en el rango altitudinal reportado en la literatura para cada especie de Pinus (Farjon, 2017; Farjon y Filer, 2013), excluyendo datos cuando la combinación ambiental de esos sitios se ubicó fuera de la combinación de los mismos factores para el rango altitudinal reportado en la literatura (material suplementario: fig. S1).
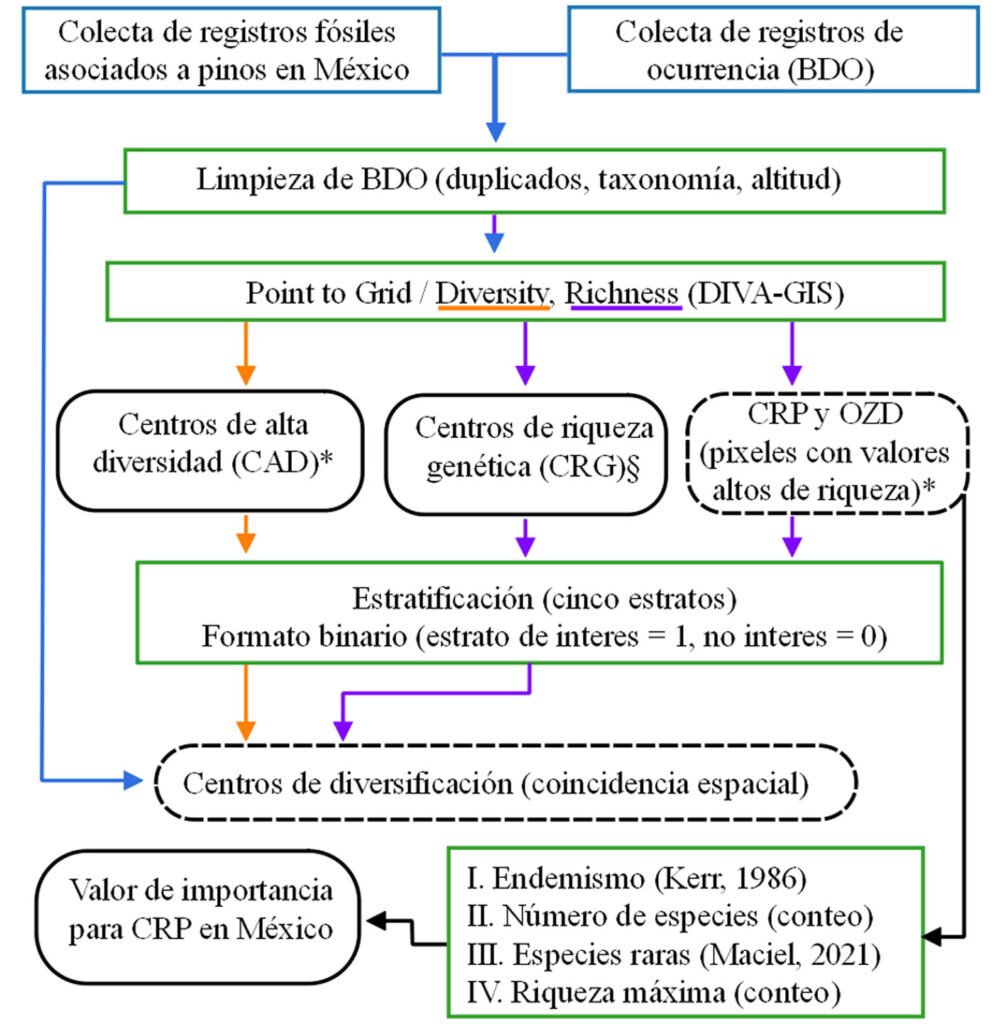
Figura 1. Esquema de trabajo seguido para la identificación de centros de alta diversidad, riqueza genética y posibles centros de diversificación del género Pinus en México. Información inicial (azul), procesos y algoritmos (verde), principales configuraciones de procesos y algoritmos (naranja y morado) y productos generados (bordes redondos) durante este estudio. Los principales objetivos de la investigación se muestran con borde segmentado. Tamaño de pixel de ~ 10 x 10 km con: tipo de vecindad simple (*) y circular de un grado sexagesimal (§).
A partir de la BDO, inicialmente se realizó un análisis de “Point to grid/ Richness/ Number of different classes” con vecindad simple (~ 10 × 10 km) en el programa DIVA-GIS v. 7.5.0 (Hijmans et al., 2012), asignando a cada pixel el número de especies contabilizado dentro del mismo, lo cual constituyó la riqueza observada. Posteriormente, se identificaron y seleccionaron conglomerados de pixeles contiguos a los que se llamó centros de riqueza de pinos (CRP). Considerando que la BDO no proviene de un muestreo geográficamente uniforme, se observaron otros grupos de pixeles no contiguos donde se presentaron valores importantes de riqueza. Tales conjuntos se agruparon y se nombraron como otras zonas dispersas de riqueza de pinos (OZD). La delimitación de los CRP y OZD se realizó de forma manual mediante un sistema de información geográfica (Quantum GIS Team Development, 2019) y se numeraron de forma consecutiva solo con propósito de identificación —no representa valor de importancia. Para identificar de forma puntual pixeles de mayor riqueza, los datos de riqueza observada a nivel pixel se clasificaron en 5 estratos mediante el método de intervalos geométricos (1 = muy baja, 2 = baja, 3 = media, 4 = alta y 5 = muy alta). Los pixeles pertenecientes al estrato superior (5 = muy alta) fueron considerados los sitios con mayor riqueza de especies de pinos dentro de los CRP y OZD (fig. 2). De acuerdo con Arenas-Navarro et al. (2020), se calculó el cociente (Es) entre la riqueza observada y la riqueza estimada (estimador no paramétrico de Chao2) por pixel, como un indicador de la calidad de las celdas resultantes del análisis de punto a cuadrícula. Los estimadores no paramétricos (e.g., Chao2) tienen la particularidad de ser menos sesgados que los de tipo paramétrico (Brose et al., 2003).
Partiendo de la BDO, mediante el módulo “Point to grid/ Richness/ Number of observations” de DIVA-GIS (Hijmans et al., 2012), se realizó un análisis punto a cuadrícula para delimitar, a nivel especie, las zonas geográficas con mayor número de presencias, lo que se tradujo en zonas de mayor riqueza genética a nivel especie (Conabio, 2007; fig. 3A-D). Para ello, se utilizó una resolución espacial (tamaño de pixel) de 0.083 grados sexagesimales (~ 10 × 10 km). Para cada especie analizada, el procedimiento generó 5 estratos (intervalo igual) de abundancia de registros de presencia (fig. 3A, B). Se nombró como centro de riqueza genética (CRG) solo al estrato superior (fig. 3C), el cual se convirtió a formato binario (1 = CRG; 0 = área sin interés; fig. 3D). De esta forma se delimitó el CRG para cada especie incluida en la BDO. Finalmente, los CRG a nivel especie se sobrepusieron espacialmente para determinar los CRG a nivel género en México.
Se utilizó el índice alfa de Fisher para estimar la diversidad de especies de Pinus a nivel pixel (~ 10 × 10 km) (Fisher et al., 1943). A pesar de que alfa de Fisher (α) es poco utilizado actualmente, decidimos utilizarlo por 2 razones: no se dispuso de datos de densidad de las especies de pino a nivel localidad y a diferencia de otros índices como Shannon-Wiener, Simpson, Margalef, Menhinick, entre otros, de uso común para propósitos similares, α es poco sensible al número de individuos muestreados, a la presencia de especies raras o comunes y al tamaño del área estudiada (Magurran, 1988). Adicionalmente, a excepción de α, los índices antes mencionados son adecuados para medir la heterogeneidad de especies localmente (Peet, 1974), por lo que al manejar unidades de estudio de gran tamaño (pixel de 10 × 10 km) en este estudio, consideramos que α es el índice más adecuado para los propósitos planteados.
Las estimaciones de α a nivel pixel se realizaron mediante el programa PAST v. 4.03 (Hammer et al., 2001). Posteriormente, mediante el método de reclasificación de intervalos geométricos se definieron 5 estratos de las predicciones de α (1 = muy baja, 2 = baja, 3 = media, 4 = alta y 5 = muy alta diversidad), de los cuales solo se retuvo el estrato superior y se convirtió a formato binario para representar los centros de alta diversidad (CAD) de Pinus en México.
Los posibles CDP en México se identificaron como aquellas áreas de coincidencia espacial (intersección) entre los CRG (nivel género) y los CAD (Santillán-Fernández et al., 2021), además de la presencia cercana a estas áreas de fósiles de Pinus. Partimos del supuesto que el registro fósil en áreas de alta riqueza del género Pinus, o cerca de éstas, indica la presencia del género Pinus desde épocas ancestrales.
Se generó un valor de importancia para cada área de riqueza en función de 4 criterios: I) valor promedio de endemismo, II) número de especies que se distribuyen en el área, III) número de especies raras y IV) riqueza máxima de especies por pixel (~ 10 × 10 km). El indicador I se obtuvo utilizando el método propuesto por Kerr (1997), que es la sumatoria del inverso al número de pixeles donde aparece cada especie, obteniendo el valor final mediante el promedio de todos los pixeles del área. Este método ha sido aplicado para identificar zonas de endemismo de plantas mexicanas (Estrada-Sánchez et al., 2019; Riemann y Exequiel, 2007; Villaseñor et al., 2006). Para el indicador III, se utilizó el índice de rareza propuesto por Maciel (2021), el cual genera un valor en función del rango geográfico, especificidad de hábitat y abundancia (número de presencias de la especie por pixel, en este trabajo) de la especie (Maciel, 2021). Se utilizó la mediana del índice de rareza para definir especies raras y comunes (material suplementario: tabla S1). Para estimar los indicadores II y IV, se contó el número de taxones distribuidos en el área y el número máximo de ellos en un pixel, respectivamente. Finalmente, los criterios I, II, III y IV fueron normalizados a valores en intervalo de 0 a 1 (para cada puntaje obtenido se restó valor mínimo de ese criterio y ésto se dividió entre la diferencia del máximo y el mínimo del mismo criterio) y se sumaron para obtener un valor final de importancia para cada CRP y OZD.
Resultados
Se consideraron como válidas 48 especies del género Pinus (material suplementario: tabla S1) que se distribuyen de manera total o parcial en México. El número de registros que integraron la BDO después del proceso de limpieza fue de 32,030 (un registro por especie dentro de 1 km2), de los cuales solo 64.6% (20,709) se ubican dentro del territorio mexicano. Las fuentes que aportaron mayor cantidad de datos a la base final fueron GBIF (67.1%), SEINet (12.4%), SNIB (8.5%), literatura científica (7.1%) y un porcentaje menor para otras fuentes. Así mismo, 18.8% de las 48 especies tuvo más de 1,000 registros, 60.4% entre 100 a 1,000 registros, 6.3% entre 50 y 99, y 14.6% menos de 50 registros. La especie con más registros fue P. leiophylla (3,555 registros) y la de menos P. vallartensis (9 registros), una especie descrita recientemente en el occidente de México. El 24.3% de las presencias se registró antes de 1980, 24% entre 1981 y 2000, y el restante 58.1% entre 2001 y mediados
de 2022.
El promedio del indicador de calidad de celdas en cada CRP y OZD varió entre 0.87 y 0.98 (material suplementario: tabla S1). Los valores de riqueza por pixel variaron entre 1 y 13 (fig. 2A). Las clases alta y muy alta de riqueza observada se restringieron a zonas concretas de la sierra Madre Occidental (SMOc), sierra Madre Oriental (SMOr), sierra Madre del Sur (SMS) y sierras de Chiapas (fig. 2Aa). Los pixeles con menor riqueza observada se registraron principalmente en la periferia de los relieves antes mencionados (fig. 2A). El estrato de muy alta riqueza (estrato 5 de riqueza observada; fig. 2Aa) va de 6 a 13 especies y se ubicaron de forma muy dispersa en algunas zonas de Durango, Chihuahua, Nuevo León, Jalisco, Michoacán, México, Guerrero, Oaxaca y Chiapas (pixeles rojos, fig. 2B).

Figura 2. Riqueza observada (A), riqueza observada estratificada (Aa) y áreas de riqueza de especies de Pinus (B) en México. En la simbología de B, el número en paréntesis indica el número de especies presentes en el área definida. Por ejemplo, CRP_1 (9) indica que en el área CRP_1 se registró la presencia de 9 especies; no indica que 9 especies fueron observadas en cada pixel (~ 10 x 10 km) del área. Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
El análisis de punto a cuadrícula detectó 10 conglomerados de CRP y 6 de OZD (fig. 2B). Es importante reiterar que el número de especies mencionados en este párrafo —número entre paréntesis en la fig. 2B— no indican que tal número se observó en cada pixel que forma parte del CRP u OZD, sino que se identificó al menos un registro de cada especie en algún pixel de dicha zona. En las áreas compactas, el mayor número de especies fue 21 (CRP_2) y el menor fue 9 (CRP_1; Baja California). En la SMOc se ubicó el área de riqueza de mayor tamaño (CRP_2), mientras que en la porción michoacana de la SMS se ubicó la de menor extensión (OZD_5). En la zona centro-oriental de la FVT se identificaron 3 áreas (CRP_4, 5, 6), cuyo número de especies aumenta de 15 en la zona este a 17 en la zona oeste. En la zona media de la SMOr se identificó un área compacta (CRP_3) y 2 áreas dispersas (OZD_4 y OZD_6) en los extremos sur y norte, respectivamente. Las OZD figuran en la periferia de las áreas compactas (fig. 2B).
Las zonas dispersas (OZD) que contaron con alto número de especies fueron el oeste de la FVT (OZD_3; sur de Zacatecas, Jalisco y Nayarit; 21 especies) y el sur de la SMOr (18 especies, Querétaro, San Luis Potosí; OZD_4), mientras que la sierra sur de Michoacán (OZD_5) fue el área de pixeles dispersos con menor presencia de especies de pino (8 especies). Finalmente, algunas áreas como CRP_1, CRP_9, OZD_2 y OZD_4 tuvieron nula o muy poca presencia de pixeles de muy alta riqueza de pinos (fig. 2B).
La delimitación de la zona de mayor concentración de presencia para cada taxón en la BDO identificó el CRG para cada especie (fig. 3A-D). Los CRG identificados representan áreas pequeñas dispersas en el territorio, ubicadas principalmente en la zona sur de la SMOc y este de la FVT, la zona media de la SMOr (Coahuila y Nuevo León) y algunas áreas en las zonas montañosas de Oaxaca y Chiapas (fig. 3E-G). En algunas zonas geográficas se observaron coincidencias del CRG para más de 1 especie, siendo las más notables en el sureste de Durango (fig. 3E-G), en colindancias entre Coahuila y Nuevo León (fig. 3F) y en Chiapas (fig. 3E-G). Para las especies con presencia periférica en México (e.g., Pinus coulteri y P. lambertiana) los CRG se detectaron fuera del territorio mexicano. Por otro lado, aunque no fueron coincidentes espacialmente, estados como Oaxaca, Jalisco, Durango y Michoacán mostraron CRG para más de 1 especie. De manera contraria, aunque se presentan 9 especies en el CRP_1, solo se observó el CRG para P. quadrifolia y P. jeffreyi al igual que para el OZD_5 que únicamente representó el CRG para P. rzedowskii (fig. 3F).
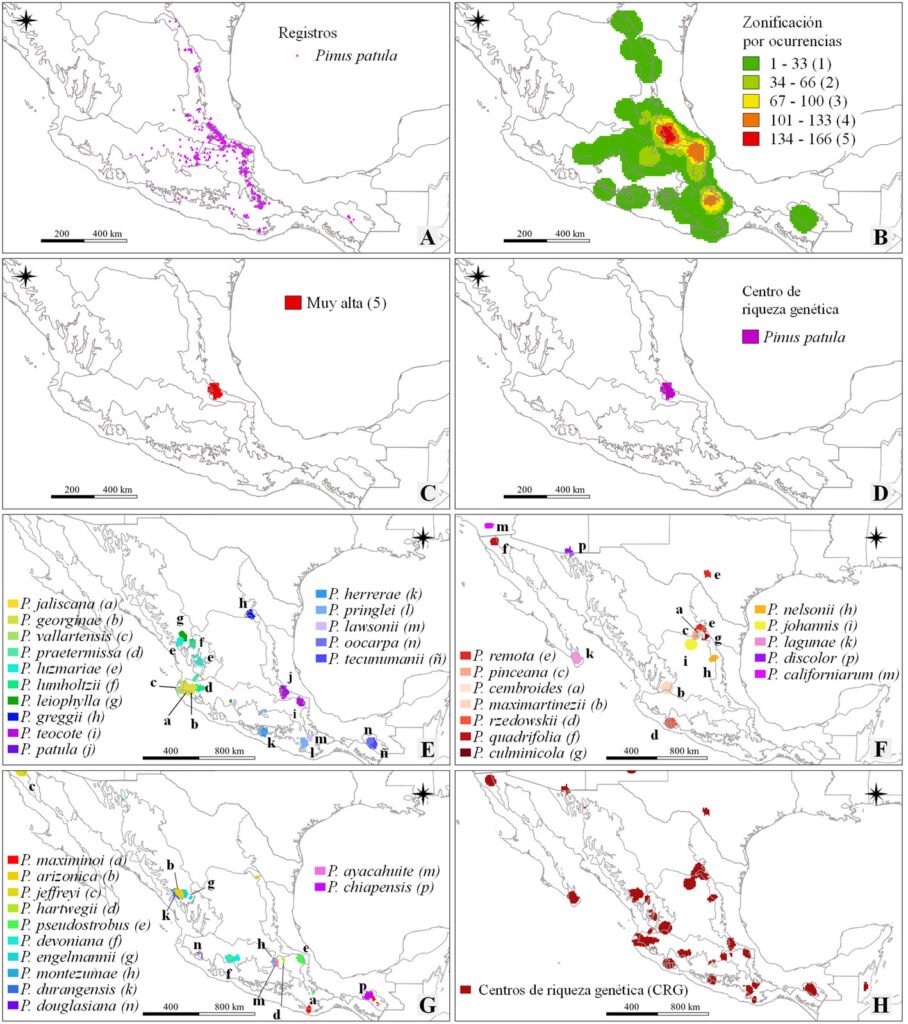
Figura 3. Ejemplo de la determinación del centro de riqueza genética (CRG) para Pinus patula (A-D) y centro de riqueza genética para especies de la subsección Australes (E), Cembroides y Nelsoniae (F), Ponderosae y Strobus (G) y a nivel género (H). Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
La distribución espacial del estrato superior (estrato 5 = muy alta diversidad) de α, definido como CAD, se ubicó principalmente en zonas de la SMOc, SMOr, FVT, además de algunas secciones de la SMS y muy poca presencia en los macizos montañosos de Chiapas. De manera más puntual, la mayor cantidad de pixeles de CAD se observó en la FVT, Chihuahua, Durango y Oaxaca, otros pixeles más aislados se identificaron entre Coahuila y Nuevo León, Guerrero y Chiapas (fig. 4).
El cálculo del índice alfa de Fisher (α) por pixel mostró diferencias importantes por zona geográfica. Los valores más altos se observaron en zonas particulares de los sistemas montañosos más importantes de México (fig. 4). Los estados de Chihuahua, Durango, Nuevo León, Michoacán, Oaxaca y algunas zonas de la FVT presentaron pixeles con los valores más altos de α (fig.4). En los CRP y OZD, el promedio de α varió de 0.9 (OZD_6) a 2.3 (CRP_8). El valor máximo por pixel, α = 20, se encontró para los CRP_7 (sierra norte de Oaxaca) y CRP_4 (Michoacán), aunque Chihuahua y Durango (CRP_2) y la sierra sur de Oaxaca (CRP_8) también exhibieron valores máximos altos (α = 18.6) por pixel. Por el contrario, el valor máximo de menor magnitud de α por pixel dentro de un CRP u OZD fue de 9.3 (Baja California, Guerrero, Chiapas, San Luis Potosí y Querétaro; fig. 4). La menor variabilidad (segundo valor del paréntesis en tabla de la fig. 4) en las predicciones de α se presentó para el CRP_1 (Baja California), mientras para el CRP_8 (sierra sur de Oaxaca) se observó lo contrario.
La coincidencia espacial (intersección) de los centros de alta diversidad (CAD) y los centros de riqueza genética (CRG) de los pinos mexicanos fue evidente en algunas zonas de los principales sistemas montañosos de México (fig. 5). Lo anterior, conjuntamente con los registros de fósiles de Pinus encontrados en México, permitió la identificación de áreas que, argumentamos, tienen una alta probabilidad de haber sido centros de diversificación para Pinus en el pasado. Entre estas áreas destaca el extremo norte de la SMOc (Chihuahua y Sonora; 1), la zona media de la SMOr (sur de Coahuila, Nuevo León y Tamaulipas; 2), el centro-este de la FVT (3) y otras zonas sureñas como los macizos montañosos de Chiapas (4) y la sierra sur de Oaxaca (5). Para áreas como Baja California, sur de SMOc y oeste de la FVT no se encontró material fósil (fig. 5), aunque para las 2 últimas existe una alta coincidencia entre CAD y CRG de pinos.
Zonas de mayor importancia para Pinus en México
El cálculo de endemismo, riqueza de especies, rareza y riqueza máxima por pixel, posibilitó la asignación de un valor de importancia para cada CRP y OZD. El área ubicada en la zona media de la SMOc (CRP_2; Durango y Chihuahua) presentó el mayor número de especies (21) y riqueza máxima (13), por lo que obtuvo también el mayor valor de importancia, 3.471 (tabla 1). En orden decreciente, siguieron la zona intermedia de la SMOr (CRP_3) y la zona ubicada en el este de la FVT (OZD_3). El CRP_3 obtuvo el segundo valor más alto en los criterios de endemismo (tabla 1) y la OZD_3 presentó el mayor número de especies raras y el número máximo de especies presentes (21). El valor de importancia para dichas áreas fue 3.056 (CRP_3) y 2.601 (OZD_3).
Algunas zonas con valores medios de importancia son el CRP_4, CRP_7 y OZD_4, los cuales presentaron niveles intermedios de riqueza máxima (12, 12 y 9 especies, respectivamente) y especies raras (5 en promedio; tabla 1). Las áreas que presentaron los valores más bajos de importancia fueron las ubicadas en la sierra sur de Michoacán (OZD_5; 0.287), el noroeste de México (CRP_1; 0.635) y el sistema montañoso costero de Chiapas (OZD_2; 0.661; tabla 1). De forma general, se observaron 7 áreas (resaltadas con negritas en tabla 1) con un valor final por arriba del promedio (1.718), las cuales podrían considerarse como las áreas de mayor importancia de Pinus en México, basándose en criterios de endemismo, rareza y riqueza.
Discusión
La delimitación de los CRP tuvo como objetivo señalar las áreas de mayor riqueza de Pinus en México. Con base en las ecorregiones de Olson et al. (2001), se observó que a lo largo de la FVT existen intervenciones de bosques secos pertenecientes a la Depresión del Balsas, similar a los que separan los macizos montañosos de Chiapas (OZD_2 y CRP_10). En el sur de San Luis Potosí (SMOr), los matorrales de la meseta central y los bosques húmedos de Veracruz interrumpen la continuidad de los bosques de pino-encino. La baja presencia de celdas con presencia de pinos en estas zonas, condujo a la delimitación de los CRP y OZD expuestos en este estudio. Además, para la SMS la regionalización basada en criterios biológicos y climáticos propuesta por Morrone (2019), muestra zonas fragmentadas cuya disposición geográfica coincide parcialmente con los CRP_7, 8, 9 y OZD_1. De forma similar, la zonificación de Suárez-Mota et al. (2013) para la FVT se asemeja geográficamente a la OZD_3 y CRP_6, mientras que los centros críticos de riqueza para musgos y senecios señalados por Villaseñor et al. (2006), coinciden geográficamente con los CRP y OZD identificados para la FVT.

Figura 4. Índice alfa de Fisher (α) para especies de Pinus en México. La tabla muestra el valor promedio (máximo, desviación estándar) por pixel de α en las áreas de riqueza de especies (CRP, OZD) definidas previamente. Tamaño de pixel ~ 10 x 10 km.

Figura 5. Centros de riqueza genética (CRG), alta diversidad (CAD) y posibles centros de diversificación (indicados con elipses y números resaltados en color amarillo) de Pinus en México —las elipses y su numeración se presentan solo con fines de visualización. Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
Se identificó un número mayor de áreas de riqueza de Pinus con respecto a estudios previos (Farjon, 1996; Sáenz-Ceja et al., 2022; Sánchez-González, 2008). Esto podría explicarse por lo siguiente: 1) el propósito de este estudio fue identificar las zonas con mayor riqueza y no el patrón general de distribución del género en México; 2) los CRP fueron identificados a partir de coordenadas provenientes de colecciones biológicas y estudios científicos, lo que no garantiza su distribución geográfica uniforme y deriva en la identificación de zonas fragmentadas y de menor tamaño y 3) diferencias metodológicas (e.g., análisis de punto a cuadrícula y modelos de distribución potencial) en la determinación de las áreas de riqueza. En relación con el número de especies, también se presentaron diferencias importantes con estudios previos. Por ejemplo, para el noroeste de México (CRP_1), se han mencionado 9, 10 y 19 especies (Farjon, 1996; Sáenz-Ceja et al., 2022; Sánchez-González, 2008, respectivamente), siendo la primera y segunda similares a las 9 registradas aquí (fig. 2B), pero con diferencias en las entidades taxonómicas. Tales variaciones pueden deberse a: 1) metodología: solo se contabilizaron las especies dentro de los pixeles incluidos en CRP_1 y no para toda la península, por lo que especies como P. lagunae (Rob-Pass.) Passini no están incluidas en la cifra mencionada (9 especies); 2) taxonomía: el nivel taxonómico empleado fue especie, con base en las entidades reconocidas por Farjon (2018) y estudios recientes sobre delimitacion de especies (Buck et al., 2020, 2023; Montes et al., 2019, 2022; Willyard et al., 2017, 2021). El número de especies observado (9, 21, 17, 16) en algunas regiones como CRP_1, 2, 3 y 7 es cercano a las 7, 20, 14 y 15 mencionadas por Sáenz-Ceja et al. (2022) respectivamente, en zonas coincidentes con las áreas de riqueza mencionadas.
Tabla 1
Valores de los criterios considerados para la asignación de un valor de importancia (V.I.) para centros de riqueza de especies de Pinus (CRP) en México. En negritas se indican los 7 CRP identificados como más importantes.
| CRP | Pixeles | E* (I) | S (II) | Sr§ (III) | Rm (IV) | V.I. |
| CRP_1 | 164 | 0.309 (0.021) | 0.077 (9) | 0.250 (4) | 0.000 (5) | 0.636 (15) |
| CRP_2 | 1212 | 0.596 (0.031) | 1.000 (21) | 0.875 (9) | 1.000 (13) | 3.471 (1) |
| CRP_3 | 280 | 0.739 (0.036) | 0.692 (17) | 0.875 (9) | 0.750 (11) | 3.056 (2) |
| CRP_4 | 164 | 0.300 (0.021) | 0.692 (17) | 0.375 (5) | 0.875 (12) | 2.242 (4) |
| CRP_5 | 274 | 0.349 (0.022) | 0.615 (16) | 0.250 (4) | 0.625 (10) | 1.840 (7) |
| CRP_6 | 299 | 0.348 (0.022) | 0.538 (15) | 0.250 (4) | 0.375 (8) | 1.511 (10) |
| CRP_7 | 159 | 0.366 (0.023) | 0.615 (16) | 0.250 (4) | 0.875 (12) | 2.106 (5) |
| CRP_8 | 136 | 0.187 (0.017) | 0.615 (16) | 0.250 (4) | 0.500 (9) | 1.552 (9) |
| CRP_9 | 133 | 0.000 (0.010) | 0.462 (14) | 0.250 (4) | 0.250 (7) | 0.962 (13) |
| CRP_10 | 107 | 0.404 (0.024) | 0.308 (12) | 0.000 (2) | 0.750 (11) | 1.461 (11) |
| OZD_1 | 112 | 0.205 (0.017) | 0.538 (15) | 0.250 (4) | 0.375 (8) | 1.369 (12) |
| OZD_2 | 107 | 0.132 (0.015) | 0.154 (10) | 0.000 (2) | 0.375 (8) | 0.660 (14) |
| OZD_3 | 345 | 0.101 (0.014) | 1.000 (21) | 1.000 (10) | 0.500 (9) | 2.601 (3) |
| OZD_4 | 164 | 0.274 (0.020) | 0.769 (18) | 0.500 (6) | 0.500 (9) | 2.043 (6) |
| OZD_5 | 38 | 0.038 (0.011) | 0.000 (8) | 0.000 (2) | 0.250 (7) | 0.288 (16) |
| OZD_6 | 89 | 1.000 (0.046) | 0.077 (9) | 0.500 (6) | 0.125 (6) | 1.702 (8) |
E = Endemismo; S = número de especies; Sr = número de especies raras; Rm = riqueza máxima por pixel; V.I. = valor de importancia (el valor entre paréntesis representa el orden de importancia); * = promedio del valor de endemismo por pixel obtenido mediante el índice de endemismo propuesto por Kerr (1997); § = la determinación de una especies rara o común se realizó con base en el índice de rareza propuesto por Maciel (2021). El orden de los valores de I a IV es el valor obtenido por la normalización del criterio (valor neto obtenido del criterio).
Algunos estudios a nivel local, como el de Ramos-Dorantes et al. (2017) mencionaron 16 especies (Puebla; CRP_6), mientras que 15 fueron las registradas en este trabajo. En inventarios florísticos de áreas naturales protegidas (ANP) como la Reserva de la Biosfera Mariposa Monarca (CRP_5), Reserva Forestal Nacional y Zona de Refugio de la Fauna Silvestre Tutuaca (CRP_2), se han reportado 15 y 12 especies, que es cercano a los observado (16 y 12) en tales sitios. Así mismo, en la Reserva de la Biosfera La Sepultura (OZD_2) y la Reserva de la Biosfera Sierra Gorda (OZD_4) se mencionan 10 y 3 especies de pino, mientras que en este estudio se registraron cifras superiores (13 y 6, respectivamente). Tales discrepancias en número de especies pueden ser posibles debido a que una especie podría presentarse dentro del CRP y estar ausente dentro de la ANP. Las ANP son espacios destinados a la conservación debido a su elevada riqueza biológica (Salinas-Rodríguez et al., 2018), por lo que se considera que pueden ser un contraste adecuado para el número de especies registrado en este estudio.
Estudios locales como el de Ríos-Altamirano et al. (2016) y Martin et al. (2021) en Oaxaca (CRP_7) describen 10 y 7 especies, respectivamente; mientras que en los pixeles que abarcan tales sitios se registraron 13 y 8 especies. En el CRP_2 (SMOc), González-Elizondo et al. (2012) mencionaron 20 especies, mientras que en este trabajo se observaron 21. Lo anterior demuestra que BDO construida y los análisis subsecuentes, son una adecuada representación de la riqueza de los pinos en México.
El aporte fundamental de los resultados de este trabajo es que puede considerarse una actualización de revisiones históricas sobre la biogeografía de Pinus (a nivel especie) en México y además, señalan de forma concreta áreas con alta riqueza, excluyendo áreas con baja o nula presencia. Sin embargo, es importante considerar que, como en cualquier análisis, los resultados dependen de los datos utilizados. Esto es relevante considerando que, recientemente, se han ventilado limitaciones y sesgos espaciales, temporales y filogenéticos de las bases digitales de registros de presencia de plantas vasculares, particularmente de la base GBIF utilizada en este trabajo (Ramírez-Barahona et al., 2023), con un aporte mayoritario de los registros de aparición (60% de total). Afortunadamente, de acuerdo con estos autores, algunas zonas montañosas de México, como aquellas que asemejan el patrón de presencia de Pinus en el país (SMOr, SMOc, FVT, SMS), son zonas con bajo sesgo espacial y temporal de recolectas de plantas vasculares (ver. fig. S4 en Ramírez-Barahona et al. [2023]). Por otro lado, en los análisis se incorporaron registros de aparición de otras fuentes (40% de los registros), lo que sin duda contribuye a disminuir los sesgos inherentes de los datos de GBIF. Además, la cercanía al valor óptimo (Es = 1) de las estimaciones sobre la calidad de las celdas (Es = 0.88 a 0.98) que formaron las áreas de riqueza de pinos identificadas aquí, sugiere una calidad suficiente para el alcance de los objetivos de este estudio (Arenas-Navarro et al., 2020).
El enfoque empleado para determinar los CRG ha sido empleado para delimitar la riqueza genética de razas de maíz en México y se desconoce su utilización en árboles (Santillán-Fernández et al., 2021). Sin embargo, existen datos que de manera indirecta podrían indicar alguna relación con los CRG identificados en este estudio. Por ejemplo, para P. greggii, Parraguirre-Lezama et al. (2002) reportaron menor número de alelos y porcentaje de polimorfismo en las poblaciones del sur (Hidalgo y Querétaro) con respecto a las del norte (Coahuila y Nuevo León), estas últimas se encuentran dentro del CRG señalado para esta especie (fig. 3E). Así mismo, García-Gómez et al. (2014) estudiaron 4 poblaciones de P. johannis y encontraron mayor número de loci polimórficos en una población (Salaverna, Zacatecas) que coincide espacialmente con el CRG identificado para esta especie (fig. 3F). El polimorfismo genético, la heterocigocidad esperada y observada, y el número de alelos, son usados para denotar diferencias en el acervo genético entre poblaciones de una especie (García-Gomez et al., 2014; González-Jiménez et al., 2021; Ledig et al., 2001).
De igual manera, poblaciones con altos valores de heterocigocidad esperada y riqueza alélica de P. remota (González-Jiménez et al., 2021) y P. pinceana (Ledig et al., 2001) coinciden espacialmente con los CRG para ambas especies (Coahuila y Nuevo León), aunque los 2 estudios citados anteriormente no han tomado en cuenta el rango completo de distribución de la especie. La evidencia anterior sugiere coincidencia geográfica entre los CRG delimitados espacialmente y la diversidad genética a nivel población, aunque se necesita mayor investigación para reforzar estos hallazgos, sobre todo con especies de amplia distribución, las cuales representan al menos 50% de este estudio.
Los valores más altos de α se ubicaron principalmente en la SMOc (Durango y Chihuahua), SMOr (Coahuila y Nuevo León), en el centro-este de la FVT y macizos montañosos de Oaxaca y Chiapas (fig. 4), emulando el patrón general de distribución del género (Rzedowski, 2006; Sáenz-Ceja et al., 2022). Aunque no existen estimaciones de α en pixeles espaciales de gran tamaño (e.g. 10 × 10 km ), sí existen estimaciones en ecosistemas con presencia de pinos, pero no exclusivamente para éstos.
En bosques mixtos de pino-encino en Oaxaca (CRP_9), Aguilar-Santelises y Castillo (2013) reportaron un α de 4.55, mientras que en rodales de la misma entidad con y sin manejo silvícola (CRP_7), Luna-Bautista et al. (2015) encontraron valores promedio de 1.778. En el sur de México (Chiapas; CRP_10), Cayuela et al. (2006) estimaron α máximo de 10.6 para rodales de pino-encino. Sánchez-González y López-Mata (2005) describen promedios de 1.01 de α en un gradiente altitudinal (bosque de encino, mixto, pino-pastizales alpinos) perteneciente al CRP_5 (este del Estado de México). En las ubicaciones de los estudios mencionados anteriormente, nuestro α fue mayor al reportado por los autores: α = 5.453, 6.376, 14.1 y 2.86 en el mismo orden. El resultado de este contraste es opuesto a lo esperado, ya que los análisis en comparación incluyeron diversos géneros de plantas (e.g. Juniperus, Arbutus, Quercus, Prunus y Alnus) y, por lo tanto, un mayor recuento de especies a nivel de sitio, lo que debería resultar en un valor mayor de α. Lo anterior podría deberse a las diferencias en el tamaño del sitio analizado. Este estudio tuvo como base de análisis pixeles de ~ 10 × 10 km, lo que posibilitó que en un pixel pudieran observarse más especies y más presencias (aunque no de la misma localidad). Contrariamente, el área muestreada en los otros estudios varió de parcelas de 400 m2 a 1,000 m2 (Cayuela et al., 2006; Luna-Bautista et al., 2015; Sánchez-González y López-Mata, 2005).
El hecho de que los CRP hayan tendido un bajo promedio de α (comparado con el máximo) pudo deberse a la distribución geográfica heterogénea de los registros presencia, que refleja un bajo esfuerzo de muestreo, sobre todo en la periferia de los CRP y OZD. A pesar de lo anterior, los valores obtenidos sobre la calidad de las celdas fueron cercanos al óptimo (material suplementario: tabla S1), por lo que puede considerarse que las celdas (al menos dentro de los CRP y OZD) tuvieron la calidad suficiente para el alcance de los objetivos de este estudio. Además, aunque es evidente que existen importantes deficiencias en la información disponible sobre biodiversidad (Ramírez-Barahona et al., 2023), las colecciones biológicas son la principal fuente de información en estudios de diversidad (Arenas-Navarro et al., 2020; Ramos-Dorantes et al., 2017; Salinas-Rodríguez et al., 2018; Suárez-Mota et al., 2018). Sin embargo, es importante enfatizar que a medida que avance la recolecta y digitalización de información biológica del país, se podrán refinar las estimaciones de diversidad de pinos en sus diversas áreas de riqueza. La información biológica sobre riqueza y diversidad es fundamental para el diseño de políticas que aseguren la permanencia de especies (Riemann y Exequiel, 2007), sobre todo aquellas con alto valor económico y ecológico como los pinos.
Posterior a su origen, el género Pinus experimentó ciclos de expansión y retroceso acoplados a fluctuaciones climáticas (Millar, 1993, 1999; Stults et al., 2010). Durante este periodo, la competencia con angiospermas (Millar, 1993), la interacción y efecto del fuego (Jin et al., 2021; Keeley, 2012), estrés por sequía y tolerancia a la sombra (Rueda et al., 2017) impulsaron su ruta evolutiva. Los probables CDP en México, identificados en este estudio por la intersección de CRG, CAD y registros fósiles, aproximan la ubicación de áreas que probablemente potenciaron la amplia distribución actual del género (Farjon, 1996; Millar, 1993). Los autores desconocen la existencia de estudios específicos sobre áreas con alta probabilidad de presencia de fenómenos de diversificación de Pinus en el pasado, por tanto, estos resultados representan un aporte importante que coadyuva al entendimiento del fenómeno.
Algunos autores nombran como “centros secundarios de origen” a zonas de latitud media con alta diversidad dentro del género (Millar, 1999), siendo en épocas recientes (Mioceno, ~ 5 – 22.5 Ma) cuando se originó su diversidad actual (Farjon, 1996; Jin et al., 2021). Aunque los fósiles hallados en tierras bajas de Chiapas que datan de al menos 90 Ma (Huerta-Vergara et al., 2013) indicarían que tales regiones ya eran habitadas por pinos antiguos mucho antes de la reciente historia evolutiva del género. De acuerdo con Jin et al. (2021), la tasa neta de diversificación de Pinus ha decrecido considerablemente desde finales del Cretácico (~ 100 Ma), por lo que, de haber existido linajes de pinos en regiones como el México antiguo, su diversidad pudo haber sido más amplia que la actual. Esto último sigue siendo una incógnita puesto que el siguiente hallazgo fósil para México, encontrado en tierras bajas de Veracruz (Millar, 1993) data de mediados del Mioceno
(~ 15 Ma), justo antes del inicio de la gran radiación actual de Pinus en esta región.
Sea como centro de diversificación o centro secundario de origen, México ha sido importante en la evolución de Pinus. Las altas tasas de diversificación del género en el país fueron desencadenadas por la actividad volcánica del Paleógeno (entre 60 y 37 Ma) (Farjon, 1996). El constante levantamiento de las principales cordilleras generó diferencias altitudinales, amplia variabilidad de suelos y una paulatina aridez con la formación del altiplano mexicano, que en épocas posteriores actuó como barrera geográfica entre zonas habitables para pinos (Millar, 1993). La heterogeneidad ambiental y el aislamiento propiciaron fragmentación, divergencia y especiación de los pinos en esas épocas (Millar, 1999; Stults et al., 2010). Además, una caída abrupta de temperatura en épocas subsecuentes ocasionó la retirada de las angiospermas hacia los trópicos (Millar, 1993), lo cual fue clave para que Pinus se expandiera a menores latitudes (Keeley, 2012). En conjunto, un clima frío, disminución de competencia y una amplia variabilidad ambiental pudieron haber provocado la liberación de una cantidad importante de nichos, lo cuales fueron ocupados por los ancestros de los pinos actuales. Esto último puede respaldarse en los hallazgos de Jin et al. (2021), quienes mencionan que la evolución del nicho ecológico y variaciones fenotípicas en Pinus aumentaron considerablemente a inicios del Oligoceno (que es la época subsecuente al gran enfriamiento mencionado anteriormente).
Zonas de importancia para Pinus en México.
El alto valor de importancia para el CRP_2 (SMOc) es explicado por presentar el máximo valor en riqueza (21 especies) y riqueza máxima (13 especies por pixel), el segundo valor más alto por especies raras y el tercer valor más alto por endemismo. Tales valores de endemismo, rareza y riqueza (tabla 1) contribuyeron a clasificarlo como el CRP de mayor importancia en México. Para algunos taxones, este CRP representa la latitud máxima (e.g., P. teocote, P. oocarpa y P. pseudostrobus), mínima (P. brachyptera) y una zona de continuidad para otras (P. strobiformis, P. arizonica y P. leiophylla), además, alberga una de las 2 poblaciones conocidas de P. maximartinezii (González-Elizondo et al., 2011). En el contexto anterior, González-Elizondo et al. (2012) mencionan que Pinus es uno de los 3 géneros más abundantes de la SMOc (24 especies). Además, los bosques del CRP_2 representan una de las zonas con mayor aporte económico al sector forestal del país (Hernández-Salas et al., 2013), lo cual hace aún más evidente la importancia tanto ecológica como económica de esta área. La zona media de la SMOc (Chihuahua y Durango) representa una de las zonas de mayor prioridad para la conservación de Pinus en México (Sáenz-Ceja et al., 2022).
Se ha sugerido que la SMOr se originó hace ~ 65 Ma, aunque se han encontrado fósiles de pinos más antiguos en el sur de México (~ 90 Ma; Chiapas; Huerta-Vergara et al., 2013), por lo que durante su emergencia y las fuertes fluctuaciones climáticas subsecuentes (Millar, 1993, 1999), la SMOr pudo haber sido un refugio para los linajes de Pinus existentes y otros grupos de plantas (Salinas-Rodríguez et al., 2017), incluso atribuyéndosele el origen de la subsección Cembroides (Farjon, 1996). Lo anterior explicaría el alto valor de importancia para CRP_3 (tabla 1), además de la presencia de especies endémicas (P. nelsonii y P. culminicola) y de distribución restringida (P. remota, P. pinceana y P. greggii) en esta región. Además, la SMOr ha sido descrita como el área de mayor rareza de coníferas en México (Farjon y Filer, 2013) y una zona con elevada diversidad de encinos, cactáceas y otras plantas (Contreras-Medina y Luna-Vega, 2007; Salinas-Rodríguez et al., 2017, 2018), convirtiéndose en una importante área de riqueza, endemismo y evolución para otras especies, además de Pinus. El CRP_3 coincide espacialmente con 2 de las áreas prioritarias para la conservación de pinos de ecosistemas semiáridos y subalpinos de México (Sáenz-Ceja et al., 2022).
El alto valor de importancia para la OZD_3 (tabla 1) es explicado por una mezcla de taxones endémicos (P. maximartinezii, P. jaliscana y P. vallartensis, P. georginae), de distribución amplia (P. oocarpa, P. hartwegii, P. leiophylla, P. devoniana; material suplementario: tabla S1) y restringida (P. praetermissa, P. luzmariae), que en conjunto favorecen altos valores de endemismo, rareza y riqueza. Algunas zonas del área OZD_3 son también importantes centros de endemismo para orquídeas y plantas vasculares (Aragón-Parada et al., 2021; Estrada-Sánchez et al., 2019; Morrone, 2019; Rodríguez et al., 2018; Vargas-Amado et al., 2013, 2020) y hongos (Hernández-López et al., 2020; Rodríguez-Alcantar et al., 2019). Sin embargo, algunas de las especies de la OZD_3 (e.g., P. maximartinezii, P. jaliscana, P. praetermissa y P. vallartensis) han experimentado alteraciones significativas de hábitat en la última década (Sáenz-Ceja et al., 2022), resaltando la importancia de esta área dada la vulnerabilidad de algunas de sus especies.
Las tasas altas de humedad existentes en OZD_3, provocadas por la entrada de viento monzónico del océano Pacífico, podría ser un importante impulsor de la elevada riqueza de esta región (Rzedowski, 2006), además de una marcada complejidad topográfica ocasionada por la unión de la FVT y SMOc y de la confluencia de 4 de los 5 biomas reconocidos por Villaseñor y Ortiz (2014) para México, cuyas zonas de transición propician una elevada diversidad biológica (Cayuela et al., 2006; Sánchez-González y López-Mata, 2005). Otro factor que pudo haber desencadenado la riqueza de Pinus en OZD_3 es el vulcanismo ocurrido hace 7.5 – 5.5 Ma en el occidente de la FVT (Gómez-Tuena et al., 2005), que coincide con la edad de divergencia promedio de especies endémicas y restringidas a esta área como P. praetermissa, P. jaliscana, P. luzmariae y P. georginae (5.62 Ma en promedio; Jin et al., 2021). Así mismo, Sáenz-Ceja et al. (2022) han señalado a las sierras meridionales de Jalisco como una de las áreas de mayor rareza y endemismo de especies de pino de México.
Áreas como el CRP_10 y OZD_2 registraron puntajes bajos para I, II y III, sin embargo, presentaron cifras considerables de riqueza máxima (tabla 1). El bajo endemismo de esas áreas, comparado con otros CRP, es causado por la presencia de especies de amplia distribución (e.g. P. teocote, P. oocarpa, P. pseudostrobus). El CRP_10 ha sido reconocido como la zona de mayor riqueza de plantas vasculares del sur de México (Cruz-Cárdenas et al., 2013; González-Espinosa et al., 2004; Villaseñor y Ortiz, 2014). El hecho que estados como Chiapas posean menor riqueza de pinos, puede deberse a la competencia con plantas angiospermas que desde la antigüedad ha sido un factor decisivo en las trayectorias evolutivas de Pinus y que actualmente podría estar limitando su distribución y abundancia en esas regiones (Farjon, 1996; Keeley, 2012; Millar, 1993).
Las áreas de riqueza identificadas para Oaxaca y Guerrero (CRP_7, 8 y 9) coinciden espacialmente con algunas de las zonas de mayor riqueza de especies de pino en México señaladas por Sáenz-Ceja et al. (2022) y con la regionalización de la SMS propuesta por Morrone (2019), siendo la más importante el CRP_7. En esta región, la presencia de bosques templados y húmedos de montaña crea condiciones ambientales que favorecen la presencia de un elevado número de especies a escala local y regional (12 y 16 especies; tabla 1) (Aragón-Parada et al., 2021; Villaseñor y Ortiz, 2014), y cuyo patrón geográfico coincide espacialmente con el de especies relacionadas como bromelias y orquídeas (Estrada-Sánchez et al., 2019). Así mismo, en Oaxaca existe la mayor riqueza de gimnospermas y plantas vasculares de México (Contreras-Medina y Luna-Vega, 2007; Cruz-Cárdenas et al., 2013), por lo que algunos sitios del CRP_7 han sido señalados por ser áreas de amplia importancia biológica (Suárez-Mota et al., 2018). A ello puede anexarse la información generada en este estudio, que ubica al CRP_7 como la quinta más importante (dados los criterios aquí considerados) para el género Pinus en México.
El bajo valor de importancia para CRP_1 se debió a los bajos puntajes de II y IV (tabla 1). Lo anterior coincide con lo descrito por Contreras-Medina y Luna-Vega (2007), quienes afirmaron que dicha zona es una de las más pobres en cuanto a presencia de gimnospermas en México, aunque estudios locales han señalado sitios con alto endemismo y riqueza de plantas vasculares (Riemann y Exequiel, 2007; Rzedowski, 2006). Sin embargo, recalcamos que el bajo valor de importancia para CRP_1 no implica necesariamente pobreza biológica, sino una disminución de ésta con respecto al resto de CRP. De acuerdo con Farjon (1996), los pinos del CRP_1 migraron hacia esas zonas a finales del Terciario siguiendo patrones de diversificación, cuyos procesos de adaptación y colonización pudieron haber desencadenado mecanismos como el hábito de cono serótino (como en P. radiata; Millar, 1999) y la variación del tamaño de la hoja debido al estrés por aridez y sequía como en P. quadrifolia y P. californiarum (Axelrod, 1975). Además, el CRP_1 representa el límite latitudinal inferior para la mayoría de los pinos que ahí se presentan (e.g., P. lambertiana, P. coulteri, P. jeffreyi y P. contorta) y debido a que son las poblaciones periféricas las que mayores tasas de evolución y extinción experimentan, su conservación se vuelve más relevante (Gaston, 2003).
Por el contrario, de acuerdo con Sáenz-Ceja et al. (2022), las sierras de San Pedro Mártir y Juárez (norte de Baja California y CRP_1 en este estudio) representan un área prioritaria para conservación de pinos en México, aunque tal región no figuró entre las más importantes de este estudio. Eso puede deberse a que especies como P. jeffreyi, P. lambertiana, P. contorta y P. coulteri son señaladas como especies de alto endemismo y rareza por los autores. Mientras que aquí se utilizó el rango geográfico completo de esas especies, el cual abarca desde las sierras antes mencionadas hasta el norte de Oregón, EUA (Farjon y Filer, 2013), por lo que los valores de endemismo y rareza resultaron bajos para esas especies y que condujeron a bajos valores de importancia al CRP_1. Sin embargo, aunque no haya resultado ser un CRP de alta importancia, en la última década algunas de sus especies (e.g., P. attenuata, P. californiarum, P. coulteri, P. jeffreyi y P. quadrifolia) han experimentado la mayor disminución de hábitat secundario entre los pinos mexicanos, indicando un alto nivel de vulnerabilidad en el CRP_1 (Sáenz-Ceja et al., 2022).
De manera similar a lo descrito en párrafos anteriores, áreas geográficas coincidentes con los CRP_4, 5 y 6 han sido señalados por presentar alta riqueza de musgos (Villaseñor et al., 2006), mientras que para algunas áreas de la SMS (CRP_9, CRP_8 y OZD_1) se ha documentado alta riqueza de orquídeas y bromelias (Estrada-Sánchez et al., 2019). De la misma forma, los CRP_10, CRP_6, CRP_7, OZD_2, OZD_3 y OZD_4 coinciden espacialmente con zonas de alta riqueza de especies de árboles de los géneros Quercus, Pinus, Juniperus, Arbutus entre otros (Téllez et al., 2020). Algunas de las áreas de mayor irremplazabilidad de especies de pino señaladas por Sáenz-Ceja et al. (2022) son parcialmente coincidentes con el CRP_2, CRP_3, OZD_3, CRP_7 y OZD_4, las cuales obtuvieron los primeros 5 valores más altos de importancia de este estudio (tabla 1). Lo anterior refuerza la elevada importancia de tales áreas para el género Pinus en México.
Para concluir, el análisis realizado sugiere que los sitios más probables de diversificación del género Pinus en México corresponden a las zonas de mayor altitud ubicadas al este de la FVT (México, Puebla, Hidalgo, y sur de San Luis Potosí), el norte de la sierra Madre Oriental (sureste de Coahuila y este de Nuevo León), el norte de la sierra Madre Occidental (Chihuahua y Durango) y los sistemas montañosos del sur de Oaxaca y meseta central de Chiapas. La información generada en esta investigación proporciona una actualización a revisiones previas sobre la distribución del género y las áreas particulares donde existe mayor riqueza, endemismo y rareza de este grupo de plantas en México. En la medida que el acervo digital sobre información biológica georreferenciada actual y antigua se complemente, las áreas de riqueza y probables centros de diversificación podrán afinarse en investigaciones futuras.
Agradecimientos
Al Consejo Nacional de Humanidades, Ciencias y Tecnologías por la beca otorgada al primer autor LS-D, para desarrollar estudios doctorales en el posgrado en Ciencias Forestales del Colegio de Postgraduados, proceso del cual derivó la presente investigación.
Referencias
Aguilar-Santelises, R. y Castillo, R. F. D. (2013). Factors affecting woody plant species diversity of fragmented seasonally dry oak forests in the Mixteca Alta, Oaxaca, Mexico. Revista Mexicana de Biodiversidad, 84, 575–590. https://doi.org/10.7550/rmb.30458
Arenas-Navarro, M., Téllez-Valdés, O., López-Segoviano, G., Murguía-Romero, M. y Tello, J. S. (2020). Environmental correlates of leguminosae species richness in Mexico: quantifying the contributions of energy and environmental seasonality. Biotropica, 52, 70–80. https://doi.org/10.1111/btp.12735
Aragón-Parada, J., Rodríguez, A., Munguía-Lino, G., De-Nova, J. A., Salinas-Rodríguez, M. M. y Carrillo-Reyes, P. (2021). Las plantas vasculares endémicas de la Sierra Madre del Sur, México. Botanical Sciences, 99, 643–660. https://doi.org/10.17129/botsci.2682
Axelrod, D. I. (1975). Evolution and biogeography of Madrean-Tethyan Sclerophyll vegetation. Annals of the Missouri Botanical Garden, 62, 280–334. https://doi.org/10.2307/2395199
Brose, U., Martinez, N. D. y Williams, R. J. (2003). Estimating species richness: Sensitivity to sample coverage and insensitivity to spatial patterns. Ecology, 84, 2364–2377. https://doi.org/10.1890/02-0558
Buck, R., Ortega-Del Vecchyo, D., Gehring, C., Michelson, R., Flores-Rentería, D., Klein, B. et al. (2023). Sequential hybridization may have facilitated ecological transitions in the Southwestern pinyon pine syngameon. New Phytologist, 237, 2435–2449. https://doi.org/10.1111/nph.18543
Buck, R., Hyasat, S., Hossfeld, A. y Flores-Renteriá, L. (2020). Patterns of hybridization and cryptic introgression among one- And four-needled pinyon pines. Annals of Botany, 126, 401–411. https://doi.org/10.1093/aob/mcaa045
Cayuela, L., Golicher, D. J., Benayas, J. M. R., González-Espinosa, M. y Ramírez-Marcial, N. (2006). Fragmentation, disturbance and tree diversity conservation in tropical montane forests. Journal of Applied Ecology, 43, 1172–1181. https://doi.org/10.1111/j.1365-2664.2006.01217.x
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (2007). Elementos para la determinación de centros de origen y centros de diversidad genética en general y el caso específico de la liberación experimental de maíz transgénico al medio ambiente en México. Revista de Geografía Agrícola, 38, 121–140.
Contreras-Medina, R. y Luna-Vega, I. (2007). Species richness, endemism and conservation of Mexican gymnosperms. Biodiversity and Conservation, 16, 1803–1821. https://doi.org/10.1007/s10531-006-9072-3
Cruz-Cárdenas, G., Villaseñor, J. L., López-Mata, L. y Ortiz, E. (2013). Distribución espacial de la riqueza de especies de plantas vasculares en México. Revista Mexicana de Biodiversidad, 84, 1189–1199. https://doi.org/10.7550/rmb.31811
Estrada-Sánchez, I., García-Cruz, J., Espejo-Serna, A. y López-Ortega, G. (2019). Identification of areas of endemism in the Mexican cloud forests based on the distribution of endemic epiphytic bromeliads and orchids. Phytotaxa, 397, 129. https://doi.org/10.11646/phytotaxa.397.2.1
Farjon, A. (1996). Biodiversity of Pinus (Pinaceae) in Mexico: speciation and palaeo-endemism. Botanical Journal of the Linnean Society, 121, 365–384. https://doi.org/10.1006/bojl.1996.0041
Farjon, A. (2017). A handbook of the world’s conifers (2nd ed.). Leiden-Boston, Netherlands: Brill.
Farjon, A. (2018). Index of botanical names of pines. En A. Farjon (Eds.), Pines: drawings and descriptions of the genus Pinus (pp. 232–235). Leiden, Boston, Netherlands: Brill.
Farjon, A. y Filer, D. (2013). An atlas of the world’s conifers: an analysis of their distribution, biogeography, diversity and conservation status. Leiden, Netherlands: Brill.
Fisher, R. A., Corbet, A. S. y Williams, C. B. (1943). The relation between the number of species and the number of individuals in a random sample of an animal population. The Journal of Animal Ecology, 12, 42–58. https://doi.org/10.2307/1411
Fortuny-Fernández, N. M., Monserrat-Ferrer, M. y Ruenes-Morales, M. R. (2017). Centros de origen, domesticación y diversidad genética de la ciruela mexicana, Spondias purpurea (Anacardiaceae). Acta Botanica Mexicana, 121, 7–38. https://doi.org/10.21829/abm121.2017.1289
García-Gómez, V., Ramírez-Herrera, C., Flores-López, C. y López-Upton, J. (2014). Diversidad y estructura genética de Pinus johannis. Agrociencia, 48, 863–873.
Gaston, K. J. (2003). The structure and dynamics of geographic ranges. Oxford, New York: Oxford University Press.
Gernandt, D. S. y Pérez-de La Rosa, J. A. (2014). Biodiversidad de Pinophyta (coníferas) en México. Revista Mexicana de Biodiversidad, 85(Suppl.), S126–S133. https://doi.org/10.7550/rmb.32195
Gómez-Tuena, A., Orozco-Esquivel, M. T. y Ferrari, L. (2005). Petrogénesis ígnea de la Faja Volcánica Transmexicana. Boletín de la Sociedad Geológica Mexicana, 57, 227–283. https://doi.org/10.18268/BSGM2005v57n3a2
González-Elizondo, M., González-Elizondo, M. S., Ruacho-González, L. y Molina-Olvera, M. (2011). Pinus maximartinezii Rzed. (Pinaceae), primer registro para Durango, segunda localidad para la especie. Acta Botanica Mexicana, 96, 33–48. https://doi.org/10.21829/abm96.2011.257
González-Elizondo, M. S., González-Elizondo, M., Tena-Flores, J. A., Ruacho-González, L. y López-Enríquez, I. L. (2012). Vegetación de la Sierra Madre Occidental, México: una síntesis. Acta Botanica Mexicana, 100, 351–404. https://doi.org/10.21829/abm100.2012.40
González-Espinosa, M., Rey-Benayas, J. M., Ramírez-Marcial, N., Huston, M. A. y Golicher, D. (2004). Tree diversity in the northern Neotropics: Regional patterns in highly diverse Chiapas, Mexico. Ecography, 27, 741–756. https://doi.org/10.1111/j.0906-7590.2004.04103.x
González-Jiménez, A., Delgado-Valerio, P., Molina-Sánchez, A., Flores-López, C., Vargas-Gutiérrez, J. P. y García-Magaña, J. J. (2021). Diversidad genética en poblaciones de Pinus remota (Pinaceae) del Noreste de México: evidencias de declinamiento demográfico histórico. Acta Botanica Mexicana, 128, e1890. https://doi.org/10.21829/abm128.2021.1890
Hernández-López, L., Rodríguez-Alcántar, O., Figueroa-García, D., Reynoso Dueñas, J. J. y Arias, A. (2020). Flora y micobiota en riesgo y endémicas en el municipio San Sebastián del Oeste, Jalisco, México. Acta Botanica Mexicana, 128, e1771. https://doi.org/10.21829/abm128.2021.1771
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1–9.
Hernández-Salas, J., Aguirre-Calderón, Ó. A., Alanís-Rodríguez, E., Jiménez-Pérez, J., Treviño-Garza, E. J., González-Tagle, M. A. et al. (2013). Efecto del manejo forestal en la diversidad y composición arbórea de un bosque templado del noroeste de México. Revista Chapingo, Serie Ciencias Forestales y del Ambiente, 19, 189–199. https://doi.org/10.5154/r.rchscfa.2012.08.052
Hijmans, R. J., Guarino, L. y Mathur, P. (2012). DIVA-GIS. Ver. 7.5. A geographic information system for the analysis of species distribution data. Lima, Perú.
Huerta-Vergara, A. R., Calvillo-Canadell, L., Cevallos-Ferriz, S. R. S. y Silva-Pineda, A. (2013). Pinaceae en el cretácico del norte y sur de México: complemento a su escaso registro fósil. Paleontología Mexicana, 63, 66–78.
Jin, W. T., Gernandt, D. S., Wehenkel, C., Xia, X. M., Wei, X. X. y Wang, X. Q. (2021). Phylogenomic and ecological analyses reveal the spatiotemporal evolution of global pines. Proceedings of the National Academy of Sciences, 118, e2022302118. https://doi.org/10.1073/PNAS.2022302118
Keeley, J. E. (2012). Ecology and evolution of pine life histories. Annals of Forest Science, 69, 445–453. https://doi.org/10.1007/s13595-012-0201-8
Kerr, J. T. (1997). Species richness, endemism, and the choice of areas for conservation. Conservation Biology, 11, 1094–1100. https://doi.org/10.1046/j.1523-1739.1997.96089.x
Ledig, F. T., Capó-Arteaga, M. A., Hodgskiss, P. D., Sbay, H., Flores-López, C., Thompson Conkle, M. et al. (2001). Genetic diversity and the mating system of a rare Mexican piñon, Pinus pinceana, and a comparison with Pinus maximartinezii (Pinaceae). American Journal of Botany, 88, 1977–1987. https://doi.org/10.2307/3558425
Luna-Bautista, L., De La Rosa, P. H., Velázquez-Martínez, A., Gómez-Guerrero, A. y Acosta-Mireles, M. (2015). El sotobosque en la composición y diversidad de áreas bajo manejo forestal en Santa Catarina Ixtepeji, Oaxaca. Revista Chapingo, Serie Ciencias Forestales y del Ambiente, 21, 109–121. https://doi.org/10.5154/r.rchscfa.2014.08.037
Maciel, E. A. (2021). An index for assessing the rare species of a community. Ecological Indicators, 124, 107424. https://doi.org/10.1016/j.ecolind.2021.107424
Magurran, A. E. (1988). Ecological diversity and its measurement. Princeton: Princeton University Press. https://doi.org/10.1007/978-94-015-7358-0
Martin, M. P., Peters, C. M., Asbjornsen, H. y Ashton, M. S. (2021). Diversity and niche differentiation of a mixed pine–oak forest in the Sierra Norte, Oaxaca, Mexico. Ecosphere, 12, e03475. https://doi.org/10.1002/ecs2.3475
Millar, C. I. (1993). Impact of the Eocene on the evolution of Pinus L. Annals of the Missouri Botanical Garden, 80, 471–498. https://doi.org/10.2307/2399795
Millar, C. I. (1999). Evolution and biogeography of Pinus radiata, with a proposed revision of its Quaternary history. New Zealand Journal of Forestry Science, 29, 335–365.
Montes, J. R., Peláez, P., Moreno-Letelier, A. y Gernandt, D. S. (2022). Coalescent-based species delimitation in North American pinyon pines using low-copy nuclear genes and plastomes. American Journal of Botany, 109, 706–726. https://doi.org/10.1002/ajb2.1847
Montes, J. R., Peláez, P., Willyard, A., Moreno-Letelier, A., Piñero, D. y Gernandt, D. S. (2019). Phylogenetics of Pinus subsection Cembroides Engelm. (Pinaceae) inferred from low-copy nuclear gene sequences. Systematic Botany, 44, 501–518. https://doi.org/10.1600/036364419×15620113920563
Morrone, J. J. (2019). Regionalización biogeográfica y evolución biótica de México: encrucijada de la biodiversidad del Nuevo Mundo. Revista Mexicana de Biodiversidad, 90, e902980. https://doi.org/10.22201/ib.20078706e.2019.90.2980
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C. et al. (2001). Terrestrial ecoregions of the Worlds: a new map of life on Earth. Bioscience, 51, 933–938. https://doi.org/10.1641/
0006-3568(2001)051[0933:TEOTWA]2.0.CO;2
Parraguirre-Lezama, C., Vargas-Hernández, J., Ramírez-Vallejo, P., Azpíroz-Rivero, H. y Jasso-Mata, J. (2002). Estructura de la diversidad genética en poblaciones naturales de Pinus greggii Engelm. Revista Fitotecnia Mexicana, 25, 279–287.
Peet, R. K. (1974). The measurement of species diversity. Annual Review of Ecology and Systematics, 5, 285–307. https://doi.org/10.1146/annurev.es.05.110174.001441
Pérez-de La Rosa, J. A. y Gernandt, D. S. (2017). Pinus vallartensis (Pinaceae), a new species from Western Jalisco, Mexico. Phytotaxa, 331, 233–242. https://doi.org/10.11646/phytotaxa.331.2.7
Quantum GIS Development Team. (2019). QGIS Geographic Information System (v. 3.10.14-A Coruña). Open Source Geospatial Foundation Project. República Checa. Recuperado el 10 diciembre, 2019 de: http://www.qgis.org
Ramírez-Barahona, S., Cuervo-Robayo, A. P. y Magallón, S. (2023). Assessing digital accessible botanical knowledge and priorities for exploration and discovery of plant diversity across Mesoamerica. New Phytologist, 240, 1659-1672. https://doi.org/10.1111/nph.19190
Ramos-Dorantes, D. B., Villaseñor, J. L., Ortiz, E. y Gernandt, D. S. (2017). Biodiversity, distribution, and conservation status of Pinaceae in Puebla, Mexico. Revista Mexicana de Biodiversidad, 88, 215–223. https://doi.org/10.1016/j.rmb.2017.01.028
Riemann, H. y Exequiel, E. (2007). Endemic regions of the vascular flora of the peninsula of Baja California, Mexico. Journal of Vegetation Science, 18, 327–336. https://doi.org/10.1111/j.1654-1103.2007.tb02544.x
Ríos-Altamirano, A., Alfonso-Corrado, C., Aguirre-Hidalgo, V., Ángeles-Pérez, G., Mendoza-Díaz, M. M., Rodríguez-Rivera, V. et al. (2016). Abundancia y distribución del género Pinus en Capulálpam de Méndez, Sierra Juárez, Oaxaca. Madera y Bosques, 22, 61–74. https://doi.org/10.21829/myb.2016.2231457
Rodríguez-Alcántar, O., Figueroa-García, D. y Herrera-Fonseca, M. J. (2019). Catálogo de los hongos de San Sebastián del Oeste, Jalisco, México. Acta Botanica Mexicana, 126, e1364. https://doi.org/10.21829/abm126.2019.1364
Rodríguez, A., Castro-Castro, A., Vargas-Amado, G., Vargas-Ponce, O., Zamora-Tavares, P., González-Gallegos, J. et al. (2018). Richness, geographic distribution patterns, and areas of endemism of selected angiosperm groups in Mexico. Journal of Systematics and Evolution, 56, 537–549. https://doi.org/10.1111/jse.12457
Rueda, M., Godoy, O. y Hawkins, B. A. (2017). Spatial and evolutionary parallelism between shade and drought tolerance explains the distributions of conifers in the conterminous United States. Global Ecology and Biogeography, 26, 31–42. https://doi.org/10.1111/geb.12511
Rzedowski, J. (2006). Vegetación de México. México D.F.: Limusa.
Sáenz-Ceja, J. E., Arenas-Navarro, M. y Torres-Miranda, A. (2022). Prioritizing conservation areas and vulnerability analyses of the genus Pinus L. (Pinaceae) in Mexico. Journal for Nature Conservation, 67, 126171. https://doi.org/10.1016/j.jnc.2022.126171
Salinas-Rodríguez, M. M., Estrada-Castillón, E. y Villarreal-Quintanilla, J. A. (2017). Endemic vascular plants of the Sierra Madre Oriental, Mexico. Phytotaxa, 328, 1–52. https://doi.org/10.11646/phytotaxa.328.1.1
Salinas-Rodríguez, M. M., Sajama, M. J., Gutiérrez-Ortega, J. S., Ortega-Baes, P. y Estrada-Castillón, A. E. (2018). Identification of endemic vascular plant species hotspots and the effectiveness of the protected areas for their conservation in Sierra Madre Oriental, Mexico. Journal for Nature Conservation, 46, 6–27. https://doi.org/10.1016/j.jnc.2018.08.012
Sánchez-González, A. (2008). Una visión actual de la diversidad y distribución de los pinos de México. Madera y Bosques, 14, 107–120. https://doi.org/10.21829/myb.2008.1411222
Sánchez-González, A. y López-Mata, L. (2005). Plant species richness and diversity along an altitudinal gradient in the Sierra Nevada, Mexico. Diversity and Distributions, 11, 567–575. https://doi.org/10.1111/j.1366-9516.2005.00186.x
Santillán-Fernández, A., Salinas-Moreno, Y., Valdez-Lazalde, J. R., Bautista-Ortega, J. y Pereira-Lorenzo, S. (2021). Spatial delimitation of genetic diversity of native maize and its relationship with ethnic groups in Mexico. Agronomy, 11, 1–13. https://doi.org/10.3390/agronomy11040672
Stults, D. Z., Axsmith, B. J. y Liu, Y. S. (2010). Evidence of white pine (Pinus subgenus Strobus) dominance from the Pliocene Northeastern Gulf of Mexico Coastal Plain. Palaeogeography, Palaeoclimatology, Palaeoecology, 287, 95–100. https://doi.org/10.1016/j.palaeo.2010.01.021
Suárez-Mota, M. E., Téllez-Valdés, O., Lira-Saade, R. y Villaseñor, J. L. (2013). Una regionalización de la Faja Volcánica Transmexicana con base en su riqueza florística. Botanical Sciences, 91, 93–105. https://doi.org/10.17129/botsci.405
Suárez-Mota, M. E., Villaseñor, J. L. y Ramírez-Aguirre, M. B. (2018). Sitios prioritarios para la conservación de la riqueza florística y el endemismo de la Sierra Norte de Oaxaca, México. Acta Botanica Mexicana, 124, 49–74. https://doi.org/10.21829/abm124.2018.1296
Téllez, O., Mattana, E., Diazgranados, M., Kühn, N., Castillo-Lorenzo, E., Lira, R. et al. (2020). Native trees of Mexico: diversity, distribution, uses and conservation. PeerJ, 8, e9898. https://doi.org/10.7717/peerj.9898
Vargas-Amado, G., Castro-Castro, A., Harker, M., Vargas-Amado, M. E., Villaseñor, J. L., Ortiz, E. et al. (2020). Western Mexico is a priority area for the conservation of Cosmos (Coreopsideae, Asteraceae), based on richness and track analysis. Biodiversity and Conservation, 29, 545–569. https://doi.org/10.1007/s10531-019-01898-2
Vargas-Amado, G., Castro-Castro, A., Harker, M., Villaseñor, J. L., Ortiz, E. y Rodríguez, A. (2013). Geographic distribution and richness of the genus Cosmos (Asteraceae: Coreopsideae). Revista Mexicana de Biodiversidad, 84, 536–555. https://doi.org/10.7550/rmb.31481
Villaseñor, J. L. (2016). Catálogo de las plantas vasculares nativas de México. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017
Villaseñor, J. L., Delgadillo, C. y Ortiz, E. (2006). Biodiversity hotspots from a multigroup perspective: mosses and senecios in the Transmexican Volcanic Belt. Biodiversity and Conservation, 15, 4045–4058. https://doi.org/10.1007/s10531-005-3056-6
Villaseñor, J. L. y Ortiz, E. (2014). Biodiversidad de las plantas con flores (División Magnoliophyta) en México. Revista Mexicana de Biodiversidad, 85, 134–142. https://doi.org/10.7550/rmb.31987
Willyard, A., Gernandt, D. S., Cooper, B., Douglas, C., Finch, K., Karemera, H. et al. (2021). Phylogenomics in the Hard Pines (Pinus subsection Ponderosae; Pinaceae) confirms paraphyly in Pinus ponderosa, and places Pinus jeffreyi with the California Big Cone pines. Systematic Botany, 46, 538–561. https://doi.org/10.1600/036364421X16312067913435
Willyard, A., Gernandt, D. S., Potter, K., Hipkins, V., Marquardt, P., Mahalovich, M. F. et al. (2017). Pinus ponderosa: a checkered past obscured four species. American Journal of Botany, 104, 161–181. https://doi.org/10.3732/ajb.1600336