Fernando Arriola-Álvarez a, Luis Gabriel Aguilar-Estrada a, *, Lucía Álvarez-Castillo b,
Ivette Ruiz-Boijseauneau a y Dení Rodríguez a
a Universidad Nacional Autónoma de México, Facultad de Ciencias, Laboratorio de Ficología (Biodiversidad Marina), Circuito Exterior s./n., Coyoacán, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Facultad de Ciencias, Posgrado en Ciencias del Mar y Limnología, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: lgae@ciencias.unam.mx (L.G. Aguilar-Estrada)
Recibido: 7 julio 2022; aceptado: 11 septiembre 2024
Resumen
Las macroalgas intermareales proporcionan alimento y refugio para diferentes organismos. El objetivo de este trabajo fue analizar los bivalvos asociados a macroalgas. Se realizaron muestreos en enero, mayo, julio y noviembre de 2014, se recolectaron manualmente 72 muestras de macroalgas y sus bivalvos asociados dentro de cuadros de 400 cm2 en 2 localidades de Guerrero: playas El Palmar y Las Gatas. La estructura comunitaria de los bivalvos se determinó a partir de la riqueza específica, composición, abundancia, distribución e índices comunitarios: diversidad de Shannon, equidad de Pielou y dominancia de Simpson. Cada especie de macroalga (59 spp.) se asoció con la propuesta de grupos morfofuncionales. Se analizó la cobertura de macroalgas, abundancia de bivalvos y sedimento retenido. Del total de individuos (873), se reconocieron 17 especies de bivalvos. El índice de Shannon fue de 2.15 bits/individuo. Los bivalvos se asociaron a 3 grupos morfofuncionales de macroalgas. La abundancia de bivalvos y los sedimentos retenidos disminuyeron por mes, mientras que la abundancia, cobertura y sedimentos disminuyeron al aumentar el nivel de marea. Estudios como este proporcionan información importante para el conocimiento de la diversidad costera, en este caso de una zona turística en Guerrero.
Palabras clave: Malacofauna; Pacífico tropical mexicano; Riqueza específica; Sedimentos
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Community structure of bivalves (Mollusca: Bivalvia) associated with intertidal macroalgae of Guerrero, Mexico
Abstract
Intertidal macroalgae provide food and shelter for different organisms. The objective of this work was to analyze the bivalves associated with macroalgae. Sampling was carried out in January, May, July, and November 2014, 72 samples of macroalgae and their associated bivalves were manually collected within 400 cm2 in 2 locations in Guerrero: El Palmar and Las Gatas beaches. The community structure of bivalves was determined from specific richness, composition, abundance, distribution, and community indices: Shannon diversity, Pielou evenness and Simpson dominance. Each macroalgal species (59 spp.) was associated with proposed morphofunctional groups. Macroalgal cover, bivalve abundance and retained sediment were analyzed. Of the total number of individuals (873), 17 bivalve species were recognized. The Shannon index was 2.15 bits/individual. Bivalves were associated with 3 morphofunctional groups of macroalgae. Bivalve abundance and retained sediment decreased by month, while abundance, cover, and sediment decreased with increasing tide level. Studies like this provide important information for understanding coastal diversity, in this case of a tourist area in Guerrero.
Keywords: Malacofauna; Tropical Mexican Pacific; Species richness; Sediments
Introducción
En el Pacífico tropical mexicano se han descrito 2 patrones principales de circulación de corrientes oceánicas: primavera (marzo-abril) y otoño (septiembre-octubre), que generan variaciones espacio-temporales como las temporadas de lluvias y secas o fenómenos climatológicos (Baumgartner y Christensen, 1985; Pérez, 2013; Vega et al., 2008; Wyrtki, 1966). La zona intermareal rocosa es un sitio de transición entre los ambientes terrestre y marino, la cual se encuentra sujeta a cambios constantes de las variables ambientales como la oscilación de la marea, la intensidad lumínica, el viento, las variaciones en la salinidad y la temperatura (Salazar-Vallejo y González, 1990; Vassallo et al.,2014); ésto genera un hábitat heterogéneo con diversos microambientes en donde varios grupos de organismos pueden desarrollarse (Flores-Garza etal., 2011, 2014). Los organismos más frecuentes en esta zona son las macroalgas (Lee, 2008), mismas que proporcionan refugio y alimento para numerosos grupos de invertebrados (García-Robledo et al.,2008; Jover-Capote y Diez, 2017; Moreno, 1995; Steneck y Watling, 1982; Yang et al., 2007). Las macroalgas son un ambiente espacialmente heterogéneo, lo que hace posible que puedan albergar distintos grupos de invertebrados a lo largo del tiempo (Benedetti-Cecchi et al., 2001; Olabarria y Chapman, 2001). Los anfípodos, poliquetos y moluscos son los grupos más importantes al interior de la comunidad de macroalgas, ya que representan 70% de la abundancia en éstas (Aguilera, 2011; Colman, 1940).
Dentro del phylum Mollusca, los bivalvos son la segunda clase más representativa (Gosling, 2015). En la zona intermareal pueden vivir adheridos a diversos sustratos como rocas, arena o macroalgas (García-Cubas y Reguero, 2007). Algunos organismos que conforman la clase Bivalvia son sésiles y tienen diferentes estrategias en cuanto a sus tipos de alimentación: suspensívoros o detritívoros (Coan y Valentich-Scott, 2006). Además, generan redes de mucus para atrapar las partículas que flotan en la columna de agua (Jorgensen, 1996; Ward et al., 1998), por lo que desempeñan papeles ecológicos importantes en los cuerpos de agua; por sus hábitos de vida, son un grupo de especial interés en los estudios ecológicos (Lozada, 2015; Vega et al., 2008).
En general, los trabajos sobre moluscos en México son numerosos. En el de Sánchez (2014) se mencionó que existen alrededor de 47 contribuciones tomando en cuenta las costas del Atlántico y del Pacífico. En Guerrero se cuenta con alrededor de 30 estudios malacológicos (Gama, 2019), los cuales en su mayoría se han orientado a conocer la riqueza y composición de especies (Flores, 2004; Flores-Rodríguez et al., 2012; Lesser, 1984; López-Rojas et al., 2017). Gran parte (70%) de los trabajos en este estado se han realizado en el área de Acapulco y se han analizado distintos aspectos de la comunidad de moluscos, incluyendo a los bivalvos (Barba-Marino et al., 2010; Castro-Mondragón et al.,2016; Flores-Garza et al., 2010, 2011, 2012, 2014; Flores-Rodríguez et al.,2003; Galeana-Rebolledo et al., 2012, 2018; Garcés, 2011; Kuk-Dzul et al.,2019; Torreblanca, 2010; Torreblanca-Ramírez et al., 2012; Valdés-González etal.,2004; Villegas-Maldonado et al., 2007; Villalpando, 1986).
En la parte norte de Guerrero, que incluye Ixtapa-Zihuatanejo, se han realizado estudios ecológicos y sobre ciclos reproductivos de moluscos (Baqueiro, 1979; Flores-Rodríguez et al.,2007; Salcedo-Martínez et al.,1988), o sobre especies de importancia comercial como el de Cerros-Cornelio et al. (2021), quienes mencionaron 24 especies de moluscos, de las cuales 13 son de la clase Bivalvia. Por su parte, en la costa sur de Guerrero existen 9 trabajos malacológicos; Flores-Garza et al. (2007) analizaron la densidad de Plicopurpura columellaris (Lamarck, 1816) y su malacofauna asociada, reportando 34 especies de moluscos, de las cuales 7 fueron bivalvos.
Entre los estudios realizados en las costas de Guerrero, resalta el de Salcedo-Martínez et al. (1988) por ser el primero sobre la relación entre las macroalgas e invertebrados de Zihuatanejo, donde los moluscos, en especial la clase Gastropoda, fueron el componente mayoritario (38.72%). Existen algunos trabajos sobre la asociación alga-molusco en Ixtapa-Zihuatanejo (Aguilar-Estrada et al., 2017, 2022; Cisneros, 2016; Gama-Kwick et al., 2021; Quiroz-González et al., 2020); sin embargo, dichos estudios están enfocados a otras clases de moluscos (gasterópodos y quitones); por lo que, el conocimiento sobre la relación de las macroalgas y bivalvos es escaso. La presente contribución tiene como objetivo aportar conocimiento de la estructura comunitaria de los moluscos bivalvos asociados a macroalgas, en un ciclo anual en la zona intermareal rocosa de Ixtapa-Zihuatanejo en Guerrero.
Materiales y métodos
Se realizaron 4 salidas de campo durante enero, mayo, julio y noviembre de 2014 a Ixtapa-Zihuatanejo, Guerrero, con el propósito de observar los posibles cambios de la estructura comunitaria de los bivalvos asociados a las macroalgas en la zona. Las comunidades de macroalgas se recolectaron en la zona intermareal rocosa en 2 localidades: playa El Palmar en Ixtapa (17°39’0.4” N, 101°36’2.79” O) y el pretil de playa Las Gatas, al interior de la bahía de Zihuatanejo (17°37’22.07” N, 101°33’4.85” O) (fig. 1A). La recolección de ejemplares se realizó con un permiso otorgado por la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) (Registro Nacional de Pesca y Acuacultura -DF00000208).
Playa El Palmar es un sitio expuesto, se encuentra frente al complejo turístico Ixtapa y la playa está formada por litoral rocoso y arenoso, tiene una longitud de 2.7 km. Este lugar consta de un relieve heterogéneo, compuesto por riscos y morros de diferente tamaño y forma irregular, la zona intermareal rocosa tiene una amplitud aproximada de 2 m (Aguilar, 2017). En esta playa se han descrito patrones con una circulación del agua dominante hacia el norte a lo largo de la zona, por lo que el oleaje es intenso en la parte norte (Trasviña y Andrade, 2002) (fig. 1B).
Playa Las Gatas es un sitio protegido porque se localiza al interior de la bahía de Zihuatanejo; tiene una extensión de 350 m y se compone principalmente de arenas, fragmentos de coral y rocas (Cisneros, 2016; López, 1993). Paralelo a la línea de costa se encuentra el “pretil”, que es un conglomerado de rocas apiladas, irregulares y de tamaños variables (Aguilar, 2017; Cisneros, 2016; Urbano, 2004). La zona intermareal tiene una amplitud aproximada de 1 m (López, 1993). La presencia de este conglomerado hace que el oleaje sea menor al interior de la playa (Aguilar, 2017) (fig. 1C).
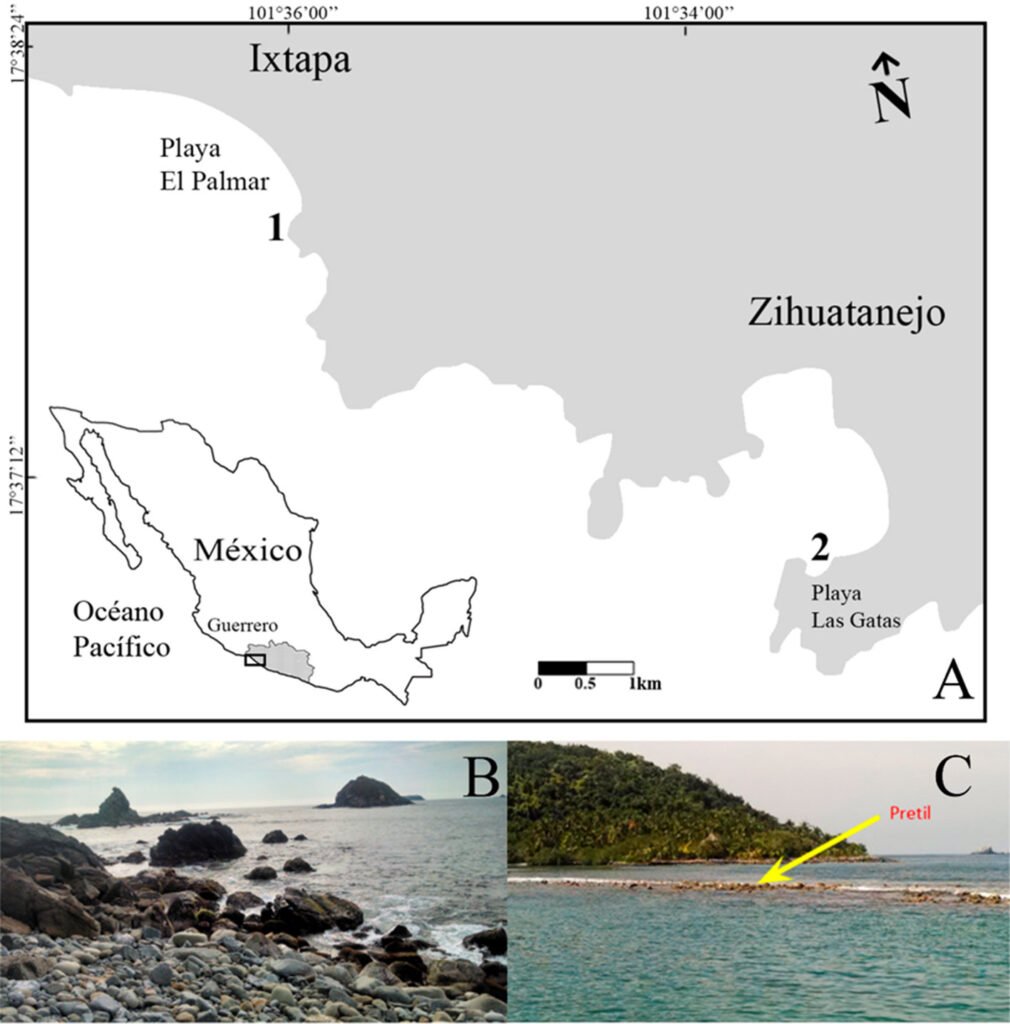
Figura 1. A, Ubicación de la zona de estudio en Ixtapa-Zihuatanejo; B, playa El Palmar; C, playa Las Gatas.
En cada localidad, 3 muestras de macroalgas se recolectaron manualmente de forma aleatoria con una espátula (Bakus, 2007), dentro de cuadros de 20 × 20 cm (0.04 m2) por cada nivel de marea: intermareal bajo (3), medio (3) y alto (3); en total, se obtuvieron 72 muestras provenientes de 36 cuadros en playa Las Gatas y de 36 cuadros en playa El Palmar. Las muestras de las comunidades de macroalgas y moluscos asociados se preservaron en una mezcla de formaldehído al 4% con agua de mar, neutralizada con borato de sodio y glicerina; después se trasladaron al Laboratorio de Ficología (Biodiversidad Marina) de la Facultad de Ciencias de la Universidad Nacional Autónoma de México (UNAM).
En el laboratorio, se calculó la cobertura de cada especie de macroalga en cm2 al colocar cada muestra sobre un área delimitada de 20 × 20 cm. Para su identificación taxonómica se tomaron en cuenta las características morfológicas externas, como tipo de talo y tipo de ramificación, e internas a partir de cortes anatómicos transversales de ejes, frondas y, de estar presentes, de estructuras reproductivas; los especímenes y cortes fueron observados bajo microscopios estereoscópico y óptico (Zeiss). La identificación taxonómica de los ejemplares de macroalgas se realizó utilizando literatura especializada para macroalgas del océano Pacífico (Abbott, 1999; Abbott y Hollenberg, 1976; Dawson, 1949, 1953, 1954, 1960, 1961, 1963; Dawson y Beaudette, 1959; Rodríguez et al.,2008; Taylor, 1945). La actualización de la nomenclatura se hizo a partir de la base de datos de Algaebase (Guiry y Guiry, 2024) y, con base en ella, se elaboró una lista sistemática de las especies de macroalgas. De cada comunidad de macroalgas se separó el sedimento retenido por las algas después de la medición de la cobertura para cada especie y se midió su peso húmedo con una balanza digital, modelo OBI.
De cada muestra, se extrajeron de forma manual todos los moluscos de la clase Bivalvia. Los ejemplares con concha y parte blanda (vivos) fueron identificados al nivel taxonómico más bajo posible, género o especie, dependiendo del estado de conservación de cada ejemplar, a partir de la observación de las características morfológicas de la concha, con apoyo de un microscopio estereoscópico. La identificación taxonómica de las especies se hizo con literatura malacológica especializada para la zona del océano Pacífico oriental (Coan et al., 2000; Keen, 1971). Se elaboró una lista sistemática con base en la propuesta de Bouchet et al. (2010) para los niveles suprafamiliares y la actualización de nomenclatura se realizó a partir de la base de datos de World Register of Marine Species (WORMS) para género y especie (Horton et al., 2024).
Los ejemplares de moluscos y macroalgas recolectados fueron depositados en la colección “Invertebrados asociados a macroalgas”, en proceso de registro, con número de inventario para bivalvos (INV-1531 a INV-1638) del Laboratorio de Ficología (Biodiversidad Marina) de la Facultad de Ciencias, UNAM y las macroalgas se depositaron en la colección del Herbario de la Facultad de Ciencias (FCME) con número de catálogo (PTM-10534 a PTM-10558; PTM-10577 a PTM-10604; PTM-10613 a PTM-10630; PTM-10640 a PTM-10648).
Se elaboró una curva de acumulación de las especies de bivalvos asociados a macroalgas recolectadas en las localidades de estudio, con la finalidad de conocer la cantidad de especies que faltaría encontrar y recolectar en dichas localidades. Con los datos de riqueza de especies (S) y abundancia de bivalvos (N) de ejemplares vivos (concha y parte blanda), se estimaron los índices de Shannon (H´) y de diversidad máxima (H’ max) para cada fecha de muestreo, ya que éstos corresponden a los miembros de la comunidad en el momento de muestreo (Aguilar-Estrada et al., 2014); H´ fue expresado en bits/individuo (Magurran, 2004). Se calculó el índice de equidad de Pielou (J´) y el índice de dominancia de Simpson (D) (Moreno, 2001). Estos índices permiten hacer comparaciones cuantitativas y cualitativas entre estudios o zonas ya que se han utilizado como referente mínimo para describir la estructura comunitaria de un lugar (Aguilar-Estrada et al., 2014).
Para evaluar la normalidad de los datos de abundancia de bivalvos y de los índices de diversidad se realizaron pruebas de Shapiro-Wilk (W) (Siegel, 1990). Posteriormente, se realizaron pruebas de Levene (F) para comprobar la homogeneidad de varianzas para los datos no normales y prueba de Bartlett para los datos con distribución normal (Bartlett, 1937; Levene, 1960). Los índices de diversidad de Shannon fueron analizados usando una prueba de “t de student” para evaluar si existían diferencias estadísticamente significativas entre los meses de muestreo. Estos análisis se realizaron utilizando la paquetería Vegan Versión 2.5-6 (Oksanen et al., 2019) en el programa R Studio 2023.12.0+369 (R Core Team, 2023).
Los datos de abundancia de bivalvos no fueron normales de acuerdo con las pruebas de normalidad, por ello, se realizaron análisis de estadística no paramétrica en el software PRIMER v6 + add on Permanova (PRIMER-E Ltd., Plymouth, UK) (Anderson et al., 2008; Clarke y Gorley, 2006). Los datos fueron transformados con 4√ y con ellos se calculó una matriz de similitud a partir del índice de Bray-Curtis. A partir de dicha matriz, se realizó un análisis de escalamiento multidimensional no métrico (nMDS) con la finalidad de observar la distribución de las abundancias de bivalvos en el área de estudio. Se incluyó la abundancia de las especies dominantes en forma de vectores azules superpuestos en el gráfico nMDS para facilitar la interpretación de las abundancias de especies dominantes en las distintas localidades y niveles de marea, donde el círculo azul representa la variación de la abundancia. Las especies dominantes que se seleccionaron en este análisis son las que estuvieron presentes en todas las muestras con abundancias mayores a la media.
Además, se realizaron análisis de varianza permutacionales (Permanova) para determinar si existían diferencias significativas en la abundancia de bivalvos (variable dependiente) con respecto a los factores utilizados: localidad con 2 niveles (El Palmar y Las Gatas), nivel de marea con 3 niveles (alto, medio y bajo) y mes de muestreo con 4 niveles (enero, mayo, julio y noviembre). En los análisis de Permanova se utilizaron 999 permutaciones de los residuos bajo un modelo reducido. Posteriormente, para los factores donde se obtuvieron diferencias significativas, se realizaron comparaciones de pares para identificar los niveles que eran diferentes estadísticamente (Anderson et al., 2008).
Utilizando las variables numéricas, se realizaron regresiones lineales múltiples con el software SPSS Statistics v20, para evaluar el efecto de la cobertura de macroalgas y los sedimentos retenidos (variables independientes) en la abundancia de bivalvos (variable dependiente) en las playas El Palmar y Las Gatas, en los diferentes niveles de marea y en los meses de muestreo.
Por último, se determinó el grupo morfofuncional (GMF): filamentosas (Fil), foliosas (Fol), foliosas corticadas (Foc), filamentosas corticadas (Fic), coriáceas (Cor), calcáreas articuladas (Cal) para cada especie de macroalgas, con base en la propuesta de Steneck y Dethier (1994) y se asociaron con las especies de bivalvos recolectadas.
Resultados
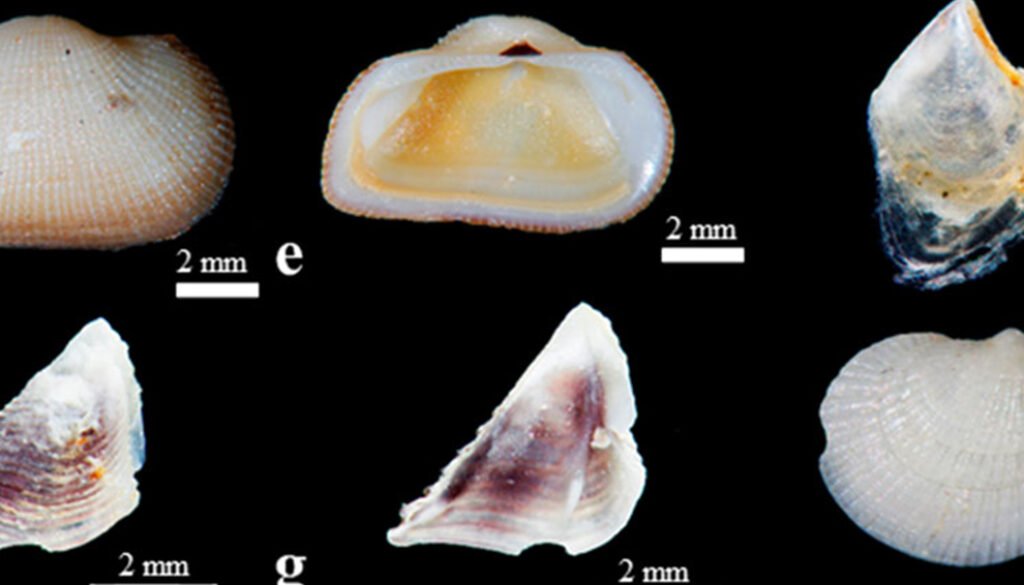
Riqueza y composición de moluscos. En 60 de las 72 muestras recolectadas se encontraron bivalvos, 35 muestras pertenecientes a playa El Palmar y 25 a playa Las Gatas. Se obtuvieron un total de 873 individuos de la clase Bivalvia. Se identificaron 17 especies (fig. 2) agrupadas en 2 subclases, 8 órdenes, 10 familias y 15 géneros. Del total de especies recolectadas, 2 de ellas Parvilucina approximata (Dall, 1901) y Pinna rugosa G. B. Sowerby I, 1835, encontradas en playa El Palmar y playa Las Gatas, respectivamente, no se incluyeron en los análisis de estructura comunitaria, dado que solo se recolectó la concha. Se obtuvieron 13 especies en playa El Palmar y 9 en playa Las Gatas. Las familias Carditidae y Mytilidae fueron las mejor representadas con 3 (18%) y 5 (30%) especies, respectivamente.
En ambas localidades, las especies más abundantes fueron: Brachidontes adamsianus (Dunker, 1857), Leiosolenus aristatus (Dillwyn, 1817) e Isognomon janus Carpenter, 1857, con 376, 205 y 124 individuos, respectivamente, lo cual representó 91% del total de individuos. Brachidontes adamsianus obtuvo la mayor abundancia en El Palmar a lo largo del ciclo anual, con el valor más elevado (161 individuos) en enero. En Las Gatas, Leiosolenus aristatus fue la especie con la mayor abundanciacon 140 individuos en enero; sin embargo, la especie más abundante fue B. adamsianus a lo largo de los otros meses de muestreo. Mientras que las especies menos abundantes fueron: Sphenia fragilis (H. Adams & A. Adams, 1854) con 2 individuos en enero y mayo en El Palmar y 1 individuo en noviembre en Las Gatas, Crassinella ecuadoriana Olsson, 1961 con 2 individuos en mayo y julio en El Palmar, Linucula declivis (Hinds, 1843) con 2 individuos en julio y noviembre en Las Gatas, Mya sp. y Mytilus edulis Linnaeus, 1758 con 1 individuo en enero en El Palmar (tabla 1).
Tabla 1
Abundancia de las especies de bivalvos recolectadas en las localidades de estudio por mes de muestreo. El arreglo sistemático sigue la propuesta de Horton et al. (2024).
| Especie | Playa El Palmar | Playa Las Gatas | |||||||
| ene | may | jul | nov | ene | may | jul | nov | Total | |
| Subclase Protobranchia | |||||||||
| Orden Nuculida | |||||||||
| Familia Nuculidae | |||||||||
| Linucula declivis | – | – | – | – | – | – | 1 | 1 | 2 |
| Subclase Autobranchia | |||||||||
| Orden Mytilida | |||||||||
| Familia Mytilidae | |||||||||
| Brachidontes adamsianus | 161 | 43 | 18 | 14 | 41 | 9 | 34 | 56 | 376 |
| Brachidontes semilaevis | 4 | – | – | 1 | – | – | – | – | 5 |
| Leiosolenus aristatus | 2 | 30 | 1 | 6 | 140 | 7 | 5 | 14 | 205 |
| Modiolus capax | 1 | 2 | 1 | 1 | – | – | – | – | 5 |
| Mytilus edulis | 1 | – | – | – | – | – | – | – | 1 |
| Orden Arcida | |||||||||
| Familia Arcidae | |||||||||
| Acar rostae | – | – | – | – | – | – | 1 | 3 | 4 |
| Orden Ostreida | |||||||||
| Familia Pteriidae | |||||||||
| Isognomon janus | 51 | 32 | 8 | 5 | 2 | – | 10 | 16 | 124 |
| Familia Pinnidae | |||||||||
| Pinna rugosa | – | – | – | – | – | – | 3 | – | 3 |
| Orden Lucinida | |||||||||
| Familia Lucinidae | |||||||||
| Parvilucina approximata | 1 | – | – | – | – | – | – | – | 1 |
| Orden Carditida | |||||||||
| Familia Carditidae | |||||||||
| Carditamera affinis | 5 | 2 | – | – | 1 | – | – | 1 | 9 |
| Carditamera radiata | – | 3 | 1 | – | 3 | – | 3 | 5 | 15 |
| Cardites grayi | – | 1 | 3 | – | – | – | – | – | 4 |
| Familia Crassatellidae | |||||||||
| Crassinella ecuadoriana | – | 1 | 1 | – | – | – | – | – | 2 |
| Orden Venerida | |||||||||
| Familia Chamidae | |||||||||
| Chama coralloides | 3 | 2 | 1 | – | – | – | – | 7 | 13 |
| Orden Myida | |||||||||
| Familia Myidae | |||||||||
| Mya sp. | 1 | – | – | – | – | – | – | – | 1 |
| Sphenia fragilis | 1 | 1 | – | – | – | – | – | 1 | 3 |
| Total | 231 | 117 | 34 | 27 | 187 | 16 | 57 | 104 | 773 |

Figura 2. Especies de bivalvos asociadas a macroalgas recolectadas en Ixtapa-Zihuatanejo, Guerrero, en vista dorsal y ventral. a, Linucula declivis;b, Brachidontes adamsianus;c, Leiosolenus aristatus; d, Mytilus edulis; e, Acar rostae; f, Isognomon janus;g, Pinna rugosa; h, Parvilucina approximata; i, Carditamera radiata; j, Cardites grayi; k, Crassinella ecuadoriana; l, Chama coralloides;m, Sphenia fragilis; n, Modiolus capax;o, Brachidontes semilaevis;p, Carditamera affinis;q, Mya sp.
La riqueza de especies con relación al ciclo anual fue de 13 especies en playa El Palmar, variando entre 5 (noviembre) y 10 especies (enero) a lo largo de los meses, mientras que en playa Las Gatas se obtuvieron 9 especies, con una variación de 2 (mayo) y 9 (noviembre) especies (tabla 1). La curva de acumulación de especies mostró un comportamiento asintótico en El Palmar, mientras que Las Gatas no mostró una tendencia a ser asintótica (fig. 3).
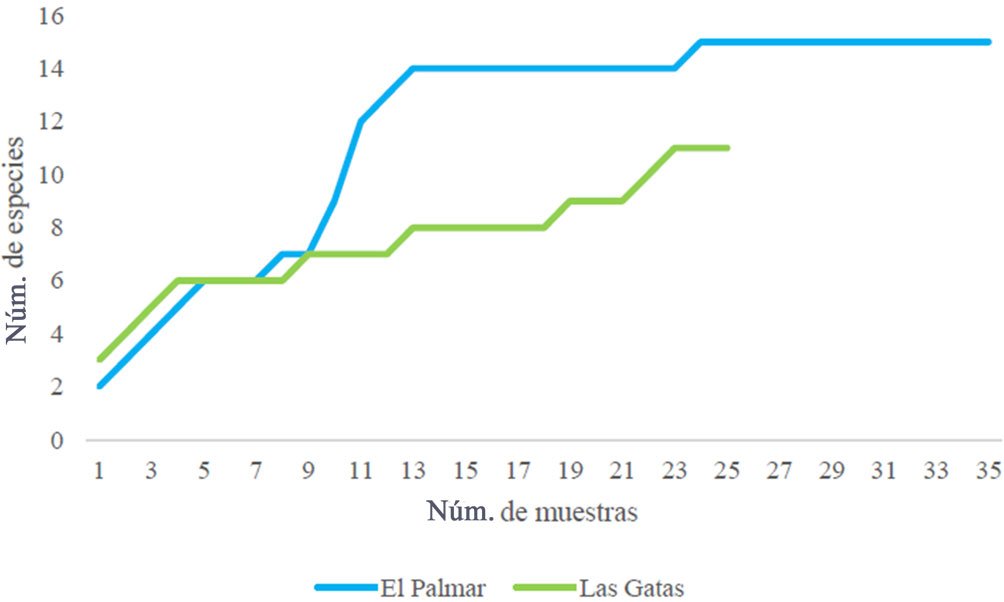
Figura 3. Curva de acumulación de especies de bivalvos registrados en las localidades de estudio. Línea azul: playa El Palmar, línea verde: playa Las Gatas.
En playa El Palmar el nivel intermareal bajo obtuvo el mayor número de especies (13) y el menor número de especies se presentó tanto en el nivel intermareal medio como en el alto (7); mientras que en playa Las Gatas, se presentó el mayor número de especies en el nivel intermareal medio (10) y el nivel alto tuvo el menor número de especies (5). Las especies que se presentaron en ambas localidades en los 3 niveles de la zona intermareal fueron Brachidontes adamsianus, Leiosolenus aristatus e Isognomon janus.
En El Palmar se registraron valores del índice de diversidad de Shannon que fluctuaron entre 1.30 y 2.15 bits/individuo, mientras que en Las Gatas este índice varió entre 0.98 y 2.09 bits/individuo (tabla 2). En general, el índice de equidad de Pielou presentó valores mayores a 0.60 en playa El Palmar, excepto en enero, mientras que en playa Las Gatas se observó que los valores fueron bajos en enero y mayo, y mayores a 0.60 en julio y noviembre. Las pruebas de “t de student”para el índice de diversidad de Shannon entre los meses de muestreo, indicaron diferencias significativas entre todos ellos (p ≤ 0.05) en El Palmar, y Las Gatas (tabla 3).
Tabla 2
Índices comunitarios calculados para las especies recolectadas en playa El Palmar y playa Las Gatas. N = número de individuos, H’= Índice de Shannon, J’= equidad de Pielou y λ = dominancia de Simpson. Los valores máximos y mínimos por localidad para el índice de Shannon (H´) se marcan con negritas.
| Playa El Palmar | Playa Las Gatas | |||||||
| Mes | N | H’ | J’ | λ | N | H’ | J’ | λ |
| Enero | 230 | 1.30 | 0.48 | 0.54 | 187 | 0.99 | 0.41 | 0.60 |
| Mayo | 117 | 2.15 | 0.81 | 0.27 | 16 | 0.98 | 0.41 | 0.50 |
| Julio | 34 | 2.03 | 0.77 | 0.34 | 54 | 1.63 | 0.68 | 0.44 |
| noviembre | 27 | 1.77 | 0.67 | 0.35 | 104 | 2.09 | 0.87 | 0.33 |
En el análisis de escalamiento multidimensional no métrico (nMDS), a partir de los valores de abundancia de las especies de bivalvos, se observó que las muestras se separan en 3 grupos: un primer grupo dominado por estaciones pertenecientes a playa El Palmar (P), un segundo grupo principalmente con estaciones de playa Las Gatas (G) y uno tercero con estaciones de ambas localidades que probablemente se separa por la dominancia de la especie Brachidontes adamsianus (fig. 4). El vector indica la dirección a través del plano de ordenación en la cual aumentan los valores de abundancia de las especies dominantes, la longitud de la línea indica la cantidad de variación total de cada especie, entonces, si toda la variación se explicara, la línea azul alcanzaría el círculo azul.
Tabla 3
Resultado de la prueba de “t de student”para evaluar diferencias significativas del índice de Shannon entre los meses de muestreo por localidad.
| Playa El Palmar | Playa Las Gatas | |||||||
| Meses | H´ | t | p | gl | H´ | t | p | gl |
| enero vs. mayo | 1.30/2.15 | -0.009 | 324 | 1 | 0.99/0.98 | 0.009 | 169 | 1 |
| mayo vs. julio | 2.15/2.03 | 0.0004 | 142 | 0.98/1.63 | -19.84 | 4 | ||
| julio vs. noviembre | 2.03/1.17 | 0.023 | 60 | 1.63/2.09 | -3.18 | 94 |
El análisis de Permanova reveló que la composición de bivalvos difiere significativamente entre las diferentes localidades muestreadas (pseudo-F = 5.2373, p = 0.001). No hubo diferencias estadísticamente significativas para los meses de muestreo (pseudo-F=1.431, p = 0.147) y el nivel de marea (pseudo-F = 1.19, p = 0.309) (tabla 4).
Tabla 4
Resultado de los análisis de Permanova para los factores de localidad, mes de muestreo y nivel de marea. GL: Grados de libertad, ms: media suma de cuadrados, perm: permutaciones, * = valores significativos.
| Factor | GL | ms | Pseudo-F | p (perm) |
| Localidad | 1 | 7,844.9 | 5.2373 | 0.001* |
| Res | 57 | 1,497.9 | ||
| Total | 58 | |||
| Mes | 3 | 2,249.9 | 1.431 | 0.147 |
| Res | 55 | 1,572.3 | ||
| Total | 58 | |||
| Nivel de marea | 2 | 1,915 | 1.1996 | 0.309 |
| Res | 56 | 1,596.3 | ||
| Total | 58 |
Riqueza y composición de macroalgas. Se encontró un total de 3 phyla, 3 clases, 5 subclases, 14 órdenes, 20 familias, 33 géneros y 59 especies de macroalgas; de las cuales, a cada localidad le pertenecen 37 especies. De las 59 especies totales, 11 fueron Chlorophyta (18%), 42 Rhodophyta (70%) y 7 Heterokontophyta-Phaeophyceae (11%). Entre ambas localidades se compartieron 16 especies. Las familias con mayor número de especies fueron Rhodomelaceae con 12 especies, Corallinaceae con 10 y Ceramiaceae y Dictyotaceae con 5 especies cada una (tabla 5).
Asociación entre grupos morfofuncionales y moluscos. Las macroalgas se clasificaron en 6 grupos morfofuncionales: algas filamentosas, foliosas, foliosas corticadas, filamentosas corticadas, coriáceas y calcáreas articuladas (tabla 5). Los grupos dominantes en las 2 localidades fueron las algas filamentosas, filamentosas corticadas y las calcáreas articuladas. En playa El Palmar se presentó una mayor riqueza de especies (14) de bivalvos al interior de las comunidades algales que contenían el grupo de algas calcáreas articuladas. En playa Las Gatas, los grupos morfofuncionales que presentaron mayor cantidad de especies fueron las algas filamentosas, filamentosas corticadas y las calcáreas articuladas con 10 especies cada uno (tabla 6).
Cobertura de macroalgas, abundancia de moluscos y sedimentos retenidos. La regresión lineal por localidad indicó que para playa El Palmar hay una correlación baja con 24% entre los componentes: cobertura de macroalgas, abundancia de bivalvos y peso de sedimento húmedo; sin embargo, se observó una relación moderada entre los sedimentos retenidos por las macroalgas y la abundancia de bivalvos (R = 0.55 y R2 = 0.24). Para playa Las Gatas la regresión lineal múltiple indicó una correlación baja con 10% entre los factores y una relación moderada entre la cobertura de macroalgas y la abundancia de bivalvos (R = 0.42 y R2 = 0.10). La cobertura de macroalgas, abundancia de bivalvos y los sedimentos retenidos varió según la localidad (fig. 5A-C), mes de muestreo (fig. 5D-F) y nivel de marea (fig. 5G-I). En El Palmar la regresión lineal mostró una relación directamente proporcional entre la abundancia de bivalvos y la cobertura de macroalgas. Los valores más altos de cobertura de macroalgas (0.89 m2) se relacionaron con los valores más altos de abundancia de bivalvos.
Con respecto al mes de muestreo, las regresiones lineales múltiples indicaron una correlación alta con 98% (R = 0.99 y R2 = 0.98), entre la cantidad de sedimento retenido y la abundancia de bivalvos. La regresión lineal múltiple sugirió que la abundancia de bivalvos disminuyó a lo largo del ciclo anual, donde enero presentó la mayor abundancia (de 187-230 individuos) y noviembre la menor (27 individuos). La relación de la abundancia de bivalvos con el peso húmedo de sedimento tuvo un comportamiento parecido, disminuyendo conforme al ciclo anual: en las muestras de enero se reportó mayor sedimento retenido (0.56 kg), mientras que en julio se encontraron menos sedimentos retenidos (0.17 kg).

Figura 4. Análisis de escalamiento multidimensional no métrico (nMDS) de las especies de bivalvos recolectadas en las localidades de estudio. Las líneas azules (vectores) indican las especies abundantes y frecuentes (dominantes). El círculo azul representa la variación de las abundancias.
Tabla 5
Especies de macroalgas asociadas a bivalvos, para cada localidad y grupo morfofuncional. Se marca con * la especie de macroalga presente en la localidad. Localidad: playa El Palmar (P), playa Las Gatas (G). Grupos morfofuncionales de macroalgas: filamentosas (Fil), foliosas (Fol), foliosas corticadas (Foc), filamentosas corticadas (Fic), coriáceas (Cor), calcáreas articuladas (Cal). Especies de bivalvos: 1) Linucula declivis, 2) Brachidontes adamsianus, 3) Brachidontes semilaevis, 4) Leiosolenus aristatus, 5) Modiolus capax, 6) Mytilus edulis, 7) Acar rostae, 8) Isognomon janus, 9) Carditamera affinis, 10) Carditamera radiata, 11) Cardites grayi, 12) Crassinella ecuadoriana, 13) Chama coralloides, 14) Mya sp., 15) Sphenia fragilis,16) Pinna rugosa, 17) Parvilucina approximata.
| Especies | Grupo morfofuncional | Especies de bivalvos | |
| P | G | ||
| Chlorophyta | |||
| Ulvales | |||
| Ulvaceae | |||
| Ulva californica Wille, 1899 | Fol | * | – |
| Ulva intestinalis Linnaeus, 1753 | Fol | – | 2, 4, 13 |
| Ulva linza Linnaeus, 1753 | Fol | – | 2, 4, 13 |
| Bryopsidales | |||
| Bryopsidaceae | |||
| Bryopsis pennata var. minor J. Agardh, 1887 | Fil | – | 2, 4, 8 |
| Caulerpaceae | |||
| Caulerpa chemnitzia (Esper) J.V. Lamouroux, 1809 | Fil | 2, 4, 8, 10, 17 | 1, 2, 4, 7, 8, 9, 10, 15 |
| Caulerpa sertularioides (S.G. Gmelin) M. Howe, 1905 | Fil | 2, 4, 8, 10, 17 | 1, 2, 4, 7-10, 15 |
| Halimedaceae | |||
| Halimeda discoidea Decaisne, 1842 | Cal | 2, 10, 17 | – |
| Cladophorales | |||
| Cladophoraceae | |||
| Chaetomorpha antennina (Bory) Kützing, 1847 | Fil | 2, 3, 7, 8-13 | 4, 7, 8, 11, 13 |
| Cladophora sp. | Fil | 2, 4, 5, 8, 9 | – |
| Cladophora graminea Collins, 1909 | Fil | – | 16 |
| Cladophora microcladioides Collins, 1909 | Fil | 2, 4, 5, 8, 9 | – |
| Rhodophyta | |||
| Gigartinales | |||
| Cystocloniaceae | |||
| Hypnea pannosa J. Agardh, 1847 | Fic | 2-6, 8-15 | 2, 4, 8-10, 16 |
| Hypnea spinella (C. Agardh) Kützing, 1847 | Fic | 2-6, 8-15, 17 | 2, 4, 8-10, 16 |
| Hypnea johnstonii Setchell y N. L. Gardner, 1924 | Fic | – | 1, 2, 4, 7-10, 16 |
| Phyllophoraceae | |||
| Ahnfeltiopsis gigartinoides (J. Agardh) P. C. Silva y DeCew, 1992 | Fic | 8 | – |
| Gymnogongrus johnstonii (Setchell y N. L. Gardner) E.Y. Dawson, 1961 | Fic | 2, 8 | – |
| Ceramiales | |||
| Ceramiaceae | |||
| Centroceras clavulatum (C. Agardh) Montagne, 1846 | Fil | 2-5, 8 | 2, 4, 10, 15 |
| Tabla 5. Continúa | |||
| Especies | Grupo morfofuncional | Especies de bivalvos | |
| P | G | ||
| Ceramium sp. | Fil | – | 1, 2, 4, 7, 8, 10, 13, 16 |
| Ceramium camouii E. Y. Dawson, 1944 | Fil | – | 1, 2, 4, 7, 8, 10, 13, 16 |
| Ceramium zacae Setchell y N. L. Gardner, 1937 | Fil | – | 1, 2, 4, 7, 8, 10, 13, 16 |
| Gayliella flaccida (HarveyyKützing) T.O. McIvory y L.J. Cho, 2008 | Fic | – | 2, 4, 7, 8, 11 |
| Delesseriaceae | |||
| Taenioma perpusillum (J. Agardh) J. Agardh, 1863 | Fil | – | 4, 16 |
| Rhodomelaceae | |||
| Chondria sp. | Fic | * | * |
| Herposiphonia secunda (C. Agardh) Ambronn, 1880 | Fic | 8 | 2, 4, 8, 10 |
| Herposiphonia tenella (C. Agardh) Ambronn, 1880 | Fic | 7 | – |
| Melanothamnus simplex (Hollenberg) Díaz-Tapia y Maggs, 2017 | Fic | 2, 8 | – |
| Melanothamnus sphaerocarpus (Borgesen) Díaz.Tapioa y Maggs, 2017 | Fic | – | 2, 4, 8 |
| Polysiphonia mollis J. D. Hooker y Harvey, 1847 | Fic | * | 2, 4, 8, 15 |
| Polysiphonia nathanielii Hollenberg, 1958 | Fic | – | 2, 4, 8, 15 |
| Polysiphonia subtilissima Montagne, 1840 | Fic | – | 2, 4, 8, 15 |
| Eutrichosiphonia confusa (Hollenberg) Savoie y G.W. Saunders, 2019 | Fic | – | 2, 4, 8 |
| Laurencia sp. | Fic | 2, 8, | 2, 7, 8, 13 |
| Laurencia hancockii E.Y. Dawson, 1944 | Fic | 2, 8 | – |
| Laurencia subcorymbosa E.Y. Dawson, 1963 | Fic | 2, 8 | – |
| Rhodymeniales | |||
| Rhodymeniaceae | |||
| Tayloriella dictyurus (J. Agardh) Kylin, 1956 | Fil | 2, 8 | – |
| Lomentariaceae | |||
| Ceratodictyon tenue (Setchell y N. L. Gardner) J.N. Norris, 2014 | Fil | – | 2, 4, 8 |
| Corallinales | |||
| Corallinaceae | |||
| Amphiroa beauvoisii J.V. Lamouroux, 1816 | Cal | 2-15, 17 | 1, 2, 4, 7-14, 16 |
| Amphiroa misakiensis Yendo, 1902 | Cal | 2-15 | 1, 2, 4, 7-14, 16 |
| Amphiroa rigida J.V. Lamouroux, 1816 | Cal | 2-15 | 1, 2, 4, 7-14, 16 |
| Amphiroa subcylindrica E.Y. Dawson, 1953 | Cal | 2-15 | – |
| Jania capillacea Harvey, 1853 | Cal | – | 2, 4, 7-10, 15, 16 |
| Jania subpinnata E.Y. Dawson, 1953 | Cal | 2, 4, 5, 8, 9, 12, 14 | 2, 4, 7-10, 15, 16 |
| Jania tenella (Kützing) Grunow, 1874 | Cal | 2, 4, 5, 8, 9, 12, 14 | 2, 4, 7-10, 15, 16 |
| Jania tenella var. tenella | Cal | 2, 4, 5, 8, 9, 12, 14 | – |
| Gelidiales | |||
| Gelidiaceae | |||
| Gelidiella acerosa (Forsskal) Feldmann y Hamel, 1934 | Fic | – | 2, 7, 8 |
| Gelidium mcnabbianum (E.Y. Dawson) B. Santelices, 1998 | Fic | – | 2, 4, 7-11 |
| Gelidium pusillum (Stackhouse) Le Jolis, 1863 | Fic | 2, 4, 5, 8, 12, 14 | 2, 4, 7-11 |
| Pterocladiaceae | |||
| Pterocladiella caloglossoides (M. Howe) Santelices, 1998 | Fic | – | 2, 4, 7, 8, 15 |
| Gracilariales | |||
| Gracilariaceae | |||
| Gracilaria sp. | Fic | 2, 8, 12, 14 | – |
| Halymeniales | |||
| Halymeniaceae | |||
| Grateloupia huertana Mateo-Cid, Mendoza-González y Gavio, 2005 | Fic | – | 4, 8 |
| Grateloupia versicolor (J. Agardh) J. Agardh, 1847 | Fic | 2, 4, 8 | – |
| Heterokontophyta-Phaeophyceae | |||
| Ectocarpales | |||
| Scytosiphonaceae | |||
| Chnoospora minima Papenfuss, 1956 | Fic | * | – |
| Fucales | |||
| Sargassaceae | |||
| Sargassum liebmannii Agardh, 1847 | Cor | 2, 4, 5, 7, 8, 10-13, 15, 17 | – |
| Dictyotales | |||
| Dictyotaceae | |||
| Dictyota sp. | Foc | – | * |
| Dictyota dichotoma (Hudson) J.V. Lamouroux, 1809 | Foc | 2, 4, 5, 8 | – |
| Lobophora variegata (J.V.Lamouroux)Womersley ex E.C.Oliveira, 1977 | Fic | 8 | – |
| Padina mexicana var. erecta Avila-Ortiz, 2003 | Foc | 2, 4, 5, 8, 9 | – |
| Padina ramonribae Avila-Ortiz, Pedroche y Díaz-Martínez, 2016 | Foc | 2, 4, 5, 8, 9 | – |
La regresión lineal por nivel de marea indicó una correlación significativa con 100% (R = 1 y R2 = 1), es decir, la cobertura de algas y el sedimento retenido están relacionados con la abundancia de bivalvos en los diferentes niveles de marea. El nivel del intermareal bajo presentó los valores más elevados de cobertura de macroalgas con 0.61 m2 (fig. 5G), mayor abundancia de moluscos con 275 individuos (fig. 5H) y mayor cantidad de sedimentos con 0.69 kg (fig. 5I). En el intermareal alto se registraron los valores más bajos de abundancia de bivalvos con 230 individuos (fig. 5H), cobertura de algas con 0.52 m2 (fig. 5G) y peso húmedo de sedimentos con 0.30 kg (fig. 5I), es decir, conforme se asciende en el intermareal, estas variables disminuyen.
Tabla 6
Asociación de las especies de bivalvos con los grupos morfofuncionales propuestos por Steneck y Dethier (1994). Grupos morfofuncionales de macroalgas: filamentosas (Fil), foliosas (Fol), foliosas corticadas (Foc), filamentosas corticadas (Fic), coriáceas (Cor), calcáreas articuladas (Cal). × = Presencia de la especie.
| Familia | Especie | Playa El Palmar | Playa Las Gatas | ||||||||||
| Fil | Fol | Foc | Fic | Cor | Cal | Fil | Fol | Foc | Fic | Cor | Cal | ||
| Nuculidae | L. declivis | – | – | – | – | – | – | × | – | – | × | – | × |
| Mytilidae | B. adamsianus | × | – | × | × | × | × | × | × | – | × | – | × |
| B. semilaevis | × | – | – | × | – | × | – | – | – | – | – | – | |
| L. aristatus | × | – | × | × | × | × | × | × | – | × | – | × | |
| M. capax | × | – | × | × | × | × | – | – | – | – | – | – | |
| M. edulis | – | – | – | × | – | × | – | – | – | – | – | – | |
| Arcidae | A. rostae | × | – | – | – | × | × | × | – | – | × | – | × |
| Pteriidae | I. janus | × | – | × | × | × | × | × | – | – | × | – | × |
| Pinnidae | P. rugosa | – | – | – | – | – | – | × | – | – | × | – | × |
| Lucinidae | P. approximata | × | – | – | × | × | × | – | – | – | – | – | – |
| Carditidae | C. affinis | × | – | × | × | – | × | × | – | – | × | – | × |
| C. radiata | × | – | – | × | × | × | × | – | – | × | – | × | |
| C. grayi | × | – | – | × | × | × | × | – | – | × | – | × | |
| Crassatellidae | C. ecuadoriana | × | – | – | × | × | × | – | – | – | – | – | – |
| Chamidae | C. coralloides | × | – | – | × | × | × | × | × | – | × | – | × |
| Myidae | Mya sp. | – | – | – | × | – | × | – | – | – | – | – | – |
| S. fragilis | – | – | – | × | × | × | × | – | – | × | – | × | |
| Total | 12 | 0 | 5 | 14 | 11 | 15 | 11 | 3 | 0 | 11 | 0 | 11 |
Discusión
Riqueza y composición de moluscos. De las 17 especies encontradas en el presente estudio, 16 ya habían sido observadas para el Pacífico tropical mexicano, específicamente para Ixtapa-Zihuatanejo en sustratos rocosos y arenosos (Flores-Rodríguez et al., 2007, 2012; Lesser, 1984; López-Rojas et al.,2017; Lozada, 2010; Sánchez, 2014), excepto Mytilus edulis que es un nuevo registro para Guerrero. Esta especie fue encontrada en playa El Palmar, asociada a los géneros de macroalgas Amphiroa e Hypnea. Dicha especie había sido registrada para el océano Pacífico desde las costas del Ártico, Canadá, EUA, hasta Cabo San Lucas, México, al interior del golfo de California en San Luquitas y Santa Rosalía, y para el Pacífico tropical mexicano en isla Socorro, por lo que su distribución se amplía hacia el sur, a Guerrero en ambientes litorales asociados a las comunidades de macroalgas (Cadena-Cárdenas et al., 2009; Fitch, 1953; Shaw et al., 1988). La ampliación de la distribución de esta especie puede deberse al movimiento de la corriente de California como ha sido reportado para bivalvos (Schulien et al., 2020), gasterópodos y escafópodos que ampliaron su distribución desde la provincia Californiana hacia la Panámica donde se señala la confluencia de especies de moluscos entre ambas provincias (Landa-Jaime y Arciniega-Flores 1998; Ríos-Jara et al., 2003; Gama-Kwick et al., 2021). Otra de las razones por la cual M. edulis amplió su distribución al sur podría ser por el fenómeno de El Niño que proporciona condiciones ambientales para que las especies que habitan en sitios templados y subtropicales se desplacen a sitios tropicales (Díaz y Ortlieb, 1993; Paredes et al., 1998; Velez y Zeballos, 1985).

Figura 5. Variación de cobertura de macroalgas, abundancia de bivalvos y sedimento retenido por localidades (A, B y C), mes de muestreo (D, E y F) y nivel de la zona intermareal (G, H e I). Verde = macroalgas, amarillo = bivalvos, rojo = sedimento retenido.
La familia mejor representada fue Mytilidae con 5 especies: Brachidontes adamsianus, B. semilaevis, Leiosolenus aristatus, Modiolus capax y Mytilus edulis (tabla 1), dichas especies coinciden con lo registrado por Flores-Garza et al.(2014), Galeana-Rebolledo et al.(2012) y Garcés (2011) en Acapulco, así como por López-Rojas et al. (2017) en diferentes localidades en Guerrero. Mytilidae también ha sido la familia mejor representada en otras localidades de Zihuatanejo (muelle municipal), donde se han observado 8 especies (Guzmán, 2022), así como en otras regiones tropicales como Brasil, donde esta familia también fue la mejor representada con 5 especies (Santos et al., 2020).
Una mayor riqueza de especies de la familia Mytilidae en Ixtapa-Zihuatanejo podría explicarse debido a la frecuencia y rápido asentamiento de larvas de bivalvos, ya que son organismos que están en constante reproducción a lo largo del año (Seed, 1969a). Suchanek (1978) mencionó que los miembros de la familia Mytilidae tienden a colonizar rápidamente los espacios disponibles en la zona intermareal rocosa, familia que se ha adaptado a distintos hábitats (Keen, 1971), gracias a su rápido aumento de talla y posterior asentamiento de larvas (Ceccherelli y Rossi, 1984). También se ha mencionado que los organismos de dicha familia pueden producir fibras de biso, por lo que son capaces de anclarse y permanecer en sustratos en los que otras familias de bivalvos no pueden, como rocas, arenas u otros organismos (Keen, 1971; Stella et al.,2010).
En general, se encontró una mayor riqueza de especies en El Palmar, valores que pueden explicarse debido a la heterogeneidad ambiental de una playa expuesta con oleaje intenso como dicho sitio (Morales et al., 2008). Se ha mencionado que la riqueza de especies de bivalvos es mayor en zonas expuestas en donde las olas impactan directamente, por su parte, las zonas protegidas o de menor oleaje presentan menor riqueza específica (Flores-Garza et al., 2014; Flores-Rodríguez et al., 2012; Valdés-González et al., 2004).
En El Palmar, se encontraron valores elevados para la riqueza de especies de bivalvos (17 spp.) respecto de lo encontrado en Las Gatas, lo anterior también se ha observado para otras clases de moluscos como los gasterópodos y poliplacóforos asociados a comunidades de macroalgas en playa El Palmar (Aguilar, 2017). También en esta playa se encontró menor cantidad de sedimentos retenidos por las macroalgas (fig. 5C). El Palmar está conformada por rocas de diferentes tamaños, que pueden moverse conforme se dan los cambios en el oleaje y la marea, lo que le confiere un alto dinamismo que no permite la acumulación de sedimentos (Gibbons, 1988), tal como se observó en el presente estudio. Dichas características ayudan a que se conformen una amplia gama de ambientes que pueden ser colonizados, donde se esperaría una mayor riqueza de especies como se observó para los bivalvos de El Palmar (Benedetti-Cecchi, 2001).
Como se ha mencionado anteriormente, playa Las Gatas es un sitio protegido, por esta razón es un lugar de baja energía, con características poco favorables para el establecimiento de especies de bivalvos de manera muy similar a los estudios realizados en otras zonas de Guerrero (Flores-Garza et al., 2014; Flores-Rodríguez et al., 2012; Valdés-González et al., 2004). Las fluctuaciones observadas entre ambas playas de la riqueza de especies, también podrían deberse a otro tipo de características presentes en algunas familias de bivalvos que no tienen hábitos epifaunales como los que se adhieren a las macroalgas y que presentan hábitos de vida semiinfaunales o infaunales (Garcés, 2011), por lo que estas especies podrían encontrarse en otros sitios, posiblemente en zonas más profundas en la zona submareal, o de igual forma, las especies de bivalvos se pueden ver afectadas por la contaminación al incorporar en sus tejidos bacterias patógenas (Gosling, 2015), que es común de una zona turística como Ixtapa-Zihuatanejo (IMTA, 2010; UNAM, 2013). Lo anterior podría explicar las fluctuaciones en la riqueza de especies de bivalvos observadas en Zihuatanejo.
Los valores de riqueza de especies no variaron considerablemente en las localidades estudiadas a lo largo del año. La riqueza de especies de bivalvos en un ciclo anual puede ser constante, ya que la mayoría de las especies (70%) de bivalvos del presente trabajo son generalmente inmóviles o sedentarias. Lo anterior hace que sus poblaciones se mantengan con pocos cambios con respecto a su riqueza de especies debido a sus patrones de reproducción anuales o bianuales (Baqueiro y Masso, 1988; Flores-Rodríguez et al., 2012; Seed, 1969a).
La especie más abundante en el presente trabajo fue B. adamsianus (Mytilidae). Esta especie ha sido registrada como la más abundante en otras localidades de Zihuatanejo (Guzmán, 2022). En particular, las familias Chamidae y Mytilidae se han registrado como las más abundantes para Guerrero; por su parte, la especie Isognomon janus Carpenter, 1857 (Isognomonidae) también ha presentado un gran número de organismos (Guzmán, 2022; López-Rojas et al. 2017). Las bajas abundancias de los bivalvos encontrados en este trabajo pueden estar dadas por el tipo de hábitos de vida de dichos moluscos. Por ejemplo, el género Sphenia tienen un hábito endolítico (Esqueda-González et al., 2014; Garcés, 2011; Guzmán, 2022), por lo que sería poco probable encontrarlos dentro de las comunidades de macroalgas, ya que es común encontrarlos incrustados en agujeros preexistentes de rocas, fragmentos de madera, incluso otros materiales como las conchas de moluscos, así como entre colonias de briozoos (Coan, 1999). El Permanova mostró que existen diferencias significativas entre localidades, esto puede deberse a que playa Las Gatas es considerada como un sitio protegido y playa El Palmar como un sitio expuesto, esto representó diferencias en abundancia y riqueza de especies, que pueden deberse a los requerimientos medioambientales propios de cada una de las especies de bivalvos como: sustrato, alimento, salinidad o temperatura (Borges et al., 2014; Galeana-Rebolledo et al., 2012; Seed 1969a).
En playa El Palmar, la curva de acumulación de especies fue asintótica, lo que sugiere que se encontró a la mayoría de los bivalvos asociados a macroalgas de esta localidad. Mientras que, en playa Las Gatas, la curva de acumulación de especies no fue asintótica. La cantidad de especies recolectadas en un sitio está relacionada con el esfuerzo de muestreo (Moreno, 2001). Por lo que el menor número de muestras en donde se encontraron bivalvos en playa Las Gatas (25), en comparación con las de playa El Palmar (35), podría explicarse por este hecho. Se ha mencionado que una curva de acumulación de especies en muy raras ocasiones llega a ser asintótica, ya que siempre habrá especies que no se recolecten o durante los muestreos pueden encontrarse especies raras, lo que puede estar determinado por el sitio de muestreo, temporada del año, tipo de sustrato, entre otras variables (Jiménez-Valverde y Hortal, 2003).
Además, otra de las razones para que la curva de acumulación de especies no haya sido asintótica para Las Gatas, podría deberse a que, en ambas localidades, las muestras de bivalvos fueron obtenidas de comunidades de macroalgas, que es un sustrato muy específico y es distinto a las rocas y arena que componen la zona intermareal que corresponden a los sustratos que se han estudiado en la mayoría de los distintos trabajos malacológicos de Guerrero. Por lo anterior, el inventario podría estar incompleto; sin embargo, es una buena aproximación de la biodiversidad de las especies de bivalvos asociadas a comunidades de macroalgas de la zona norte de Guerrero en Ixtapa-Zihuatanejo. Para tener una curva de acumulación de especies asintótica se recomienda muestrear todos los sustratos posibles y de esta forma, obtener casi todas las especies de bivalvos de la zona.
Se encontraron cambios con respecto a la abundancia de bivalvos asociados a macroalgas a lo largo del año, fluctuaciones que pudieran estar relacionadas con sus patrones reproductivos, lo que podría explicar la disminución en la abundancia de bivalvos en los meses cálidos (mayo y julio) y un aumento en la cantidad de individuos en los meses fríos (enero y noviembre). Los cambios en la abundancia de bivalvos se han estudiado en trabajos sobre reproducción de diferentes especies de moluscos (Baqueiro y Aldana, 2000, 2003). Algunas de las especies de bivalvos que han sido utilizadas en estudios reproductivos o sobre ciclos gonádicos son: Chione undatella (G. B. Sowerby I, 1835), Megapitaria aurantiaca (G. B. Sowerby I, 1831) (Veneridae), Brachidontes rodriguezii (d’Orbigny, 1842), Mytilus edulis y Mytilus chilensis Hupé, 1854 (Mytilidae), así como Anadara tuberculosa (G. B. Sowerby I, 1833) (Arcidae), tanto en México como otros países de Sudamérica. Dichos estudios destacan que los bivalvos se reproducen continuamente a lo largo del año y se ha mencionado que el momento del desove comprende desde la primavera hasta el otoño con temperaturas por encima de los 25 °C; se ha observado que las larvas se instalan en octubre y noviembre, con una metamorfosis de 15 a 25 días, dichas larvas permanecen adheridas a las algas de noviembre a mayo, en donde llevan a cabo su metamorfosis (Aguillón, 2011; Baqueiro y Masso, 1988; García-Domínguez et al., 2008; Hernández-Moreno et al., 2020; Oyarzún et al., 2011; Seed, 1969a; Torroglosa, 2015). Solo se encontró a Mytilus edulis como especie de importancia comercial para el presente trabajo. En especies que no se les ha considerado importantes para la industria pesquera, es muy poco lo que se conoce acerca de sus hábitos reproductivos (Aguilar, 2017).
Las 3 especies más abundantes del presente trabajo son epifaunales de hábitos filtradores por suspensión (García-Cubas, 1981), Isognomon janus (Isognomonidae) habita en la zona intermareal hasta profundidades de 20 m, Leiosolenus aristatus (Mytilidae)puede encontrarse desde el litoral hasta los 300 m sobre rocas u otros bivalvos (Coan y Valentich-Scott, 2012) y Brachidontes adamsianus (Mytilidae)habita sobre grietas de rocas grandes en zonas expuestas (Landa-Jaime et al., 2013). Las especies que no pertenecen a las familias Isognomonidae y Mytilidae, en general, son organismos infaunales de hábitos filtradores por suspensión, a excepción de la familia Myidae que son infaunales perforadores de hábitos filtradores por suspensión (García-Cubas, 1981; Coan, 1999).
Los bivalvos están presentes en diferentes lugares al interior de la zona intermareal rocosa y hay especies que tienen preferencia por algún sitio a lo largo de dicha zona (Román-Contreras et al.,1991; Sibaja-Cordero y Vargas-Zamora, 2006; Suchanek, 1978). En el presente estudio se observó un incremento en la abundancia y riqueza en los niveles intermareales medio y bajo. Este mismo patrón se ha observado en otras especies de moluscos como gasterópodos y poliplacóforos de Zihuatanejo (Aguilar, 2017; Gama-Kwick et al., 2021).
El índice de diversidad de Shannon obtenido en este trabajo fue bajo, menor a 2.16 bits/individuo para ambos sitios de muestreo, en comparación con otros trabajos sobre bivalvos asociados a macroalgas para Zihuatanejo, como el de Guzmán (2022), donde se encontraron valores de 3.41 bits/individuo en el muelle municipal. Flores-Garza et al.(2014), en su estudio en Acapulco, presentaron valores de 3.65 bits/individuo y Galeana-Rebolledo et al.(2012) reportaron valores de 3.64 bits/individuo. Las diferencias con respecto al índice de diversidad de Shannon pueden deberse a la baja riqueza de especies encontrada en Ixtapa-Zihuatanejo, respecto de otras localidades del Pacífico tropical mexicano, donde se han registrado valores superiores a 17 especies; Reguero y García-Cubas (1989) encontraron 53 especies de bivalvos para Nayarit, y Esqueda-González et al. (2014) reportaron 89 especies de bivalvos para Sinaloa. Lo anterior también puede relacionarse con los altos valores de abundancia de ciertas especies, como es el caso de Brachidontes adamsianus. Ésto también se ve reflejado en los valores calculados del índice de dominancia de Simpson, el cual dio como resultado valores moderados, ya que la abundancia de las especies de bivalvos no es homogénea a lo largo de la zona intermareal rocosa en ambas localidades del presente estudio.
Garcés (2011), describió valores similares del índice de diversidad de Shannon para especies de bivalvos en sustratos rocosos en Acapulco (2.41 bits/individuo) y mencionó que éstos varían según el tipo de sustrato, ya que la riqueza de especies fue mayor en sustratos arenosos que en sustratos rocosos, lo que ocasiona que en estos sustratos, los valores disminuyan.
En el nMDS se observan 3 agrupaciones: una con muestras de la localidad de playa El Palmar, otra con estaciones de playa Las Gatas y la tercera con estaciones de ambas localidades, donde solamente hubo presencia de la especie Brachidontes adamsianus (tabla 1). Dicha especie es una de las más comunes en varias localidades de Jalisco, Oaxaca y Guerrero, por lo que sus valores de abundancia en Ixtapa-Zihuatanejo concuerdan con lo encontrado en otras contribuciones (Castro-Mondragón et al., 2016; Galeana-Rebolledo et al., 2012; Garcés, 2011; Holguín-Quiñones y González-Pedraza 1989; Landa-Jaime et al., 2013; López-Rojas et al., 2017; Torreblanca-Ramírez et al., 2012).
Asociación entre grupos morfofuncionales y moluscos. Los bivalvos recolectados tuvieron una mayor presencia en el grupo morfofuncional de algas filamentosas en ambas localidades, este mismo resultado se observó en muelle municipal en Zihuatanejo por Guzmán (2022) para los bivalvos asociados a macroalgas. Lo anterior puede verse favorecido porque este grupo de algas proporciona refugio ante el oleaje y la desecación, de igual forma tienen un papel fundamental en el asentamiento de las larvas de bivalvos, ya que son utilizadas como un sitio para evitar la competencia entre estadios juveniles y adultos (Dobretsov, 1999; Seed, 1969a).
Las larvas de la familia Mytilidae son atraídas hacia los filamentos de algas rojas de los géneros Ceramium y Polysiphonia, en donde llevan a cabo su metamorfosis (Seed, 1969a), ambos géneros fueron encontrados en el presente trabajo. Las especies de bivalvos de la familia Mytilidae también se encontraron junto con otros géneros de macroalgas como: Bryopsis, Caulerpa, Chaetomorpha y Cladophora (Chlorophyta), dichos géneros también se han relacionado a comunidades de bivalvos en el Caribe colombiano (Quirós-Rodríguez y Campos, 2013). Los géneros Gayliella, Herposiphonia, Taenioma y Tayloriella (Rhodophyta) también se han observado junto a especies de bivalvos, en particular el género Tayloriella se ha encontrado vinculado a 9 diferentes especies de bivalvos en el muelle municipal en Zihuatanejo (Guzmán, 2022). Aun cuando es poco lo que se conoce sobre las asociaciones de bivalvos con macroalgas, es posible sugerir que las larvas de las otras familias de bivalvos encontradas en el presente trabajo (Arcidae, Carditidae, Crassatellidae, Chamidae, Myidae y Pteriidae) puedan tener un comportamiento similar al de Mytilidae y, por esta razón, se podría reconocer su presencia en las comunidades de macroalgas.
La asociación de las especies de bivalvos (B. adamsianus, B. semilaevis, L. aristatus, M. capax, M. edulis, A. rostae, I. janus, C. affinis, C. radiata, C. grayi, C. ecuadoriana, C. coralloides, Mya sp. y S. fragilis) con el grupo de algas filamentosas corticadas fue explicado para especies del género Gigartina porSeed (1969a), quien afirmó que este tipo de algas proporciona una mayor protección y partículas de sedimento retenido (alimento), comparado con las algas filamentosas. En el presente trabajo se encontraron especies de los géneros Ceratodyction, Gelidiella, Gelidium, Gracilaria e Hypnea, que podrían tener una relación similar a la dada por las especies de Gigartina, ya que comparten el mismo grupo morfofuncional propuesto por Steneck y Dethier (1994).
Todas las especies de bivalvos se asociaron al grupo de algas calcáreas articuladas. Las especies del género Corallina proporcionan condiciones ambientales adecuadas para los bivalvos como: refugio, captación de partículas y cantidad de CaCO3 (Seed, 1969a). De esta forma, los bivalvos son capaces de alcanzar tallas mayores en menor tiempo (Seed, 1969a, b). Probablemente, la cantidad de CaCO3 obtenida del ambiente por las macroalgas, queda disponible para que los bivalvos la aprovechen, una vez que las macroalgas mueren. En el presente trabajo, se observó a las especies de algas calcáreas articuladas de los géneros Amphiroa, Halimeda y Jania asociadas a las especies de bivalvos son muy similares a las del género Corallina y comparten el mismo grupo morfofuncional, por lo que podrían funcionar de la misma forma al ser algas que pueden fijar CaCO3 y ser una fuente de aprovechamiento para otros organismos; estas algas calcáreas son la fuente principal de carbonatos marinos (Feely et al., 2004).
Cobertura de macroalgas, abundancia de moluscos y sedimento retenido. La cobertura de macroalgas, abundancia de bivalvos y sedimento retenido disminuyeron conforme se aumentó el nivel del intermareal, los valores más elevados para dichas variables se observaron en el nivel del intermareal bajo (fig. 5G-I). Los resultados de la regresión lineal múltiple sustentan lo anterior, ya que se encontró una relación entre la cobertura de macroalgas y abundancia de bivalvos. Lo anterior podría explicarse por las características del terreno (emersión), debido a que, en un ambiente cambiante como la zona intermareal rocosa, las macroalgas quedan expuestas a una mayor radiación solar en el nivel alto. Por lo tanto, al haber menos céspedes algales (Huovinen et al., 2006), la retención de sedimento es baja, estos 2 factores influyen en las necesidades de cada especie de bivalvo, lo que determina la supervivencia de estos moluscos en esta zona (Airoldi, 2003; Rosenberg, 1977).
Renaud et al. (1997) encontraron una relación entre la abundancia de macroalgas con respecto al sedimento, donde la cobertura de macroalgas era sistemáticamente mayor en las zonas con baja cantidad de sedimentos y un aumento notable en la abundancia de macroalgas se observó después de la remoción de sedimentos. Esto se relaciona con lo encontrado en el presente trabajo, donde se observó una menor cobertura de macroalgas asociada a valores elevados de sedimento. Con respecto de los bivalvos, Forster y Zettler (2004) observaron que la biomasa de Mya arenaria Linnaeus, 1758 se redujo con la presencia de sedimentos finos, lo que podría sugerir que en playa Las Gatas existe una menor abundancia de bivalvos (Airoldi, 2003).
El sedimento en las comunidades de macroalgas queda retenido ya que se acumula en los espacios que hay entre los talos; las cantidades de sedimento acumuladas pueden estar determinadas por la complejidad estructural del alga y las condiciones del medio (García, 2009). La variación en la tasa de sedimentación podría ser un factor de alteración y estrés sobre las comunidades de macroalgas, lo que ocasiona que la tasa de crecimiento algal se vea reducida por la falta de incidencia de luz. Por ello, la fauna que ahí se establece, como las especies de bivalvos, también es menor, ya que una gran cantidad de sedimentos retenidos provoca que los organismos puedan sofocarse y el reclutamiento larval se vea reducido (Airoldi, 2003; Rosenberg, 1977). La clase Bivalvia tiene una preferencia por sustratos arenosos, rocosos, lodosos y fangosos, sin embargo, cuando los sitios no tienen corrientes fuertes y la acumulación de sedimento es alta, la abundancia de bivalvos baja drásticamente (Gosling, 2015).
Las larvas de bivalvos se instalan sobre las algas, donde permanecen adheridas a ellas y llevan a cabo su metamorfosis entre 15 y 25 días; en este lapso, los céspedes algales les proporcionan alimento por el sedimento que retienen y protección contra depredadores y factores abióticos. Posteriormente, los bivalvos juveniles migran fuera de las algas ya que han alcanzado una talla óptima o las algas ya no les brindan suficientes recursos, y llegan a otro sitio que será el definitivo para llevar a cabo el resto de su ciclo de vida (Seed, 1969a, 1969b; Suchanek, 1978).
Olafsson (1986) encontró una relación significativa entre la abundancia de bivalvos y el sedimento, estos resultados son consistentes con lo encontrado en el presente estudio en Ixtapa-Zihuatanejo. Sin embargo, Vázquez (2009) en playa Las Gatas no encontró relación entre la riqueza de especies y el sedimento retenido. Por su parte, en playa El Palmar, que es una zona expuesta, una posible explicación para la relación entre abundancia de bivalvos y sedimento es debido al tipo de hábitos de vida de la mayoría de las especies encontradas en el presente trabajo, ya que la mayoría de ellas son epifaunales o infaunales con hábitos filtradores suspensívoros. La erosión del sustrato rocoso por la acción de las olas y por el movimiento de los sedimentos puede generar heterogeneidad ambiental (Airoldi, 2003). La mezcla constante del agua provee mayor humedad, así como nutrientes al suspender los sedimentos, lo que ocasiona una mayor supervivencia de los organismos, lo que explicaría la relación entre abundancia y sedimento (Gama-Kwick et al., 2021).
Las condiciones de playa El Palmar con un oleaje intenso (Morales et al., 2008), no permite la retención de sedimentos, su baja cantidad podría influir en la composición de las macroalgas. Por lo tanto, la composición de los invertebrados al interior de éstos puede ser muy particular en esta localidad (Gama-Kwick et al., 2021), lo que puede incrementar su diversidad (Chemello y Milazzo, 2002; Prathep et al., 2003). En contraste, playa Las Gatas es un sitio protegido con un oleaje de baja energía y alta cantidad de sedimentos, por lo que su comunidad de macroalgas y bivalvos puede ser menos diversa, abundante y compleja. Lo anterior es similar a lo encontrado en trabajos de la zona para otras clases de moluscos como gasterópodos y poliplacóforos (Aguilar, 2017).
Las comunidades de macroalgas pueden funcionar como sustrato de captura de las larvas desde la columna de agua (Aguilar, 2017). Dichos sitios constituyen zonas de crianza en parte o en todo el ciclo de vida de los bivalvos, ya que proporcionan protección y alimento (Seed, 1969a, b), que está determinado por los sedimentos que las macroalgas retienen.
El presente trabajo aporta resultados que contribuyen al conocimiento de la biodiversidad marina, en especial de los bivalvos asociados a la ficoflora del Pacífico tropical mexicano. Los esfuerzos posteriores deberían centrarse en explorar la biodiversidad de los invertebrados sobre sustratos diferentes en el litoral rocoso, posiblemente utilizando metodologías similares a las del presente estudio con la finalidad de generar comparaciones. En los estudios futuros se debe profundizar en el conocimiento de la distribución geográfica de Mytilus edulis y así corroborar los resultados de este trabajo. Se debe promover el estudio de las interacciones ecológicas, ya que muchas especies de moluscos son impactadas por diferentes factores tanto bióticos, como la depredación o la epibiosis (Aguilar-Estrada et al., 2022; García-Ibáñez et al., 2014; Quiroz-González et al., 2020), así como por distintas condiciones abióticas como circulación del agua, temperatura, pH, régimen de mareas y sedimento (López et al., 2017, 2023). Por ello, es fundamental realizar más investigaciones enfocadas hacia el estudio de la variación espacio-temporal de los organismos en periodos distintos a un ciclo anual en diferentes localidades de México, con el objetivo de sentar las bases pertinentes para su conservación y posterior manejo ante el incremento del desarrollo de infraestructuras turísticas/urbanas en zonas como Guerrero, que pueden tener un efecto desfavorable sobre las comunidades intermareales a largo plazo (Zamorano y Leyte-Morales, 2009).
Agradecimientos
Al proyecto DGAPA-PAPIIT, UNAM (IN220714), al Registro Nacional de Pesca y Acuacultura por el permiso para la recolección de material biológico (DF00000208). A Norma López por el préstamo de las instalaciones de la UMDI-Zihuatanejo, a Carlos Candelaria por su apoyo técnico en campo y a Isabel Bieler, por su apoyo en la toma de las fotografías de los ejemplares para
este estudio.
Referencias
Abbott, I. A. (1999). Marine red algae of the Hawaiian Island. Honolulu, Hawaii: Bishop Museum Press.
Abbott, I. A. y Hollenberg, G. J. (1976). Marine algae of California. Stanford, California: Sanford University Press.
Aguilar, L. G. (2017). Estructura comunitaria de los moluscos (gasterópodos pateliformes y poliplacóforos) asociados a los ensambles macroalgales en el intermareal rocoso de Ixtapa-Zihuatanejo, Guerrero, México (Tesis de maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Aguilar-Estrada, L. G., Ortigosa, D., Urbano, B. y Reguero, M. (2014). Análisis histórico de los gasterópodos de la laguna arrecifal de Isla Verde, Veracruz, México. Revista Mexicana de Biodiversidad, 85, 502–512. https://doi.org/10.7550/rmb.
33802
Aguilar-Estrada, L. G., Ruiz-Boijseauneau, I. y Rodríguez, D. (2017). Estadios juveniles de las especies de gasterópodos pateliformes y de poliplacóforos (Mollusca) asociados a macroalgas intermareales de Guerrero, México. Revista Mexicana de Biodiversidad, 88, 280–299. https://doi.org/10.1016/j.rmb.2017.03.021
Aguilar-Estrada, L. G., Quiroz-González, N., Ruiz-Boijseauneau, I., Álvarez-Castillo, L. y Rodríguez, D. (2022). Algal epibiont species on Chiton articulatus (Mollusca: Polyplacophora) from a rocky intertidal coast from the Mexican Tropical Pacific. Revista Mexicana de Biodiversidad, 93, e934163. https://doi.org/10.22201/ib.20078706e.2022.93.4163
Aguilera, M. A. (2011). The functional roles of herbivores in the rocky intertidal systems in Chile: A review of food preferences and consumptive effects. Revista Chilena de Historia Natural, 84, 241–261.
Aguillón, A. (2011). Variación espacio-temporal del recluta-
miento en Mollusca y Echinodermata en bahía de La Paz, Baja California Sur, México (Tesis de maestría). Ciudad de México: Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional.
Airoldi, L. (2003). The effects of sedimentation on rocky coast assemblages. Oceanography and Marine Biology an Annual Review, 41, 167–171.
Anderson, M., Gorley, R. y Clarke, K. (2008). Permanova+ for PRIMER: guide to software and statistical methods, PRIMER-E, Plymouth.
Bakus, G. J. (2007). Quantitative analysis of marine biological communities: field biology and environmental. Hoboken, New Jersey: John Wiley and Sons Inc.
Baqueiro, E. (1979). Sobre la distribución de Megapitaria aurantiaca (Sowerby), M. squalida (Sowerby) y Dosinia ponderosa (Gray) en relación a la granulometría del sedimento (Bivalvia: Veneridae). Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 6, 25–32.
Baqueiro, E. y Aldana, D. (2000). A review of reproductive patterns of bivalve mollusks from Mexico. Bulletin of Marine Science, 66, 13–27.
Baqueiro, E. y Aldana, D. (2003). Patrones en la biología poblacional de moluscos de importancia comercial en México. Revista de Biología Tropical, 51, 97–107.
Baqueiro, E. y Masso, J. A. (1988). Variaciones poblacionales y reproducción de dos poblaciones de Chione undatella (Sowerby, 1835) bajo diferentes regímenes de pesca en la bahía de La Paz, BCS México. Ciencia Pesquera, 6, 51–67.
Barba-Marino, F., Flores-Rodríguez, P., Flores-Garza, R., García-Ibáñez, S. y Arana-Salvador, D. G. (2010). Biodiversidad y zonificación de la comunidad de moluscos, que habita el sustrato rocoso en dos sitios con distinta acción del oleaje, en la Isla “La Roqueta”, Acapulco, Guerrero, México. En L. J. Rangel, J. Gamboa, S. L. Arriaga y W. M. Contreras (Eds.), Perspectiva en malacología mexicana (pp. 44–56). Villahermosa: Universidad Juárez Autónoma de Tabasco.
Bartlett, M.S. (1937). Properties of sufficiency and statistical test. Proceedings of the Royal Society A, 160, 268–282. https://doi.org/10.1098/rspa.1937.0109
Baumgartner, T. R. y Christensen, N. (1985). Coupling of the Gulf of California to large-scale interannual climatic variability. Journal of Marine Research, 43, 825–848.
Benedetti-Cecchi, L. (2001). Variability in abundance of algae and invertebrates at different spatial scales on rocky sea shores. Marine Ecology Progress Series, 215, 79–92.
Benedetti-Cecchi, L., Rindi, F., Bertocci, I., Bulleri, F. y Cinelli, F. (2001). Spatial variation in development of epibenthic assemblages in a coastal lagoon. Estuarine, Coastal and
Shelf Science, 52, 659–668. https://doi.org/10.1006/ecss.20
01.0775
Borges, L., Merckelbach, L. M., Sampaio, Í. y Cragg, S. M. (2014). Diversity, environmental requirements, and biogeography of bivalve wood-borers (Teredinidae) in European coastal waters. Frontiers in Zoology, 11, 1–13. https://doi.org/10.1186/1742-9994-11-13
Bouchet, P., Rocroi, J. P., Bieler, R., Carter, J. G. y Coan, E. V. (2010). Nomenclator of bivalve families with a classification of bivalve families. Malacologia, 52, 1–185. https://doi.org/
10.4002/040.052.0201
Cadena-Cárdenas, L., Méndez-Rodríguez, L., Zenteno-Savín, T., García-Hernández, J. y Acosta-Vargas, B. (2009). Heavy metal levels in marine mollusks from areas with, or without, mining activities along the Gulf of California, Mexico. Archives of Environmental Contamination and Toxicology, 57, 96–102. https://doi.org/10.1007/s00244-008-9236-0
Castro-Mondragón, H., Flores-Garza, R., Valdez-González, A., Flores-Rodríguez, P., García-Ibáñez, S. y Rosas-Acevedo, J. L. (2016). Diversidad, especies de mayor importancia y composición de tallas de los moluscos en la pesca ribereña en Acapulco, Guerrero, México. Acta Universitaria, 26, 24–34. https://doi.org/10.15174/au.2016.1025.
Ceccherelli, V. U. y Rossi, R. (1984). Settlement, growth and production of the mussel Mytilus galloprovincialis. Marine Ecology Progress Series, 16, 173–184.
Cerros-Cornelio, J. C., Flores-Garza, R., Landa-Jaime, V., García-Ibáñez, S., Rosas-Guerrero, V., Flores-Rodríguez, P. et al. (2021). Composición de especies e ingreso económico por la pesca ribereña de moluscos en la Costa Grande de Guerrero México. Revista Bio Ciencias, 8, e1054. https://doi.org/10.15741/revbio.08.e1054
Chemello, R. y Milazzo, M. (2002). Effect of algal architecture on associated fauna: some evidence from phytal molluscs. Marine Biology, 140, 981–990. https://doi.org/10.1007/s00
227–002–0777–x
Cisneros, F. (2016). Estructura comunitaria de gasterópodos asociados a macroalgas en el litoral rocoso de Ixtapa-Zihuatanejo, Guerrero, México (Tesis). Facultad de Ciencias,
Universidad Nacional Autónoma de México. Ciudad de México.
Clarke K. R. y Gorley, R. N. (2006) PRIMER v6: User Manual/Tutorial. PRIMER-E Ltd, Plymouth, Reino Unido.
Coan, E. V. (1999). The eastern Pacific species of Sphenia (Bivalvia: Myidae). Nautilus-Sanibel, 113, 103–120. https://doi.org/10.5962/bhl.part.2019
Coan, E. V., Scott, P. V. y Bernard, F. R. (2000). Bivalve seashells of western North America. Santa Bárbara, California: Santa Barbara Museum of Natural History Monographs.
Coan, E. V. y Valentich-Scott, P. (2006). Marine Bivalvia. En C. F. Sturm, T. A. Pearce y A. Valdés (Eds.), The mollusks: a guide to their study, collection, and preservation (pp. 339–349). Pittsburgh, Pennsylvania: American Malacological Society.
Coan E.V. y Valentich-Scott P. (2012). Bivalve seashells of tropical West America. Marine bivalve mollusks from Baja California to Peru. Santa Barbara: Santa Barbara Museum of Natural History Monographs.
Colman, J. (1940). On the faunas inhabiting intertidal seaweeds. Journal of the Marine Biological Association of the United Kingdom, 24, 129–183. https://doi.org/10.1017/S0025315400054503
Dawson, E. Y. (1949). Resultados preliminares de un reco-
nocimiento de las algas marinas de la costa del pacífico de México. Revista de la Sociedad Mexicana de Historia Natural, 9, 215–255.
Dawson, E. Y. (1953). Marine red algae of Pacific Mexico. Part 1. Bangiales to Corallinaceae subf. Corallinoidae. Allan Hancock Pacific Expedition, 17, 1–239.
Dawson, E. Y. (1954). Marine red algae of Pacific Mexico. Part 2. Cryptonemiales (cont.). Allan Hancock Pacific Expedition, 17, 241–397.
Dawson, E. Y. (1960). Marine red algae of Pacific Mexico. Part 3. Cryptonemiales, Corallinaceae subf. Melobesioidae. Pacific Naturalist, 2, 3–125.
Dawson, E. Y. (1961). Marine red algae of Pacific Mexico. Part 4. Gigartinales. Pacific Naturalist, 2, 191–343.
Dawson, E. Y. (1963). Marine red algae of Pacific Mexico part 8. Ceramiales: Dasyaceae, Rhodomelaceae. Nova Hedwigia, 6, 401–481.
Dawson, E. Y. y Beaudette, P. T. (1959). Field notes from the 1959 Eastern Pacific Cruise of the Stella Polaris. Pacific Naturalist, 1, 1–24.
Díaz, A. y Ortlieb, L. (1993). El fenómeno “El Niño” y los moluscos de la costa peruana. Bulletin de l’Institut Français d’Études Andines, 22, 159–177.
Dobretsov, S. V. (1999). Effects of macroalgae and biofilm on settlement of blue mussel (Mytilus edulis l.) larvae, Bio-
fouling, 14, 153–165. https://doi.org/10.1080/089270199093
78406
Esqueda-González, M., Ríos-Jara, E., Galván-Villa, C. M. y Rodríguez-Zaragoza, F. A. (2014). Species composition, richness, and distribution of marine bivalve molluscs in Bahía de Mazatlán, México. Zookeys, 399, 43–69. https://doi.org/10.3897/zookeys.399.6256
Feely, R. A., Sabine, C. L., Lee, K., Berelson, W., Kleypas, J., Fabry, V. J. et al. (2004). Impact of anthropogenic CO2 on the CaCO3 system in the oceans. Science, 305, 362–366. https://doi.org/10.1126/science.1097329
Fitch, J. E. (1953). Common marine bivalves of California. Sacramento, California: California Department of Fish and Game.
Flores, P. (2004). Estructura de la comunidad de moluscos del mesolitoral superior en las playas de facie rocosa del estado de Guerrero, México (Tesis doctoral). Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. San Nicolás de los Garza.
Flores-Garza, R., Flores-Rodríguez, P., García-Ibáñez, S. y Valdés-González, A. (2007). Demografía del caracol Plicopurpura pansa (Neotaenioglossa: Muricidae) y constitución de la comunidad malacológica asociada en Guerrero, México. Revista de Biología Tropical, 55, 867–878.
Flores-Garza, R., García-Ibáñez, S., Flores-Rodríguez, P., Torreblanca-Ramírez, C., Galeana-Rebolledo, L., Valdés-González, A. et al. (2012). Commercially important marine mollusks for human consumption in Acapulco, México. Natural Resources, 3, 11–17. http://dx.doi.org/10.4236/nr.20
12.31003
Flores-Garza, R., López-Rojas, V., Flores-Rodríguez, P. y Ramírez, C. T. (2014). Diversity, distribution, and composition of the Bivalvia class on the rocky intertidal zone of marine priority region 32, Mexico. Open Journal of Ecology, 4, 961–973 https://doi.org/10.4236/oje.2014.415080
Flores-Garza, R., Torreblanca-Ramírez, C., Flores-Rodríguez, P., García-Ibáñez, S. y Galeana-Rebolledo, L. (2010). Riqueza y análisis de la comunidad malacológica en el mesolitoral rocoso de la playa Tlacopanocha, Acapulco, Guerrero. En L. J. Rangel, J. Gamboa, S. L. Arriaga y W. M. Contreras (Eds.), Perspectiva en malacología mexicana (pp. 125–138). Villahermosa: Universidad Juárez Autónoma de Tabasco.
Flores-Garza, R., Torreblanca-Ramírez, C., Flores-Rodríguez, P., García-Ibáñez, S., Galeana-Rebolledo, L., Valdés-González, A. et al. (2011). Mollusc community from a rocky intertidal zone in Acapulco, Mexico. Biodiversity, 12, 144–153. https://doi.org/10.1080/14888386.2011.625520
Flores-Rodríguez, P., Flores-Garza, R., García-Ibáñez, S. y Valdés-González, A. (2003). Riqueza y diversidad de la malacofauna del mesolitoral rocoso de la Isla la Roqueta, Acapulco, Guerrero, México. Ciencia, Revista de Investigación Científica, 11, 5–14.
Flores-Rodríguez, P., Flores-Garza, R., García-Ibáñez, S. y Valdés-González, A. (2007). Variación en la diversidad malacológica del mesolitoral rocoso en Playa Troncones, La Unión, Guerrero, México. Revista Mexicana de Biodiversidad, 78, 33–40. https://doi.org/10.22201/ib.20078706e.2007.002.298
Flores-Rodríguez, P., Flores-Garza, R., García-Ibáñez, S., Valdés-González, A., Violante-González, J., Santiago, C. E. et al. (2012). Mollusk species richness on the rocky shores of the state of Guerrero, Mexico, as affected by rains and their geographical distribution. Natural Resources, 3, 248–260. http://dx.doi.org/10.4236/nr.2012.34032
Forster, S. y Zettler, M. L. (2004). The capacity of the filter-feeding bivalve Mya arenaria L. to affect water transport in sandy beds. Marine Biology, 144, 1183–1189. https://doi.org/10.1007/s00227-003-1278-2
Galeana-Rebolledo, L., Flores-Garza, R., Torreblanca-Ramírez, C., García-Ibáñez, S., Flores-Rodríguez, P. y López-Rojas, V. I. (2012). Biocenosis de Bivalvia y Polyplacophora del intermareal rocoso en playa Tlacopanocha, Acapulco, Guerrero, México. Latin American Journal of Aquatic Research, 40, 943–954. http://dx.doi.org/10.3856/vol40-
issue4-fulltext-11
Galeana-Rebolledo, L., Flores-Garza, R., Violante-González, J., Flores-Rodríguez, P., García-Ibáñez, S., Landa-Jaime, V. et al. (2018). Socioeconomic aspects for coastal mollusk commercial fishing in Costa Chica, Guerrero, México. Natural Resources, 9, 229–241. https://doi.org/10.4236/nr.
2018.96015
García-Domínguez, F. A., Haro-Hernández, D., García-Cuellar, Á., Villalejo-Fuerte, M. y Rodríguez-Astudillo, S. (2008). Ciclo reproductivo de Anadara tuberculosa (Sowerby, 1833) (Arcidae) en Bahía Magdalena, México. Revista de Biología Marina y Oceanografía, 43, 143–152. http://dx.doi.org/10.4067/S0718-19572008000100015.
Gama, N. (2019). Aspectos ecológicos de la comunidad de gasterópodos (Mollusca: Gastropoda) asociados a ensambles macroalgales en el intermareal rocoso de Ixtapa Zihuatanejo, Guerrero, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Gama-Kwick, N., Aguilar-Estrada, L. G., Quiroz-González, N. y Ruiz-Boijseuneau, I. (2021). Nuevos registros de gasterópodos (Mollusca) asociados a macroalgas inter-
mareales de Guerrero, México. Revista Mexicana de Biodiversidad, 92, 1–18. http://dx.doi.org/10.22201/ib.200
78706e.2021.92.3441
Garcés, J. L. (2011). Micromoluscos bivalvos de la Bahía de Acapulco Guerrero, México: composición específica y diversidad (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
García, M. (2009). Estructura comunitaria de la fauna asociada a algas submareales en tres sitios contrastantes en Zihuatanejo, Guerrero (Tesis de maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
García-Cubas, A. (1981). Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche). Publicaciones especiales-Instituto de Ciencias del Mar y Limnología, 5, 1–379.
García-Cubas, A. y Reguero, M. (2007). Catálogo ilustrado de moluscos bivalvos del Golfo de México y Mar Caribe. Ciudad de México: Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México.
García-Ibáñez, S., Flores-Rodríguez, P., Navarro, J. T. N., Garza, R. F. y Moreno, I. E. B. (2014). Respuesta del carnívoro Plicopurpura pansa (Mollusca: Gastropoda) y el herbívoro Chiton articulatus (Mollusca: Polyplacophora) a factores ambientales en Acapulco, México. CienciaUAT, 8, 11–21.
García-Robledo, E., Corzo, A., van Bergeijk, S. y Yúfera, M. (2008). Impacto de las acumulaciones de macroalgas en la comunidad biológica intermareal. Revista de la Sociedad Gaditana de Historia Natural, 8, 115–137.
Gibbons, M. J. (1988). The impact of sediment accumulation, relative habitat complexity and elevation on rocky shore meiofauna. Journal of Experimental Marine Biology Ecology, 122, 225–241. https://doi.org/10.1016/0022-0981(88)90125-6
Gosling, E. (2015). Marine bivalve molluscs. Chichester, West Sussex: John Wiley y Sons.
Guiry, M. D. y Guiry, G. M. (2024). AlgaeBase. National University of Ireland, Galway. Recuperado el 12 enero, 2024 de: http://www.algaebase.org
Guzmán, A. R. (2022). Estructura comunitaria de bivalvos asociados a macroalgas en el litoral rocoso de Muelle Municipal, Zihuatanejo, Guerrero, México (Tesis). Facultad de Ciencias. Universidad Nacional Autónoma de México. Ciudad de México
Hernández-Moreno, E. P., Romo-Piñera, A. K., Fernández-Rivera Melo, F. J., Aguilar-Cruz, C. A., Reyes-Bonilla, H. y López-Vivas, J. M. (2020). Reproductive Study of Megapitaria aurantiaca (Sowerby, 1831) (Bivalvia: Veneridae) in Puerto Libertad, Sonora, Mexico. Journal of Shellfish Research, 39, 441–447.
Holguín-Quiñones, O. E. y González-Pedraza, A. C. (1989). Moluscos de la franja costera del estado de Oaxaca, México. México D.F.: Dirección de Bibliotecas y Publicaciones, Instituto Politécnico Nacional.
Horton, T., Kroh, A., Ahyong, S., Bailly, N., Boyko, C. B. y Brandão, S. N. (2024. World Register of Marine Species. Recuperado el 14 de marzo, 2024: http://www.marinespecies.org
Huovinen, P., Gómez, I. y Lovengreen, C. (2006). A five-year study of solar ultraviolet radiation in Southern Chile (39° S): Potential impact on physiology of coastal marine algae? Photochemistry and Photobiology, 82, 515–522. https://doi.org/10.1562/2005-07-05-RA-601
IMTA (Instituto Mexicano de Tecnología del Agua). (2010). Estudio de clasificación de la Bahía de Ixtapa-Zihuata-
nejo. No. FON-CNA-2004-02-016. Informe final. Comisión Nacional del Agua.
Jiménez-Valverde, A. y Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151–161.
Jorgensen, C. B. (1996). Bivalve filter feeding revisited. Marine Ecology Progress Series, 142, 287–302.
Jover-Capote, A. y Diez, Y. L. (2017). Abundancia de moluscos en mantos de macroalgas del mesolitoral rocoso en la costa suroriental de Cuba. Amici Molluscarum, 25, 27–43.
Keen, A. M. (1971). Sea shells of Tropical West America Marine mollusks from Baja California to Peru. Standford, California: Stanford University Press.
Kuk-Dzul, J. G., Padilla, J. G., Torreblanca, C., Flores, R., Flores, P. y Muñiz, X. I. (2019). Structure of molluscan communities in shallow subtidal rocky bottoms of Acapulco, Mexico. Turkish Journal of Zoology, 43, 465–479.
Landa-Jaime, V. y Arciniega-Flores, J. (1998). Macromoluscos bentónicos de fondos blandos de la plataforma continental de Jalisco y Colima, México. Ciencias Marinas, 24, 155–l67.
Landa-Jaime, V., Michel-Morfín, E., Arciniega-Flores, J., Castillo-Vargasmachuca, S. y Saucedo-Lozano, M. (2013). Moluscos asociados al arrecife coralino de Tenacatita, Jalisco, en el Pacífico central mexicano. Revista Mexicana de Biodiversidad, 84, 1121–1136. https://doi.org/10.7550/rmb.32994
Lee, R. E. (2008). Basic characteristics of the algae. En R. E. Lee (Ed.), Phycology (pp. 3-29). Nueva York: Cambridge University Press.
Lesser, H. (1984). Prospección sistemática y ecológica de los moluscos bentónicos de la plataforma continental del estado de Guerrero, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Levene, H. (1960) Robust tests for equality of variances. En I. Olkin (Ed.), Contributions to probability and statistics (278–292). Palo Alto, California: Standford University Press.
López, N. A., (1993). Caracterización de la ficoflora sublitoral de Acapulco y Zihuatanejo, Gro. (Tesis). Facultad de Cien-
cias, Universidad Nacional Autónoma de México. Ciudad de México.
López, N., Candelaria, C. y Ramírez-García, P. (2023). Assessment of macroalgae coverage in a scarcely studied deep rocky reef in the tropical eastern Mexican Pacific. Latin American Journal of Aquatic Research, 51, 23–33. https://doi.org/10.3856/vol51-issue1-fulltext-2920
López, N., Candelaria, C., Ramírez-García, P. y Rodríguez, D. (2017). The structure of tropical turf-forming algae assemblages. Zihuatanejo Bay, México. Latin American Journal of Aquatic Research, 45, 329–340 http://dx.doi.org/10.3856/vol45-issue2-fulltext-9
López-Rojas, V. I., Flores-Garza, R., Flores-Rodríguez, P., Torreblanca-Ramírez, C. y García-Ibáñez, S. (2017). La clase Bivalvia en sitios rocosos de las Regiones Marinas Prioritarias en Guerrero, México: riqueza de especies, abundancia y distribución. Hidrobiológica, 27, 69–86.
Lozada, O. (2010). Actualización sistemática de los bivalvos de la Colección Malacológica Dr. Antonio García-Cubas del Instituto de Ciencias del Mar y Limnología (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Lozada, O. (2015). Presencia de metales pesados en Isogno-
mon alatus (Gmelin, 1791) de la laguna Tampamachoco, Veracruz (Tesis de maestría). Facultad de Ciencias Bio-
lógicas y Agropecuarias, Universidad Veracruzana. Tuxpan, Veracruz.
Magurran, A. E. (2004). Measuring biological diversity. Malden, Massachusetts: Blackwell Publishing.
Morales, R., Vélez, H., Mejía, A. Ramírez, I., Izurierta, J. y Saldaña, P. (2008). Hidrodinámica de la Bahía de Zihuata-
nejo. XXIII Congreso Latinoamericano de Hidráulica, 2 al 6 de septiembre de 2008, Cartagena de Indias, Colombia.
Moreno, C. A. (1995). Macroalgae as a refuge from predation for recruits of the mussel Choromytilus chorus (Molina, 1782) in southern Chile. Journal of Experimental Marine Biology and Ecology, 191, 181–193.
Moreno, C. E. (2001). Métodos para medir la biodiversidad. Zaragoza, España: M&T–Manuales y Tesis SEA.
Oksanen, J., Guillaume-Blanchet, F., Friendly, M., Kindt, R. Legendre, P., McGlinn, D. et al. (2019). Vegan: community ecology package. R package versión 2.5-6. https://CRAN.R-project.org/package=vegan
Olabarria, C. y Chapman, M. G. (2001). Comparison of patterns of spatial variation of microgastropods between two contrasting intertidal habitats. Marine Ecology Progress Series, 220, 201–211. https://doi.org/doi:10.3354/meps220201
Olafsson, E. B. (1986). Density dependence in suspension-feeding and deposit-feeding populations of the bivalve Macoma balthica: a field experiment. Journal of Animal Ecology, 55, 517–526. https://doi.org/10.2307/4735
Oyarzún, P. A., Toro, J. E., Jaramillo, R., Guiñez, R., Briones, C. y Astorga, M. (2011). Ciclo gonadal del chorito Mytilus chilensis (Bivalvia: Mytilidae) en dos localidades del sur de Chile. Latin American Journal of Aquatic Research, 39, 512–525.
Paredes, C., Tarazona, J., Canahuire, E., Romero, L., Cornejo, O. y Cardoso, F. (1998). Presencia de moluscos tropicales de la provincia panameña en la costa central del Perú y su relación con los eventos “El Niño”. Revista Peruana de Biología, 5, 123–128. https://doi.org/10.15381/rpb.v5i2.8330
Pérez, L. M. (2013). Descripción espacio-temporal de la temperatura superficial del mar en el Pacífico Sur Mexicano de 1996-2009 (Tesis). Universidad del Mar. Puerto Ángel, Oaxaca.
Prathep, A., Marrs, R. H. y Norton, T. A. (2003). Spatial and temporal variations in sediment accumulation in an algal turf and their impact on associated fauna. Marine Biology, 142, 381–390. https://doi.org/10.1007/s00227–002–0940–4
Quirós-Rodríguez, J. y Campos, N. H. (2013). Moluscos asociados a ensamblajes macroalgales en el litoral rocoso de Córdoba, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 42, 101–120.
Quiroz-González, N., Aguilar-Estrada, L. G., Ruiz-Boijseauneau, I. y Rodríguez, D. (2020). Biodiversidad de algas epizoicas en el Pacífico tropical mexicano. Acta Botanica Mexicana, 127, 1-22. https://doi.org/10.21829/abm127.2020.1645
R Core Team (2020). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Reguero, M., y García-Cubas, A. (1989). Moluscos de la plataforma continental de Nayarit: sistemática y ecología (cuatro campañas oceanográficas). Anales del Instituto de Ciencias del Mar y Limnología, 16, 33–58.
Renaud, P. E., Riggs, S. R., Ambrose Jr, W. G., Schmid, K. y Snyder, S. W. (1997). Biological-geological interactions: storm effects on macroalgal communities mediated by sediment characteristics and distribution. Continental Shelf Research, 17, 37–56. https://doi.org/10.1016/0278-43
43(96)00019-2
Ríos-Jara, E., López-Uriarte, E., Pérez-Peña, M. y Juárez-Carrillo, E. (2003). Nuevos registros de escafópodos para las costas de Jalisco y Colima, México. Hidrobiológica, 13, 167–170.
Rodríguez, D., López, N. y González-González, J. (2008). Gelidiales (Rhodophyta) en las costas del Pacífico mexicano con énfasis en las especies tropicales. En A. Sentíes y K. M. Dreckmann (Eds.), Monografías ficológicas, Vol. 3 (pp. 27–74). Ciudad de México: Universidad Autónoma Metropolitana.
Román-Contreras, R., Cruz-Abrego, F. M. e Ibáñez-Aguirre, A. L. (1991). Observaciones ecológicas de los moluscos de la zona intermareal rocosa de la Bahía de Chamela, Jalisco, México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología, 62, 17–31.
Rosenberg, R. (1977). Effects of dredging operations on estuarine benthic macrofauna. Marine Ecology Progress Series, 62, 185–202.
Salazar-Vallejo, S. I. y González, E. (1990). Ecología costera en la región de La Mancha, Veracruz. La Ciencia y el Hombre, 6,101–120.
Salcedo-Martínez, S., Green, G., Gamboa-Contreras, A. y Gómez,
P. (1988). Inventario de macroalgas y macroinvertebrados bénticos, presentes en áreas rocosas de la región de Zihuatanejo, Guerrero, México. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 15, 73–95.
Sánchez, M. (2014). Base de datos de los moluscos presentes en la colección biológica de la Secretaría de Marina-Armada de México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Santos, L., Souza, J., Lima, S. y Guimarães, C. (2020). Diversity of bivalve mollusks associated with macroalgae on the continental shelf in the states of Alagoas, Sergipe and Bahia, Northeastern Brazil. Zoological Studies, 59, e58. https://doi.org/10.6620/ZS.2020.59-58
Schulien, J. A., Adams, J. y Felis, J. (2020). Pacific continental shelf environmental assessment (PaCSEA): characterization of seasonal water masses within the Northern California current system using airborne remote sensing off Northern California, Oregon, and Washington, 2011–2012. Camarillo, California: US Department of the Interior, Bureau of Ocean Energy Management/ Pacific OCS Region/ OCS Study BOEM.
Seed, R. (1969a). The ecology of Mytilus edulis L. (Lamellibranchiata) on exposed rocky shores. Oecologia, 3, 277–316. https://doi.org/10.1007/BF00390380
Seed, R. (1969b). The ecology of Mytilus edulis L. (Lamelli-
branchiata) on exposed rocky shores: II. Growth and mortality. Oecologia, 3, 317–350. https://www.jstor.org/stable
/4214550
Shaw, W. N., Hassler, T. J. y Moran, D. P. (1988). California sea mussel and bay mussel: species profiles. Life histories and environmental requirements of coastal fishes and invertebrates (Pacific Southwest). Washington D.C.: Fish and Wildlife Service.
Sibaja-Cordero, J. A. y Vargas-Zamora, J. A. (2006). Zonación vertical de epifauna y algas en litorales rocosos del Golfo de Nicoya, Costa Rica. Revista de Biología Tropical, 54, 49–67.
Siegel, S. (1990). Estadística no paramétrica: aplicada a las ciencias de la conducta. Ciudad de México: Trillas.
Stella, C., Vijayalakshmi, S. y Siva, J. (2010). Two new records of bivalve species of Mytilidae family from Palk Bay and Mandapam area-south-east coast of India. Global Journal of Environmental Research, 4, 40–42.
Steneck, R. S. y Dethier, M. N. (1994). A functional group approach to the structure of algal-dominated communities. Oikos, 69, 476–498. https://doi.org/10.2307/3545860
Steneck, R. S. y Watling, L. (1982). Feeding capabilities and limitation of herbivorous molluscs: a functional group approach. Marine Biology, 68, 299–319. https://doi.org/10.
1007/BF00409596
Suchanek, T. H. (1978). The ecology of Mytilus edulis L. in exposed rocky intertidal communities. Journal of Experimental Marine Biology and Ecology, 31, 105–120. https://doi.org/10.1016/0022-0981(78)90139-9
Taylor, W. R. (1945). Pacific marine algae of the Allan Hancock Expeditions to the Galapagos Islands. Allan Hancock Pacific Expeditions, 12, 1–528.
Torreblanca, C. (2010). Análisis de la diversidad y estructura de la comunidad de moluscos del mesolitoral rocoso de Acapulco, Guerrero (Tesis).Unidad Académica de Ecología Marina, Universidad Autónoma de Guerrero. Acapulco de Juárez.
Torreblanca-Ramírez, C., Flores-Garza, R., Flores-Rodríguez, P., García-Ibáñez, S. y Galeana-Rebolledo, L. (2012). Riqueza, composición y diversidad de la comunidad de moluscos asociada al sustrato rocoso intermareal de playa Parque de la Reina, Acapulco, México. Revista de Biología Marina y Oceanografía, 47, 283–294. http://dx.doi.org/10.4067/S0718-19572012000200010
Torroglosa, M. E. (2015). Biología reproductiva y crecimiento de Brachidontes rodriguezii (d´Orbign 1846) en sustratos duros artificiales en playas arenosas de la provincia de Buenos Aires (Tesis doctoral). Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Argentina.
Trasviña, A. y Andrade, C. A. (2002). La circulación costera del Pacifico Tropical Oriental, con énfasis en la Alberca Cálida Mexicana (ACM). En Corcas (Eds.), Circulación oceánica y climatología tropical en México y Colombia (pp. 9–37). Bogotá: Consejo Nacional de Acreditación-Ministerio de Educación.
UNAM (Universidad Nacional Autónoma de México) (2013). Laguna Las Salinas Zihuatanejo. Proyecto ejecutivo UNAM 1989-1994 basado en plano base FONATUR-SCT. Universidad Nacional Autónoma de México, México. Recuperado el 14 enero, 2024 de https://mmacreactive.wordpress.com/
Urbano, B. (2004). Estructura comunitaria de gasterópodos de Zihuatanejo, Guerrero (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Valdés-González, A., Flores-Rodríguez, P., Flores-Garza, R. y García-Ibáñez, S. (2004). Molluscan communities of the rocky intertidal zone at two sites with different wave action on Isla La Roqueta, Acapulco, Guerrero, Mexico. Journal of Shellfish Research, 23, 875–880.
Vassallo, A., Dávila, Y., Luviano, N., Deneb-Amozurrutia, S., Vital, X. G., Conejeros, C. A. et al. (2014). Inventario de invertebrados de la zona rocosa intermareal de Montepío, Veracruz, México. Revista Mexicana de Biodiversidad, 85, 349–362. https://doi.org/10.7550/rmb.42628
Vázquez, P. (2009). Efecto del sedimento retenido en la estructura de los ensambles algales submareales (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Vega, C., Olabarria, C. y Carballo, J. L. (2008). Variación espacio-temporal de moluscos y macroalgas en sustratos rocosos intermareales en la bahía de Mazatlán. Ciencia y Mar, 34, 3–16.
Velez, J. y Zeballos, J. (1985). Ampliación de la distribución de algunos peces e invertebrados durante el fenómeno “El Niño” 1982–1983. En W. Arntz, A. Landa y J. Tarazona (Eds.), “El Niño” su impacto en la fauna marina (pp. 173– 180). Callao, Perú: Boletín del Instituto del Mar del Perú.
Villalpando, E. (1986). Diversidad y zonación de moluscos de facie rocosa Isla Roqueta, Acapulco, Gro. (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Villegas-Maldonado, S., Neri-García, E., Flores-Garza, R., García-Ibáñez, S., Flores Rodríguez, P. y Arana-Salvador, D. G. (2007). Datos preliminares de la diversidad de moluscos para el consumo humano que se expenden en Acapulco, Guerrero. En E. Ríos-Jara, M. C. Esqueda-González y C. M Galván-Villa (Eds.), Estudios sobre la malacología y conquiliología en México (pp. 57-59). Guadalajara: Universidad de Guadalajara.
Ward, J. E., Sanford, L. P., Newell, R. I. E. y MacDonald, B. A. (1998). A new explanation of particle capture in suspension-feeding bivalve molluscs. Limnology and Oceanography, 43, 741–752.
Wyrtki, K. 1966. Oceanography of the eastern equatorial Pacific Ocean. Oceanography and marine biology: an annual review, 4, 33–68.
Yang, J. L., Satuito, C. G., Bao, W. Y. y Kitamura, H. (2007). Larval settlement and metamorphosis of the mussel Mytilus galloprovincialis on different macroalgae. Marine Biology, 152, 1121–1132. https://doi.org/10.1007/s00227-007-0759-0
Zamorano, P. y Leyte-Morales, G. E. (2009). Equinodermos asociados a formaciones arrecifales en Zihuatanejo y Acapulco, Guerrero, México. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 38, 7–28.