Manuel Palomo-Morales a, b, *, Luis Enrique Sánchez-Ramos c, d, Luis Gerardo Herrera-Montalvo e, Adolfo G. Navarro-Sigüenza d, f y Pedro Luis Valverde b
a Universidad Autónoma Metropolitana, Doctorado en Ciencias Biológicas y de la Salud, Av. Ferrocarril San Rafael Atlixco, Núm. 186,
Col. Leyes de Reforma 1 A Sección, 09310 Ciudad de México, México
b Universidad Autónoma Metropolitana-Iztapalapa, Departamento de Biología, Av. Ferrocarril San Rafael Atlixco, Núm. 186, Col. Leyes de Reforma 1 A Sección, 09310 Ciudad de México, México
c Universidad Nacional Autónoma de México, Instituto de Geociencias, Blvd. Juriquilla 3001, La Mesa, 76230 Juriquilla, Querétaro, México
d Universidad Nacional Autónoma de México, Facultad de Ciencias, Museo de Zoología, Apartado postal 70-399, 04510 Ciudad de México, México
e Universidad Nacional Autónoma de México, Instituto de Biología, Estación de Biología Chamela, Carretera Federal Barra de Navidad-Puerto Vallarta Km 59, 48854 Chamela, Jalisco, México
f Universidad Nacional Autónoma de México, Unidad Multidisciplinaria de Docencia e Investigación, Facultad de Ciencias-Campus Juriquilla, Blvd. Juriquilla 3001, La Mesa, 76230 Juriquilla, Querétaro, México
*Autor para correspondencia: manuelpm.biol@gmail.com (M. Palomo-Morales)
Recibido: 25 junio 2024; aceptado: 15 agosto 2024
Resumen
Evaluamos la diversidad de pastos nativos, pastos no nativos y aves de pastizal en el Desierto Chihuahuense en un contexto histórico-ambiental de presión antropogénica en los periodos de 1930-1964, 1965-1981 y 1982-2019. Analizamos la riqueza regional, la diversidad beta y la composición de 41 especies de aves de pastizal, 149 especies de pastos nativos y 60 especies de pastos no nativos, así como la prevalencia de pastos nativos y su correlación con las aves de pastizal en cada periodo. Los resultados mostraron una reducción de la diversidad beta en los 3 ensambles a lo largo del tiempo, sin relaciones significativas entre el ensamble de aves y la prevalencia de pastos nativos en el último periodo. Esto sugiere que la distribución actual de las aves de pastizal es independiente del tipo de pasto a nivel regional. La expansión de pastos no nativos en el Desierto Chihuahuense, favorecida por políticas públicas a lo largo del tiempo, ha conformado un ensamble de pastizales mixtos, lo que actualmente no afecta la composición de aves de pastizal a escala regional. Sugerimos realizar evaluaciones locales para comprender mejor la relación entre las aves de pastizal y los distintos pastos presentes en la región.
Palabras clave: Diversidad beta; Presencia-ausencia; Ensamble de especies; Índice de prevalencia; NMDS
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Influence of the introduction of non-native grasses on the species richness of bird assemblages in the Chihuahuan Desert region: a temporal analysis
Abstract
We assessed the diversity of native grasses, non-native grasses, and grassland birds in the Chihuahuan Desert in a historical-environmental context of anthropogenic pressure during the periods 1930-1964, 1965-1981, and 1982-2019. We analyzed the regional richness, beta diversity, and composition of 41 grassland bird species, 149 native grass species, and 60 non-native grass species, as well as the prevalence of native grasses and their correlation with grassland birds in each period. The results showed a reduction in beta diversity in the 3 assemblages over time, with no significant relationships between bird assemblage and native grass prevalence in the last period. This suggests that the current distribution of grassland birds is independent of grass type at the regional level. The expansion of non-native grasses in the Chihuahuan Desert, favored by public policies over time, has formed an assemblage of mixed grasslands, which currently does not affect the composition of grassland birds at the regional level. We suggest conducting local assessments to better understand the relationship between grassland birds and the different grasses present in the region.
Keywords: Beta diversity; Presence-absence; Species assemblage; Prevalence rate; NMDS
Introducción
Las especies introducidas de animales y plantas alteran la composición y ecología de las comunidades biológicas, tanto local como regionalmente (Davis, 2003). En particular, las investigaciones sobre plantas introducidas e invasoras se han centrado en cuantificar y describir sus impactos a diversas escalas, desde poblaciones y especies, hasta comunidades y ecosistemas (Hejda et al., 2009; Pyšek et al., 2012). Con el tiempo, muchas especies de plantas introducidas se han expandido y pueden, potencialmente, acelerar la extirpación de poblaciones de especies nativas de forma localizada y, eventualmente, aumentar la homogeneidad biótica del hábitat, lo que reduce la diferenciación de las floras a nivel regional (Qian y Ricklefs, 2006).
Las especies de pastos (familia Poaceae) que han sido introducidas en diferentes regiones son el principal agente que ha perturbado los pastizales nativos de extensas regiones del mundo, como ha sucedido por ejemplo en las praderas de California, las Grandes Planicies del centro de los EUA, así como en varias regiones del centro de Australia, entre otras (Gibson, 2009). Los efectos de la invasión de pastos exóticos dependen en parte de la gravedad de cualquier cambio ambiental o del régimen de perturbación humana, como el pastoreo excesivo, la sequía, la frecuencia de incendios, el pisoteo del ganado, la fragmentación del hábitat y la cercanía con tierras agrícolas que favorecen su dispersión (Chaneton et al., 2002; Gibson, 2009; Hamilton, 1999; Weaver et al., 1996). Algunas de las consecuencias de las invasiones por estos pastos incluyen la simplificación de la estructura de la vegetación, la reducción de la biodiversidad al disminuir el hábitat preferente de muchas especies de vida silvestre, así como la alteración de los regímenes naturales de incendios y ciclo de nutrientes, entre otras (Wied
et al., 2020).
En Norteamérica, las regiones de pastizales naturales ocupan una importante porción de la superficie continental (Gibson, 2009). Se pueden encontrar áreas importantes de este tipo de vegetación desde Canadá hasta el centro de México (APCP, 2010), albergando una gran biodiversidad a lo largo de su extensión. En México este tipo de vegetación ocupa, aproximadamente, 118,320 km2 (Challenger, 1998), las áreas más importantes se encuentran en extensas zonas del norte, principalmente en el Desierto Chihuahuense (Desmond y Montoya, 2006). Existe también una gran diversidad de condiciones en las que los pastizales naturales se presentan en el país, como por ejemplo los pastizales submontanos del Eje Neovolcánico Transversal (dispersos en zonas como la sierra nevada del sistema Popocatépetl-Iztaccíhuatl, el nevado de Colima, y el volcán Ajusco), entre otros (Challenger y Soberón, 2009). Otras zonas de pastizal húmedo se pueden encontrar en áreas de selva tropical con distribución restringida en Tabasco y Campeche (Challenger, 1998). Sin embargo, también existe una considerable extensión de pastizales inducidos dispersa por el país derivado de actividades ganaderas desde hace varias décadas (Challenger y Soberón, 2009).
Ante la presencia cada vez mayor de pastizales inducidos, el sistema de pastizales nativos del Desierto Chihuahuense, pese a su fisonomía y estructura aparentemente simples, representa una región de gran importancia para la conservación de los pastizales semiáridos, por la considerable riqueza de especies vegetales y presencia de pastos endémicos (Challenger y Soberón, 2009; Desmond y Montoya, 2006). Además, la extensión de estos pastizales se ha reconocido como relevante para una gran diversidad de taxones animales, que incluyen tanto aves de pastizal residentes (y algunas endémicas; e.g., Spizella wortheni) como migratorias, que son compartidas con Canadá y EUA (Macías-Duarte et al., 2009). Factores como la deforestación, la fragmentación del hábitat y el reemplazo de las comunidades de pastos nativos por paisajes agrícolas, han contribuido en el deterioro a gran escala de los pastizales, siendo a la vez los responsables de la disminución de las poblaciones de aves de pastizal (Brennan y Kuvlesky, 2005). Adicionalmente, se puede considerar que las zonas semiáridas del norte de México son de las menos susceptibles a la invasión de plantas no nativas debido a un menor desarrollo urbano, en contraste con los enormes centros urbanos en el centro y sur de México (del Val et al., 2015). Dentro de esta región, la gran extensión de pastizales naturales ha sido ocupada por varias especies de pastos no nativos que se han establecido desde principios del siglo XX (Melgoza-Castillo et al., 2014; Valenzuela-Núñez et al., 2009). Las zonas de pastizales invadidas por gramíneas no nativas proveen una menor cantidad de hábitats disponibles y, por lo tanto, menos recursos en comparación con aquellas zonas de pasto nativo que soportan un mayor conjunto de aves de pastizal (George et al., 2013). Por lo tanto, se vuelve necesario mantener y restaurar las condiciones originales de los pastizales para evitar la reducción de las poblaciones de aves residentes y migratorias de pastizal (Macías-Duarte et al., 2017).
En México, la introducción y expansión de especies de pastos exóticos obedece, probablemente, a la aplicación de políticas públicas impulsadas para promover la producción cárnica (Challenger y Soberón, 2009). En la historia del desarrollo agropecuario de México se pueden distinguir 3 periodos principales que implican cambios radicales en las prácticas ganaderas y que, por consiguiente, guiaron la transformación de los pastizales naturales (Chauvet-Sánchez, 1999). El primero, de 1930 a 1964 se caracterizó por la sustitución de las importaciones ganaderas para incentivar el mercado nacional, los intentos de erradicación de la tuberculosis y la fiebre aftosa en el ganado, así como la consolidación de la medicina veterinaria en México (Cervantes-Sánchez y Román de Carlos, 2001; Chauvet-Sánchez, 1999). El segundo periodo refleja la consolidación del mercado ganadero de exportación de cárnicos de manera constante, lo que dio lugar al auge ganadero nacional entre 1965-1981 con la ganaderización de la agricultura caracterizado por la sobreexplotación y agotamiento de los pastizales (Chauvet-Sánchez, 1999). Posteriormente, la eliminación de las políticas proteccionistas y el incremento de importación de cárnicos en el inicio de las políticas neoliberales dieron lugar al tercer periodo considerando la decadencia ganadera de 1982 hasta la actualidad (Chauvet-Sánchez, 1999). Cabe mencionar que durante este periodo surgen políticas de manejo y conservación de pastizales en varios sitos del Desierto Chihuahuense, como consecuencia del auge de la ciencia de la ecología y una mayor preocupación por la conservación de los recursos naturales (Hoth, 2012). Además, el cambio de modelo económico posterior a la firma del Tratado de Libre Comercio de América del Norte (TLCAN) produjo una menor presión sobre el pastizal al reducir el tiempo de cría del ganado para su engorde en EUA y posterior retorno a nuestro país como productos cárnicos procesados (Carrera-Chávez et al., 2010; Chauvet-Sánchez, 1999).
Estas etapas en el país enmarcan el tiempo en que la presión antropogénica pudo ser relevante para favorecer la introducción y expansión de pastos no nativos dentro del Desierto Chihuahuense, sobre todo porque estas especies de pastos, una vez establecidas, se expandieron con el tiempo ampliando su área de distribución geográfica (Guo et al., 2006). Comprender la dinámica temporal de cambio en la biodiversidad vegetal sobre las especies nativas es crucial para las estrategias de conservación a una escala regional. Estos cambios se han abordado a través de análisis de la diversidad beta (Qian, 2008; Qian y Ricklefs, 2006), entendida como los cambios en la composición de especies en ámbitos espacial, temporal y ambiental (Calderón-Patrón y Moreno, 2019).
Para evaluar el efecto de las especies de gramíneas introducidas sobre la composición de especies nativas en sistemas de pastizal (Eskelinen y Harrison, 2015; Joner et al., 2021; Szentes et al., 2012), la diversidad beta puede valorarse a través de índices de similitud con análisis basado en 2 componentes: el recambio y el anidamiento (Baselga, 2010; Calderón-Patrón y Moreno, 2019). Ecológicamente, estos componentes pueden reflejar una selección de especies por el ambiente o por procesos de dispersión, así como una relación entre las dinámicas de pérdida o colonización de especies (Baselga, 2010). Por ejemplo, en los pastizales centrales de Norteamérica, la diversidad beta mostró cambios en la composición de especies de aves a lo largo de un gradiente de disponibilidad de pastizales, lo que refleja la pérdida del hábitat original en el espacio tras varios años de modificación antropogénica (Pavlacky et al., 2022). Por otro lado, también se ha descrito que una partición de la diversidad total entre tipos de pastizales de una región puede mostrar el comportamiento del recambio total de la composición de aves de pastizal (Żmihorski et al., 2016).
La diversidad beta ofrece una herramienta adecuada para medir la disimilitud en la composición de especies debido a factores como el arreglo espacial, las restricciones espaciales o históricas, así como el gradiente de riqueza de especies (Baselga, 2010). Esto permite explorar los patrones de diversidad beta a lo largo del tiempo (Almeida-Neto et al., 2011), por lo que resulta valioso para evaluar el efecto de la introducción de pastos no nativos sobre la diversidad de aves de pastizal en el Desierto Chihuahuense.
Partiendo del contexto histórico-ambiental de la región antes descrito, se espera en el presente estudio que el recambio composicional de pastos nativos por pastos no nativos influya en la pérdida de especies de aves de pastizal. El objetivo de este estudio fue analizar el efecto de la introducción de pastos no nativos en la riqueza de aves de pastizal en el Desierto Chihuahuense, durante los 3 periodos descritos (1930-1964, 1965-1981 y 1982-2019) con distintas prácticas agropecuarias con la finalidad de evaluar si las políticas económicas han tenido una influencia sobre la diversidad de la biota asociada a esos ecosistemas. Especialmente, se pretende analizar si el incremento de los cambios en la gestión agrícola a largo plazo ha propiciado cambios en la diversidad de aves de pastizal (Chamberlain, 2000; Rosenberg et al., 2019). De manera específica, se plantearon los siguientes objetivos particulares: 1) obtener la diversidad beta regional de los pastos nativos y no nativos, así como de aves de pastizal en la región; 2) evaluar si existen diferencias en la composición de especies de los ensambles de aves, pastos nativos y no nativos, entre los 3 periodos propuestos; 3) evaluar la relación de los componentes de la diversidad beta (pérdida/ganancia de especies y si las especies son únicas o compartidas) de pastos nativos y no nativos sobre la composición de aves de pastizal; 4) probar si existe una correlación entre la prevalencia de pastos nativos y las aves de pastizal. Los resultados de esta investigación aportarán un enfoque novedoso para entender la influencia del cambio composicional en los pastizales (nativos/no nativos) sobre la diversidad de aves, resultado de las actividades de manejo planteadas en los planes de desarrollo agropecuario mexicano en el último siglo.
Materiales y métodos
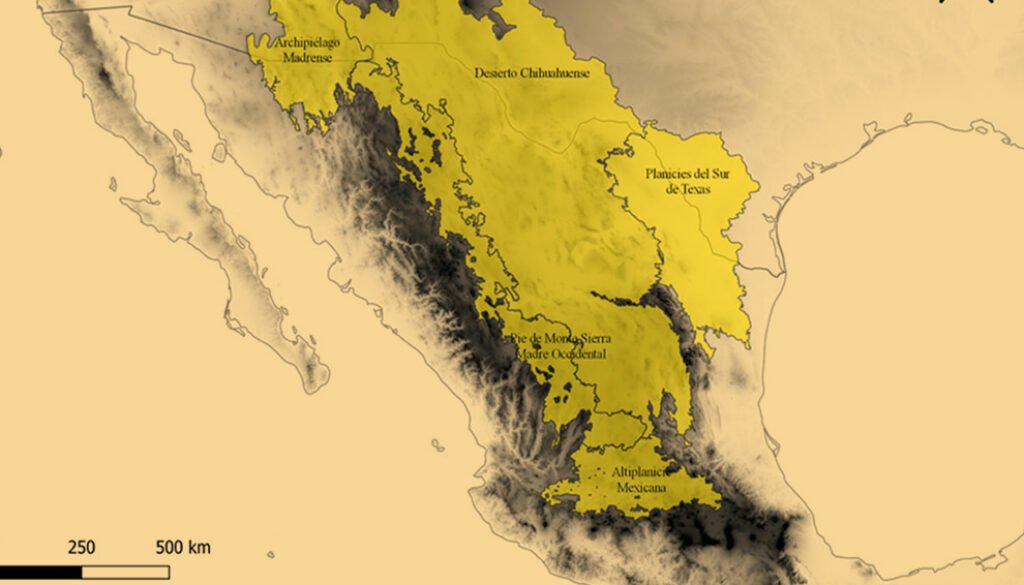
El área de estudio son los pastizales semiáridos que se extienden a lo largo del Desierto Chihuahuense en EUA y México, destacando que estos pastizales varían considerablemente en la composición de pastos nativos (González-Medrano, 2012). Además, en esta región se ha registrado la presencia de diversas especies de aves de pastizal residentes y migratorias (Levandoski y Panjabi, 2014; Ruvalcaba-Ortega y Panjabi, 2018; Vickery et al., 1999). La delimitación del área de estudio (fig. 1a) se estableció utilizando el sistema de información geográfica QGis 3.16, a partir de la unión de los polígonos correspondientes a las ecorregiones de la CCA (Comisión de Cooperación Ambiental) extraídas del mapa de la North American Terrestrial Ecoregions-Level III (Wiken et al., 2011): 1) Archipiélago Madrense, 2) Desierto Chihuahuense, 3) Planicies del Sur de Texas, 4) Pie de Monte Sierra Madre Occidental y 5) Altiplanicie Mexicana (fig. 1a). Estas ecorregiones fueron elegidas por la presencia de pastizales naturales y son consideradas como los pastizales cálidos de Norteamérica (Brown y Makings, 2014).
A partir del polígono del área de estudio, se construyó en QGis 3.16 una malla de celdas triangulares con una resolución geográfica de 1° de longitud por celda (aprox. 111.1 km2). La forma de las celdas fue elegida de entre varias alternativas, como cuadrícula (e.g., Rojas-Soto et al., 2003) o hexágonos (e.g., Sánchez-Ramos et al., 2018), optando por las celdas triangulares debido a que fueron las que mejor se ajustaron al área del polígono, y el nivel de resolución fue el óptimo para organizar los registros de especies para algunos de los análisis posteriores (fig. 1b).
Para obtener los registros de pastos nativos y no nativos (material suplementario: tabla 1S) se tomó como base el Catálogo de las gramíneas malezas nativas e introducidas de México (Melgoza-Castillo et al., 2014; Sánchez-Ken et al., 2012). Considerando a las especies presentes dentro del área del polígono, se seleccionaron 149 especies de pastos nativos y 60 especies de pastos no nativos. Para la nomenclatura taxonómica se siguió a The World Checklist of Vascular Plants(WCVP; Govaerts, 2022).
Para obtener los registros de las aves de pastizal de acuerdo con la literatura científica, se seleccionaron las especies que previamente han sido catalogadas como dependientes de este tipo de hábitat, ya sea por utilizar estos sitios como áreas reproductivas o importantes en sus rutas migratorias dentro del Desierto Chihuahuense (Levandoski y Panjabi, 2014; Ruvalcaba-Ortega y Panjabi, 2018; material suplementario: tabla 2S). En total, se obtuvieron los registros de 41 especies de aves (residentes y migratorias) asociadas a pastizales, que se determinaron siguiendo la nomenclatura de American Ornithological Society (AOS, Chesser et al., 2022).

Figura 1. a, Ecorregiones extraídas del mapa de North American Terrestrial Ecoregions —Level III (Wiken et al., 2011) con las que se definió el polígono del Desierto Chihuahuense (amarillo); b, rejilla de 1 minuto de arco (verde) sobre el área de estudio usada para realizar las matrices de presencia-ausencia.
Los datos primarios de presencia de las especies seleccionadas de aves, pastos nativos y no nativos, se extrajeron del explorador de registros de la Global Biodiversity Information Facility (GBIF, https://www.gbif.org), utilizando el polígono del área de estudio para delimitar espacialmente la consulta (los enlaces de descarga [DOI] de las consultas se encuentran en el material suplementario: tabla 1S). Se utilizó el intervalo de tiempo de 1930 a 2019, correspondiente a los 3 periodos del desarrollo agropecuario mexicano en el último siglo. Los datos de presencia disponibles permitieron contar con un registro histórico confiable del recambio espacial de las especies de la región. No fue posible establecer una base previa a este intervalo debido a la escasez de registros de pastos no nativos antes de 1930. Los registros obtenidos fueron reorganizados en 3 bases de datos (pastos nativos, pastos no nativos y aves de pastizal) construidas en un sistema de gestión de bases de datos (Microsoft Access®). En cada una de las bases de datos se realizó una depuración de las georreferencias repetidas y los registros mal georreferenciados con respecto al polígono, con el fin de eliminar las inconsistencias generadas por la captura de datos. Por último, se consideraron los intervalos de tiempo de 1930 a 1964, 1965 a 1981 y 1982 a 2019 para detectar los posibles cambios temporales en la composición de especies de aves, consecuencia de la introducción de especies de pastos no nativos.
Con la finalidad de evaluar la calidad del muestreo de los diferentes taxones, se generaron curvas de acumulación de las especies de aves, pastos nativos y pastos no nativos para cada periodo. Estas curvas representan el número acumulado de especies encontradas al aumentar el tamaño de muestra (e.g., el aumento del esfuerzo de muestreo en el tiempo para cada periodo). Los estimadores de las curvas de acumulación de especies por grupo taxonómico y periodo se obtuvieron a partir de las matrices de presencia-ausencia con el paquete EstimateS 9.1 (Colwell, 2013). Adicionalmente, se estimaron los estadísticos de Chao2 para evaluar la completitud del muestreo (Colwell, 2013).
Diversidad beta
Índices de disimilitud. Con los datos de presencia-ausencia, se exploraron los cambios en la composición de especies en las celdas durante los 3 periodos mediante el cálculo de la diversidad β de Sorensen (βsor aditivo) (Baselga, 2010). Esta métrica está compuesta por el recambio, medido por la diversidad β de Simpson (βsim), y por el anidamiento medido por la diversidad β anidada (βnes) (Baselga, 2010). El primer componente corresponde a cuántas especies de un sitio son reemplazadas por especies diferentes de otros sitios (valores de 0 = todas las especies son iguales y 1 = todas las especies son diferentes), mientras que el segundo componente se refiere a la pérdida gradual de especies de un sitio a otro (valores de 0 = pérdida total de especies y 1 = ganancia total de especies); es decir, un sitio es un subconjunto del otro (Baselga, 2010). Estos componentes se consideran un reflejo de los procesos de selección de especies por factores ambientales, así como una dinámica de pérdida o colonización de especies (Calderón-Patrón y Moreno, 2019; Vellend, 2010). Estos índices se calcularon en la paquetería “betapart” de R por medio de betapair a partir de las matrices de presencia-ausencia (Baselga et al., 2018). Con estos índices se midió la variación en la composición de especies de pastos nativos, pastos no nativos y aves de pastizal en cada uno de los 3 periodos (Baselga y Orme, 2012; Llanes-Quevedo et al., 2024).
Riqueza de aves de pastizal, pastos nativos y no nativos, y prevalencia de pastos nativos. Para evaluar las diferencias de la composición de especies de aves de pastizal y la composición de pastos nativos y no nativos entre los 3 periodos, se obtuvo la riqueza total de pastos nativos y no nativos por celda por periodo. Estas riquezas totales fueron utilizadas para calcular un índice de prevalencia de especies de pastos nativos (IPPN). Para cada celda por periodo, este índice sintetiza la riqueza de especies de pastos nativos y no nativos en una variable (adaptado de Legendre, 2019). El IPPN se calcula como: PN / (PN + PNN), donde PN es el número de especies de pastos nativos y PNN es el número de especies de pastos no nativos. Este índice varía de 0 (cuando todas las especies son pastos no nativos) a 1 (cuando todas las especies son pastos nativos). Las celdas sin registros de especies de pastos nativos o no nativos se eliminaron. Adicionalmente, para cada celda se obtuvo la riqueza total de aves de pastizal por periodo. Para evaluar las diferencias en la riqueza total de aves, pastos nativos, pastos no nativos, así como en el IPPN entre periodos, se utilizaron análisis de varianza de Kruskal-Wallis (KW). En cada análisis, el periodo con 3 niveles (1930-1964, 1965-1981 y 1982-2019) fue considerado como factor (Zar, 2010). Los análisis de KW se realizaron utilizando la función de kruskal.test() del paquete R (Kloke y McKean, 2015). En el caso de detectarse diferencias significativas, se realizaron pruebas “post-hoc” de Wilcoxon con la probabilidad ajustada de Bonferroni (α = 0.05/3 = 0.0166; Wright, 1992). Las posibles relaciones entre el IPPN y la riqueza total de aves de pastizal en cada uno de los 3 periodos, se analizaron con correlaciones de Spearman (rs) utilizando la función cor.test() del paquete R (Hollander y Wolfe, 1973). Estas variables fueron transformadas al arcoseno√ y log10+1, respectivamente (Zar, 2010). Adicionalmente, se visualizó y exploró la composición de cada conjunto de especies (i.e., aves de pastizal, pastos nativos y pastos no nativos) en los 3 periodos con análisis de escalamiento multidimensional no métrico (NMDS) con la función metaMDS() de la paquetería Vegan de R (Oksanen et al., 2013). Se utilizó la matriz transpuesta de presencia/ausencia (especies × sitios) de las especies de aves de pastizal, pastos nativos y pastos no nativos de cada uno de los 3 periodos con base en el coeficiente de distancia euclidiana (Palacio et al., 2020). La visualización por medio del análisis NMDS nos permite explorar y presentar, de manera más accesible, el efecto de los 3 periodos.
Resultados
El total de datos descargados que se obtuvieron para los 3 conjuntos de especies fue de 2,345,226 registros para aves de pastizal, 37,750 registros para pastos nativos y 8,815 para pastos no nativos. Al reorganizar, depurar, ajustar geográficamente y dividir los datos para cada uno de los 3 periodos correspondientes, se obtuvieron en total 328,809 registros de las 41 especies de aves de pastizal, 25,429 registros de las 149 especies de pastos nativos y 5,555 de las 60 especies de pastos no nativos. El número total de especies y conjunto de registros para cada uno de los periodos, así como la disposición espacial de los mismos, se puede consultar en el material suplementario (fig. 1S; tabla 3S). La mayor parte (93.33%) de los registros recolectados en GBIF correspondientes a las especies tanto de pastos nativos como no nativos, proceden de colecciones científicas y, en menor medida, de observaciones en campo o artículos de investigación (6.77%). Por el contrario, los registros de aves de pastizal proceden, en su mayor parte (97.16%), de observaciones de campo, seguido de investigaciones publicadas o de colecciones científicas (2.84%).
Se observaron patrones consistentes en la riqueza de especies en pastizales a lo largo de los 3 periodos analizados. En cada periodo, las curvas de acumulación indicaron que la mayor diversidad de especies se observó en pastos nativos, seguida de los pastos no nativos y las aves de pastizal (fig. 2). Los estimadores Chao2 respaldaron estos patrones con tamaños de muestra de diversidad distintos para cada conjunto. Para los pastos nativos, se estimó un registro de aproximadamente 94.7%, 90.4% y 99.8% de la riqueza total esperada en cada uno de los 3 periodos, respectivamente. Para pastos no nativos, las estimaciones fueron de 84.9%, 96.1%, y 96.9%, respectivamente. Para aves de pastizal, se estimó un registro de alrededor de 97.6% de la riqueza de especies en el primer periodo, mientras que, en los periodos siguientes, se estimó en 100% de la riqueza de especies, aunque esta estimación perfecta podría deberse a características particulares del estimador y al número fijo de especies a analizar.
El índice de disimilitud (βsor) mostró una tendencia en la disminución en los 3 ensambles a lo largo de los 3 periodos, lo que indica que aumentó la similitud entre las celdas que conforman el área de estudio para aves de pastizal, pastos nativos y no nativos (tabla 1). El índice de recambio (βsim) también disminuyó entre el primer periodo y el último, principalmente para las aves de pastizal (tabla 1). Por su parte, el índice de anidamiento (βsne) incrementó en todos los casos (tabla 1). Los resultados indican que, en la actualidad, las celdas comparten más especies entre sí y el recambio de especies ha disminuido para el último periodo.
Tabla 1
Índices de diversidad beta (βsor = βsim + βnes) obtenidos con beta.pair() de aves de pastizal, pastos nativos y pastos no nativos para cada periodo. x = Media y DE = desviación estándar.
| Periodo | Aves de pastizal | Pastos nativos | Pastos no nativos | ||||
| 1930-1964 | x | DE | x | DE | x | DE | |
| βsor | 0.74 | 0.21 | 0.83 | 0.16 | 0.81 | 0.23 | |
| βsim | 0.50 | 0.36 | 0.66 | 0.29 | 0.70 | 0.38 | |
| βsne | 0.24 | 0.27 | 0.16 | 0.22 | 0.12 | 0.20 | |
| 1965-1981 | x | DE | x | DE | x | DE | |
| βsor | 0.73 | 0.23 | 0.81 | 0.16 | 0.85 | 0.20 | |
| βsim | 0.40 | 0.39 | 0.64 | 0.28 | 0.69 | 0.38 | |
| βsne | 0.33 | 0.32 | 0.17 | 0.22 | 0.15 | 0.25 | |
| 1982-2019 | x | DE | x | DE | x | DE | |
| βsor | 0.35 | 0.21 | 0.74 | 0.18 | 0.77 | 0.19 | |
| βsim | 0.09 | 0.11 | 0.52 | 0.28 | 0.55 | 0.36 | |
| βsne | 0.26 | 0.23 | 0.23 | 0.23 | 0.22 | 0.27 |
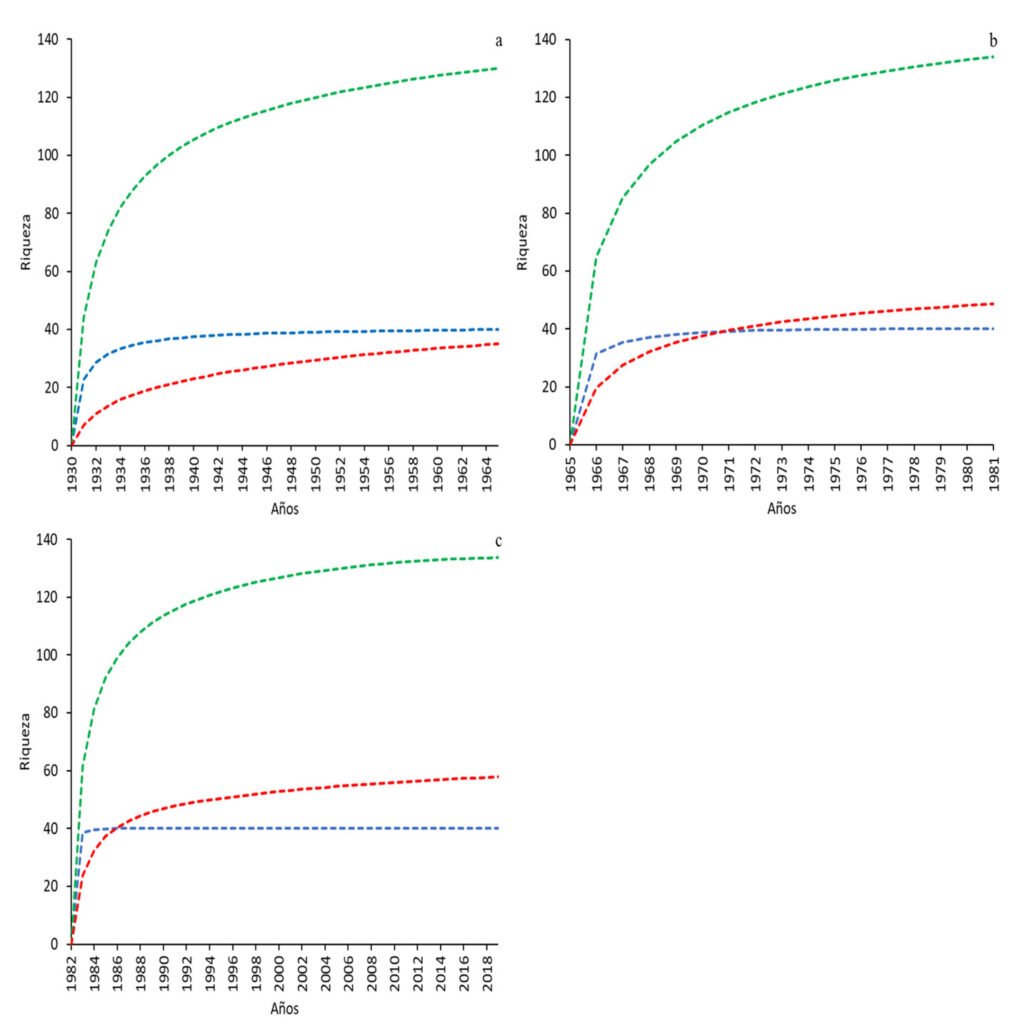
Figura 2. Curvas de acumulación de especies de aves de pastizal (azul), pastos nativos (verde) y pastos no nativos (rojo) para los periodos de a) 1930-1964, b) 1965-1981 y c) 1982-2019.
Los análisis revelaron diferencias significativas de la riqueza de aves de pastizal (H = 196.24, g.l. = 2, p = 0.0001), pastos nativos (H = 35.78, g.l. = 2, p = 0.0001), pastos no nativos (H = 50.74, g.l. = 2, p = 0.0009) y el IPPN (H = 47.40, g.l. = 2, p = 0.0005) entre periodos (fig. 3). Estos hallazgos indican un efecto significativo a lo largo del tiempo en cada uno de los grupos taxonómicos evaluados, lo que refleja posibles cambios en la composición y estructura de las comunidades biológicas en respuesta a factores de manejo específicos o ambientales de cada período. La riqueza de aves de pastizal del periodo 1982-2019 fue significativamente mayor (p < 0.0001) con respecto a los periodos 1930-1964 y 1965-1981. Similarmente, la riqueza de pastos nativos y no nativos del periodo 1982-2019 fue significativamente mayor en comparación con aquella del periodo 1930-1964 (p = 0.0001) y 1965-1981 (p = 0.0013). Por otro el contrario, el IPPN del periodo 1982-2019 fue significativamente menor en comparación con el del periodo de 1930-1964 (p < 0.0001) y 1965-1981 (p = 0.0003).

Figura 3. Diagramas de caja de la riqueza de aves de pastizal, pastos nativos, pastos no nativos y el índice de prevalencia de pastos nativos (IPPN) para cada periodo. Periodos identificados con letras diferentes indican diferencias significativas (p ≤ 0.0166) con el resto a partir de pruebas “post-hoc” de Wilcoxon (ver detalles en Materiales y métodos).
Hubo correlaciones negativas débiles entre el IPPN y la riqueza de aves de pastizal en los periodos de 1930-1964 (rs = -0.1553, p = 0.0400) y 1965-1981 (rs = -0.1784, p = 0.0100). Sin embargo, no se encontró una correlación significativa entre ambas variables (rs = 0.0321, p = 0.6600) en el periodo de 1982-2019. La proyección de IPPN sobre la región muestra que durante el periodo de 1930-1964, el ensamble regional de pastos estaba conformado principalmente por pastos nativos, en contraste con una reducida prevalencia de pastos nativos para el periodo de 1982-2019 (fig. 4).
Finalmente, los NMDS revelaron una variación en la composición y riqueza regional del ensamble de especies tanto de aves como de pastos nativos y no nativos entre los periodos estudiados (fig. 5). Se observó una discontinuidad en la composición de especies de aves de pastizal a lo largo del tiempo, con una marcada contracción durante el periodo de 1965-1981 y una distribución más dispersa en el periodo de 1982-2019, indicando cambios abruptos en la estructura del ensamble (fig. 5a). En contraste, se observó un cambio gradual en la composición de especies de pastos nativos, con un incremento en la distribución del ensamble en varios sitios de la región con una posible contracción entre periodos (fig. 5b). Por último, se observó un marcado aumento en la composición del ensamble de pastos no nativos, especialmente notable durante el periodo de 1982-2019 (fig. 5c). Este patrón de cambio confirma la expansión significativa del ensamble de pastos no nativos en comparación con los periodos anteriores, en el mismo sentido que la proyección del IPPN para el último periodo (fig. 4). Estos resultados sugieren que el periodo de 1982-2019 muestra cambios en el ensamble de especies respecto a los otros periodos en términos del IPPN y la riqueza de especies. Sin embargo, esta tendencia no se mantuvo de manera consistente en el último periodo.
Discusión
Este estudio representa un acercamiento a escala regional sobre la influencia de los pastos no nativos en los pastizales del Desierto Chihuahuense, sugiriendo cambios en la composición general de las aves de pastizal, atribuibles al considerable cambio en la riqueza de especies y composición taxonómica de los pastos nativos influenciados por los procesos agropecuarios a lo largo del tiempo. Esto no involucra únicamente esta región, ya que debido a su conectividad, es fundamental para las aves migratorias provenientes de las praderas templadas y de pastos mixtos de las Grandes Llanuras Centrales de Norteamérica (Comer et al., 2018). Aunado a lo anterior, en esta región se han identificado procesos de diversificación y dispersión de diversos grupos de vertebrados terrestres y de plantas vasculares (Savage, 1982). En cuanto a las dinámicas ecológicas, estos hábitats también son importantes para diversas especies de animales, como el perrito de las praderas de cola negra (Cynomys ludovicianus), considerada especie clave en la dinámica de pastizales del Desierto Chihuahuense (Detling, 2013). Nuestro estudio aporta evidencia sobre cómo la implementación histórica de políticas públicas pudo modelar de forma positiva la diversidad beta de pastos no nativos y negativamente para los pastos nativos.
Los índices de disimilitud de diversidad βsor (tabla 1) revelaron que los pastos nativos y no nativos están caracterizados por un marcado reemplazo, que se explica por una ausencia de anidamiento a lo largo de los 3 periodos analizados. En cambio, las aves de pastizal cambian este patrón solo en el último periodo al aumentar el anidamiento. Este patrón sugiere que el impacto de las diferentes políticas de aprovechamiento de pastizales a lo largo del tiempo puede influir en la diversidad beta a nivel regional. El reemplazo de especies de pastos nativos y no nativos puede estar más vinculado a eventos de manejo que varían de manera diferencial en cada periodo (Chauvet-Sánchez, 1999; Hoth, 2012), además de otros procesos como los gradientes ambientales (Baselga, 2010).

Figura 4. Proyección del índice de prevalencia de pastos nativos (IPPN) sobre los sitios para cada periodo. La escala de colores corresponde a los valores de IPPN. Valores de 0 indican ensambles dominados completamente por pastos no nativos y 1 cuando dominan completamente los pastos nativos.
Por otro lado, los valores constantes de reemplazo en los 2 tipos de pastos a lo largo del tiempo, no necesariamente se asocian con procesos de homogeneización biótica, debido a la pérdida de especies de plantas nativas frente a las no nativas (Alignier y Baudry, 2016). Aunque esto puede ocurrir en un nivel alfa local, el nivel beta regional es imperceptible, como puede ser nuestro caso. Por ejemplo, se ha observado que los cambios en la diversidad taxonómica de pastizales a nivel alfa local se asocian con la presión por pastoreo, mientras que un nivel beta regional, la diversidad filogenética se asocia con gradientes ambientales, los cuales corresponden a procesos históricos y evolutivos (Wang et al., 2019). Aunque la diversidad filogenética no fue objeto de nuestro estudio, esta observación nos ayuda a entender por qué en nuestros conjuntos de especies no se logran apreciar cambios considerables a lo largo del tiempo, puesto que los periodos de estudio son relativamente cortos históricamente. En el caso de las aves de pastizal, el patrón de diversidad beta sugiere una homogenización de las comunidades, atribuible a la disminución de la disimilitud en el último periodo. Esto indica que las diferencias en la riqueza de especies entre los sitios también han disminuido, lo cual puede atribuirse al incremento del patrón de anidamiento a lo largo del tiempo detectado desde el periodo de 1965-1981. Estas evidencias pueden estar influenciadas por el incremento de la presión debido a la expansión de la ganadería a partir de 1965 (Chauvet-Sánchez, 1999; Hoth, 2012), ya que desde entonces existía un considerable sobrepastoreo de los pastizales del norte del país (CFAN, 1965).
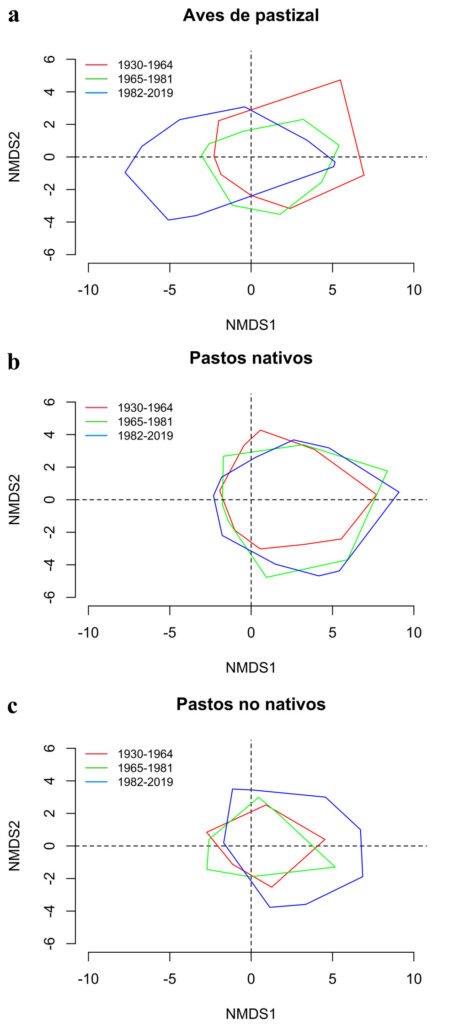
Figura 5. Análisis de escalamiento multidimensional no métrico (NMDS) de la composición de especies de a) aves de pastizal, b) pastos nativos y c) pastos no nativos. Los polígonos dentro de cada gráfico corresponden al espacio que ocupa la composición de especies en 2 dimensiones.
Periodo de 1930-1964
Nuestros resultados evidenciaron una mayor estabilidad en la riqueza estimada de aves de pastizal con respecto de los pastos nativos y no nativos en la región durante este periodo. Esto puede atribuirse en gran parte al amplio conocimiento taxonómico de las aves en México (Navarro-Sigüenza et al., 2014), pero también a que la selección de especies de aves de nuestro universo de análisis fue restringido y limitado a aquellas que dependen del pastizal para eventos clave de su ciclo de vida. Por otro lado, los pastos nativos tuvieron una mejor representación con respecto a los pastos no nativos. Al examinar la proyección del IPPN y los NMDS (figs. 4, 5b), es claro que la región estaba predominantemente conformada por ensambles de pastos nativos. La poca representación del ensamble de pastos no nativos pudo deberse a que algunas de las introducciones se dieron desde inicios del siglo XX, al ser originalmente introducidas en el suroeste de EUA (Herrera, 2001), por lo que su presencia pudo haberse pasado por alto en este periodo.
Se debe tener en cuenta que durante las décadas de 1930 y 1940, los esfuerzos gubernamentales estaban más centrados en establecer la tenencia de la tierra entre propiedad comunal y propiedad privada (González-Navarro, 1969), así como en recuperar los niveles de producción ganadera previos a la revolución de 1910 (de S. Lopes, 2008). La correlación significativa del IPPN y la riqueza de aves de pastizal, aunque baja y negativa, sugiere que el periodo en que se tiene la mayor prevalencia por parte de pastos nativos influyó poco sobre la riqueza de aves de pastizal del Desierto Chihuahuense. Se debe tener en cuenta que se introdujeron especies de pastos de manera directa en la región a partir de 1956 con la intención de mejorar la producción de forraje para el ganado por parte de la Oficina de Estudios Especiales del Gobierno de México (Ortega et al., 2013). Como incentivo adicional, durante este periodo se logró la consolidación de la práctica veterinaria pecuaria a nivel nacional con la erradicación de la fiebre aftosa en 1956 (Chauvet-Sánchez, 1999). Estos factores serían fundamentales para estimular la producción cárnica dentro de zonas de pastizales y serían la antesala de la expansión de pastos no nativos dentro del Desierto Chihuahuense.
Periodo de 1965-1981
La riqueza de especies estimada para el periodo 1965-1981 muestra que es cuando se detecta una mayor presencia de pastos no nativos en el Desierto Chihuahuense. Sin embargo, esto se refleja mínimamente en el IPPN (fig. 4) y en los análisis NMDS correspondientes a pastos no nativos. No obstante, se pudo observar que el ensamble de pastos en la región ya no está conformado únicamente por pastos nativos en todos los sitios (fig. 5b, c). Por su parte, el ensamble de aves de pastizal exhibe a nivel regional una contracción de su NMDS (fig. 5a), lo que implica una menor riqueza de aves de pastizal en varios sitios con respecto al periodo anterior.
Lo antes mencionado y la correlación negativa entre la riqueza de las aves de pastizal con el IPPN sugiere que durante el auge ganadero entre 1965 y 1981, se desencadenó un efecto que favoreció en algunos sitios la presencia de pastos no nativos, mientras que para las aves sucedió lo contrario. Esto coincide con lo observado en los pastizales centrales de EUA, donde la disminución de la diversidad de aves de tierras de cultivo se correlacionó con cambios significativos en las prácticas agrícolas entre 1966 y 1980 (Stanton et al., 2018). Además, por monitoreos estandarizados en gradientes de pastizal nativo en EUA (Wiens, 1973), se sabe que el grupo de aves de pastizal presentó la mayor pérdida poblacional atribuible al incremento de la agricultura y la urbanización en zonas de pastizal desde la década de 1970 (Rosenberg et al., 2019). Durante este periodo, varias zonas de pastizal sobrepastoreadas en el Desierto Chihuahuense presentaban erosión leve o avanzada, lo que provocó pérdida de hábitat (CFAN, 1965; Royo et al., 2005). En los últimos años de este periodo, comienzan a aparecer investigaciones que analizan el impacto de estas especies como malezas nocivas sobre el hábitat original (Espinosa-García y Villaseñor, 2017). Esto pudo ser una respuesta a la permisiva explotación de los pastizales durante la ganaderización de la agricultura en varias zonas de pastizal para la producción cárnica (Chauvet-Sánchez, 1999), incluido el Desierto Chihuahuense. Los pastos nativos parecen responder de manera diferente, ya que los NMDS (fig. 5b) muestran que con el tiempo se tiene una mejor representación del ensamble de especies al ir incrementado entre las 2 dimensiones, pese a que la producción cárnica durante el auge ganadero se mantuvo constante hasta la apertura comercial con el TLCAN en 1992 (Chauvet-Sánchez, 1999). Estos pueden ser efectos a largo plazo, atribuibles al auge ganadero (Chauvet-Sánchez, 1999), cuyo uso como recurso pudo haber sido generalizado y no exclusivo para el consumo del ganado.
Periodo de 1982-2019
Finalmente, la diversidad de especies observada en el periodo de 1982-2019 siguió la tendencia del periodo anterior siendo más alta en pastos nativos, seguida de pastos no nativos y aves de pastizal. Sin embargo, los pastos no nativos empiezan a alcanzar una estabilidad para el final del periodo, lo que puede ser resultado de la colaboración entre EUA y México para la conservación de los pastizales, así como del mejoramiento de las prácticas ganaderas dentro del Desierto Chihuahuense (Hoth, 2012). Pese a esto, la riqueza de pastos no nativos ha llegado a representar poco más de la tercera parte de la totalidad de especies de pastos que se pueden encontrar dentro del Desierto Chihuahuense.
Las curvas para los 3 periodos dentro de toda la región en general revelan el importante esfuerzo de registro taxonómico que se viene llevando desde principios del siglo XX, no solo en la región sino en todo territorio mexicano (Llorente-Bousquets y Ocegueda, 2008). Todas las pruebas “post-hoc” evidencian las discrepancias de este periodo con respecto a los anteriores en términos de riqueza de los 3 conjuntos de especies, así como del IPPN. No obstante, es importante considerar, sobre todo para las aves de pastizal, la mayor densidad de registros en la porción territorial norteamericana lo que pudo influir en que este periodo difiera en comparación con los anteriores. Sin embargo, la ausencia de correlación entre la riqueza de aves y el IPPN exhibe que la representación del ensamble de aves de pastizal no es una variable relacionada con el comportamiento del ensamble de pastos nativos. Esto sugiere la ausencia de un efecto sobre la riqueza de aves por la expansión de los pastos no nativos, aunque se ha detectado que los ensambles de aves presentan frecuentemente cambios en la abundancia relativa de las especies, pero no en la riqueza, en zonas homogenizadas por pastos no nativos (Harris et al., 2019), especialmente relacionados al reordenamiento de las abundancias y no al recambio en la riqueza de especies (Jones et al., 2017; Rosenberg et al., 2019).
La falta de correlación entre la riqueza de aves y el IPPN podría deberse a: 1) que las especies de aves tienen una mayor capacidad de persistir en cualquiera de las configuraciones de pastizal presentes dentro de la región (Ellis-Felege et al., 2013); 2) que su distribución es más amplia de la que abarca nuestra resolución, debido a que la región tiene conectividad con pastizales norteamericanos (Vickery et al., 1999) y 3) finalmente porque son un grupo biológico con alta capacidad de movilidad dentro de la región (Comer et al., 2018). La proyección del IPPN (fig. 4) y los NMDS correspondientes a pastos nativos y no nativos (fig. 5b, c) sugieren que el ensamble de pastos no nativos se encuentra en prácticamente los mismos sitios de pastizal nativo. Es posible que los pastos no nativos se hayan visto influenciados positivamente debido a que la constante degradación de los pastizales en la región por sobrepastoreo del periodo anterior, contribuyó a la expansión regional y que en parte, nuestros resultados son un reflejo de la enorme fragmentación del hábitat (Hoth, 2012).
Por otro lado, los esfuerzos de conservación en varias zonas de pastizal del Desierto Chihuahuense durante el periodo más reciente (APCP, 2010; Aguirre et al., 2007), en un inicio no fueron especialmente selectivos sobre las especies de pastos que conforman el hábitat, pudiendo contribuir al incremento en la riqueza de especies, tanto de pastos nativos como no nativos. En este sentido, una parte considerable del ensamble de pastos no nativos presentes en la región pudieron originarse de pastizales nativos degradados o bien de la deforestación de zonas con arbustos y árboles (Buisson et al., 2022). Por lo tanto, las especies de pastos no nativos se establecieron aleatoriamente en toda la región a partir de tierras agrícolas (Rzedowski y Calderón, 1990; Rzedowski et al., 1995). Esta expansión produjo ensambles de pastos más reducidos en cada sitio en comparación con zonas con pastos nativos (Flanders et al., 2006), pero que finalmente, en la actualidad se deben considerar como parte de la flora de la región (Brown y Makings, 2014).
Nuestros resultados sugieren que la introducción de especies de pastos no nativos no fue un evento único y que el aumento en la presencia de estas especies, con el paso del tiempo, fue en los mismos sitios en los que se detectaron los pastos nativos, lo que denota la necesidad de priorizar los esfuerzos de conservación selectivos para los pastos nativos. Además, se requiere analizar si la cobertura de otros tipos de hábitat, como el incremento de matorrales espinosos sobre la configuración de pastizales en el Desierto Chihuahuense, ha cambiado dentro de la región.
Nuestros resultados indican cambios en la diversidad beta de aves de pastizal, de pastos nativos y de pastos no nativos a nivel regional. Considerando la resolución espacial y temporal utilizada en este estudio, nuestros análisis sugieren que estos cambios pueden ser atribuibles a las diferentes políticas económicas de cada periodo. No obstante, se destaca la importancia de analizar a las especies de pastos no nativos en un nivel de diversidad alfa, con énfasis en una posible respuesta de los ensambles de aves de pastizal, posiblemente asociada a las particularidades de cada comunidad. También subrayamos la necesidad de identificar sitios prioritarios para la gestión y conservación selectiva de pastos nativos en zonas de pastizal con el objetivo de mitigar posibles alteraciones en el ensamble de aves de pastizal en la región.
Agradecimientos
El presente artículo forma parte de los requisitos para la obtención del grado de Doctor de MP-M en el programa de posgrado de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana, quien cuenta con una beca del Conahcyt (CVU 718731). Agradecemos el apoyo financiero del programa PAPIIT-UNAM IN214621 (a AGN-S) y Proyecto UAM 143.05.27 (a PLV). A Alejandro Gordillo, Alexander Llanes, Ronald Fernández, Reinhard Matadamas, Rodolfo Flores, Itzel Estrada, José Zazueta, Carlos Lara y dos revisores anónimos, por su apoyo logístico y valiosos comentarios durante el desarrollo de esta investigación. LES-R agradece a DGAPA-UNAM por la beca posdoctoral.
Referencias
Aguirre, C., Hoth, J. y Lafón, A. (Eds.). (2007). Estrategia para la Conservación de Pastizales del Desierto Chihuahuense (ECOPAD). Repórte técnico. https://doi.org/10.13140/RG.2.
2.36081.74089
Alignier, A. y Baudry, J. (2016). Is plant temporal beta diversity of field margins related to changes in management practices? Acta Oecologica, 75, 1–7. http://dx.doi.org/10.1016/j.actao.
2016.06.008
Almeida-Neto, M., Frensel D. M. B. y Ulrich, W. (2011). Rethinking the relationship between nestedness and beta diversity: a comment on Baselga (2010). Global Ecology and Biogeography, 21, 772–777. https://doi.org/10.1111/j.
1466-8238.2011.00709.x
APCP (Áreas Prioritarias de Conservación Pastizal). (2010). Comisión para Cooperación Ambiental (CCA). http://www.cec.org/es/atlas-ambiental-de-america-del-norte/areas-pri
oritarias-de-conservacion-pastizales-2010/
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143. https://doi.org/10.1111/j.1466-82
38.2009.00490.x
Baselga, A. y Orme, C. D. L. (2012). betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Baselga, A., Orme, D., Villeger, S., De Bortoli, J., Leprieur, F., Logez, M. et al. (2018). Package ‘betapart’: Partitioning Beta Diversity into Turnover and Nestedness Components. Ver 1.5. 1. CRAN.
Brennan, L. A. y Kuvlesky Jr., W. P. (2005). North American grassland birds: an unfolding conservation crisis? The Journal of Wildlife Management, 69, 1–13. https://doi.org/10.2193/0022-541X(2005)069<0001:NAGBAU>2.0.CO;2
Brown, D. E. y Makings, E. (2014). Desert plants. Tucson:The University of Arizona for the Boyce Thompson Arboretum.
Buisson, E., Archibald, S., Fidelis, A. y Suding, K. N. (2022). Ancient grasslands guide ambitious goals in grassland restoration. Science, 377, 594–598. https://doi.org/10.1126/science.abo4605
Calderón-Patrón, J. M. y Moreno, C. E. (2019). Diversidad beta basada en índices de disimilitud: Su partición en componentes de recambio y diferencias en riqueza. En C. E. Moreno (Ed.), La biodiversidad en un mundo cambiante: fundamentos teóricos y metodológicos para su estudio (pp. 203–222). Ciudad de México: Universidad Autónoma del Estado de Hidalgo/ Libermex.
Guo, B., Cortázar-Martínez, A. y Ayala-Garay, A. V. (2010). Competitividad de la ganadería bovina de carne en México. En B. A. Cavallotti-Vázquez, C. F. Marcof-Álvarez y B. Ramírez-Valverde (Eds.), Los grandes retos para la ganadería: hambre, pobreza y crisis ambiental. (pp. 3–14). Estado de México: Universidad Autónoma Chapingo. México.
Cervantes-Sánchez, J. M. y Román de Carlos, A. M. (2001). Consecuencias de la epizootia de la fiebre aftosa en la medicina veterinaria y la zootecnia mexicanas (1946–1955). Imagen Veterinaria, 1, 17–20.
CFAN (Consejo de Fomento Agropecuario del Norte de México). (1965). Estudio integral preliminar sobre la ganadería de la zona norte de la República Mexicana. Tomo IV. Ciudad de México: Consejo de Fomento Agropecuario del Norte de México/ COPARMEX.
Challenger, A. (1998). Utilización y conservación de los ecosistemas terrestres de México: pasado, presente y futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Instituto de Biología, UNAM/ Agrupación Sierra Madre. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Challenger, A. y Soberón, J. (2009). Los ecosistemas terrestres. En J. Soberón, G. Halffter y J. Llorente-Bousquets (Eds.), Capital natural de México, Vol. 1. Conocimiento actual de la biodiversidad (pp. 88–105). Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Chamberlain, D. E., Fuller, R. J., Bunce, R. G., Duckworth, J. C., y Shrubb, M. (2000). Changes in the abundance of farmland birds in relation to the timing of agricultural intensification in England and Wales. Journal of Applied Ecology, 37, 771–788. https://doi.org/10.1046/j.1365-2664.2000.00548.x
Chaneton, E. J., Perelman, S. B., Omacini, M. y León, R. J. (2002). Grazing, environmental heterogeneity, and alien plant invasions in temperate Pampa grasslands. Biological Invasions, 4, 7–24.
Chauvet-Sánchez, M. (1999). La ganadería bovina de carne en México: del auge a la crisis. México D.F.: Universidad Autónoma Metropolitana.
Chesser, R. T., Billerman, S. M., Burns, K. J., Cicero, J. C., Dunn, L., Hernández-Baños, B. E. et al. (2022). Check-list of North American birds. American Ornithological Society. Recuperado 19 diciembre, 2022 de: https://checklist.americanornithology.org/taxa/
Colwell, R. K. (2013). Estimates: statistical estimation of species richness and shared species from samples. Version 9. User’s Guide and Application.
Comer, P. J., Hak, J. C., Kindscher, K., Muldavin, E. y Singhurst, J. (2018). Continent-scale landscape conservation design for temperate grasslands of the Great Plains and Chihuahuan Desert. Natural Areas Journal, 38, 196–211. https://doi.org/10.3375/043.038.0209
Davis, M. A. (2003). Biotic globalization: does competition from introduced species threaten biodiversity? Bioscience, 53, 481–489. https://doi.org/10.1641/0006-3568(2003)053[0481:
BGDCFI]2.0.CO;2
del Val, E., Balvanera, P., Castellarini, F., Espinosa-García, F. J., Murguía, M. y Pacheco, C. (2015). Identifying areas of high invasion risk: a general model and an application to Mexico. Revista Mexicana de Biodiversidad, 86, 208–216. https://doi.org/10.7550/rmb.44743
Desmond, M. y Montoya, J. A. (2006). Status and distribution of Chihuahuan Desert grasslands in the United States and Mexico. En X. Basurto y D. Hadley (Eds.), Grasslands ecosystems, endangered species, and sustainable ranching in the Mexico-US borderlands: Conference proceedings. RMRS-P-40 (pp. 17–25). Fort Collins, CO: US Department of Agriculture, Forest Service, Rocky Mountain Research Station.
Detling, J. K. (2013). Do prairie dog compete with livestock? En J. Hoogland (Ed.), Conservation of the black-tailed prairie dog: saving North America’s western grasslands (pp. 65–88). Washington D.C.: Island Press.
Ellis-Felege, S. N., Dixon, C. S. y Wilson, S. D. (2013). Impacts and management of invasive cool-season grasses in the Northern Great Plains: challenges and opportunities for wildlife. Wildlife Society Bulletin, 37, 510–516. https://doi.org/10.1002/wsb.321
Eskelinen, A. y Harrison, S. (2015). Erosion of beta diversity under interacting global change impacts in a semi-arid grassland. Journal of Ecology, 103, 397–407. https://doi.org/10.1111/1365-2745.12360
Espinosa-García, F. J. y Villaseñor, J. L. (2017). Biodiversity, distribution, ecology and management of non-native weeds in Mexico: a review. Revista Mexicana de Biodiversidad, 88, 76–96. https://doi.org/10.1016/j.rmb.2017.10.010
Flanders, A. A., Kuvlesky Jr, W. P., Ruthven III, D. C., Zaiglin, R. E., Bingham, R. L., Fulbright, T. E. et al. (2006). Effects of invasive exotic grasses on south Texas rangeland breeding birds. The Auk, 123, 171–182. https://doi.org/10.1093/auk/
123.1.171
George, A. D., O’Connell, T. J., Hickman, K. R. y Leslie Jr, D. M. (2013). Food availability in exotic grasslands: a potential mechanism for depauperate breeding assemblages. The Wilson Journal of Ornithology, 125, 526–533. https://doi.org/10.1676/13-003.1
Gibson, D. J. (2009). Grasses and grassland ecology. Nueva York: Oxford University Press.
González-Medrano, F. (2012). Las zonas áridas y semiáridas de México y su vegetación. México D.F.: Instituto Nacional de Ecología.
González-Navarro, M. (1969). La tenencia de la tierra en México. Cahiers du monde hispanique et luso-brésilien, 12, 115–134.
Govaerts, R. (2022). The World Checklist of Vascular Plants (WCVP). En O. Bánki, Y. Roskov, M. Döring, G. Ower, L. Vandepitte, D. Hobern et al. (Eds.), Catalogue of Life Checklist (10.0). Kew: The Royal Botanic Gardens. https://doi.org/10.48580/dfqt-4nz
Guo, Q., Qian, H., Ricklefs, R. E. y Xi, W. (2006). Distributions of exotic plants in eastern Asia and North America. Ecology Letters, 9, 827–834. https://doi.org/10.1111/j.1461-0248.2006.
00938.x
Hamilton, J. G., Holzapfel, C. y Mahall, B. E. (1999). Coexistence and interference between a native perennial grass and non-native annual grasses in California. Oecologia, 121, 518–526. https://doi.org/10.1007/s004420050958
Harris, M. A., Greve, M., Voysey, M. D. y Jamison, S. L. (2019). Changes in bird assemblages because of vegetation homogenisation in communal livestock systems. Koedoe: African Protected Area Conservation and Science, 61, 1–18. https://doi.org/10.4102/koedoe.v61i1.1543
Hejda, M., Pyšek, P. y Jarošík, V. (2009). Impact of invasive plants on the species richness, diversity and composition of invaded communities. Journal of Ecology, 97, 393–403. https://doi.org/10.1111/j.1365-2745.2009.01480.x
Herrera, Y. (2001). Las gramíneas de Durango. Durango, México: Instituto Politécnico Nacional/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Editorial Filo de Agua.
Hollander, M. y Wolfe, D. A. (1973). Nonparametric statistical methods. New York: John Wiley and Sons.
Hoth, J. (2012). Buenas prácticas ganaderas en México. Montreal: Comisión para la Cooperación Ambiental de América del Norte (CCA).
Joner, F., Giehl, E. L. y Pillar, V. D. (2021). Functional and taxonomic alpha and beta diversity responses to burning grasslands in southern Brazil. Journal of Vegetation Science, 32, e13060. https://doi.org/10.1111/jvs.13060
Jones, S. K., Ripplinger, J. y Collins, S. L. (2017). Species reordering, not changes in richness, drives long-term dynamics in grassland communities. Ecology Letters, 20, 1556–1565. https://doi.org/10.1111/ele.12864
Kloke, J., McKean, J. W. y McKean, J. W. (2015). Nonparametric statistical methods using R. Boca Raton: CRC Press.
Legendre, P. (2019). A temporal beta-diversity index to identify sites that have changed in exceptional ways in space–time surveys. Ecology and Evolution, 9, 3500–3514. https://doi.org/10.1002/ece3.4984
Levandoski, G. y Panjabi, A. (2014). Las aves de pastizal. En Conabio (Ed.), La biodiversidad en Chihuahua: estudio de estado (pp. 128–134). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Llanes-Quevedo, A., Sánchez-Ramos, L. E. y Navarro-Sigüenza, A. G. (2024). Patrones históricos y actuales de diversidad y relaciones biogeográficas de la avifauna residente de los bosques tropicales de México. Revista Mexicana de Biodiversidad, 95, e955341. https://doi.org/10.22201/ib.2007
8706e.2024.95.5341
Llorente-Bousquets, J. y Ocegueda, S. (2008). Estado del conocimiento de la biota. En Conabio (Ed.), Capital natural de México, Vol. I. Conocimiento actual de la biodiversidad (pp. 283–322). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Macías-Duarte, A., Montoya, A. B., Méndez-González, C. E., Rodríguez-Salazar, J. R., Hunt, W. G. y Krannitz, P. G. (2009). Factors influencing habitat use by migratory grassland birds in the state of Chihuahua, Mexico. The Auk, 126,
896–905. https://doi.org/10.1525/auk.2009.08251
Macías-Duarte, A., Panjabi, A. O., Strasser, E. H., Levandoski, G. J., Ruvalcaba-Ortega, I., Doherty, P. F. et al. (2017). Winter survival of North American grassland birds is driven by weather and grassland condition in the Chihuahuan Desert. Journal of Field Ornithology, 88, 374–386. https://doi.org/10.1111/jofo.12226
Melgoza-Castillo, A., Balandrán Valladares, M. I., Mata-González, R. y Pinedo Álvarez, C. (2014). Biología del pasto rosado Melinis repens (Willd.) e implicaciones para su aprovechamiento o control: Revisión. Revista Mexicana de Ciencias Pecuarias, 5, 429–442.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Townsend-Peterson, A., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85 (Suplem.), S476–S495. https://doi.org/10.7550/rmb.41882
Ortega, S. J. A., Ibarra-Flores, F. A., Melgoza, A., González-Valenzuela, E. A., Martin-Rivera, M. H., Ávila-Curiel, J. M. et al. (2013). Exotic grasses and wildlife in northern Mexico. Wildlife Society Bulletin, 37, 537–545. https://doi.org/10.1002/wsb.325
Palacio, F. X., Apodaca, M. J. y Crisci, J. V. (2020). Análisis multivariado para datos biológicos: teoría y su aplicación utilizando el lenguaje R. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara.
Pavlacky Jr, D. C., Green, A. W., George, T. L., Iovanna, R., Bartuszevige, A. M., Correll, M. D. et al. (2022). Landscape-scale conservation mitigates the biodiversity loss of grassland birds. Ecological Applications, 32, e2548. https://doi.org/10.1002/eap.2548
Pyšek, P., Jarošík, V., Hulme, P. E., Pergl, J., Hejda, M., Schaffner, U. et al. (2012). A global assessment of invasive plant impacts on resident species, communities and ecosystems: the interaction of impact measures, invading species’ traits and environment. Global Change Biology, 18, 1725–1737. https://doi.org/10.1111/j.1365-2486.2011.02636.x
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2022). Vegan. Community Ecology Package: Ordination, Diversity and Dissimilarities. 3.4.
Qian, H. y Ricklefs, R. E. (2006). The role of exotic species in homogenizing the North American flora. Ecology Letters, 9, 1293–1298. https://doi.org/10.1111/j.1461-0248.
2006.00982.x
Qian, H. (2008). A latitudinal gradient of beta diversity for exotic vascular plant species in North America. Diversity and Distributions, 14, 556–560. https://doi.org/10.1111/j.1472-
4642.2008.00466.x
Rojas-Soto, O. R., Alcántara-Ayala, O. y Navarro-Sigüenza, A. G. (2003). Regionalization of the avifauna of the Baja California Peninsula, Mexico: a parsimony analysis of endemicity and distributional modelling approach. Journal of Biogeography, 30, 449–461. https://doi.org/10.1046/j.1365-
2699.2003.00836.x
Rosenberg, K. V., Dokter, A. M., Blancher, P. J., Sauer, J. R., Smith, A. C., Smith, P. A. et al. (2019). Decline of the North American avifauna. Science, 366, 120–124. https://doi.org/
10.1126/science.aaw1313
Royo, M., Melgoza, A., Santos, J. S., Carrillo, R., Jurado, P., Gutiérrez, R. et al. (2005). La salud de los pastizales medianos en los estados de Chihuahua y Zacatecas. II Simposio Internacional de Manejo de Pastizales. Memorias. Zacatecas, México.
Ruvalcaba-Ortega I. y Panjabi, A. O. (2018). Aves de pastizal del Desierto Chihuahuense. En Conabio (Ed.), La biodiversidad en Coahuila. Estudio de Estado, vol. II. (pp. 375–384). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Coahuila de Zaragoza.
Rzedowski, J. y Calderón, de R. G. (1990). Nota sobre el elemento africano en la flora adventicia de México. Acta Botanica Mexicana, 12, 21–24. https://doi.org/10.21829/abm12.1990.602
Rzedowski, J., Calderón, de R. G. y Galván, R. (1995). Los pastizales calcífilos del estado de Guanajuato. Flora del Bajío y de Regiones Adyacentes. Fascículo Complementario IX. Pátzcuaro, Mich.: Instituto de Ecología, A.C. – Centro Regional del Bajío.
de S. Lopes, M. A. (2008). Revolución y ganadería en el norte de México. Historia Mexicana, 57, 863–910. https://www.jstor.org/stable/25139806
Sánchez-Ken, J. G., Zita-Padilla, G. A. y Mendoza-Cruz, M. (2012). Catálogo de las gramíneas malezas nativas e introducidas de México. México D.F.: Conacofi.
Sánchez-Ramos, L. E., Gordillo-Martínez, A., Gutiérrez-Arellano, C. R., Kobelkowsky-Vidrio, T., Ríos-Muñoz, C. A. y Navarro-Sigüenza, A. G. (2018). Bird diversity patterns in the Nuclear Central American Highlands: a conservation priority in the Northern Neotropics. Tropical Conservation Science, 11, 1940082918819073. https://doi.org/10.1177/1940082918819073
Savage, J. M. (1982). The enigma of the Central American herpetofauna: dispersals or vicariance? Annals of the Missouri Botanical Garden Press, 69, 464–547. https://doi.org/10.2307/2399082
Stanton, R. L., Morrissey, C. A. y Clark, R. G. (2018). Analysis of trends and agricultural drivers of farmland bird declines in North America: A review. Agriculture, Ecosystems & Environment, 254, 244–254. https://doi.org/10.1016/j.agee.
2017.11.028
Szentes, S., Sutyinszki, Z., Szabó, G., Zimmermann, Z., Házi, J., Wichmann, B. et al. (2012). Grazed Pannonian grassland beta-diversity changes due to C4 yellow bluestem. Central European Journal of Biology, 7, 1055–1065.
Valenzuela-Núñez, L. M., Mojica-Guerrero, A. S., González-Barrios, J. L. y Trucíos-Caciano, R. (2009). Evolución del matorral en el sur del Área Natural Protegida Sierra de Lobos, Guanajuato. Tecnociencia Chihuahua, 3, 131–137.
Vellend, M. (2010). Conceptual synthesis in community ecology. The Quarterly Review of Biology, 85, 183–206. https://doi.org/10.1086/652373
Vickery, P. D., Tubaro, P. L., Cardoso-da Silva, J. M., Peterjohn, B. G., Herkert, J. R. y Cavalcanti, R. B. (1999). Conservation of grassland birds in the Western Hemisphere. Studies in Avian Biology, 19, 2–26.
Wang, Y., Wang, J., Chen, C., Li, J. y Chu, J. (2019). Grazing plays an important role in structuring alpha and beta components of taxonomic, functional, and phylogenetic diversity in semiarid sandy land of northern China. Global Ecology and Conservation, 20, e00790. https://doi.org/10.1016/j.gecco.
2019.e00790
Weaver, T., Payson, E. M. y Gustafson, D. L. (1996). Prairie ecology —the shortgrass prairie. En F. B. Samson y F. L. Knopf (Ed.), Prairie Conservation. Washington D.C.: Island Press.
Wied, J. P., Perotto-Baldivieso, H. L., Conkey, A. A., Brennan, L. A. y Mata, J. M. (2020). Invasive grasses in South Texas rangelands: historical perspectives and future directions. Invasive Plant Science and Management, 13, 41–58.
Wiens, J. A. (1973). Pattern and process in grassland bird communities. Ecological Monographs, 43, 237–270. https://doi.org/10.2307/1942196
Wiken, E., Jiménez-Nava, F. y Griffith, G. (2011). North American terrestrial ecoregions —Level III. Montreal, Canada: Commission for Environmental Cooperation.
Wright, S. P. (1992). Adjusted p-values for simultaneous inference. Biometrics, 48, 1005–1013. https://doi.org/10.2307/2532694
Zar, J. H. (2010). Biostatistical analysis. Upper Saddle River, New Jersey: Pearson Education Inc.
Żmihorski, M., Pärt, T., Gustafson, T. y Berg, Å. (2016). Effects of water level and grassland management on alpha and beta diversity of birds in restored wetlands. Journal of Applied Ecology, 53, 587–595. https://doi.org/10.1111/1365-2664.12588