Héctor Alejandro Hernández-Castellanos a, *, Víctor Landa-Jaime a y Jesús Emilio Michel-Morfín b
a Universidad de Guadalajara, Centro Universitario de la Costa Sur, Departamento de Estudios para el Desarrollo Sustentable de Zonas Costeras, Gómez Farías Núm. 82, 48980 San Patricio-Melaque, Jalisco, México
b Universidad de Guadalajara, Centro Universitario de Ciencias Biológicas y Agropecuarias, Departamento de Ecología Aplicada, Camino Ramón Padilla Sánchez Núm. 2100, 45510 Zapopan, Jalisco, México
*Autor para correspondencia: hecalehercas96@gmail.com (H.A. Hernández-Castellanos)
Resumen
El archipiélago de Revillagigedo se ubica en el Pacífico este tropical y consta de 4 islas volcánicas, isla Clarión es la más occidental y remota de este parque marino de México. Esta región está influenciada por aguas frías provenientes de la corriente de California y aguas cálidas de la corriente Norecuatorial, lo que resulta en una zona de convergencia, con una alta biodiversidad marina. Clarión es una isla pequeña y distante, dominada por acantilados, con playas arenosas-rocosas en su cara sur, lo que se traduce en áreas poco accesibles para llevar a cabo investigaciones. El objetivo de esta contribución es dar a conocer una lista de especies de babosas marinas presentes en la isla. El estudio se llevó a cabo entre enero y marzo de 2023, y febrero-marzo de 2024, a través del muestreo continuo en playas, pozas intermareales y zonas arrecifales someras de la cara sur de la isla. En total, se registraron 14 especies de babosas marinas, 13 registros nuevos para esta isla y 5 para el archipiélago de Revillagigedo. Este estudio contribuye significativamente al conocimiento de la biodiversidad de las babosas marinas heterobranquias insulares del Pacífico tropical.
Palabras clave: Moluscos; Gasterópodos; Pacífico este tropical; Zona intermareal; Isla oceánica; Biodiversidad marina
New records of sea slugs (Gastropoda: Heterobranchia) from Clarion Island, Revillagigedo Archipelago, Mexico
Abstract
The Revillagigedo Archipelago is located on the East Tropical Pacific; it consists of 4 volcanic islands. Clarion Island is the most western and remote island of this marine national park. The region is influenced by the cold currents from California and the warm waters of the North Equatorial current, creating a convergence zone, with high marine biodiversity. Clarion is a small and distant island, dominated by high cliffs with rocky sandy beaches on the south side, with hard-to-access areas for research. The objective of this contribution is to provide a species list of the sea slugs present on the island. The study was performed from January to March 2023, and February to March 2024, through a continual survey of the beaches, intertidal pools and shallow reef areas in the south side of the island. In total, we recorded 14 species of sea slugs, 13 were new records for this island and 5 new records for the Revillagigedo Archipelago. This study significantly contributes to the knowledge of the biodiversity of island heterobranch sea slugs of the Tropical Pacific.
Keywords: Mollusks; Gastropods; Eastern Tropical Pacific; Intertidal zone; Oceanic island; Marine biodiversity
Introducción
El archipiélago de Revillagigedo es un conjunto de 4 islas de origen volcánico ubicadas en la ecorregión del Pacífico Transicional Mexicano. Se localiza en la zona de encuentro de las provincias Panámica, Californiana y de Cortés, en un área de convergencia de aguas frías provenientes de la corriente de California y aguas cálidas de la corriente Norecuatorial, lo que propicia valores altos de diversidad, tanto en tierra como en el océano (Conanp, 2018). Comprende, de mayor a menor tamaño, a las islas Socorro, Clarión, San Benedicto y el islote Roca Partida.
Clarión es la isla más occidental del Archipiélago (18°21’ N, 114°45’ O) (fig. 1A). Se ubica a 390 km al oeste de isla Socorro, 707 km al suroeste de Baja California Sur (Cabo San Lucas) y 1,100 km al oeste de Colima (Manzanillo) (Conanp, 2018). Comprende un área de 1,925 ha, 8.5 km de largo y 3.6 km de ancho y su punto más alto es el monte Gallegos (335 m snm; fig. 1A). En la zona oceánica predomina la influencia de las corrientes de California y la corriente Norecuatorial, con temperaturas del agua entre 20 y 28 °C. Presenta un régimen de mareas de tipo semidiurno, con oleaje alto y periodicidad de surgencias estacionales (Conanp, 2018). La costa de la isla está conformada por acantilados de entre 3 y 250 m de alto en sus lados norte, este y oeste, mientras que en la porción sur se localizan 3 playas arenosas, separadas entre ellas por formaciones rocosas. Estas playas se extienden por 2.5 km aproximadamente, lo que constituye 10% del litoral de la isla (Conanp, 2018; Holroyd y Trefy, 2010).
Las babosas marinas son moluscos de la subclase Heterobranchia, clase Gastropoda, que suelen presentar las branquias y el intestino en la parte posterior del cuerpo, proceso que ocurre en fases tempranas del desarrollo, además de carecer de concha externa en su mayoría (salvo algunas especies que poseen una pequeña concha, interna o externa) (Behrens et al., 2022; Hermosillo-González, 2006). Habitan en todos los océanos, desde la zona intermareal hasta las ventilas hidrotermales. La mayoría de especies son bentónicas, aunque algunas se adaptaron a vivir en la zona pelágica y unas pocas pueden ser encontradas en agua salobre (Camacho-García et al., 2005). Su tamaño va desde los 3 a los 1,000 mm en algunas especies, como es el caso de Aplysia vaccaria (Winkler, 1955) (Behrens et al., 2022; Camacho-García et al., 2005; Hermosillo et al., 2006). A excepción de los órdenes Aplysiida, algunos Cephalaspidea y el superorden Sacoglossa (cuyas dietas se basan en algas), todas las especies se consideran carnívoras (Behrens et al., 2022). Todas las babosas marinas heterobranquias son hermafroditas y se reproducen sexualmente (Behrens et al., 2022; Camacho-García et al., 2005; Hermosillo et al., 2006). Para el Pacífico este, se tienen descritas alrededor de 360 especies con algunas más en proceso de descripción (Behrens et al., 2022).
En el Pacífico este tropical (PET) se han llevado a cabo importantes estudios sobre la riqueza y distribución de este grupo de moluscos. La guía de campo de babosas marinas del PET de Camacho-García et al. (2005) describe 163 especies bentónicas. Behrens y Hermosillo (2005) y Gosliner (2010) reportaron 122 especies para las costas de California. Por su parte, la guía de babosas marinas del Pacífico de Hermosillo et al. (2006) contempla 234 especies para el litoral mexicano y es el trabajo más completo para esta región.
Las regiones insulares del PET han sido estudiadas por diferentes autores. Kaiser (1997) registra 54 especies para las islas Galápagos, Ecuador. Kaiser y Bryce (2001) registraron 27 especies en la isla de Malpelo, Colombia. Para el atolón francés de Clipperton, Kaiser (2007) registra la presencia de 35 especies. Finalmente, García-Méndez y Camacho-García (2016) incrementan en 13 el número de especies de babosas marinas en isla del Coco, Costa Rica, para compilar un total de 40 especies. En la península de Baja California destaca el trabajo de Sánchez-Ortíz (2000), quien registra 45 especies para las islas cercanas a Loreto y las localidades de La Paz, Cabo San Lucas, isla Cedros y bahía Tortugas; en el mismo año, Millen y Bertsch (2000) describen 3 especies nuevas para la misma región. Hermosillo y Valdés (2008) describieron 2 especies nuevas para el PET. Ortea y Llera (1981) describieron una especie endémica para isla Isabel. Para Bahía de Banderas, Hermosillo (2006) registró 140 especies y para la región compartida entre Colima, Michoacán y Guerrero, 76 especies fueron reportadas (Hermosillo y Behrens, 2005). Hermosillo-González (2006) reconoce que el Pacífico Transicional Mexicano comparte especies, tanto con la provincia Panámica, como con la provincia de California.
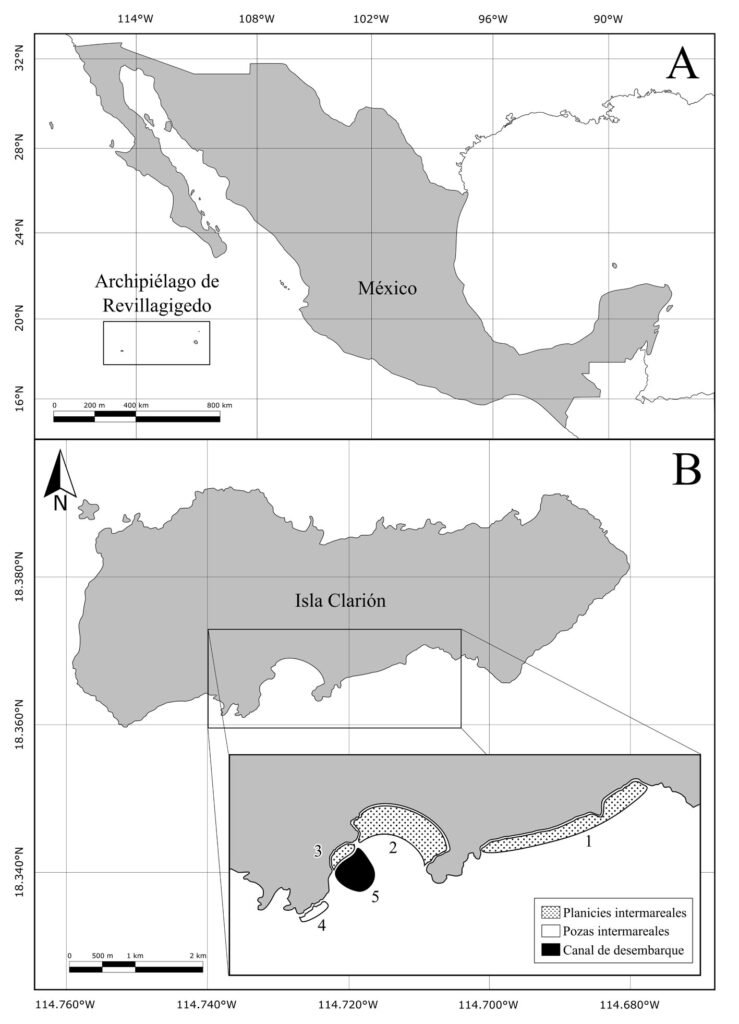
Figura 1. A, Ubicación de isla Clarión y el archipiélago de Revillagigedo en México; B, ubicación de los sitios de muestreo en isla Clarión: playa este (1), bahía Azufre (2), playa oeste (3), pozas intermareales (4) y canal de desembarque (5). Mapa por H. A. Hernández-Castellanos.
Por otra parte, los esfuerzos encaminados a incrementar el conocimiento de las babosas marinas en el archipiélago Revillagigedo han sido escasos. Hermosillo y Gosliner (2008) registraron 37 especies submareales para las 4 islas, sumando un total de 42 especies para este parque marino. En isla Socorro se obtuvo la mayor riqueza de especies, con 36 registros, mientras que fueron reportadas solamente 5 especies en isla Clarión. Behrens et al. (2009) describieron 1 especie nueva (Felimida socorroensis Behrens, Gosliner y Hermosillo, 2009) derivada del estudio de Hermosillo y Gosliner (2008).
El objetivo de este estudio fue incrementar el conocimiento sobre las babosas marinas del Pacífico de México al presentar nuevos registros para isla Clarión, derivados de observaciones realizadas en la zona intermareal y submareal somera, así como actualizar el número de estas especies de moluscos presentes en el archipiélago de Revillagigedo.
Materiales y métodos
Se realizaron observaciones en diferentes zonas de la porción sur de isla Clarión: en la zona intermareal de las playas, la zona de pozas intermareales y el canal de desembarque (fig. 1B). La porción sur es la única área del litoral de la isla por la cual se puede acceder de manera segura a la zona intermareal. Dentro de esta porción, se definieron 5 sitios principales de muestreo: 1) playa este, con una superficie de 17 ha, se compone de fragmentos de coral y arena, es una planicie de aproximadamente 150 m de ancho en su parte más amplia, que queda expuesta durante la bajamar y en la cual hay algunas rocas y cabezas grandes de coral, así como pozas y canales intermareales; 2) bahía Azufre, se encuentra en el centro de la cara sur de la isla y se drena casi por completo durante la bajamar, exponiendo 19 ha de litoral conformado por sustrato arenoso en el centro, rocas en los extremos este y oeste, y canales y pozas intermareales en el centro-sur (fig. 2). En la entrada de la bahía se encuentra el área con mayor cobertura de arrecife de coral del archipiélago (Ketchum y Reyes-Bonilla, 2009), el cual queda parcialmente expuesto durante la bajamar; 3) playa oeste: se encuentra en el extremo oeste de la bahía Azufre. Es la más pequeña de las 3 playas (0.7 ha) y consiste en una caleta independiente, adyacente al canal de desembarque. Se conforma principalmente de sustrato rocoso con algunos parches arenosos y rocas grandes sueltas. Al igual que las otras playas, durante la bajamar queda expuesta un área considerable, donde hay canales y pozas intermareales; 4) pozas intermareales, consisten en una serie de 3 pozas relativamente grandes (~ 50-170 m2 cada una) con comunicación intermitente con el océano. Se ubican debajo del “cerro del faro” y todas poseen profundidades entre 1 y 4 m, conteniendo sustrato rocoso y algunos parches arenosos; 5) canal de desembarque: consiste en una zanja tallada en el fondo rocoso-coralino, acondicionada por personal de la Marina mexicana para facilitar el desembarque en la isla. Tiene una longitud aproximada de 30 m y un ancho que va aumentando de 2 a 10 m conforme se aleja de la línea de costa. El sustrato es arenoso y rocoso, y se encuentra rodeado por arrecife coralino. La profundidad va de 20 cm a 10 m en la parte más alejada de tierra firme.
Los sitios de muestreo en intermareal somero fueron seleccionados por su accesibilidad durante los eventos de marea baja, al ser estos los momentos en los que se puede realizar una búsqueda activa de los especímenes en la zona. Por la misma razón, las búsquedas en el intermareal profundo se realizaron durante la pleamar, siendo éste el momento más accesible a estas zonas. Se llevaron a cabo 40 muestreos en la zona intermareal de las 3 playas arenosas-rocosas, el canal de desembarque y la zona de pozas intermareales adyacente al faro de la isla durante enero, febrero y marzo de 2023, y febrero y marzo de 2024. Para las playas este y oeste, bahía Azufre y la parte somera del canal de desembarque, se trazaron transectos de entre 80 y 350 m de longitud × 3 m de ancho (dependiendo de la morfología y extensión del sitio de muestreo), 2 h antes y 2 h después de la bajamar de las mareas vivas (3 días antes y 3 días después de las lunas nueva y llena), revisando exhaustivamente tanto en la superficie del sustrato como debajo de rocas y cabezas de coral sueltas, cada 2 a 5 m, aproximadamente. Para la zona de pozas intermareales y el canal de desembarque se realizó el mismo proceso 2 veces por semana, pero haciendo uso de equipo de buceo libre, entre 40 cm y 2 m de profundidad. Se seleccionaron horarios diurnos y vespertinos variables durante los eventos de marea alta, 2 h antes y 2 h después de la pleamar. Una vez localizado un organismo, se fotografió a detalle, mostrando tanto las características del ejemplar como de la fauna y flora acompañantes, así como el sustrato donde se encontró. Para ello, se utilizó una cámara Olympus Tough TG6 con el modo “Macro-Microscope”, con un aumento entre 2.9x y 11x. La profundidad donde se encontró cada organismo fue registrada con el profundímetro integrado en la cámara, el cual cuenta con una precisión de 10 cm. Se tomaron numerosas fotografías de cada ejemplar, las cuales fueron almacenadas y posteriormente revisadas a detalle. Todas las fotografías fueron tomadas por el primer autor de este estudio.
De acuerdo con los lineamientos consignados en el Programa de Manejo del Parque Nacional Archipiélago de Revillagigedo (Conanp, 2018), ningún ejemplar fue recolectado, manipulado o extraído de su hábitat para este estudio, por lo que la identificación de los ejemplares se realizó mediante las fotografías obtenidas, la observación posterior y la comparación de caracteres morfológicos (como la coloración principal del manto, rinóforos y branquias, así como la presencia o ausencia de estructuras [ceratas, apéndices] y marcas o patrones de coloración) con las guías de identificación disponibles para esta zona geográfica, así como listados históricos (Behrens et al., 2022; Camacho-García et al., 2005; Hermosillo y Gosliner, 2008; Hermosillo et al., 2006). La validez taxonómica que se presenta para cada una de las especies y géneros fue revisada de acuerdo con el World Register of Marine Species (WoRMS Editorial Board, 2024), así como con la autoridad taxonómica. El arreglo taxonómico desde orden y superorden hasta la especie fue el utilizado por Behrens et al. (2022) y por Bouchet et al. (2017).

Figura 2. Comparación de la bahía Azufre durante la altamar (A) y la bajamar (B).
Resultados
Se registraron 143 ejemplares de moluscos gasterópodos de la subclase Heterobranchia pertenecientes a 14 especies, en los 5 sitios del intermareal de isla Clarión.
Phylum Mollusca Linnaeus, 1758
Clase Gastropoda Cuvier, G. 1795
Subclase Heterobranchia (Burmeister y Hermann, 1837)
Orden Cephalaspidea P. Fischer, 1883
Familia Aglajidae Pilsbry, 1895
Navanax aenigmaticus (Bergh, 1893). Fig. 3A.
Material examinado: 17 ejemplares.
Descripción. Concha interna. El cuerpo es café con manchas color crema y puede variar a rosa fuerte o café claro. Tiene una serie de puntos azul turquesa a lo largo del margen interior de los parapodios. La parte ventral del cuerpo es negra con puntos amarillos y blancos y alcanza los 75 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Todos los organismos fueron observados debajo de rocas, sobre sustrato arenoso y rocoso en las 3 playas y el canal de desembarque, a profundidades de entre 10 cm y 2 m de profundidad.
Distribución. Desde San Diego, California, Bahía Vizcaíno, Baja California, México, a Panamá; islas Galápagos, Ecuador, este y oeste del Atlántico tropical (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. Visto en pareja en una ocasión. Seis variedades fueron identificadas gracias a las diferencias en la pigmentación (coloración y patrones), se clasificaron como marrón, café claro, café oscuro, negro, oliva y ocre (material suplementario: fig. S1). Carece de rádula. Se alimenta de otras babosas marinas heterobranquias, como notaspídeos y nudibranquios (Behrens et al., 2022).
Familia Haminoeidae Pilsbry, 1895
Haminoea virescens (G. B. Sowerby II, 1833). Fig. 3B.
Material examinado: 1 ejemplar.
Descripción. Concha expuesta, verde, con la espira hundida (material suplementario: fig. S2). Diferente de H. vesicula en la abertura mayor. Cuerpo verde con puntos amarillos en el escudo cefálico y manchas amarillo y blanco en los parapodios. Llega a medir 45 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Observado después del atardecer y sobre sustrato arenoso en la Bahía Azufre, aproximadamente a 15 cm de profundidad.
Distribución. Desde Alaska, EUA, hasta Panamá (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión y el Archipiélago. Habita en áreas rocosas intermareales en marea baja.
Superorden Sacoglossa Ihering, 1876
Familia Caliphyllidae Tiberi, 1881
Cyerce orteai Valdés y Camacho-García, 2000. Fig. 3C.
Material examinado: 68 ejemplares.
Descripción. El color varía desde crema pálido con algunas incrustaciones blancas, hasta verde oliva con puntos verde claro y café. La cabeza tiene puntos blancos opacos y un par de áreas color crema claro alrededor de los ojos. Los rinóforos y tentáculos orales apuntan hacia adelante. Las ceratas son grandes, redondas e infladas, cubiertas de tubérculos. Alcanza los 20 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Se observó en las 3 playas y el canal de desembarque, entre 5 y 50 cm de profundidad, sobre sustrato arenoso, rocoso y entre la vegetación y fragmentos de coral. Ocasionalmente en parejas y/o acompañada de masas ovígeras (material suplementario: fig. S3).
Distribución. Desde La Paz, Baja California, hasta Costa Rica, Hawaii y Okinawa (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión y el archipiélago. Hermosillo et al. (2006) mencionan que esta especie es de hábitos nocturnos y se alimenta del alga Halimeda. Fue la especie más abundante en este estudio. C. orteai ha sido registrada previamente en Baja California Sur, Costa Rica y en la isla de Oahu (Hawaii) (Behrens et al., 2022; Hermosillo et al., 2006; Valdés y Camacho-García, 2000). Sin embargo, no había sido observada en el archipiélago Revillagigedo, a pesar de encontrarse en el mismo corredor biogeográfico.
Polybranchia mexicana Medrano, Krug, Gosliner, Biju Kumar y Valdés, 2018. Fig. 3D.
Material examinado: 1 ejemplar.
Descripción. Cuerpo translúcido variable del amarillo al verde claro, con pequeños lunares blancos. Los rinóforos bifurcados están orientados al frente. Las ceratas tienen pequeñas manchas negras y las glándulas digestivas son visibles. Los rinóforos no poseen papilas. Llega a medir 12 mm (Behrens et al., 2022).
Ecología y hábitat. Observada a 1.5 m de profundidad en la zona de pozas intermareales.
Distribución. Desde el sur de Baja California Sur, México, hasta las islas Galápagos (Medrano et al., 2018).
Observaciones. Nuevo registro para isla Clarión y el archipiélago. Especie descrita recientemente por Medranoet al.(2018). Anteriormente pertenecía al complejo de especies dentro de P. viridis. Se trata de una especie nocturna con la capacidad de autotomizar sus ceratas cuando es molestada.
Orden Aplysiida [= Anaspidea] P. Fischer, 1883
Familia Aplysiidae Lamarck, 1809
Dolabella cf. auricularia (Lighfoot, 1786). Fig. 3E.
Material examinado: 1 ejemplar.
Descripción. La parte posterior del cuerpo forma un disco en diagonal, con papilas en toda la orilla y un sifón exhalante en el centro (material suplementario: fig. S4). Es de color muy variable, pero usualmente presenta tonos moteados de verde o café, lo que le da un muy buen camuflaje. Produce tinta cuando es molestada. Alcanza 500 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Solo fue observada en una ocasión, a 1.5 m de profundidad en una de las pozas intermareales, parcialmente enterrada en sustrato arenoso.

Figura 3. Babosas marinas heterobranquias de isla Clarión, archipiélago de Revillagigedo, observadas en este estudio (Cephalaspidea, Sacoglossa y Aplysiida). La talla aproximada se encuentra entre paréntesis.A, Navanax aenigmaticus (35 mm); B, Haminoea virescens (15 mm); C, Cyerce orteai (40 mm); D, Polybranchia mexicana (10 mm); E, Dolabella cf. auricularia (90 mm); F, Stylocheilus ricketsii (35 mm).
Distribución. Especie circumtropical (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. Es citada como especie nocturna. Rara vez observada durante el día, aunque en este estudio se observó alrededor de las 10:00 h. Behrens et al. (2022) consideran que existe evidencia de que D. cf. auricularia es en realidad un complejo de varias especies no descritas en su totalidad; a la fecha de realización de esta contribución, el nombre Dolabella. cf. auricularia es válido para esta especie.
Stylocheilus ricketsii (MacFarland, 1966). Fig. 3F.
Material examinado: 3 ejemplares.
Descripción. Cuerpo alargado y pequeño en comparación con otras especies de la misma familia. Líneas oscuras irregulares longitudinales, con puntos azules dispersos. Posee apéndices ramificados por todo el cuerpo, así como una pequeña joroba y cola alargada. Alcanza 65 mm y libera tinta cuando es molestada (material suplementario: fig. S5) (Behrens et al., 2022).
Ecología y hábitat. Observado debajo de rocas en sustrato arenoso con presencia de algas del género Halimeda.
Distribución. Desde Baja California, México, hasta las islas Galápagos (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. Especie críptica, difícil de ver entre las algas del fondo.
Orden Pleurobranchida [Pleurobranchoidea] Gray, 1827
Familia Pleurobranchidae Gray, 1827
Berthella martensi (Pilsbry, 1896). Fig. 4A.
Material examinado: 1 ejemplar.
Descripción. Variable en su coloración, desde blanco a anaranjado y marrón intenso. Branquia bajo el manto en el lado derecho del cuerpo. Esta especie tiene lunares característicos más oscuros que el cuerpo y frecuentemente una banda oscura en la orilla del manto y pie. Alcanza 70 mm de longitud total (Behrens et al., 2022).
Ecología y hábitat. Solo fue observada una vez, a 1.5 m de profundidad en el canal de desembarque, bajo una roca grande en sustrato rocoso.
Distribución. Desde Las Arenas, Baja California, hasta Panamá; también citada para el Indopacífico (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. Al igual que otras especies de babosas, esta especie tiene la capacidad de autotomizar partes de su manto cuando es molestada.
Berthella grovesi Hermosillo y Valdés, 2008. Fig. 4B.
Material examinado: 1 ejemplar.
Descripción. El cuerpo es ovalado. El manto sobresale el ancho del pie, cubriendo completamente las branquias, el velo bucal y los rinóforos parcialmente. Estos últimos son enrollados, cortos, robustos y unidos basalmente. El pie es bilabiado. El color del fondo varía de un marrón rosado claro a uno más oscuro. Esta especie llega a medir 30 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Solo fue observada una vez bajo una roca pequeña sobre sustrato rocoso en la playa oeste, a 10 cm de profundidad.
Distribución. Registrada en isla Isabel y Bahía de Banderas, México y Panamá (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión y el archipiélago. Se encuentra bajo rocas en la zona intermareal y submareal somero. Esta es la observación más alejada del litoral continental publicada hasta ahora (707 km al suroeste de Baja California Sur y 1,100 km al oeste de Colima), reportada previamente en isla Isabel, Nayarit; en el Parque Nacional Coiba en Panamá y en el litoral continental mexicano (Bahía de Banderas en Jalisco-Nayarit, Manzanillo en Colima y Caleta de Campos en Michoacán) (Behrens et al., 2022; Hermosillo et al., 2006; Hermosillo y Valdés, 2008).
Berthella cf. agassizii (MacFarland, 1909). Fig. 4C.
Material examinado: 2 ejemplares.
Descripción. El cuerpo es translúcido y va del rosa a café claro, en ocasiones con puntos blancos dispersos. Los rinóforos están enrollados y la superficie dorsal se aprecia arrugada. Alcanza 12 mm (Behrens et al., 2022).
Ecología y hábitat. Solo observada en una ocasión, a 80 cm de profundidad en el canal de desembarque, debajo de una roca grande en sustrato rocoso.
Distribución. En el océano Pacífico, desde Punta Eugenia, Baja California, hasta Panamá. En el océano Atlántico, desde el mar Caribe hasta Santa Catarina, Brasil (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. De acuerdo con Behrens et al. (2022), B. agassizii fue descrita originalmente para Brasil. Dado el distanciamiento geográfico, diferencias en tamaño, color y tracto reproductivo entre ambas especies (Pacífico y Atlántico), se consideran especies distintas (Alvim y Pimienta, 2015). Sin embargo, a la fecha de escritura de este documento, Berthella cf. agassizii es un nombre válido para la especie observada.
Orden Nudibranchia Cuvier, 1817
Familia Dendrodorididae O’Donoghue, 1924
Dendrodoris cf. fumata (Rüpell y Leuckart, 1831). Fig. 5A, B.
Material examinado: 21 ejemplares.
Descripción. Típico nudibranquio dórido, tiene el manto altamente ondulado. Se reconocen 3 variaciones de color: cuerpo negro aterciopelado con una línea roja en el margen, cuerpo blanquecino translúcido y cuerpo anaranjado o rojo. Todas las variaciones presentan puntas blancas en los rinóforos y en la pluma branquial, que es de gran tamaño. Alcanza una longitud total corporal de 30 mm (Behrens et al., 2022).
Ecología y hábitat. Se observó en las 3 playas en sustrato rocoso, arenoso y en zonas con coral, entre 10 y 50 cm de profundidad. Se identificaron las 3 coloraciones descritas para esta especie, además de la coloración propia de los juveniles: rojo (juvenil), negro, rojinegro y blanco, siendo este último el más abundante (material suplementario: fig. S6). En ocasiones fue visto en pareja.

Figura 4. Babosas marinas heterobranquias de isla Clarión, archipiélago de Revillagigedo, observadas en este estudio (Pleurobranchida). La talla aproximada se encuentra entre paréntesis.A, Berthella martensi (35 mm); B, Berthella grovesi (30 mm); C, Berthella cf. agassizii (15-20 mm).
Distribución. Desde bahía Vizcaíno, Baja California, hasta Costa Rica, Panamá y las islas Galápagos, Ecuador (Behrens et al., 2022).
Observaciones. Fue el nudibranquio más abundante, así como la única especie de este estudio reportada previamente para isla Clarión (Hermosillo y Gosliner, 2008). Nombrada así por el color de la variación oscura. Según Behrens et al. (2022), D. fumata es una especie ampliamente distribuida en el Indopacífico, genéticamente distinta a la presente en el Pacífico este tropical. Sin embargo, Dendrodoris cf. fumata es un nombre válido para esta especie a la fecha de escritura de este documento (Behrens et al., 2022; Valdés, Á., com. pers., 13 de julio de 2023).
Dendrodoris nigromaculata (Cockerell, 1905). Fig. 5C.
Material examinado: 2 ejemplares.
Descripción. Tiene el cuerpo alargado con márgenes ondulados. Su color va de blanco a crema con una serie de manchas de color chocolate o marrón de diferentes tamaños y cantidades. Las manchas se observan en 3 grupos, uno justo detrás de los rinóforos, otro en la parte central del cuerpo y una más anterior a la branquia, la cual es de color blanco o crema (al igual que los rinóforos). Alcanza una longitud corporal de 27 mm (Behrens et al., 2022).
Ecología y hábitat. Se registró en la playa oeste en sustrato rocoso, entre 10 y 20 cm de profundidad.
Distribución. Carmel, California; isla Guadalupe y las islas San Benito, Baja California (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión y el archipiélago. Los ejemplares fueron registrados en el intermareal y submareal somero. Este es el registro más meridional para esta especie, ya que anteriormente había sido registrada hasta las islas San Benito, Baja California (Behrens et al., 2022; Camacho-García et al., 2005; Goddard y Valdés, 2015; Hermosillo et al., 2006; Millen y Bertsch, 2005). Esta observación amplía su distribución y agrega a esta especie a la provincia del Pacífico Transicional Mexicano.

Figura 5. Babosas marinas heterobranquias de isla Clarión, archipiélago de Revillagigedo, observadas en este estudio (Nudibranchia). La talla aproximada se encuentra entre paréntesis.A, Dendrodoris cf. fumata var.blanca(25 mm); B, D. cf. fumata var. negra (30 mm); C, Dendrodoris nigromaculata (30 mm); D, Chromolaichma sedna (40 mm); E, Anteaeolidiella ireneae (30 mm); F, Anteaeolidiella lurana (10 mm).
Familia Chromodorididae Bergh, 1891
Chromolaichma sedna (Ev. Marcus & Er. Marcus, 1967). Fig. 5D.
Material examinado: 17 ejemplares.
Descripción. El cuerpo es de color blanco, con una banda amarilla delgada y otra de color rojo brillante, un poco más ancha rodeando el manto, el pie y la cola. Los rinóforos y branquias son blancos con puntas rojas (material suplementario: fig. S7B). Alcanza 65 mm de longitud (Behrens et al., 2022).
Ecología y hábitat. Observada en las playas este y oeste, entre 5 y 15 cm de profundidad, siempre bajo rocas en sustrato rocoso y arenoso.
Distribución. Desde el golfo de California y el Pacífico mexicano, hasta Panamá, Colombia, Ecuador y el Caribe (Behrens et al., 2022).
Observaciones. Nuevo registro para isla Clarión. Especie gregaria que se alimenta de esponjas. Observada en cópula en una ocasión (fig. S7A). Su coloración brillante es probablemente aposemática (Behrens et al., 2022).
Familia Aeolidiidae Gray, 1827
Anteaeolidiella ireneae Carmona, Bhave, Salunkhe, Pola, Gosliner y Cervera, 2014. Fig. 5E.
Material examinado: 7 ejemplares.
Descripción. El cuerpo es de color blanco translúcido, con pigmentación naranja dispersa sobre la espalda. Hay una línea blanca irregular desde la cabeza, que inicia entre los rinóforos y se extiende en forma de lágrima sobre el pericardio. Esta línea continua como varias manchas en forma de diamante de pigmento blanco o amarillo pálido a lo largo de la línea media. Los rinóforos y los tentáculos orales son de color naranja con puntas blancas. Las ceratas son largas y cilíndricas con puntas redondeadas, y se extienden desde la parte trasera de los rinóforos hasta la cola, dejando una zona desnuda sobre el dorso; son de color naranja brillante o gris oscuro, con una banda blanca y una punta blanca, y están dispuestas en hasta 36 filas, con hasta 12 ceratas en las filas anteriores y tan solo 4 en las últimas filas. Alcanza una longitud total de 12 mm (Behrens et al., 2022; Carmona et al., 2014).
Ecología y hábitat. Registrada en las playas este y oeste, bajo fragmentos de coral grandes y sobre sustrato rocoso, entre 5 y 20 cm de profundidad.
Distribución. En el Pacífico oriental. Ha sido registrada en México, Costa Rica y Panamá (Carmona et al., 2014).
Observaciones. Nuevo registro para isla Clarión. Esta especie fue descrita a partir de especímenes recolectados bajo coral suelto y arena en isla Clipperton. Recientemente, A. indica atravesó por una reestructuración taxonómica, pasando de ser una especie con una distribución circumtropical, a 8 nuevas especies. A. ireneae se distribuye en Clipperton, Revillagigedo, Panamá y Costa Rica (Behrens et al., 2022; Carmona et al., 2014).
Anteaeolidiella lurana (Ev. Marcus et Er. Marcus, 1967). Fig. 5F.
Material examinado: 2 ejemplares.
Descripción. Cuerpo delgado y alargado, con una cola relativamente corta. El cuerpo es de color blanco traslúcido, con una mancha en forma de herradura en la cabeza y que se extiende desde la base de los rinóforos hasta la base de los tentáculos orales. Posee 2 líneas onduladas anaranjadas discretas, que se extienden desde la parte posterior de la cabeza hasta encontrarse en la cola, formando diamantes blancos entre ellas. Los rinóforos y los tentáculos orales poseen pigmentación naranja en su base. Las ceratas son largas y más gruesas en la parte superior. Se extienden desde la parte posterior de los rinóforos hasta la cola. El epitelio de las ceratas está cubierto con pigmento naranja difuminado. Alcanza 12 mm de longitud (Carmona et al., 2014).
Ecología y hábitat. Observada en el canal de desembarque a 10 cm de profundidad.
Distribución. Posee una amplia distribución circumtropical: península de Yucatán y mar Caribe hasta Brasil; mar Mediterráneo y las islas Canarias; Australia (Carmona et al., 2014). En el Pacífico oriental ha sido registrada en el archipiélago de Revillagigedo (isla Socorro) y Bahía de Banderas, Nayarit, México (Carmona et al., 2014).
Observaciones. Nuevo registro para isla Clarión. Observada junto a masas ovígeras. Al igual que A. ireneae, esta especie fue recientemente separada de A. indica (Carmona et al., 2014).
Discusión
Todas las especies reportadas en este estudio constituyen nuevos registros para isla Clarión, a excepción de D. cf. fumata, que había sido previamente citada por Hermosillo y Gosliner (2008). Además, de las 14 especies observadas en este estudio, 5 representan registros nuevos para todo el archipiélago Revillagigedo (H. virescens, P. mexicana, C. orteai, B. grovesi y D. nigromaculata) (tabla 1). Este estudio incrementa de manera notable el conocimiento de las especies de babosas marinas de la zona intermareal en isla Clarión y el archipiélago de Revillagigedo. Constituye el primero de su tipo para isla Clarión y complementa el trabajo desarrollado por Hermosillo y Gosliner (2008), el cual se enfocó principalmente en especies de la zona submareal.
Con los registros nuevos presentados en esta investigación, se incrementa el número de babosas marinas de 42 a 47 especies para el Parque Nacional Archipiélago de Revillagigedo, y de 5 a 18 especies para isla Clarión. Esta riqueza de especies de babosas marinas en el archipiélago es equiparable a la riqueza registrada en otras islas y archipiélagos del PET, como isla Clipperton, Francia (Kaiser, 2007), isla del Coco, Costa Rica (García-Méndez y Camacho-García, 2015), isla de Malpelo, Colombia (Kaiser y Bryce, 2001) y las islas Galápagos, Ecuador (Kaiser, 1997) (tabla 2). No obstante, será necesario llevar a cabo estudios similares en las otras islas del archipiélago y a profundidades mayores a las de la zona submareal para conocer de mejor manera la biodiversidad de este grupo taxonómico en la región. De la misma manera, es importante complementar esta contribución con estudios moleculares para confirmar algunas de las incertidumbres taxonómicas actuales y poder realizar estudios de filogeografía y conectividad en el Pacífico este tropical. Además, es necesario incrementar el esfuerzo de estudio en las otras islas y zonas continentales del Pacífico de México.
Dedicar esfuerzos para incrementar el conocimiento de grupos de invertebrados poco estudiados en el archipiélago permitirá contar con una línea base más completa de la biodiversidad de este parque nacional y brindará elementos para determinar la efectividad de las medidas de manejo que buscan la protección de esta importante zona marina, considerada patrimonio de la humanidad (UNESCO, 2016). Finalmente, la ubicación del archipiélago, así como el hecho de ser la isla más alejada del territorio mexicano convierte a isla Clarión en un importante punto de investigación y un laboratorio natural para observar y comprender diferentes procesos ecológicos.
Agradecimientos
A la Secretaría de Marina y al Grupo de Ecología y Conservación de Islas por el apoyo logístico durante el viaje y la estancia en isla Clarión. A Ángel Valdés y a Alicia Hermosillo por su valioso apoyo en la identificación de algunos ejemplares y facilitar material bibliográfico. A los estudiantes de la licenciatura en Biología Marina de la Universidad de Guadalajara, Joshua Martín y Lizely Estrada por su colaboración en el trabajo de campo, y finalmente a la bióloga Elizabeth Piña Vera por su compañía y apoyo durante todo el proceso de elaboración de este trabajo.
Referencias
Alvim, J. y Pimienta, A. D. (2015). Taxonomic review of Berthella and Berthellina (Gastropoda: Pleurobranchoidea) from Brazil, with description of two new species. Zoologia, 32, 497–531. https://doi.org/10.1590/S1984-46702015000600010
Behrens, D. W., Fletcher, K., Hermosillo, A. y Jensen, G. C. (2022). Nudibranch and sea slugs of the Eastern Pacific. Bremerton, Washington: MolaMarine.
Behrens, D. W., Gosliner, T. M. y Hermosillo, A. (2009). A new species of dorid nudibranch (Mollusca) from the Revillagigedo Islands of the Mexican Pacific. Proceedings of the California Academy of Sciences, 4, 423–429.
Bouchet, P., Rocroi, J. P., Hausdorf, B., Kaim, A., Kano, Y., Nützel, A. et al. (2017). Revised classification, nomenclator and typification of gastropod and monoplacophoran families. Malacologia, 61, 1–526. https://doi.org/10.4002/040.061.0201
Camacho-García, Y. (2009). Benthic opisthobranchs. En I. S. Wehrtmann y J. Cortés (Eds.), Marine biodiversity of Costa Rica, Central America (pp. 371–386). Berlín: Springer Science and BussinesMedia. https://doi.org/10.1007/978-1-4020-8278-8_33
Camacho-García, Y., Gosliner, T. M. y Valdés, A. (2005). Guía de campo de las babosas marinas del Pacífico este tropical. San Francisco, CA: California Academy of Sciences.
Carmona, L., Bhave, V., Salunkhe, R., Pola, M., Gosliner, T. y Cervera, J. L. (2014). Systematic review of Anteaeolidiella (Mollusca, Nudibranchia, Aeolidiidae) based on morphological and molecular data, with a description of three new species. Zoological Journal of the Linnean Society, 171, 108–132. https://doi.org/10.1111/zoj.12129
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2018). Programa de Manejo Parque Nacional Revillagigedo. Ciudad de México: Secretaría de Medio Ambiente y Recursos Naturales.
García-Méndez, K. y Camacho-García, Y. E. (2016). New records of heterobranch sea slugs (Mollusca: Gastropoda) from Isla del Coco National Park, Costa Rica. Revista de Biología Tropical, 64, 205–219. https://doi.org/10.15517/rbt.v64i1.23449
Goddard, J. H. R. y Valdés, A. (2015). Reviving a cold case: two northeastern Pacific dendrodorid nudibranch reassessed (Gastropoda: Opisthobranchia). The Nautilus, 129, 31–42.
Gosliner, T. M. (2010). Two new species of nudibranch mollusks from the coast of California. Proceedings of the California Academy of Sciences, Ser., 4, 61, 623–631.
Hermosillo, A. y Behrens, D. W. (2005). The opisthobranch fauna (Gastropoda, Opistobranchia) of the Mexico states of Colima, Michoacán and Guerrero: filling in the faunal gap. Vita Malacológica, 3, 11–22.
Hermosillo, A., Behrens, D. W. y Ríos-Jara, E. (2006). Opistobranquios de México. Guía de babosas marinas del Pacífico, golfo de California y las islas oceánicas. Guadalajara, Jalisco: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Universidad de Guadalajara.
Hermosillo, A. y Gosliner, T. M. (2008). The opisthobranch fauna of the Archipiélago de Revillagigedo, Mexican Pacific. The Festivus, 40, 25–34.
Hermosillo, A. y Valdés, A. (2008). Two new species of opisthobranch mollusks from the Tropical Eastern Pacific. Proceedings of the California Academy of Sciences, Ser., 4, 59, 521–532.
Hermosillo-González, A. (2006). Ecología de los opistobranquios (Mollusca) de Bahía de Banderas, Jalisco-Nayarit, México (Tesis doctoral). Centro Universitario de Ciencias Biológicas y Agropecuarias. Posgrado en Ciencias Biológicas. Universidad de Guadalajara. Guadalajara, Jalisco.
Holroyd, G. L. y Trefry, H. E. (2010). The importance of Isla Clarión, Archipelago Revillagigedo, Mexico, for green
turtle (Chelonia mydas) nesting. Chelonian Conservation and Biology, 9, 305–309. https://doi.org/10.2744/CCB-0831.1
Kaiser, K. L. (1997). The recent molluscan marine fauna of the Islas Galapagos. The Festivus, XXIX (Supl.), 1–67. https://doi.org/10.5962/bhl.title.129924
Kaiser, K. L. (2007) The recent molluscan fauna of Île Clipperton (Tropical Eastern Pacific). The Festivus, XXXIX (Supl.), 1–162. https://doi.org/10.5962/bhl.title.129868
Kaiser, K. L. y Bryce, C. W. (2001) The recent molluscan marine fauna of Isla Malpelo, Colombia. The Festivus, XXXIII (Occasional paper 1), 1–49.
Ketchum, J. T. y Reyes-Bonilla, H. (2009). Taxonomía y distribución de los corales hermatípicos (Scleractinia) del archipiélago de Revillagigedo, México. Revista de Biología Tropical, 49, 803–848.
Medrano, S., Krug, P. J., Gosliner, T. M., Biju-Kumar, A. y Valdés, A. (2019). Systematics of Polybranchia Pease, 1860 (Mollusca: Gastropoda: Sacoglossa) based on molecular and morphological data. Zoological Journal of the Linnean Society, 186, 76–115. https://doi.org/10.1093/zoolinnean/zly050
Millen, S. V. y Bertsch, H. (2000). Three new species of dorid nudibranchs from Southern California, USA, and the Baja California Peninsula, Mexico. The Veliger, 43, 354–366.
Millen, S. V. y Bertsch, H. (2005). Two new species of porostome nudibranch (family Dendrodorididae) from the coast of California (USA) and Baja California (Mexico). Proceedings of the California Academy of Sciences, Ser. 4, 56, 189–199.
Ortea, J. y Llera, E. M. (1981). Un nuevo dórido (Mollusca: Nudibranchiata) de la Isla Isabel, Nayarit, México. Iberus, 1, 47–52.
Sánchez-Ortíz, C. A. (2000). Biodiversidad de moluscos opistobranquios (Mollusca: Opisthobranchiata), del Pacífico mexicano: isla Cedros, Vizcaíno e islas del golfo de California parte Sur. Universidad Autónoma de Baja California Sur. Informe final SNIB-Conabio proyecto Núm. L136. México D.F.
Valdés, A. y Camacho-García, Y. (2000). A new species of Cyerce Bergh, 1871 (Mollusca, Sacoglossa, Polybranchiidae)
from the pacific coast of Costa Rica. Bulletin of Marine Science, 66, 445–456.
UNESCO (2016). Lista del Patrimonio Mundial. United Nations Educational Scientific and Cultural Organization. Recuperado el 27 de enero, 2025 de: https://whc.unesco.org/es/list/1510
WoRMS Editorial Board (2024). World Register of Marine Species. Disponible en http://www.marinespecies.org