Gabriela Diaz a, b, *, Vanesa Pellegrini-Piccini a, Liliana Moreno d, Martín Palma c, e, Vanesa Bentancourt c y Valeria Corbalán f
a Universidad Nacional de Cuyo-Sede Malargüe, Campus Educativo Municipal, Facultad de Ciencias Exactas y Naturales, Rosario Vera Peñaloza y Beltrán, 5613 Malargüe, Mendoza, Argentina
b Universidad Nacional de Cuyo, Instituto de Ingeniería y Ciencias Aplicadas a la Industria-CONICET, Facultad de Ciencias Aplicadas a la Industria, Bernardo de Yrigoyen Núm. 375, 5600 San Rafael, Mendoza, Argentina
c Instituto de Educación Física Núm. 9-016 “Jorge E. Coll” Dirección General de Escuelas-Sede Malargüe, Tecnicatura en Conservación de la Naturaleza, Campus Educativo Municipal, Rosario Vera Peñaloza y Beltrán, 5613 Malargüe, Mendoza, Argentina
d Universidad Nacional de San Luis, Facultad de Química Bioquímica y Farmacia, Ejército de los Andes Núm. 950, 5700 San Luis, Argentina
e Ministerio de Ambiente y Desarrollo Sustentable de la Provincia de Mendoza, Dirección de Recursos Naturales Renovables, Delegación Malargüe, San Martín Norte Núm. 352, 5613 Malargüe, Mendoza, Argentina
f Instituto Argentino de Investigaciones de Zonas Áridas (CCT Mendoza-CONICET), Av. Ruiz Leal s/n, Parque Gral. San Martín, 5500 Mendoza, Argentina
*Autor para correspondencia: gdiaz@infoar.net (G. Diaz)
Recibido: 02 octubre 2023; aceptado: 15 agosto 2024
Resumen
La ranita del Pehuenche, Alsodes pehuenche, es endémica de los Andes centrales de Argentina y Chile, ha sido categorizada en peligro crítico por la UICN y entre sus amenazas se encuentran la ruta internacional que atraviesa los arroyos que habita, la presencia del hongo quitridio, los salmónidos exóticos invasores, el ganado y el cambio climático. El objetivo de este trabajo fue evaluar el estado actual de conservación de A. pehuenche en el valle Pehuenche para conocer tendencias poblacionales, el impacto de las amenazas y futuras acciones de manejo. Se realizaron 14 salidas de campo durante 3 temporadas (2021-2023) y se muestrearon 12 arroyos usando la técnica de encuentro visual nocturno. Se delimitaron y nombraron 7 subpoblaciones: Nacientes, del Límite, Pichintur, Rial Rojas, Nueva, Campanaria y Cajón Largo. Los resultados muestran conteos de adultos (5.82 en 200 m2 y 13.64 por hora) y de larvas (6.24 en 200 m2 y 17.76 por hora). Éstos no variaron significativamente entre temporadas, pero fueron mayores en enero y febrero. Con base en la conectividad y las amenazas, los índices del estado de conservación permiten priorizar las subpoblaciones como unidades de conservación, de las cuales la del Límite requiere esfuerzos más urgentes.
Palabras clave: Especie amenazada; Encuentro visual; Conectividad; Subpoblaciones; Priorización de conservación
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Population monitoring and conservation status of the Pehuenche frog (Alsodes pehuenche) in the valle Pehuenche, Mendoza, Argentina
Abstract
The Pehuenche spiny-chest frog, Alsodes pehuenche, is endemic to the Central Andes of Argentina and Chile. It has been categorized as critically endangered by the IUCN and its threats include the international road that crosses the streams inhabited by the species, the presence of the chytrid fungus, invasive exotic salmonids, livestock, and climate change. The objective of this work was to evaluate the current conservation status of A. pehuenche in the Pehuenche Valley as a basis for understanding population trends, the impact of threats, and future management actions. Fourteen field trips were conducted during 3 seasons (2021-2023) and 12 streams were sampled using the nocturnal visual encounter technique. Seven subpopulations were delimited and named: Nacientes, del Límite, Pichintur, Rial Rojas, Nueva, Campanaria, and Cajón Largo. The results show counts of adults (5.82 in 200 m2 and 13.64 per hour) and larvae (6.24 in 200 m2 and 17.76 per hour). These did not vary significantly between seasons but were higher in January and February. According to connectivity and threats, the conservation status indices allow us to prioritize the subpopulations as conservation units, with del Límite being the one that requires the most urgent efforts.
Keywords: Threatened species; Visual encounter; Connectivity; Subpopulations; Conservation prioritization
Introducción
Los anfibios son el grupo de vertebrados más amenazados de nuestro planeta, varias son las causas responsables de la disminución de sus poblaciones (Grant et al., 2020; Green et al., 2020; Luedtke et al., 2023). Más de 45% de la diversidad de anfibios del mundo se distribuyen en el Neotrópico (Kacoliris et al., 2022). Alrededor de 25% de las especies de Argentina son endémicas (Vaira et al., 2017), 37% de ellas en Argentina y Chile se encuentran en disminución, mientras que del 22% de las especies no se conoce su tendencia poblacional (Kacoliris et al., 2022). Las amenazas más importantes con las que se asocian la disminución poblacional o extinciones locales son los depredadores invasores, enfermedades emergentes y la ganadería (Kacoliris et al., 2022; Velasco et al., 2016).
La ranita del Pehuenche, Alsodes pehuenche, fue descrita por Cei (1976). Luego de estudios citogenéticos realizados entre 1983 y 2003 (Cuevas y Formas, 2003), se renueva el interés sobre la especie en Argentina debido a las obras viales sobre la ruta internacional ARG145 – CH115, cuya pavimentación desvió el curso de 5 afluentes del arroyo Pehuenche con presencia de la especie (Corbalán et al., 2010). La ranita del Pehuenche es una especie endémica y su distribución está restringida a los Andes centrales de Argentina y Chile (Corbalán et al., 2010, 2023; Correa et al., 2013, 2018, 2020). Habita arroyos de montaña en ecosistemas de vegas o mallines entre 2,150 y 2,825 m snm (Corbalán et al., 2023). Los arroyos poseen lechos pedregosos y una fina capa de sedimentos. La especie presenta dimorfismo sexual y como otras especies de Alsodes, tiene larvas de desarrollo prolongado con juveniles y adultos de hábitos acuáticos (Cei, 1976, 1980; Herrera y Velázquez, 2016a; Úbeda, 2021). Las larvas son de gran tamaño y pasan al menos 4 años en los cuerpos de agua permanentes hasta completar el ciclo larval (Corbalán et al., 2014). Se ha reportado la puesta de huevos ocultos bajo rocas o en oquedades en las márgenes de los arroyos (Corbalán et al., 2014; Piñeiro et al., 2020). Estas cavidades son utilizadas también como refugio por los adultos (Cei, 1980; Correa et al., 2013; Herrera y Velázquez, 2016b).
Los datos de conteos disponibles corresponden a muestreos de tramos cortos de arroyos en Argentina y Chile (Corbalán et al., 2010, 2023; Correa et al., 2013). La coexistencia de individuos en una cavidad durante el día sugiere densidades elevadas en una categoría de microhábitat (Correa et al., 2013). Han ocurrido eventos de mortalidad y se han reportado nuevas poblaciones (Corbalán et al., 2023; Correa et al., 2018), lo cual hace necesaria una evaluación actualizada de su estatus de conservación y tendencia poblacional.
Las evaluaciones del estado de conservación de la ranita del Pehuenche la han colocado en la categoría más alta de amenaza: “en peligro” por la Asociación Herpetológica Argentina (Vaira et al., 2012), cuarta en orden de prioridad entre los 58 anfibios evaluados de Chile (Vidal et al., 2024) y “en peligro crítico” por la Unión Internacional para la Conservación de la Naturaleza (IUCN, 2019), según los criterios B1ab basados en su extensión de presencia estimada y su disminución continua estimada, provocada principalmente por la pavimentación de la ruta. El área de ocupación de la especie (AOO sensu UICN) estimada actualmente es de 4.84 km2 y su extensión de presencia (EOO sensu UICN) 497.9 km2 (Corbalán et al., 2023). En cuanto a las amenazas consideradas en la categorización de IUCN (2019), se enumeran el desvío de los cursos de agua por la construcción de la ruta, el impacto del ganado, el cambio climático, la presencia del hongo quitridio (Batrachochytrium dendrobatidis) y la depredación por salmónidos exóticos invasores tales como la trucha arcoíris (Oncorhynchus mykiss)y trucha marrón (Salmo trutta) (Corbalán et al., 2023; Ghirardi et al., 2014; Zarco et al., 2020).
Si bien los avances en el conocimiento de la distribución de A. pehuenche han sido importantes en los últimos años, aún se desconocen aspectos básicos de la ecología, sistemática, reproducción, comportamiento y estrategias ecofisiológicas de esta especie en los humedales de altura. Por tratarse de una especie endémica y amenazada, la historia de vida y demografía son fundamentales para la evaluación del estatus de conservación (Luja et al., 2015). Los programas de seguimiento de poblaciones son necesarios para identificar y detectar disminuciones que amenacen la persistencia de poblaciones y deben llevarse a cabo en un marco de gestión adaptativa que permita realizar monitoreos que maximicen la detección y minimicen el esfuerzo (Pollock, 2006, Yoccoz et al., 2001). A su vez, la definición de subpoblaciones es una herramienta útil que permite definir su estado actual y priorizar acciones de conservación (Velasco, 2018).
El objetivo de este trabajo fue evaluar el estado de conservación actual de A. pehuenche en el valle Pehuenche. Esta información es fundamental para estimar tendencias poblacionales a largo plazo, evaluar el impacto de las amenazas y el éxito de futuras acciones de manejo. En este trabajo se muestran los primeros datos del programa de monitoreo iniciado en 2021 en el valle Pehuenche. A partir del mismo, se definen y delimitan subpoblaciones como unidades de conservación sobre las que se deben priorizar las acciones.
Materiales y métodos
El área de estudio corresponde al valle Pehuenche, en el lado argentino de la zona limítrofe entre Argentina y Chile; forma parte de los Andes centrales, en el departamento de Malargüe, suroeste de la provincia de Mendoza. Las precipitaciones anuales son de 400 a 600 mm (Rivera et al., 2018) y están influidas por los vientos provenientes del Pacífico sur, creando un gradiente de precipitación y humedad de oeste a este con fuertes nevadas en invierno (Garreaud et al., 2009). Durante la primavera-verano, el deshielo alimenta los humedales, denominados localmente vegas o mallines, donde se asientan familias con su ganado en los puestos, denominados reales o riales. El área es considerada un corredor ecológico y cultural trashumante de gran importancia (Llano et al., 2021).
La cuenca del arroyo Chico en Argentina incluye las subcuencas donde se distribuye A. pehuenche: arroyos Pehuenche y Callao (Corbalán et al., 2023). El arroyo Chico es afluente del río Grande en el departamento de Malargüe, provincia de Mendoza. En Chile, el área de distribución de la especie se ubica en la cuenca del río Maule, con 2 subpoblaciones posiblemente aisaldas: laguna del Maule y Lo Aguirre (Correa et al., 2013, 2018).
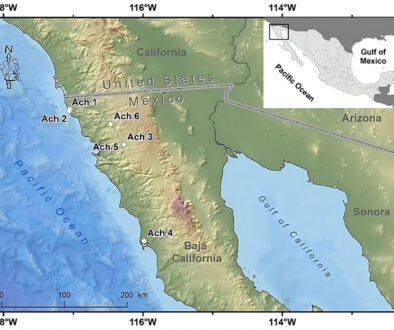
Durante 3 temporadas se muestrearon 14 arroyos tributarios del arroyo Pehuenche (fig. 1). Doce de los 14 arroyos fueron muestreados exhaustivamente y en los 2 restantes (B0 y A8), solo se constató la presencia de la especie. La especie fue observada en la desembocadura de los arroyos de primer orden en el arroyo Pehuenche.
Siguiendo a Corbalán et al. (2010) y Prado et al. (2019), los arroyos de primer orden que desembocan en el arroyo Pehuenche se distinguen, según su ubicación respecto a este último, en arroyos A que se ubican hacia el sur y son atravesados por la ruta Núm. 145, mientras que los arroyos B se ubican al norte del arroyo Pehuenche (fig. 1). A los arroyos con bifurcaciones y cursos de agua paralelos a menos de 100 m de distancia se los denominó con el mismo nombre. Durante el estudio, se tomaron datos de temperatura del agua con termómetro de mercurio, así como pH, oxígeno disuelto y conductividad con sonda multiparamétrica Lutron WA-2017SD, y de temperatura ambiente mediante la aplicación yr (Jensen et al., 2007). La conductividad fue baja, entre 0 y 181.56 μS/cm (n = 65), el valor medio del pH estuvo cercano a la neutralidad 6.41 ± 1.2, variando entre 3.29 y 8.25 (n = 77) y la concentración de oxígeno disuelto varió entre 1.3 y 15.8 mg/l (n = 16). La temperatura ambiente durante los muestreos osciló entre 2 y 21 ºC (n = 89), y la temperatura del agua entre 2 y 17.6 ºC (n = 75).
Se realizaron un total de 14 salidas de campo con una duración de 2 a 4 días/noches (tabla 1). Las 14 salidas se distribuyeron en 3 temporadas; cada una se inicia con el deshielo (octubre-noviembre-diciembre) y finaliza con la caída de las primeras nevadas (marzo-abril). En enero de 2021 se iniciaron muestreos preliminares diurnos y nocturnos consistentes en encuentros visuales sin manipulación de individuos. Los muestreos nocturnos iniciaron luego de la puesta del sol que coincide con el pico de actividad de los individuos adultos. Se optó por continuar con los muestreos nocturnos debido a que no se obtuvieron diferencias significativas en la cantidad de larvas entre el día y la noche (W = 191, p = 0.859).

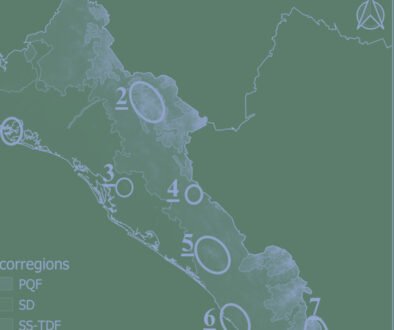
Figura 1. Arroyos muestreados en la cuenca del valle Pehuenche, distribuidos en 7 subpoblaciones locales: I. Nacientes, II. del Límite, III. Pichintur, IV. Rial Rojas, V. Nueva, VI. Campanaria, VII. Cajón Largo. Los arroyos de cada subpoblación se indican con el mismo color.
Se contabilizaron adultos, juveniles y larvas usando la técnica de encuentro visual (Crump y Scott, 1994). Los transectos fueron de rumbo variable siguiendo el curso del arroyo y el ancho fue de 1 m a cada lado del arroyo. Cada transecto se realizó con 2 a 5 observadores. Siguiendo las recomendaciones de Pereyra et al. (2021), al menos un observador tenía experiencia previa y las salidas se programaron en días con condiciones meteorológicas similares: días sin lluvias, mayormente despejados y con vientos leves a moderados.
Para los estadios maduros se registró sexo (macho, hembra e indeterminado). Se registró punto GPS y hora de inicio y de finalización del transecto. Se calcularon las abundancias relativas como individuos/área e individuos/tiempo. El área de los arroyos se consideró como el tramo muestreado en metros multiplicado por 2 m de ancho. Los individuos contabilizados estuvieron a no más de 1 m de distancia del curso del arroyo, cuando éste está claramente definido, y solo se observaron más dispersos en las zonas húmedas de vegas. Para el cálculo de individuos/tiempo se usó el tiempo en minutos de la duración del muestreo (Pereyra et al., 2021).
Adicionalmente, se realizaron muestreos en transectos de 800 m de longitud en los márgenes de la calzada: 10 en la temporada estival de 2021 y 5 en las temporadas siguientes. Este registro se realizó ya que en enero de 2018 se observaron individuos deshidratados o muertos, adyacentes a un cordón o bordillo de 20 cm de altura y 15 cm de ancho.
Se definieron subpoblaciones, siguiendo a Velasco (2018), formadas por un grupo de arroyos que contienen individuos de A. pehuenche, con hábitat adecuado (sensu Corbalán et al., 2010; Correa et al., 2013) y cuya distancia entre ellos no fue mayor a 500 m lineales. De este modo, los 14 arroyos iniciales fueron agrupados en 7 subpoblaciones (fig. 1). Los nombres de las subpoblaciones se relacionan con referencias a las características del paisaje donde se encuentran, excepto la subpoblación denominada Nueva. Se calculó el índice de conectividad (IC) entre subpoblaciones de acuerdo con la fórmula de Lin (2009), modificada por Velasco (2018): IC = A1*(1/D1*T1) + A2*(1/D2*T2), donde Ai es el área (= tamaño poblacional) de la población local vecina hacia el lado i, Di es la distancia a la población local vecina hacia el lado i y Ti la presencia de truchas en hábitat intermedios (presencia multiplica por 2, ausencia multiplica por 1). Para estimar el área correspondiente a cada subpoblación, se usaron las coordenadas GPS de los muestreos de campo y en el caso de las 2 subpoblaciones donde solo se constató presencia, se estimó tamaño del área en Google Earth Pro.
Tabla 1
Temporadas y subpoblaciones en las que se realizaron los muestreos de Alsodes pehuenche. Se indican la cantidad de muestreos realizados en la ruta y los nombres de los arroyos (tipos A, B; P: arroyo Pehuenche) muestreados por subpoblación.
| Temporada | Mes | Quincena primera (1) segunda (2) | Ruta | Subpoblaciones | ||||||
| I | II | III | IV | V | VI | VII | ||||
| 1 (2021) | enero | 1 | 2 | B0 | A1, A2 | |||||
| enero | 2 | 6 | A1, A2, A3, A4 | A5 | A7 | |||||
| febrero | 2 | 1 | A1, A2 | B2 | B3 | |||||
| abril | 2 | 1 | A1, A2 | A5 | A8 | |||||
| 2 (2021-2022) | noviembre | 2 | 1 | A1, B1 | B2 | A5 | A7 | |||
| febrero | 1 | A2 | B3 | |||||||
| marzo | 1 | A1 | B2 | |||||||
| marzo | 2 | B1 | B3 | |||||||
| 3 (2022-2023) | noviembre | 2 | 1 | A5 | ||||||
| diciembre* | 1 | 1 | A1, A3, B1 | B2, B2 | A5-B3 | A6 | A7 | |||
| enero | 1 | 1 | A2, P | A5, B3, P | A6, P | A7, P | ||||
| febrero | 2 | 1 | A1, P | A7, P | ||||||
| marzo | 2 | A3, P | B4, P | B6, P |
Las amenazas que se registraron durante los conteos se consideraron de manera cualitativa, en una escala de 0 a 3, de acuerdo con la intensidad de la amenaza (Velasco, 2018). En la tabla 2 se muestran las amenazas consideradas: 1) la presencia de salmónidos que fueron registrados por encuentro visual; 2) la sequía observada de arroyos que podría ser reversible según la época del monitoreo y cárcavas permanentes cuya profundidad va en aumento; 3) la presencia de ganado, principalmente vacuno y caprino, el primero es el que podría causar mayor impacto debido al mayor uso de las vegas; 4) mortalidad de individuos por causas indeterminadas; 5) la ruta, considerada como una barrera para la dispersión, ya sea porque las alcantarillas no fueron diseñadas como pasos de fauna o porque la altura del cordón o bordillo construido sobre la misma es muy alto para el libre tránsito de ranas juveniles y adultas. Y a pesar de que la ruta representa una barrera, la construcción posterior de rampas, con el objetivo de mitigar este impacto, se considera una acción concreta de conservación. Se registró, además, la presencia de depredadores no acuáticos potenciales y de otras especies de anfibios, pero ninguno de estos casos se considera como amenaza, aunque podrían representar interacciones interespecíficas negativas.
El estado de conservación (EC) relativo de cada subpoblación se obtuvo a partir de la sumatoria de los valores asignados al índice de conectividad y las amenazas (Velasco, 2018). Los valores fueron estandarizados (ECE = EC subpoblación – promedio de todos los EC/desviación estándar de todos los EC) y el valor resultante se multiplicó por -1. Así, los valores negativos de ECE quedaron relacionados con situaciones menos favorables. Se establecieron 2 categorías de prioridades de conservación: baja a media (valores positivos de ECE) y alta (valores negativos de ECE). Los valores altos son los que requieren medidas más urgentes de manejo (Velasco, 2018).
Tabla 2
Variables consideradas para evaluar estado de conservación de las subpoblaciones de Alsodes pehuenche en el valle Pehuenche. IC: Índice de conectividad. Valores 0 a 3 son los que se le asignan a cada variable.
| Variables | 0 | 1 | 2 | 3 |
| Área (m2) | 7,500-10,000 | 5,000-7,500 | 2,500-5,000 | 1,000-2,500 |
| IC1 | 7.51-10 | 5.1-7.5 | 2.51-5 | 0-2.5 |
| Amenazas | ||||
| Efecto especies exóticas: salmónidos | sin | presencia registrada | presencia registrada en más de un conteo | presencia registrada y presencia de anfibio/s con signo de depredación |
| Fragmentación por la ruta | Sin ruta | Sin cordón o bordillo | Con cordón o bordillo y con rampas | Con cordón o bordillo y sin rampas |
| Pérdida de hábitat por sequía/ cárcavas | Sin evidencias de sequía ni cárcavas | Algún arroyo parcialmente seco | Algún arroyo parcialmente seco y/o con presencia cárcavas | Algún arroyo completamente seco y/o presencia de individuos muertos por sequía |
| Efecto del ganado | Sin ganado | Con caprinos | Con vacunos | Con vacunos y cabras |
| Indeterminada | Sin registro de individuos muertos sin causa aparente | Registro de individuos con manchas en la piel | Registro de individuos con manchas y uno muerto sin causa aparente | Registro de más de un individuo muerto sin causa aparente |
1 = Índice de conectividad calculado de acuerdo con Lin (2009), modificado por Velasco (2018).
Se realizaron análisis de los conteos con R versión 4.1.3 y los análisis estadísticos consideraron 0.05 de nivel de significación de alfa. La normalidad de los datos se verificó con la prueba de Shapiro-Wilk. La cantidad de individuos (adultos, juveniles y larvas) por área y por hora no se distribuyó normalmente (W < 0.82934, p < 0.001), por lo que se usaron las pruebas estadísticas no paramétricas de Mann-Whitney-Wilcoxon y de Kruskal-Wallis para 2 grupos y más de 2 grupos, respectivamente. Se evaluó estadísticamente si hubo diferencias entre adultos y juveniles considerados en conjunto versus larvas. También se evaluaron diferencias en relación con variables temporales (temporadas, meses) y espaciales (entre arroyos A y B y entre subpoblaciones). Cuando se obtuvieron diferencias significativas con la prueba de Kruskal-Wallis, se usó el paquete conover.test versión 1.1.5 (2017), basado en Conover-Iman Test para comparaciones múltiples. En todos los casos, los resultados se expresan en mediana, el rango intercuartílico (IQR) como medida de dispersión, los valores mínimos y máximos (min-max) y el tamaño de la muestra (n).
Resultados
Los transectos muestreados alcanzaron un total de 51,292 m lineales recorridos en 181 horas con un esfuerzo de muestreo 12.35 horas/persona. De los 14 arroyos estudiados, todos tuvieron presencia de la especie y el área total fue de 0.04 km². Más de la mitad corresponde a los arroyos denominados A (56.2%).
Cuando se analizaron los conteos respecto de la cantidad de observadores, la correlación de Spearman resultó en valores de rho cercanos a 0, lo que sugiere que no hay correlación lineal (p > 0.05), tanto para individuos postmetamórficos (por área: rho = -0.0427, n = 99; por hora: rho = 0.0975, n = 99), como para larvas (por área: rho = -0.0297, n = 92; por hora rho = -0.0063,
n = 92).
A lo largo del periodo de muestreo se observaron 5.82 adultos y juveniles/área (IQR = 9.27, 0-45 min-max, n = 99) y 13.64 adultos y juveniles/hora (IQR = 30.29, 0-108 min-max, n = 99); 6.24 larvas/área (IQR = 31, 0-175 min-max, n = 92) y 17.76 larvas/hora (IQR = 65, 0-367 min-max, n = 92). La comparación entre estadios muestra menos postmetamórficos que larvas, tanto para los conteos de individuos por área (W = 12.524, p < 0.001) como por hora (W = 26.918, p < 0.001).
Tabla 3
Prioridades de conservación para las subpoblaciones de Alsodes pehuenche en el valle Pehuenche, con base en el tamaño de la población, la conectividad y las amenazas.
| Sub-población | Área (m2) | IC | Amenazas | ECE | PC1 | ||||
| Ruta | Sequía/cárcavas | Ganado | Muertes indet. | Salmónidos | |||||
| I. Nacientes | 4,044 | 8.41 | 0 | 0 | 2 | 0 | 1 | 0.88 | Baja |
| II. del Límite | 5,744 | 8.39 | 2 | 3 | 2 | 2 | 3 | -1.26 | Muy alta |
| III. Pichintur | 5,002 | 9.91 | 0 | 0 | 2 | 3 | 2 | 0.08 | Media |
| IV. Rial Rojas | 6,208 | 6.05 | 1 | 3 | 2 | 1 | 2 | -0.73 | Alta |
| V. Nueva | 2,160 | 9.61 | 1 | 0 | 2 | 3 | 0 | -0.19 | Media |
| VI. Campanaria | 5,860 | 5.26 | 1 | 0 | 1 | 3 | 3 | -0.46 | Media |
| VII. Cajón Largo | 9,550 | 6.64 | 0 | 0 | 1 | 0 | 0 | 1.69 | Muy baja |
1 PC: Prioridad de conservación calculada de acuerdo con Velasco (2018).
Las comparaciones entre las 3 temporadas no mostraron diferencias significativas para ninguno de los grupos estudiados adultos y juveniles/área (H = 1.9935, df = 2, p = 0.369), adultos y juveniles/hora (H = 1.3599, df = 2, p = 0.5066), larvas/área (H = 0.13936, df = 2, p = 0.933) y larvas por hora (H = 0.6051, df = 2, p = 0.7389). Entre meses, la diferencia no fue significativa para larvas (H = 4.5278, df = 5, p = 0.4762 por área, H = 4.0986, df = 5, p = 0.5353 por hora), en cambio para los postmetamórficos solo fue significativa para los conteos por área (H = 13.97, df = 5, p = 0.0158). Los análisis post hoc indican menores cantidades de adultos y juveniles en febrero respecto a diciembre (p = 0.0075) y enero (p = 0.0021), como también en marzo respecto a enero (p = 0.0185, fig. 2).
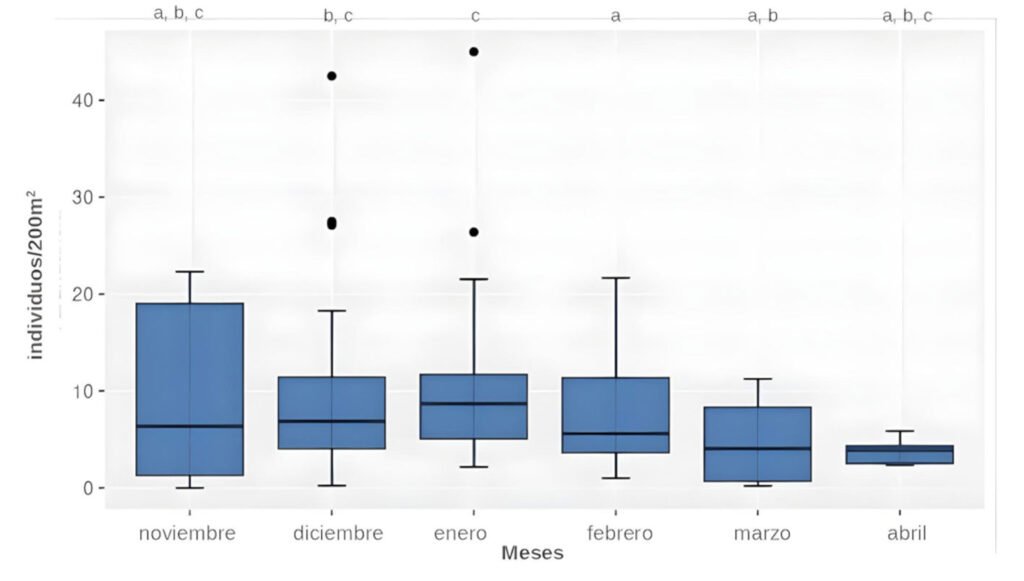
Figura 2. Variación mensual de la abundancia de adultos y juveniles (individuos/200 m2) de Alsodes pehuenche. Los meses con diferentes códigos de letras indican diferencias significativas (p < 0.05).
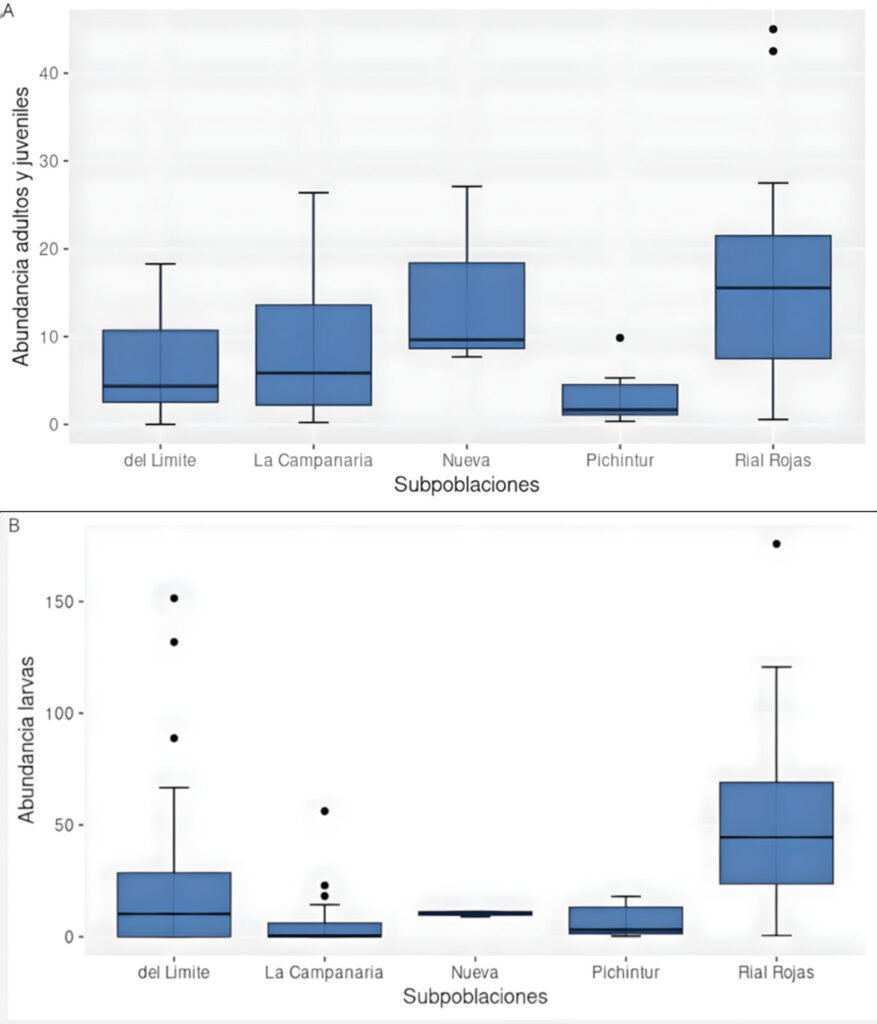
Figura 3. Abundancia de Alsodes pehuenche (individuos/200 m2) entre 5 subpoblaciones. A, Adultos y juveniles; B, larvas. Las subpoblaciones con diferentes códigos de letras indican diferencias significativas (p < 0.05).
De los 14 arroyos del valle Pehuenche con presencia de A. pehuenche, los arroyos A tienen un área de ocupación de 49% respecto de los arroyos B con 51%. Y en los 12 arroyos donde se realizaron conteos por área, éstos fueron mayores en los arroyos A que en los B, tanto para adultos y juveniles (H = 31.977, df = 2, p < 0.001), como para larvas (H = 10.42, df = 2, p = 0.0055).
Se reconocieron 7 subpoblaciones en el valle Pehuenche: Nacientes, del Límite, Pichintur, Rial Rojas, Nueva, Campanaria y Cajón Largo (fig. 1). De éstas, se tienen datos de conteo de 5 (todas, excepto Nacientes y Cajón Largo). Cuando se comparan estas 5 subpoblaciones, se encuentran diferencias significativas tanto para adultos y juveniles/área (H = 17.436, df = 4, p = 0.0016), como para larvas/área (por área H = 23.639, df = 4, p < 0.001). Se registraron más adultos y juveniles en las subpoblaciones Rial Rojas y Nueva, y más larvas en Rial Rojas (fig. 3). Sin embargo, estas diferencias no son significativas cuando se analizan los datos de postmetamórficos/hora (H = 8.8053, df = 5, p = 0.1171) y larvas/hora (H = 4.0986, df = 5, p = 0.5353).
El único lugar donde se encontraron solo larvas fue en una charca de la subpoblación del Límite. Éstas coexistían con larvas y adultos de rana de 4 ojos (Pleurodema bufoninum). Además, esta última especie ha sido observada eventualmente coexistiendo con A. pehuenche en las subpoblaciones Rial Rojas, Campanaria y del Límite. Otras especies registradas durante los muestreos, que se identifican como posibles depredadores de A. pehuenche son el zorro gris (Lycalopex gymnocercus), el chiñe o zorrino (Conepatus chinga), la gaviota capucho café (Chroicocephalus maculipennis) y el águila mora (Geranoaetus melanoleucus).
Aunque la detección de huevos no fue objeto de este estudio, dado que no se realizó búsqueda activa en oquedades ni se manipularon hembras, en noviembre 2022 se observó una masa de 20 huevos aproximadamente, flotando en una pequeña poza de la subpoblación Rial Rojas en época de deshielo. Los huevos no eran pigmentados y cada uno midió entre 6 y 7 mm de diámetro.
Los índices de conectividad calculados para cada una de las subpoblaciones se muestran en la tabla 3. El arroyo Pehuenche representa la principal conexión entre subpoblaciones. En este arroyo se encontraron individuos adultos en la desembocadura de arroyos de primer orden pertenecientes a las subpoblaciones del Límite, Rial Rojas, Nueva y Campanaria (tabla 1). Si bien Cajón Largo tiene relativamente bajo índice de conectividad, el área de esta subpoblación es la mayor de todas.
Se registraron 24 individuos muertos durante el periodo de estudio: 1) 6 individuos adultos —2 hembras, 2 machos y 2 adultos indeterminados— en el mes de enero de la temporada estival 2021 y 2 en la temporada 2022-2023 en los muestreos realizados en la ruta internacional ARG145; 2) 3 individuos —1 adulto indeterminado y 2 larvas— encontrados muertos por desecación sobre el curso de un arroyo de Rial Rojas que mostró una disminución abrupta del caudal luego del deshielo entre noviembre y diciembre 2022; 3) 4 adultos —3 machos y 1 indeterminado— encontrados con signos de depredación (patas traseras lastimadas o mutiladas) al costado o dentro del curso del arroyo donde se registra presencia de salmónidos, esto es, en las subpoblaciones del Límite y Campanaria; 4) 6 adultos —2 machos y 4 indeterminados—, 1 juvenil indeterminado y 2 larvas encontrados muertos sin causa evidente, dentro del curso del arroyo o próximo a éste.
Finalmente, los valores de ECE negativos usados como indicadores, permitieron identificar a las subpoblaciones del Límite y Rial Rojas como unidades de conservación prioritarias, de las cuales la del Límite requiere esfuerzos más urgentes.
Discusión
Corbalán et al. (2010) reportaron 355 individuos de A. pehuenche en 2,500 m lineales (equivalente a 14 individuos/200 m2) en un muestreo realizado en 2008 en arroyos de la subpoblación del Límite. Si se compara ese valor con el obtenido en este estudio para los mismos arroyos en el mismo mes en 2021 (8 individuos/200 m2), el primero es mayor, pero se encuentra dentro del intervalo de variación de este estudio. Cabe mencionar que se usaron 2 técnicas diferentes para el conteo (búsqueda activa de individuos en oquedades durante el día y encuentro visual nocturno, con 3 observadores en los 2 casos), por lo que, con la información disponible actualmente, solo la mortalidad de individuos reportada desde 2008 permite estimar una tendencia poblacional decreciente para esta subpoblación.
En 2 arroyos muy cercanos a la subpoblación del Límite en Chile, Correa et al. (2013) reportaron 20 y 24 adultos/h o 15 y 66 adultos/200 m². Estos últimos datos corresponden a muestreos nocturnos realizados en marzo de 2012, con 4 observadores. La cantidad máxima de adultos por área observados por Correa et al. (2013) es mayor al máximo obtenido en este estudio, lo cual puede deberse a un error de muestreo en solo 30 m lineales, o bien a fluctuaciones poblacionales naturales (Kissel et al., 2020). En arroyos de Rial Moreno, a 21 km al NE de la población del valle Pehuenche, Corbalán et al. (2023) reportaron 26 adultos/hora y 4 juveniles/hora en un muestreo nocturno realizado en enero de 2019, los cuales se encuentran dentro de valores obtenidos en el valle Pehuenche en este estudio.
Durante las 3 temporadas consecutivas muestreadas en este trabajo, no se detectaron cambios significativos para ningún estadio de desarrollo de A. pehuenche. Esto puede deberse a que se trata de un periodo corto en términos de monitoreo. Por lo tanto, es necesario mantener los muestreos para conocer tendencias poblacionales a largo plazo. Por otro lado, la detección de individuos por encuentro visual a lo largo de los arroyos, podría compararse con otros estudios enfocados al monitoreo poblacional de la especie para lograr establecer un óptimo en términos de esfuerzo de muestreo. Dado que estas investigaciones dependen del presupuesto disponible y de limitaciones logísticas (Joseph et al., 2006) principalmente ligadas a la elevada demanda de horas/persona en un ambiente de alta montaña, se debe buscar una estrategia que permita satisfacer tanto la demanda de datos pertinentes para la gestión, como la obtención de información ecológica de calidad (Stephens et al., 2015; Yoccoz et al., 2001).
En relación con la primera acción de conservación llevada a cabo en la población del valle Pehuenche, que consistió en la construcción de 800 m de cordón o bordillo en la ruta y 2 cámaras de infiltración para evitar que la sal vertida en la ruta llegue a los arroyos, provocó la deshidratación y muerte de 18 individuos que fueron encontrados en diciembre de 2017, y 50 en enero de 2018. Posiblemente, la construcción a posteriori de rampas entre el cordón o bordillo y la calzada en febrero de 2018, ha evitado que se vuelvan a registrar mortalidades tan abruptas. Si bien nunca pudo constatarse el uso de las rampas por parte de la especie, las mismas habrían mejorado la conexión entre las secciones superior e inferior de los arroyos. Esto demuestra la necesidad de seguimiento de las acciones de conservación que se llevan a cabo. Pero, por otro lado, si bien la ruta pudo haber provocado una disminución poblacional (Corbalán et al., 2010; IUCN, 2019), el número elevado de individuos muertos registrado en este estudio alerta sobre la necesidad de avanzar en el conocimiento de otras amenazas, como la depredación por salmónidos invasores, el cambio climático y la infección por el hongo quitridio (Batrachochytrium dendrobatidis) de los anfibios.
En este trabajo, de todos los estadios evaluados, las larvas fueron las más abundantes, las más estables en el tiempo y presentaron el mismo patrón de variación que los adultos entre arroyos A y B, y subpoblaciones (fig. 3). Al igual que lo reportado por Corbalán et al. (2010, 2023), se encontraron larvas de diferentes tamaños conviviendo en pozas, pero también se observaron en rápidos, remansos y debajo de la vegetación acuática. Estos resultados son coherentes con la estrategia de especies con desarrollo larval plurianual (Úbeda, 2021). Por otro lado, la menor cantidad de juveniles registrada respecto de adultos podría ser un problema de detectabilidad por su tamaño (Petrovana y Schmidt, 2019), podría corresponder a una segregación por microhábitats según el estadio (Gonwouo et al., 2022), o bien, ser evidencia de una dinámica poblacional particular solo en esta fase de su ciclo de vida (Kissel et al., 2020).
Los muestreos preliminares realizados de día y de noche demuestran que hay arroyos permanentes que solo tienen adultos. Los estudios a futuro podrán determinar las causas que posiblemente puedan estar asociadas con aspectos fisicoquímicos del agua, o a la dispersión de individuos. La información actual permite suponer que las rutas de dispersión de A. pehuenche con base en sus hábitos acuáticos, son los mismos arroyos. Los registros de individuos secos en la ruta, principalmente entre diciembre y enero, al igual que la mayor cantidad de adultos y juveniles registrados en estos meses (fig. 2), podrían estar indicando una mayor dispersión en esa temporada del año.
Los arroyos del valle Pehuenche son los mejores conocidos hasta el momento y el área que ocupan representa solo 6% del área de distribución de A. pehuenche (487.9 km²) reportada por Corbalán et al. (2023). De la misma manera, habiendo considerado en nuestro estudio casi todos los arroyos presentes en el valle Pehuenche, representa 0.8% del área de ocupación total para la especie (4.84 km²; Corbalán et al., 2023). El espacio sin ocupación efectiva de la especie, actualmente, es muy grande (Corbalán et al., 2023), aunque en el pasado pudo haber estado presente en un área mayor si se comparan los registros de presencia en Cajón Grande (Cei y Roig, 1965; Corbalán et al., 2023). Si se considera desde la descripción de la especie en 1965, A. pehuenche ha reducido su área de distribución histórica, lo cual puede deberse a diferentes causas. La depredación por salmónidos en la actualidad podría ser la causa de que la especie haya quedado restringida solo a las zonas altas de las cuencas. Por ello, es necesario conocer la distribución de salmónidos e identificar dónde coexisten estos peces y la rana. Donde esto ocurre en el valle Pehuenche, se registraron adultos muertos de A. pehuenche con signos de depredación. Así, los salmónidos representan una barrera para la dispersión de las ranas, reduciendo la conectividad entre subpoblaciones y dentro de ellas entre arroyos A y B (tabla 3). Como se ha demostrado para otras especies de anfibios, la consecuencia es la disminución del intercambio genético o demográfico (e.g., Kacoliris et al., 2022; Velasco, 2018). Por lo tanto, para conservar las subpoblaciones se requiere asegurar su conectividad, tanto entre las secciones inferior y superior de los arroyos A impactados por la ruta, como dentro de las subpoblaciones entre los arroyos A y B, y entre las subpoblaciones conectadas a través del arroyo Pehuenche.
Las observaciones de campo sugieren que los individuos se distribuyen de manera agrupada a lo largo de los cursos de agua y vegas, no solo las larvas en las pozas, sino también los adultos a lo largo de los arroyos. Esto debe ser evaluado en la etapa reproductiva a inicios de la temporada y al final de ésta, cuando el caudal disminuye y algunos cauces se secan total o parcialmente, donde solo quedan pozas pequeñas con agua. Si este efecto es acentuado por la disminución de cobertura permanente de nieve en la cuenca del Río Grande (Aumassanne et al., 2019), es posible que más arroyos, que todavía mantienen agua hasta el final de la temporada, se sequen como ha ocurrido en los arroyos A3 y A4 de la población del Límite, aumentando así la fragmentación del hábitat. Si A4 no se hubiera secado, las 3 subpoblaciones (del Límite, Pichintur y Rial Rojas) estarían conectadas, formando una sola subpoblación (fig. 1).
Si bien gran parte de las amenazas han sido identificadas (Corbalán et al., 2010, 2023), la mayoría no han sido cuantificadas. Con base en las observaciones realizadas durante los muestreos en este estudio, se sistematizaron las amenazas para cada arroyo y cada subpoblación en el valle Pehuenche (tablas 2, 3). Como resultado de la priorización, las subpoblaciones del Límite y Rial Rojas se identifican como prioritarias para iniciar acciones concretas de conservación. Es posible que ambas sean fragmentos de una población mayor y que hayan estado unidas cuando el arroyo intermedio no estaba seco. En la del Límite se podría iniciar la mitigación de la depredación por salmónidos y reducir los efectos de la ruta. Es necesario continuar con el seguimiento y cuantificación de las amenazas, considerar las aún no evaluadas, tales como las que pueden estar generando las actividades turísticas, el vertido de sal en la ruta, crecidas extraordinarias y otras potenciales como el tendido de líneas de alta tensión, planificada desde el Maule (Chile) al río Diamante (San Rafael, Argentina).
El avance logrado en 20 años de estudios sobre la biología y conservación de este anfibio endémico de Argentina y Chile nos brinda herramientas para sostener acciones concretas de manejo que alivien alguna de las amenazas y que aseguren la viabilidad de las poblaciones a largo plazo. Se espera que un programa de monitoreo anual permita avanzar en el conocimiento de las tendencias poblacionales a largo plazo. Las subpoblaciones del valle Pehuenche son las mejor conocidas hasta el momento y han sufrido disminuciones, fragmentaciones y también extinciones locales. La priorización de su estado de conservación brinda herramientas para implementar acciones necesarias a corto plazo.
Agradecimientos
Por la colaboración en el trabajo de campo, se agradece a estudiantes de la Tecnicatura en Conservación de la Naturaleza Sede Malargüe del IEF Núm. 9-016, especialmente a Julián Rodríguez, Armando Barros, Francisco Jofré y Pablo Lucero; también a estudiantes voluntarios y Graciela Ríos. A Karen Olate por la elaboración del mapa. Y a un revisor anónimo por sus aportes a la primera versión del manuscrito y a los dos revisores que realizaron aportes importantes para mejorar el manuscrito. La investigación se logró gracias al financiamiento del proyecto SIIP 06/M003 Resol. 3978/2022 UNCUYO y aportes personales de investigadoras y estudiantes.
Referencias
Aumassanne, C. M., Beget, M. E., Di Bella, C. M., Oricchio, P. y Gaspari, F. J. (2019). Cobertura de nieve en las cuencas de los ríos Grande y Barrancas (Argentina) y su relación con la morfometría. Revista de Investigación Agropecuaria, 45, 394–403.
Cei, J. M. (1976). Remarks on some neotropical amphibians of the genus Alsodes from southern Argentina. Atti della Società Italiana di Scienze Naturali e del Museo Civico di Storia Naturale di Milano, 117, 159–164.
Cei, J. M. (1980). Amphibians of Argentina. Monitore Zoologico Italiano, N.S. Monografia 2. Florencia: Universitá degli studi di Firenze.
Cei, J. M. y Roig, V. G. (1965). The systematic status and biology of Telmatobius montanus Lataste (Amphibia: Leptodactylidae). Copeia, 4, 421–425.
Corbalán, V., Debandi, G. y Martínez, F. (2010). Alsodes pehuenche (Anura: Cycloramphidae): past, present and future. Cuadernos de Herpetología, 24, 17–23.
Corbalán, V., Debandi, G., Martínez, F. y Úbeda, C. (2014). Prolonged larval development in the critically endangered Pehuenche’s Frog Alsodes pehuenche: implications for conservation. Amphibia–Reptilia, 35, 283–292. http://dx.doi.
org/10.1163/15685381-00002951
Corbalán V., Debandi G., Literas S., Álvarez L., Rivera J. A., Dopazo J. et al. (2023). Newly discovered sites and potential threats for the critically endangered frog, Alsodes pehuenche, in Southern South America. Herpetological Conservation and Biology, 18, 48–56.
Correa, C., Pastenes, L., Iturra, P., Calderón, P., Vásquez, D., Lam, N. et al. (2013). Confirmation of the presence of Alsodes pehuenche Cei, 1976 (Anura, Alsodidae) in Chile: morphological, chromosomal and molecular evidence. Gayana, 77, 117–123. http://dx.doi.org/10.4067/S0717-65382013000200006
Correa, C., Zepeda, P., Lagos, N., Salinas, H., Palma, R. E. y Vásquez, D. (2018). New populations of two threatened species of Alsodes (Anura, Alsodidae) reveal the scarce biogeographic knowledge of the genus in the Andes of central Chile. Zoosystematics and Evolution, 94, 349–358.
Correa, C. J. Morales, C. Schussler y J. C. Ortiz. (2020). An enigmatic population of Alsodes (Anura, Alsodidae) from the Andes of central Chile with three species-level mitochondrial lineages. Mitochondrial DNA Part A DNA Mapping, Sequencing, and Analysis, 31, 25–34. https://doi.org/10.1080/24701394.2019.1704744
Crump, M. L. y Scott, N. J. (1994). Visual encounter surveys. En W. R.Heyer, M. A. Donnelly, R. W. Mc Diarmid, L. A. C. Hayek y M. S. Foster (Eds.). Measuring and Monitoring Biological Diversity Standard Methods for Amphibians (pp. 84–92). Washington D.C.: Smithsonian Institution Press.
Cuevas, C. C. y Formas, J. R. (2003). Cytogenetic analysis of four species of the genus Alsodes (Anura: Leptodactylidae) with comments about the karyological evolution of the genus. Hereditas, 138, 138–147. https://doi.org/10.1034/j.1601-5223.2003.01677.x
Garreaud, R., Vuille, M., Compagnucci, R. y Marengo, J. (2009). Present-day south american climate. Palaeogeography, Palaeoclimatology, Palaeoecology, 281, 180–195. http://dx.
doi.org/10.1016/j.palaeo.2007.10.032
Ghirardi, R., Levy, M. G., López, J. A., Corbalán, V., Steciow, M. M. y Perotti, M. G. (2014). Endangered amphibians infected with the chytrid fungus Batrachochytrium dendrobatidis in austral temperate wetlands from Argentina. Herpetological Journal, 24, 129–133.
Gonwouo, N. L. Schäfer, M. y Tsekané, S. J. (2022). Goliath frog (Conraua goliath) abundance in relation to frog age, habitat, and human activity. Amphibian and Reptile Conservation, 16, e319.
Grant, E. H. C., Miller, D. A. y Muths, E. (2020). A synthesis of evidence of drivers of amphibian declines. Herpetologica, 76, 101–107. https://doi.org/10.1655/0018-0831-76.2.101
Green D. M., Lannoo M. J., Lesbarrères D. y Muths E. (2020). Amphibian population declines: 30 years of progress in confronting a complex problem. Herpetologica, 76, 97–100. https://doi.org/10.1655/0018-0831-76.2.97
Herrera, F. y Velásquez, N. A. (2016a). Dimorfismo sexual en Alsodes pehuenche Cei 1976 (Amphibia, Anura, Alsodidae). Boletín Chileno de Herpetología, 3, 4–6.
Herrera, F. y Velásquez, N. A. (2016b). Uso de cuevas en Alsodes pehuenche Cei 1976 (Amphibia, Anura, Alsodidae). Boletín Chileno de Herpetología, 3, 17–20.
Jensen, I. S., Haugen, V. F. y Skålin, R. (2007). Yr. Norwegian Meteorological Institute and the Norwegian Broadcasting Corporation. Recuperado el 15 de agosto, 2024 de https://www.yr.no/nb
Joseph, L. N., Field, S. A., Wilcox, C. y Possingham, H. P. (2006). Presence-absence versus abundance data for monitoring threatened species. Conservation Biology, 20, 1679–1687. https://doi.org/10.1111/j.1523-1739.2006.00529.x
Kacoliris, F. P., Berkunsky, I., Acosta, J. C., Acosta, R., Agostini, M. G., Akmentins, M. et al. (2022). Current threats faced by amphibian populations in the southern cone of South America. Journal for Nature Conservation, 69, 126254. https://doi.org/10.1016/j.jnc.2022.126254
Kissel, A. M., Tenan, S. y Muths, E. (2020). Density dependence and adult survival drive dynamics in two high elevation amphibian populations. Diversity, 12, 478.
Lin, J. P. (2009). The functional linkage index: a metric for measuring connectivity among habitat patches using least-cost distances. Journal of Conservation Planning, 5, 28–37.
Llano, C., Durán, V., Gasco, A., Reynals, E. y Zárate, M. S. (2021). Traditional puesteros´ perceptions of biodiversity in semi-arid Southern Mendoza, Argentina. Journal of Arid Environments, 192, 104553. https://doi.org/10.1016/j.ja
ridenv.2021.104553
Luedtke, J. A., Chanson, J., Neam, K., Hobin L., Maciel, A. O., Catenazzi, A. et al. (2023). Ongoing declines for the world’s amphibians in the face of emerging threats. Nature, 622, 308–314. https://doi.org/10.1038/s41586-023-06235-w
Luja, V., Rodríguez-Estrella, H. R., Schaub, M. y Schmidt, B. R. (2015). Among-population variation in monthly and annual survival of the Baja California treefrog, Pseudacris hypochondriaca curta, in desert oases of Baja California Sur, Mexico. Herpetological Conservation and Biology, 10, 112–122.
Pereyra, L. C., Etchepare, E. y Vaira, M. (2021). Manual de técnicas y protocolos para el relevamiento y estudio de anfibios de Argentina. San Salvador de Jujuy: Editorial de la Universidad Nacional de Jujuy.
Petrovana, S. O. y Schmidt, B. R. (2019). Neglected juveniles; a call for integrating all amphibian life stages in assessments of mitigation success (and how to do it). Biological Conservation, 236, 252–260. https://doi.org/10.1016/j.biocon.
2019.04.016
Piñeiro, A., Fibla, P., López, C., Velásquez, N. y Pastenes, L. (2020). Characterization of an Alsodes pehuenche breeding site in the Andes of central Chile. Herpetozoa, 33, 21–26. https://doi.org/10.3897/herpetozoa.33.e49268
Pollock, J. E. (2006). Detecting population declines over large areas with presence-absence, time-to-encounter, and count survey methods. Conservation Biology, 20, 882–892. https://doi.org/10.1111/j.1523-1739.2006.00559.x
Prado, W. S., Meriggi, J., Martínez, F. y Corbalán, V. (2019). Ampliación del área de distribución de Alsodes pehuenche en Argentina. Revista del Museo de La Plata, 4 (Suplem.), 1R–117R.
Rivera, J. A., Marianetti, G. y Hinrichs, S. (2018). Validation of CHIRPS precipitation dataset along the Central Andes of Argentina. Atmospheric Research, 213, 437–449. https:
//doi.org/10.1016/j.pce.2022.103184
Stephens, P. A., Pettorelli, N., Barlow, J., Whittingham, M. J. y Cadotte, M. W. (2015). Management by proxy? The use of indices in applied ecology. Journal of Applied Ecology, 52, 1–6. https://doi.org/10.1111/1365-2664.12405
Úbeda, C. (2021). Estrategias reproductivas, hábitats y otros aspectos ecológicos de los anfibios altoandinos en la vertiente oriental de la Cordillera de los Andes. Boletín Chileno de Herpetología, 8, 10–21.
UICN (Unión Internacional para la Conservación de la Naturaleza), Species Survival Commission Amphibian Specialist Group. (2019). Alsodes pehuenche. IUCN Red List of threatened species, 2019. https://www.iucnredlist.org
Vaira, M., Akmentins, M., Attademo, M., Baldo, D., Barrasso, D., Barrionuevo, S. et al. (2012). Categorización del estado de conservación de los anfibios de la República Argentina. Cuadernos de Herpetología, 26 (Suplem. 1), 131–159.
Vaira, M., Pereyra, L. C., Akmentins M. S. y Bielby, J. (2017). Conservation status of Amphibians of Argentina: An update and evaluation of national assessments. Amphibian y Reptile Conservation, 11, e135.
Velasco, M. A. (2018). Dinámica poblacional y conservación de la ranita del Valcheta (Pleurodema somuncurense) (Cei, 1969), Patagonia, Argentina (Tesis doctoral). Universidad Nacional de La Plata, La Plata, Buenos Aires.
Velasco, M. A., Kacoliris, F. P., Berkunsky, I., Quiroga, S. y Williams, J. D. (2016). Current distributional status of the critically endangered Valcheta frog: implications for conservation. Neotropical Biology and Conservation, 11, 110–113. http://dx.doi.org/10.4013/nbc.2016.112.08
Vidal, M. A., Henríquez, N., Torres-Díaz, C., Collado, G. y Acuña-Rodríguez, I. S. (2024). Identifying strategies for effective biodiversity preservation and species status of Chilean amphibians. Biology, 13, 169. https://doi.org/10.33
90/biology13030169
Yoccoz, N. G., Nichols, J. D. y Boulinier, T. (2001). Monitoring of biological diversity in space and time. Trends in Ecology and Evolution, 16, 446–453. https://doi.org/10.1016/S0169-
5347(01)02205-4
Zarco, A., Corbalán, V. y Debandi, G. (2020). Depredación por truchas arcoíris invasoras en la rana de pecho espinoso Pehuenche, en peligro crítico. Journal of Fish Biology, 98, 878-880. https://doi.org/10.1111/jfb.14401