Functional diversity and composition of insect communities at different levels of disturbance
Víctor Manuel Caballero-Chan, Alejandra González-Moreno*, Horacio Salomón Ballina-Gómez y Carlos Juan Alvarado-López
Tecnológico Nacional de México, Instituto Tecnológico de Conkal, División de Estudios de Posgrado e Investigación, Av. Tecnológico s/n, 97345 Conkal, Yucatán, México
*Autor para correspondencia: alejandra.gonzalez@itconkal.edu.mx (A. González-Moreno)
Recibido: 18 enero 2025; aceptado: 30 mayo 2025
Resumen
La diminución en la cobertura vegetal y la perturbación antropogénica tienen efectos negativos sobre la diversidad de insectos. Este trabajo tuvo como objetivo evaluar la diversidad funcional y la composición de comunidades de insectos fitófagos y benéficos en diferentes niveles de perturbación de Yucatán, México. Se instalaron 6 trampas Malaise por sitio, durante 5 meses en temporada de lluvias. Los ejemplares se identificaron a nivel familia y grupo funcional; se analizó la diversidad en términos de riqueza, familias comunes y dominantes de cada grupo funcional. Se registraron 25,872 individuos de 106 familias, 12 órdenes y 4 grupos funcionales (fitófagos, polinizadores, depredadores y parasitoides). Aunque la riqueza de familias fue similar, la diversidad de familias comunes y dominantes mostró diferencias en los sitios con niveles medios y altos de perturbación. Estos resultados sugieren que algunas familias son exitosas en niveles altos de perturbación y otras disminuyen su diversidad. Las familias dominantes de los fitófagos, polinizadores, parasitoides y depredadores fueron: Pyralidae, Geometridae, Tachinidae y Coccinellidae, respectivamente.
Palabras clave: Urbanización; Grupos funcionales; Fitófagos; Insectos benéficos
Abstract
Decreased vegetation cover and anthropogenic disturbance can negatively impact insect diversity. This research aimed to assess the functional diversity and community composition of phytophagous and beneficial insects at different levels of disturbance in Yucatán, Mexico. Six Malaise traps were deployed at each site during 5 months in the rainy season. Specimens were identified to the family and functional group levels, and diversity was analyzed based on family richness, as well as the composition of common and dominant families for every functional group. A total of 25,872 individuals representing 106 families, 12 orders, and 4 functional groups were recorded (phytophagous, pollinators, predators and parasitoids). While family richness was comparable across sites, the diversity of common and dominant families differed between areas with medium and high levels of disturbance. These results suggest that some families thrive under high disturbance levels, whereas other experiences a decline in diversity. The dominant families of phytophagous, pollinators, parasitoids and predators were: Pyralidae, Geometridae, Tachinidae, and Coccinellidae, respectively.
Keywords: Urbanization; Functional groups; Phytophagous; Beneficial insects
Introducción
En México, un país considerado megadiverso, el crecimiento de las zonas urbanas y la intensificación de la agricultura, están poniendo en riesgo la diversidad de insectos nativos presentes en zonas naturales (Martínez-Ramos et al., 2016), así como ocasionando cambios en el comportamiento de distintos grupos de insectos, que comprometen funciones ecológicas críticas como la polinización, el control biológico de plagas y la descomposición de la materia orgánica (Wagner et al., 2021). La perturbación antropogénica derivada de la urbanización, que incluye la construcción de infraestructura y el desarrollo de asentamientos humanos, junto con la agricultura intensiva, la deforestación, la fragmentación del hábitat, la contaminación y cambio climático, está generando una presión sin precedentes sobre la biodiversidad (Betts et al., 2019; Fahrig et al., 2019). La disminución de especies de vertebrados, como aves, anfibios y mamíferos está bien documentada; sin embargo, la pérdida de diversidad en invertebrados es menos conocida y se desconoce si está ocurriendo a la misma velocidad que en otros grupos; aunque estudios más recientes, incluidos varios metaanálisis, han evidenciado el declive de los insectos (Wagner et al., 2021).
En particular, se ha demostrado que la urbanización y agricultura intensiva afectan negativamente a los polinizadores, principalmente por la pérdida de hábitat, cambios en la disponibilidad de alimentos y la alteración de sus patrones de comportamiento (Biella et al., 2022; Fisogni et al., 2020; Tavares-Brancher et al., 2024). Pero, la urbanización no solo afecta a los polinizadores, sino que en general contribuye a la disminución de insectos debido a múltiples factores, como el incremento en la intensidad lumínica (Boyes et al., 2021), en la temperatura, evaporación y la exposición al viento y a diversos contaminantes, que alteran su comportamiento y actividad (Dirzo, 2014; Wagner et al., 2021); especialmente aquellos que ocupan altos niveles tróficos como los parasitoides y depredadores (Betancourt et al., 2021; Janzen y Hallwachs, 2021). Esta pérdida de diversidad no solo es preocupante por la pérdida de especies en sí misma, sino también por la disminución de las múltiples funciones ecológicas que realizan los insectos (Fenoglio et al., 2020; Wagner et al., 2021).
En México se han realizado algunos estudios sobre cómo la diversidad de insectos varía en varios niveles de perturbación, con resultados contrastantes, dependiendo del taxón a estudiar, del grupo funcional al que pertenecen y de las características de los sitios perturbados. En general, se ha demostrado que la urbanización tiene un impacto negativo sobre la diversidad de abejas (Muñoz-Urías et al., 2025), coleópteros (Cortés-Arzola y León-Cortés, 2021) y hormigas, principalmente de hábitos arborícolas (Roche-Ortega y Castaño- Meneses, 2015) y mariposas (Ramírez-Restrepo y Halffter, 2013). Actualmente, la península de Yucatán está siendo amenazada por el crecimiento urbano descontrolado y las prácticas agrícolas no sostenibles, por lo que se planteó la siguiente pregunta de investigación ¿cómo varían las comunidades de insectos en términos de diversidad funcional y composición, en diferentes niveles de perturbación? Tomando en cuenta que los resultados de las evaluaciones de diversidad pueden variar según el nivel taxonómico considerado y los requerimientos ecológicos del taxón a estudiar (Fenoglio et al., 2020), en este trabajo se planteó abordarlo a nivel de familia, considerando el grupo funcional que conforman y la función que llevan a cabo como fitófagos, depredadores, parasitoides o polinizadores.
El objetivo del presente trabajo fue evaluar la diversidad funcional y la composición de comunidades de insectos fitófagos y benéficos en diferentes niveles de perturbación de Yucatán; para ello se plantearon las siguientes hipótesis: la diversidad de insectos fitófagos será mayor en zonas con mayor nivel de perturbación; por el contrario, los insectos benéficos serán más diversos en niveles de perturbación menores y la familia dominante de cada grupo funcional será diferente en cada nivel de perturbación. Realizar estas evaluaciones podría ser significativo para implementar estrategias de conservación dentro de las ciudades, además de que las evaluaciones de la diversidad de invertebrados son prioritarias para avanzar en el entendimiento de la defaunación, principalmente en regiones tropicales (Dirzo, 2014; Wagner et al., 2021).
Materiales y métodos
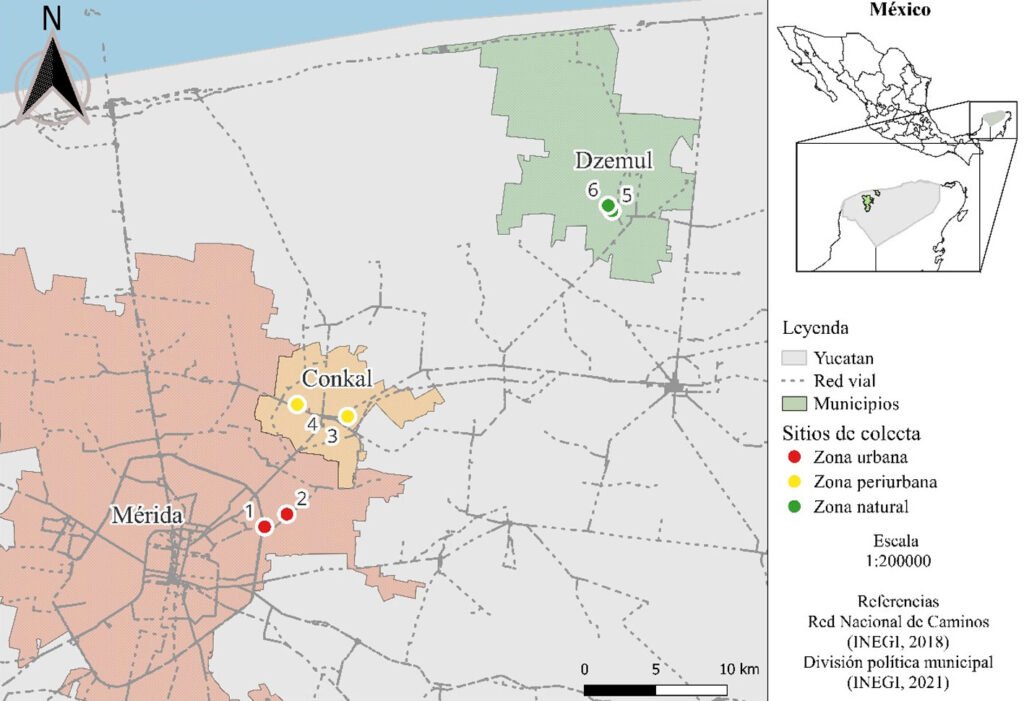
El estudio se llevó a cabo en 3 zonas de Yucatán que se eligieron considerando el grado de perturbación, de acuerdo con el índice de disturbio (ID), según el método propuesto por Martorell y Peters (2005). En cada zona, se seleccionaron 2 sitios al azar, se utilizaron fotografías aéreas (INEGI SINFA 1:250 000, 2019 CLAVE F16-10 LÍNEA 166) que fueron importadas al programa Arc view 3.1. El ID se basa en la cuantificación de 15 parámetros, los cuales están comprendidos en 1 de 3 categorías: 1) cría de ganado (frecuencia de excrementos de cabra, frecuencia de excremento de vaca, ramoneo, caminos para el ganado y compactación del suelo); 2) actividades humanas (extracción de leña, número de caminos, superficie de senderos, proximidad de asentamientos humanos, cercanía a núcleos de actividad humana, porcentaje de uso del suelo y evidencia de incendios forestales) y 3) degradación del suelo (porcentaje de erosión, presencia de islas de erosión y superficie totalmente modificada). Una vez que se estimó el índice de perturbación en cada sitio, se establecieron 3 niveles de perturbación: alto (índice de perturbación entre 10 y 15), medio (entre 2.1 y 5) y bajo (entre 0 y 2). Así, se seleccionaron 2 sitios por nivel de afectación, resultando 6 sitios en total (tabla 1).
La zona con alto nivel de perturbación, a la cual se denominó zona urbana, se ubicó alrededores de la ciudad de Mérida (21°01’ N, 89°33’ O), al norte del estado, dominada por un paisaje urbano, con 75% de cobertura gris y apenas 10% de cobertura de material vegetal (Biles y Lemberg, 2023). La zona con nivel medio de perturbación, nombrada zona periurbana, se localiza en el municipio de Conkal (21°05’ N, 89°30’ O), al este del municipio de Mérida, con 40% de cobertura gris y 35% de cobertura vegetal, dominada por cultivos de maíz y vegetación circundante de selva baja caducifolia (Rzedowski, 1978). La zona, con bajo nivel de perturbación, llamada zona natural, se localiza en la reserva privada “Komchén de los Pájaros” (21°13’ N, 89°19’ O), al oeste de los municipios de Dzemul y Telchac, presenta una cobertura vegetal de 80% y una cobertura gris inferior a 5% (fig. 1); la vegetación es selva baja caducifolia, conformada principalmente por varias especies de la familia Fabaceae: Piscidia piscipula (jabín), Caesalpinia gaumeri (kitinché), Lysiloma latisiliquum (tzalam) y la familia Burseraceae: Bursera simaruba (palo mulato) (Flores y Espejel, 1994). Las 3 zonas presentan un clima cálido subhúmedo con lluvias en verano con rangos de precipitación anual que van de 1,050 mm a 1,200 mm. La temperatura media anual es de 26 a 28 °C.
Tabla 1
Índice y categoría de perturbación de los 6 sitios seleccionados en México.
| Nombre del sitio | Tipo de sitio | Índice | Nivel |
| Mérida 1 | Huerto en ciudad | 10.33 | Alto |
| Mérida 2 | Huerto en ciudad | 11.35 | Alto |
| Conkal 1 | Huerto periurbano con cultivo de maíz | 2.22 | Medio |
| Conkal 2 | Huerto periurbano con cultivo de maíz | 3.59 | Medio |
| Komchén de los Pájaros 1 | Selva baja caducifolia | 0.78 | Bajo |
| Komchén de los Pájaros 2 | Selva baja caducifolia | 0.81 | Bajo |
Se llevaron a cabo muestreos sistemáticos durante la temporada de lluvias, de julio a diciembre de 2023. En cada nivel de perturbación se instalaron 2 trampas de intercepción tipo Malaise, separadas por más de 2 km, para asegurar la independencia de las muestras; estas trampas fueron seleccionadas por su alta eficacia en la captura pasiva de insectos voladores, incluidos lepidópteros diurnos y nocturnos (Schmidt et al., 2019), además de ser uno de los métodos de muestreo mayormente utilizados para hacer evaluaciones de biodiversidad, y permiten obtener un muestreo representativo de los ensambles presentes en cada sitio (Chan-Canché et al., 2020; Kaczmarek et al., 2022). En los sitios urbanos las trampas fueron colocadas en jardines de casas particulares; en la zona periurbana se colocaron en cultivos de maíz y en la zona natural en parches de vegetación. Las trampas funcionaron ininterrumpidamente durante 5 meses con cortes quincenales de recolecta, resultando un total de 10 muestras por sitio. Los botes recolectores de las trampas tenían 1 L de etanol desnaturalizado al 70%, el cual era reemplazado en cada recolecta. Cada muestra se procesó según las técnicas curatoriales convencionales, en el laboratorio de plagas agrícolas del Instituto Tecnológico de Conkal; todos los insectos se conservaron en etanol al 70% y se seleccionaron algunos ejemplares para su montaje en seco en alfileres entomológicos para su posterior identificación; en el caso de los lepidópteros, se empleó la técnica de relajación en cámara húmeda, extensión de alas sobre planchas entomológicas y posterior secado para su correcta preservación y manejo en la colección. Posteriormente se realizó la identificación taxonómica de los ejemplares a categoría de familia, utilizando claves especializadas en insectos de Latinoamérica, como las de Goulet y Huber (1993), Borror y White (1998), Arnett (2000), Triplehorn y Johnson (2005).
Se analizó la representatividad del muestreo con el software EstimateS 9.10 mediante curvas de acumulación, con el estimador no paramétrico jackknife 1, conocido por ser uno de los estimadores menos sesgados para muestras pequeñas (Magurran, 2004); se utilizaron las 10 fechas de recolecta como medida del esfuerzo de muestreo, con un total de 3,600 horas de recolecta por trampa. Asimismo, se analizaron las diferencias entre la riqueza de familias entre sitios, considerando los intervalos de confianza al 95% de 1,000 remuestreos calculados mediante la prueba de bootstrap (Colwell y Elsensohn, 2014); la no superposición de los intervalos de confianza indica diferencias estadísticamente significativas (Colwell, 2006). Para realizar el análisis de diversidad de insectos en cada nivel de perturbación, las familias identificadas se agruparon considerando el grupo funcional que conforman: fitófagos, polinizadores, parasitoides o depredadores; para cada grupo el análisis de diversidad fue calculado mediante medidas de diversidad verdadera, usando el software SPADE (Chao y Shen, 2010). Estas medidas contemplan 3 niveles de diversidad basadas en los números de Hill, qD (Jost, 2006): 0D, se refiere a la riqueza de familias solamente; 1D, es la diversidad ecológica si todas las familias tuvieran la misma importancia relativa, usa el inverso del exponencial de la entropía de Shannon; y 2D que considera solo a las familias dominantes, mediante el inverso del índice de Simpson (Moreno et al., 2011). Todos los valores de qD se calcularon por separado y se tomó en cuenta cada zona de manera individual (zona urbana, zona periurbana y zona natural), lo que permitió evaluar la diversidad por cada zona de perturbación para después comparar entre sitios, usando intervalos de confianza de 95% que fueron calculados mediante la prueba de bootstrap, para saber si existen diferencias significativas entre zonas, la no superposición de los intervalos de confianza indica diferencias estadísticamente significativas (Colwell, 2006).
Posteriormente, se analizó la composición de los ensambles de cada grupo funcional en términos de la distribución de abundancias de cada familia, para lo que se construyeron curvas de rango-abundancia para cada nivel de perturbación (Whittaker, 1972).
Resultados
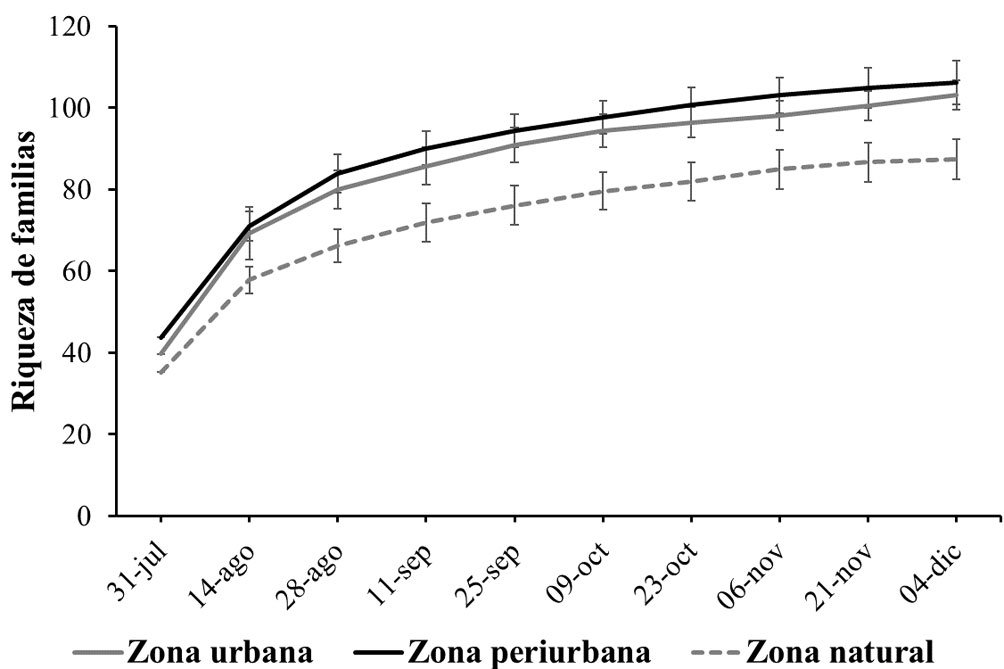
Se recolectaron 25,872 individuos pertenecientes a 4 grupos funcionales: fitófagos, polinizadores, parasitoides y depredadores, clasificados en 12 órdenes y 106 familias (tabla 2). Las curvas de acumulación indican que el muestreo tuvo una eficiencia de 83.4%, (familias observadas = 86; jackknife 1 = 103.1) para la zona urbana, de 84.7% para la zona periurbana (familias observadas = 90; jackknife 1 = 106.2) y de 83.5 % para la zona natural (familias observadas = 73; jackknife 1 = 87.4), con menor riqueza para la zona natural, con intervalos de confianza al 95% (fig. 2).
En el grupo de los fitófagos, la riqueza de familias (0D) y la diversidad de familias dominantes (2D) no mostraron diferencias significativas entre zonas, considerando el sobrelapamiento de los intervalos de confianza al 95%; únicamente la diversidad de familias comunes (1D) muestra que la zona periurbana tiene el valor más alto (tabla 3). La familia Pyralidae se registró dominando en las zonas periurbana y natural, en cambio, la familia Cicadellidae, lo hizo únicamente en la zona urbana (fig. 3A).
Los insectos polinizadores, al igual que los fitófagos, presentaron diferencias en la diversidad de familias comunes (1D), siendo los más diversos en la zona urbana con los intervalos de confianza al 95%. La riqueza (0D) y diversidad de familias dominantes (2D) fueron similares en los 3 sitios (tabla 3). Sin embargo, pese a que la diversidad fue similar, las familias dominantes fueron diferentes en cada nivel de perturbación: Geometridae en los sitios periurbanos con maíz, Nymphalidae en el sitio natural y Erebidae en la zona urbana (fig. 3B).
Tabla 2
Grupos funcionales, órdenes y familias de insectos identificados en un gradiente de perturbación de Yucatán, México.
| Grupo | Orden | Familia | Zona urbana | Zona periurbana | Zona natural | Total |
| Fitófago | Lepidoptera | Pyralidae | 2,298 | 2,117 | 1,459 | 5,874 |
| Crambidae | 219 | 969 | 505 | 1,693 | ||
| Tortricidae | 242 | 363 | 164 | 769 | ||
| Noctuidae | 3 | 286 | 23 | 312 | ||
| Tineidae | 12 | 116 | 54 | 182 | ||
| Oecophoridae | 0 | 1 | 0 | 1 | ||
| Hemiptera | Cicadellidae | 3,063 | 1,034 | 281 | 4,378 | |
| Diaspididae | 309 | 24 | 4 | 337 | ||
| Psyllidae | 1 | 122 | 2 | 125 | ||
| Aphididae | 43 | 11 | 19 | 73 | ||
| Derbidae | 9 | 25 | 3 | 37 | ||
| Cicadidae | 13 | 8 | 10 | 31 | ||
| Cixiidae | 9 | 7 | 7 | 23 | ||
| Liviidae | 19 | 0 | 1 | 20 | ||
| Rhyparochromidae | 1 | 18 | 0 | 19 | ||
| Berytidae | 7 | 3 | 0 | 10 | ||
| Delphacidae | 2 | 6 | 1 | 9 | ||
| Alydidae | 3 | 4 | 0 | 7 | ||
| Membracidae | 3 | 1 | 1 | 5 | ||
| Cercopidae | 4 | 0 | 0 | 4 | ||
| Coreidae | 0 | 4 | 0 | 4 | ||
| Miridae | 0 | 2 | 1 | 3 | ||
| Pentatomidae | 1 | 2 | 0 | 3 | ||
| Pyrrhocoridae | 0 | 3 | 0 | 3 | ||
| Lygaeidae | 0 | 2 | 0 | 2 | ||
| Triozidae | 0 | 0 | 2 | 2 |
| Tropiduchidae | 1 | 1 | 0 | 2 | ||
| Cydnidae | 1 | 0 | 0 | 1 | ||
| Dictyopharidae | 0 | 1 | 0 | 1 | ||
| Rhopalidae | 0 | 1 | 0 | 1 | ||
| Tingidae | 1 | 0 | 0 | 1 | ||
| Diptera | Drosophilidae | 496 | 284 | 98 | 878 | |
| Ulidiidae | 158 | 71 | 47 | 276 | ||
| Tephritidae | 1 | 11 | 8 | 20 | ||
| Psilidae | 1 | 0 | 0 | 1 | ||
| Coleoptera | Chrysomelidae | 48 | 62 | 34 | 144 | |
| Curculionidae | 20 | 19 | 14 | 53 | ||
| Mordellidae | 9 | 1 | 3 | 13 | ||
| Bruchidae | 0 | 2 | 0 | 2 | ||
| Orthoptera | Gryllidae | 5 | 15 | 57 | 77 | |
| Acrididae | 1 | 22 | 6 | 29 | ||
| Tettigoniidae | 1 | 6 | 2 | 9 | ||
| Thysanoptera | Phlaeothripidae | 2 | 13 | 0 | 15 | |
| Thripidae | 1 | 3 | 3 | 7 | ||
| Polinizador | Lepidoptera | Geometridae | 187 | 1,672 | 222 | 2,081 |
| Erebidae | 251 | 1,214 | 390 | 1,855 | ||
| Nymphalidae | 25 | 257 | 1,127 | 1,409 | ||
| Pieridae | 77 | 122 | 119 | 318 | ||
| Hesperiidae | 31 | 82 | 58 | 171 | ||
| Pterophoridae | 12 | 38 | 64 | 114 | ||
| Lycaenidae | 23 | 66 | 14 | 103 | ||
| Riodinidae | 2 | 61 | 0 | 63 | ||
| Sphingidae | 14 | 8 | 1 | 23 | ||
| Diptera | Bombyliidae | 25 | 459 | 66 | 550 | |
| Syrphidae | 25 | 103 | 7 | 135 | ||
| Tipulidae | 6 | 25 | 25 | 56 | ||
| Hymenoptera | Apidae | 25 | 14 | 7 | 46 | |
| Halictidae | 1 | 0 | 0 | 1 | ||
| Parasitoide | Diptera | Tachinidae | 106 | 593 | 158 | 857 |
| Pipunculidae | 13 | 18 | 15 | 46 | ||
| Hymenoptera | Braconidae | 146 | 99 | 78 | 323 | |
| Ichneumonidae | 37 | 114 | 63 | 214 | ||
| Encyrtidae | 114 | 28 | 14 | 156 | ||
| Figitidae | 67 | 2 | 2 | 71 | ||
| Chalcididae | 21 | 23 | 3 | 47 | ||
| Bethylidae | 31 | 4 | 11 | 46 | ||
| Eulophidae | 22 | 5 | 6 | 33 | ||
| Eupelmidae | 14 | 5 | 5 | 24 | ||
| Diapriidae | 12 | 4 | 5 | 21 | ||
| Aphelinidae | 12 | 5 | 2 | 19 | ||
| Pteromalidae | 12 | 4 | 3 | 19 | ||
| Mymaridae | 3 | 0 | 11 | 14 | ||
| Eurytomidae | 9 | 3 | 0 | 12 | ||
| Evaniidae | 5 | 2 | 3 | 10 | ||
| Tiphiidae | 4 | 4 | 1 | 9 | ||
| Trichogrammatidae | 5 | 0 | 3 | 8 | ||
| Perilampidae | 4 | 1 | 1 | 6 | ||
| Chrysididae | 0 | 5 | 0 | 5 | ||
| Platygastridae | 3 | 1 | 0 | 4 | ||
| Eucharitidae | 3 | 0 | 0 | 3 | ||
| Tetracampidae | 0 | 1 | 2 | 3 | ||
| Mutillidae | 0 | 2 | 0 | 2 | ||
| Dryinidae | 0 | 0 | 1 | 1 | ||
| Rhopalosomatidae | 0 | 1 | 0 | 1 | ||
| Depredador | Coleoptera | Coccinellidae | 451 | 118 | 51 | 620 |
| Dytiscidae | 5 | 2 | 1 | 8 | ||
| Carabidae | 2 | 3 | 0 | 5 | ||
| Diptera | Dolichopodidae | 250 | 41 | 25 | 316 | |
| Asilidae | 43 | 140 | 59 | 242 | ||
| Scenopinidae | 0 | 4 | 0 | 4 | ||
| Hemiptera | Anthocoridae | 2 | 2 | 1 | 5 | |
| Reduviidae | 1 | 3 | 0 | 4 | ||
| Stenocephalidae | 1 | 0 | 0 | 1 | ||
| Hymenoptera | Crabronidae | 58 | 16 | 18 | 92 | |
| Vespidae | 20 | 22 | 4 | 46 | ||
| Pompilidae | 5 | 8 | 2 | 15 | ||
| Sphecidae | 3 | 2 | 0 | 5 | ||
| Sapygidae | 0 | 2 | 1 | 3 | ||
| Thynnidae | 0 | 2 | 0 | 2 | ||
| Scoliidae | 0 | 0 | 1 | 1 | ||
| Mantodea | Mantidae | 9 | 17 | 8 | 34 | |
| Mantoididae | 2 | 1 | 0 | 3 | ||
| Mecoptera | Bittacidae | 1 | 0 | 0 | 1 | |
| Neuroptera | Chrysopidae | 24 | 73 | 31 | 128 | |
| Berothidae | 0 | 0 | 1 | 1 | ||
| Myrmeleontidae | 0 | 0 | 1 | 1 |
Los parasitoides, mostraron mayores diferencias en términos de diversidad, siendo la zona urbana la que tuvo la mayor diversidad de especies comunes (1D) y dominantes (2D), pese que la riqueza de familias (0D) fue similar en los 3 niveles de perturbación, según los valores de los intervalos de confianza al 95% (tabla 3). La familia Tachinidae, contrario a lo esperado, se registró como dominante en la zona periurbana y natural, pero en la zona urbana, la familia Braconidae fue la dominante (fig. 3C).
Los insectos depredadores presentaron la misma riqueza de familias (0D) en los diferentes sitios, pero fueron más diversos (1D y 2D) en la zona natural y periurbana, de acuerdo con los intervalos de confianza al 95% (tabla 3) con la familia Asilidae dominando las comunidades más diversas; por el contrario, Coccinellidae dominó las comunidades de la zona urbana (fig. 3D).
Discusión
Los resultados de este trabajo fueron contrarios a nuestra hipótesis de investigación, ya que ésta sugiere que en zonas con altos niveles de perturbación como las ciudades, habría menor diversidad de insectos, principalmente especialistas como los parasitoides, considerando la hipótesis del aumento del disturbio, que indica una disminución en la riqueza de artrópodos, particularmente especialistas, conforme aumenta el grado de urbanización (Gray, 1989, en Fenoglio et al., 2020) y la teoría sobre la complejidad estructural de la vegetación, que afirma que a mayor cobertura vegetal en ecosistemas, habrá un mayor número de plantas disponibles, lo que permitirá alojar mayor diversidad de fitófagos y, por consiguiente, de depredadores y parasitoides (González-Moreno et al., 2023; Guo et al., 2021; Neal et al., 2024).
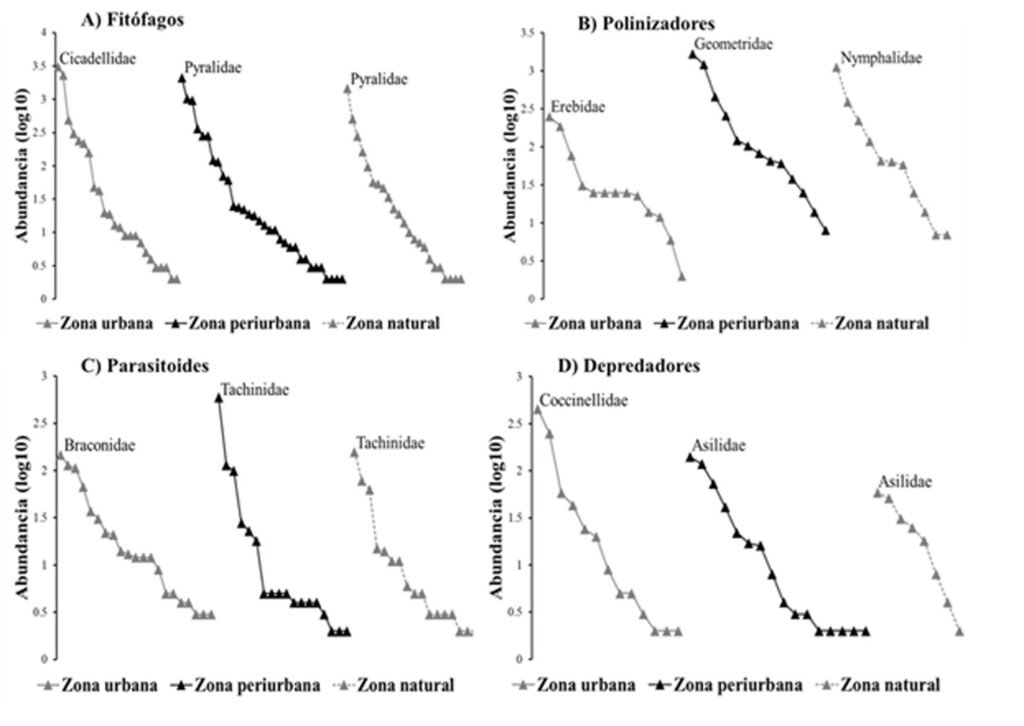
Tabla 3
Diversidad verdadera de grupos funcionales de insectos, como número efectivo de familias, con números de Hill para estimar la riqueza de familias (0D), la diversidad de familias comunes (1D) y la diversidad de familias dominantes (2D) en 3 zonas con diferente nivel de perturbación de Yucatán. *Los intervalos de confianza (IDC) al 95%, indican diferencias significativas.
| Grupos funcionales | Índices de diversidad verdadera | ||
| 0D (95% IDC) | 1D (95% IDC) | 2D (95% IDC) | |
| Fitófagos | |||
| Zona urbana | 50.6 (39.9, 84.8) | 4.8 (4.6, 4.9)* | 3.2 (2.4, 4.1) |
| Zona periurbana | 42.4 (39.0, 56.7) | 7.2 (6.9, 7.4)* | 4.7 (4.0, 5.3) |
| Zona natural | 30.3 (27.7, 43.1) | 5.3 (5.0, 5.6)* | 3.1 (2.5, 3.8) |
| Polinizadores | |||
| Zona urbana | 14.9 (14.1, 25.2) | 6.7 (6.2, 7.2)* | 4.6 (4.2, 5.0) |
| Zona periurbana | 13.0 (13.0, 13.0) | 5.2 (5.0, 5.4)* | 3.7 (3.1, 4.3) |
| Zona natural | 12.5 (12.0, 20.0) | 4.4 (4.2, 4.7)* | 2.9 (2.3, 3.6) |
| Parasitoides | |||
| Zona urbana | 21.0 (21.0, 21.0) | 10.8 (10.0, 11.6)* | 7.7 (7.4, 8.0)* |
| Zona periurbana | 23.6 (22.3, 32.0) | 4.0 (3.6, 4.3)* | 2.3 (1.5, 3.1)* |
| Zona natural | 21.3 (20.2, 29.3) | 6.9 (6.0, 7.8)* | 4.2 (3.6, 4.8)* |
| Depredadores | |||
| Zona urbana | 18.7 (16.4, 31.7) | 4.1 (3.8, 4.5)* | 2.8 (2.0, 3.6)* |
| Zona periurbana | 17.5 (17.0, 22.7) | 7.0 (6.3, 7.7) | 5.0 (4.5, 5.6) |
Las diferencias encontradas en la riqueza de familias de insectos, sin tomar en cuenta su función en los ecosistemas, puede explicarse según la hipótesis de la perturbación media, que propone que la diversidad puede ser mayor en sitios donde la perturbación no es muy frecuente ni muy intensa, comparada con sitios no perturbados o con perturbación intensa (Connell, 1978).
El efecto de la perturbación y heterogeneidad del paisaje sobre la diversidad puede ser diferente dependiendo de la escala de estudio (Corcos et al., 2019), del taxón y del grupo funcional (Fenoglio et al., 2020), como se pudo observar en este trabajo. Las comunidades más diversas de fitófagos se presentaron en los sitios periurbanos con cultivos de maíz, probablemente, por la oferta mayor de alimento que puede representar el cultivo, facilitando el acceso a recursos alimenticios y refugio, que a su vez, favorece una mayor equidad de familias comunes (Landry et al., 2020); además, si consideramos nuevamente la hipótesis del disturbio medio, los sitios periurbanos con un nivel medio de perturbación, estarían alojando mayor diversidad, en este caso de fitófagos. Asimismo, se ha demostrado que zonas perturbadas que integran espacios verdes como parques urbanos, jardines residenciales, huertos verticales y familiares, parcelas de policultivos y parches de vegetación natural, favorecen la diversidad de fitófagos, al proporcionarles recursos alimenticios y refugios suficientes, que les permite adaptarse y prosperar en hábitats alterados por la actividad humana (Landry et al., 2020; Ruiz-Montoya et al., 2014). En los ensambles, la familia Pyralidae fue dominante en las zonas periurbana y natural, debido a su capacidad para aprovechar tanto plantas cultivadas como nativas, lo que le permite alimentarse y completar su ciclo de vida con eficacia (Cepeda, 2017). En cambio, las comunidades de la zona urbana estuvieron dominadas por la familia Cicadellidae, lo que refleja su adaptación a ambientes con altos niveles de perturbación (Trivellone et al., 2021).
La mayor diversidad de polinizadores en ciudad puede estar relacionada con la variabilidad y abundancia de recursos florales de los jardines, parques y áreas verdes presentes en los sitios, al proporcionar ciertas fuentes polínicas que favorecen dicha diversidad; estos resultados son contrarios a la que esperábamos si se considera la teoría sobre el espectro de polinización, que afirma, que a mayor cobertura vegetal en los ecosistemas, habrá un mayor número de plantas con flores, lo que permitirá alojar mayor diversidad de polinizadores. Sin embargo, es importante señalar que esta diversidad estuvo representada por familias de lepidópteros y no por abejas, debido probablemente a que estas últimas son de los grupos más sensibles a la contaminación de las ciudades (Roguz et al., 2023). Aunque se ha demostrado que en áreas urbanas, cuando se crean nuevos hábitats o refugios, como hoteles para polinizadores, jardines florales y corredores de flores silvestres, la diversidad de polinizadores tiende a incrementarse (Francini et al., 2022; Persson et al., 2023); pero el grupo de polinizadores varía dependiendo de ciertos factores asociados a la urbanización, por ejemplo, los abejorros son muy sensibles a la contaminación de las ciudades (Roguz et al., 2023); pero otros grupos pueden tener la capacidad de alimentarse en entornos urbanos (McLeod et al., 2021), como las mariposas (Lepidoptera: Papilionoidea) que son más tolerantes a la urbanización que otros polinizadores como sírfidos, moscas abejorros (Diptera: Syrphidae, Bombyliidae) y abejas (Hymenoptera: Apoidea) (Ávalos-Hernández et al., 2024). Es importante señalar que la diversidad observada es de familias consideradas comunes, lo que está reflejando la adaptación de ciertos polinizadores generalistas, que se adaptan rápidamente a las condiciones altamente perturbadas y son capaces de aprovechar la oferta floral de estos sitios (Deguines et al., 2016; Neumann et al., 2024). Las familias dominantes encontradas en este trabajo se han registrado interactuando con varias especies de plantas en jardines urbanos, realizando la función de polinización (Wonderlin et al., 2019). Geometridae fue dominante en los huertos periurbanos con maíz, probablemente porque son lepidópteros que disminuyen en sitios más urbanizados (Gaona et al., 2021); Nymphalidae fue dominante en la vegetación natural y Erebidae en la ciudad; esto es relevante porque las áreas urbanas y agrícolas alteran los patrones de comportamiento de los lepidópteros nocturnos debido a la luz artificial, mientras que los lepidópteros diurnos en áreas naturales reflejan su dependencia de hábitats con bajo impacto humano (Seymoure, 2018).
La diversidad de parasitoides encontrada, también fue contraria a los patrones esperados, ya que, a mayor cobertura vegetal en los ecosistemas, habrá un mayor número de hospederos disponibles, lo que permitirá alojar mayor diversidad de parasitoides (Parsons y Frank, 2019). Esto puede explicarse por la denso-dependencia de los parasitoides a sus hospederos, incluso en ciudades (Rocha y Fellowes, 2018), probablemente, porque las trampas se colocaron en jardines de casas particulares, los cuales tenían diferentes especies vegetales, ornamentales, frutales y arbustivas que ofrecían microhábitats y recursos alimenticios a los hospederos y por consiguiente a sus parasitoides (Klaus et al., 2024; Lucatero et al., 2024; Start et al., 2020). Otra razón de los valores elevados de diversidad en la zona urbana, puede explicarse por la habilidad de dispersión de los bracónidos, ya que se ha comprobado que los artrópodos que ocupan altos niveles tróficos como depredadores y parasitoides, serán exitosos en sitios urbanos, si tienen alta capacidad de dispersión (Korányi et al., 2022). Tachinidae, que no ha sido registrada como una familia particularmente abundante para la región, fue dominante en los huertos periurbanos con maíz y la vegetación natural; además no es una familia de parasitoides hiperdiversa en comparación con los himenópteros parasitoides, por lo que es menos probable de encontrarse como dominante en los sitios (Kankonda et al., 2018). Por otra parte, se ha registrado que la abundancia de esta familia disminuye en áreas con altas densidades de edificios y calles que actúan como barreras que dificultan la dispersión de los individuos, así como la localización de sus hospederos (Corcos et al., 2019). Por el contrario, la familia Braconidae dominó los sitios de zonas urbanas, lo que podría sugerir su adaptación a ambientes altamente perturbados (Koptur et al., 2024), además de que se ha demostrado que la urbanización favorece especies generalistas capaces de explotar diferentes recursos, como podría ser el caso de Braconidae, parasitoides con mayor variedad en estrategias de desarrollo y biología.
Los depredadores fueron más diversos en áreas periurbanas con maíz y selva, al contrario de los parasitoides, que fueron más diversos en ciudad, probablemente porque al ocupar nichos similares, estén evitando la competencia. Cabe destacar que los depredadores, estuvieron representados mayoritariamente por diferentes familias del orden Coleoptera, que es uno de los grupos de insectos más afectados por la urbanización en términos de riqueza de especies, pero no de abundancia (Fenoglio et al., 2020). Aunque los coleópteros depredadores pueden aprovechar más eficientemente la oferta extendida del alimento que otros enemigos naturales, al adaptarse mejor a los cambios ambientales por urbanización (Gardiner et al., 2021; Liere y Cowal, 2024); como se observó en nuestros resultados, Coccinellidae fue dominante únicamente en la zona urbana, lo que confirma que son los depredadores mejor adaptados a la urbanización, por su capacidad para prosperar en las condiciones microclimáticas características de este ambiente (Kawakami et al., 2016; Meseguer et al., 2024). En cambio, Asilidae fue dominante en las zonas periurbana con maíz y natural, lo que puede reflejar su mayor supervivencia en zonas menos modificadas por la actividad humana (Pascacio-Villafán y Cohen, 2023).
Las diferencias de diversidad observadas para los diferentes ensambles de insectos, reflejan que las zonas urbanas pueden inducir cambios en las comunidades de insectos, e incluso, en algunos casos, favorecer esta diversidad. Pero, esto solo funcionará para cierto grupo de organismos que tengan estrategias tipo “r”, con hábitos generalistas y alta capacidad de dispersión y adaptación, que los hace exitosos en ambientes urbanos (Martinson y Raupp, 2013), como ciertas especies de avispas que pueden ser resistentes a la urbanización (Christie y Hochuli, 2009), como en nuestros resultados representadas por Braconidae; también familias que estén mejor adaptadas a ambientes con altos niveles de perturbación y que pueden colonizar nuevos hábitats creados por la actividad humana y volverse dominantes dentro de las comunidades al verse favorecidas por factores ambientales como la temperatura y la humedad (Adams et al., 2020; Sire et al., 2022). Sin embargo, los resultados contrastantes reportados en la literatura sobre los efectos de la urbanización sobre las comunidades de artrópodos (Arnold, 2022), sugieren que es prioritario continuar con esta línea de investigación.
En conclusión, la riqueza de insectos en sitios con distintos niveles de perturbación fue similar; sin embargo, se encontraron diferencias en la diversidad de familias comunes, esto resulta relevante debido a que los análisis se realizaron a un nivel taxonómico alto, de familia, donde normalmente es difícil detectar variaciones significativas en diversidad. Cabe destacar, que las diferencias fueron con las familias consideradas comunes, que probablemente sean las que presentan biologías generalistas que les permite adaptarse a condiciones adversas como las que existen en zonas perturbadas.
Contrario a lo esperado, la mayor diversidad de insectos no se encontró en la vegetación natural, sino que fue en los sitios periurbanos con cultivos de maíz, con niveles de perturbación moderados, con la familia Pyralidae dominando las comunidades. En la zona urbana, con el mayor grado de perturbación, los grupos de insectos más diversos fueron parasitoides y polinizadores con las familias Tachinidae y Erebidae, representando la dominancia de cada grupo funcional, respectivamente. Por el contrario, en la zona de menor perturbación, como fue la vegetación natural, únicamente los depredadores presentaron la mayor diversidad de insectos, con la familia Asilidae como dominante.
Agradecimientos
Los autores agradecen al Tecnológico Nacional de México por el financiamiento del proyecto “Huertos familiares y conservación de la diversidad de entomofauna benéfica” (clave: 20070.24-P) y al Consejo Nacional de Humanidades, Ciencia y Tecnología por la beca de posgrado otorgada al primer autor. También agradecemos a Xiomara Gálvez Aguilera, directora de la asociación Caribbean Conservation Coastal Ecosistem A.C., por permitirnos el acceso a la reserva privada “Komchen de los pájaros”.
Referencias
Adams, B. J., Li, E., Bahlai, C. A., Meineke, E. K., McGlynn, T. P. y Brown, B. V. (2020). Local and landscape scale variables shape insect diversity in an urban biodiversity hotspot. Ecological Applications, 30, e02089. https://doi.org/10.1002/eap.2089
Ávalos-Hernández, O., Trujano-Ortega, M., Ortega-Álvarez, R., Martínez-Fuentes, R. G., Calderón-Parra, R., García-Luna, F. et al. (2024). How does urbanization affect the fauna of the largest urban forest in Mexico? Urban Forestry and Urban Greening, 92, 128191. https://doi.org/10.1016/j.ufug.2023.128191
Arnold, J.E. (2022). Biological control services from parasitic Hymenoptera in urban agriculture. Insects, 13, 467. https://doi.org/10.3390/insects13050467
Arnett Jr., R. H. (2000). American insects: a handbook of the insects of America North of Mexico. Boca Ratón, Florida: CRC Press. https://doi.org/10.1201/9781482273892
Betancourt, E. O. M., Batis, B. V., Quiala, A. P., García, Y. M. R., Madariaga, M. C. y González, R. M. (2021). Diversidad de insectos benéficos asociada a la flora existente en fincas suburbanas en Santiago de Cuba, Cuba. Revista Chilena de Entomología, 47, 121–145. https://doi.org/10.35249/rche.47.1.21.13
Betts, M. G., Wolf, C., Pfeifer, M., Banks-Leite, C., Arroyo-Rodríguez, V., Ribeiro, D. B. et al. (2019). Extinction filters mediate the global effects of habitat fragmentation on animals. Science, 366, 1236–1239. https://doi.org/10.1126/science.aax9387
Biella, P., Tommasi, N., Guzzetti, L., Pioltelli, E., Labra, M. y Galimberti, A. (2022). City climate and landscape structure shape pollinators, nectar and transported pollen along a gradient of urbanization. Journal of Applied Ecology, 59, 1586–1595. https://doi.org/10.1111/1365-2664.14168
Biles, J. J. y Lemberg, D. S. (2023). A multi-scale analysis of urban warming in residential areas of a Latin American city: the case of Mérida, Mexico. Journal of Planning Education and Research, 43, 881–896. https://doi.org/10.1177/0739456X20923002
Borror, D. J. y White, R. E. (1998). A field guide to insects: America North of Mexico (Peterson field guides). Boston: Houghton Mifflin Harcourt.
Boyes, D. H., Evans, D. M., Fox, R., Parsons, M. S. y Pocock, M. J. (2021). Is light pollution driving moth population declines? A review of causal mechanisms across the life cycle. Insect Conservation and Diversity, 14, 167–187. https://doi.org/10.1111/icad.12447
Cepeda, D. E. (2017). Introducción a los Phycitinae de Chile (Lepidoptera: Pyralidae), nuevo registro y descripción de una nueva especie del género Homoeographa Ragonot, 1888. Insecta Mundi, 556, 1–9.
Chan-Canché, R., Ballina-Gómez, H., Leirana-Alcocer, J., Bordera, S. y González-Moreno, A. (2020). Sampling of parasitoid Hymenoptera: influence of the height on the ground. Journal of Hymenoptera Research, 78, 19–31. https://doi.org/10.3897/jhr.78.54309
Chao, A. y Shen, T.J. (2010). User’s guide for program SPADE (Species Prediction and Diversity Estimation). Taiwan: National Tsing Hua University.
Christie, F. J. y Hochuli, D. F. (2009). Responses of wasp communities to urbanization: effects on community resilience and species diversity. Journal of Insect Conservation, 13, 213–221. https://doi.org/10.1007/s10841-008-9146-5
Colwell, R. K. (2006). EstimateS: statistical estimation of species richness and shared species from samples. Versión 8 [consultado 18 Abr 2025]. Recuperado de: http://purl.oclc.org/estimates
Colwell, R. K. y Elsensohn, J. E. (2014). EstimateS turns 20: Statistical estimation of species richness and shared species from samples, with non parametric extrapolation. Ecography, 37, 609–613.
Connell, J. (1978). Diversity in tropical rain forests and coral reefs. Science, 199, 1304–1310. https://doi.org/10.1126/science.199.4335.1302
Corcos, D., Cerretti, P., Caruso, V., Mei, M., Falco, M. y Marini, L. (2019). Impact of urbanization on predator and parasitoid insects at multiple spatial scales. Plos One, 14, e0214068. https://doi.org/10.1371/journal.pone.0214068
Cortés-Arzola, S. V. y León-Cortés, J. L. (2021). Response of beetle assemblages (Insecta: Coleoptera) to patch characteristics and habitat complexity in an ever-expanding urban landscape in the Yucatán Peninsula, Mexico. Annals of the Entomological Society of America, 114, 511–521. https://doi.org/10.1093/aesa/saab017
Deguines, N., Julliard, R., De Flores, M. y Fontaine, C. (2016). Functional homogenization of flower visitor communities with urbanization. Ecology and Evolution, 6, 1967–1976. https://doi.org/10.1002/ece3.2009
Dirzo, R., Young, H. S., Galetti, M., Ceballos, G., Isaac, N. J. y Collen, B. (2014). Defaunation in the Anthropocene. Science, 345, 401–406. https://doi.org/10.1126/science.1251817
Fahrig, L., Arroyo-Rodríguez, V., Bennett, J. R., Boucher-Lalonde, V., Cazetta, E., Currie, D. J. et al. (2019). Is habitat fragmentation bad for biodiversity? Biological Conservation, 230, 179–186. https://doi.org/10.1016/j.biocon.2018.12.026
Fenoglio, M. S., Rossetti, M. R. y Videla, M. (2020). Negative effects of urbanization on terrestrial arthropod communities: a meta-analysis. Global Ecology and Biogeography, 29, 1412–1429. https://doi.org/10.1111/geb.13107
Fisogni, A., Hautekèete, N., Piquot, Y., Brun, M., Vanappelghem, C., Michez, D. et al. (2020). Urbanization drives an early spring for plants but not for pollinators. Oikos, 129, 1681–1691. https://doi.org/10.1111/oik.07274
Flores, J. S. y Espejel, I. (1994). Tipos de vegetación de la Península de Yucatán. Etnoflora yucatanense, Fascículo 3. Mérida: Universidad Autónoma de Yucatán.
Francini, A., Romano, D., Toscano, S. y Ferrante, A. (2022). The contribution of ornamental plants to urban ecosystem services. Earth, 3, 1258–1274. https://doi.org/10.3390/earth
3040071
Gaona, F. P., Íñiguez-Armijos, C., Brehm, G., Fiedler, K. y Espinosa, C. I. (2021). Drastic loss of insects (Lepidoptera: Geometridae) in urban landscapes in a tropical biodiversity hotspot. Journal of Insect Conservation, 25, 395–405. https://doi.org/10.1007/s10841-021-00308-9
Gardiner, M. M., Perry, K. I., Riley, C. B., Turo, K. J., Delgado-de la Flor, Y. A. y Sivakoff, F. S. (2021). Community science data suggests that urbanization and forest habitat loss threaten aphidophagous native lady beetles. Ecology and Evolution, 11, 2761–2774. https://doi.org/10.1002/ece3.7229
González-Moreno, A., Bordera, S., Ballina-Gómez, H. y Leirana-Alcocer, J. (2023). Age matters: variations in parasitoid diversity along a successional gradient in a dry semi-deciduous tropical forest. Bulletin of Entomological Research, 113, 604–614. https://doi.org/10.1017/S0007485323000287
Goulet, H. y Huber, J. T. (1993). Hymenoptera of the World: an identification guide to families. Ottawa: Agriculture Canada, Research Branch.
Guo, P. F., Wang, M. Q., Orr, M., Li, Y., Chen, J.T., Zhou, Q. S. et al. (2021). Tree diversity promotes predatory wasps and parasitoids but not pollinator bees in a subtropical experimental forest. Basic and Applied Ecology, 53, 134–142. https://doi.org/10.1016/j.baae.2021.03.007
Janzen, D. H. y Hallwachs, W. (2021). To us insectometers, it is clear that insect decline in our Costa Rican tropics is real, so let’s be kind to the survivors. Proceedings of the National Academy of Sciences, 118, e2002546117. https://doi.org/10.1073/pnas.2002546117
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Kaczmarek, M., Entling, M. H. y Hoffmann, C. (2022). Using malaise traps and metabarcoding for biodiversity assessment in vineyards: Effects of weather and trapping effort. Insects, 13, 507. https://doi.org/10.3390/insects13060507
Kankonda, O. M., Akaibe, B. D., Sylvain, N. M. y Le Ru, B. P. (2018). Response of maize stemborers and associated parasitoids to the spread of grasses in the rainforest zone of Kisangani, DR Congo: effect on stemborers biological control. Agricultural and Forest Entomology, 20, 150–161. https://doi.org/10.1111/afe.12238
Kawakami, Y., Yamazaki, K. y Ohashi, K. (2016). Population dynamics, seasonality and aphid prey of Cheilomenes sexmaculata (Coleoptera: Coccinellidae) in an urban park in central Japan. European Journal of Entomology, 113, 192–199. https://doi.org/10.14411/eje.2016.023
Klaus, F., Tscharntke, T. y Grass, I. (2024). Trophic level and specialization moderate effects of habitat loss and land-
scape diversity on cavity nesting bees, wasps, and their parasitoids. Insect Conservation and Diversity, 17, 65–76. https://doi.org/10.1111/icad.12688
Koptur, S., Primoli, A. S., Paulino-Neto, H. F. y Whitfield, J. (2024). Pierid butterflies, legume hostplants, and parasitoids in urban areas of Southern Florida. Insects, 15, 123. https://doi.org/10.3390/insects15020123
Korányi, D., Egerer, M., Rusch, A., Szabó, B. y Batáry, P. (2022). Urbanization hampers biological control of insect pests: a global meta-analysis. Science of the Total Environment, 834, 155396. https://doi.org/10.1016/j.scitotenv.2022.155396
Landry, B., Basset, Y., Hebert, P. D. y Maes, J. M. (2020). On the Pyraloidea fauna of Nicaragua. Tropical Lepidoptera Research, 30, 93–102.
Liere, H. y Cowal, S. (2024). Local and landscape factors differentially influence predatory arthropods in urban agroecosystems. Ecosphere, 15, e4816. https://doi.org/10.
1002/ecs2.4816
Lucatero, A., Smith, N. R., Bichier, P., Liere, H. y Philpott, S. M. (2024). Shifts in host–parasitoid networks across community garden management and urban landscape gradients. Ecosphere, 15, e4833. https://doi.org/10.1002/ecs2.4833
Magurran, A. E. (2004). Measuring biological diversity. Oxford: Blackwell Publishing.
Martínez-Ramos, M., Pingarroni, A., Rodríguez-Velázquez, J., Toledo-Chelala, L., Zermeño-Hernández, I. y Bongers, F. (2016). Natural forest regeneration and ecological restoration in human modified tropical landscapes. Biotropica, 48, 745–757. https://doi.org/10.1111/btp.12382
Martinson, H. M. y Raupp, M. J. (2013). A meta-analysis of the effects of urbanisation on ground beetle communities. Ecosphere, 4, 1–24. https://doi.org/10.1890/ES12-00262.1
Martorell, C. y Peters, E. M. (2005). The measurement of chronic disturbance and its effects on the threatened cactus Mammillaria pectinifera. Biological Conservation, 124, 199–207. https://doi.org/10.1016/j.biocon.2005.01.025
Mc Leod, B. C., Águila, M. K., Zegers, M. G. y Cárcamo, G. J. (2021). Refugio u “Hoteles de Insectos”, simulación de hábitat para el establecimiento de fauna auxiliar. Punta Arenas, Chile: Informativo INIA Kampenaike. Núm. 110. Recuperado el 15 de enero, 2025 de: https://hdl.handle.net/20.500.14001/67359
Meseguer, R., Madeira, F., Kavallieratos, N. G. y Pons, X. (2024). Phenology, population trends and natural enemy complex of Illinoia liriodendri in Spain. Phytoparasitica, 52, 40. https://doi.org/10.1007/s12600-024-01145-7
Moreno, C. E., Barragán, F., Pineda, E. y Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249–1261. https://doi.org/10.22201/ib.20078706e.2011.4.745
Muñoz-Urias, A., Araujo-Alanis, L., Huerta-Martínez, F. M., Jacobo-Pereira, C. y Razo-León, A. E. (2025). Effects of urbanization and floral diversity on the bee community (Hymenoptera, Apoidea) in an oak forest in a Protected Natural Area of Mexico. Journal of Hymenoptera Research, 98, 47–68. https://doi.org/10.3897/jhr.98.131191
Neal, W., Araya, Y. y Wheeler, P. M. (2024). Influence of canopy structural complexity on urban woodland butterfly species richness. Journal of Insect Conservation, 28, 1051–1062. https://doi.org/10.1007/s10841-024-00594-z
Neumann, A. E., Conitz, F., Karlebowski, S., Sturm, U., Schmack, J. M. y Egerer, M. (2024). Flower richness is key to pollinator abundance: the role of garden features in cities. Basic and Applied Ecology, 79, 102–113. https://doi.org/10.1016/j.baae.2024.06.004
Parsons, S. E. y Frank, S. D. (2019). Urban tree pests and natural enemies respond to habitat at different spatial scales. Journal of Urban Ecology, 5, juz010. https://doi.org/10.1093/jue/juz010
Pascacio-Villafán, C. y Cohen, A. C. (2023). How rearing systems for various species of flies benefit humanity. Insects, 14, 553. https://doi.org/10.3390/insects14060553
Persson, A. S., Hederström, V., Ljungkvist, I., Nilsson, L. y Kendall, L. (2023). Citizen science initiatives increase pollinator activity in private gardens and green spaces. Frontiers in Sustainable Cities, 4, 1099100. https://doi.org/10.3389/frsc.2022.1099100
Ramírez-Restrepo, L. R. y Halffter, G. (2013). Butterfly diversity in a regional urbanization mosaic in two Mexican cities. Landscape and Urban Planning, 115, 39–48.
https://doi.org/10.1016/j.landurbplan.2013.03.005
Rocha, E. A. y Fellowes, M. D. E. (2018). Does urbanization explain differences in interactions between an insect herbivore and its natural enemies and mutualists? Urban Ecosystems, 21, 405–417. https://doi.org/10.1007/s11252-017-0727-5
Rocha-Ortega, M. y Castaño-Meneses, G. (2015). Effects of urbanization on the diversity of ant assemblages in tropical dry forests, Mexico. Urban ecosystems, 18, 1373–1388. https://doi.org/10.1007/s11252-015-0446-8
Roguz, K., Chiliński, M., Roguz, A. y Zych, M. (2023). Pollination of urban meadows. Plant reproductive success and urban-related factors influencing frequency of pollinators visits. Urban Forestry and Urban Greening, 84, 127944. https://doi.org/10.1016/j.ufug.2023.127944
Ruiz-Montoya, L., Alias, V. L. A., Alias, V. D. J., Guillén, D. T. A. y de la Mora, E. L. F. (2014). Diversidad y distribución de familias de insectos en el Cerrito de San Cristóbal. En L.Ruiz-Montoya (Coord.), Diversidad biológica y enriquecimiento florístico del Cerrito de San Cristóbal (pp. 39–56). El Colegio de la Frontera Sur.
Rzedowski, J. (1978). Vegetación de México. México D.F.: Limusa.
Schmidt, O., Schmidt S., Häuser, C., Hausmann, A. y Van Vu, L. (2019). Using Malaise traps for collecting Lepidoptera (Insecta), with notes on the preparation of Macrolepidoptera from ethanol. Biodiversity Data Journal, 7, e32192. https://doi.org/10.3897/BDJ.7.e32192
Seymoure, B. M. (2018). Enlightening butterfly conservation efforts: the importance of natural lighting for butterfly behavioral ecology and conservation. Insects, 9, 22. https://doi.org/10.3390/insects9010022
Sire, L., Yáñez, P. S., Wang, C., Bézier, A., Courtial, B., Cours, J. et al. (2022). Climate-induced forest dieback drives compositional changes in insect communities that are more pronounced for rare species. Communications Biology, 5, 57. https://doi.org/10.1038/s42003-021-02968-4
Start, D., Barbour, M. A. y Bonner, C. (2020). Urbanization reshapes a food web. Journal of Animal Ecology, 89, 808–816. https://doi.org/10.1111/1365-2656.13136
Tavares-Brancher, K. P., Graf, L. V., Ferreira-Júnior, W. G., Faria, L. D. B. y Zenni, R. D. (2024). Plant-pollinator interactions in the neotropics are affected by urbanization and the invasive bee Apis mellifera. Journal of Insect Conservation, 28, 251–261. https://doi.org/10.1007/s10841-024-00547-6
Triplehorn, C. A. y Johnson, N. F. (2005). Borror and Delong’s introduction to the study of insects. 7th Edition. Independence, KY: Cengage Learning.
Trivellone, V., Forte, V., Filippin, L. y Dietrich, C. H. (2021). First records of the North American leafhopper Gyponana mali (Hemiptera: Cicadellidae) invading urban gardens and agroecosystems in Europe. Acta Entomologica Musei Nationalis Pragae, 61, 213–219. https://doi.org/10.37520/aemnp.2021.011
Vergnes, A, Pellissier, V, Lemperiere, G, Rollard, C. y Clergeau, P. (2014). Urban densification causes the decline of ground-dwelling arthropods. Biodiversity and Conservation, 23, 1859–1877. https://doi.org/10. 1007/s10531-014-0689-3
Wagner, D. L., Grames, E. M., Forister, M. L., Berenbaum, M. R. y Stopak, D. (2021). Insect decline in the Anthropocene: Death by a thousand cuts. Proceedings of the National Academy of Sciences, 118, e2023989118. https://doi.org/10.1073/pnas.2023989118
Whittaker, R. H. (1972). Evolution and measurement of species diversity. Taxon, 21, 213–251. https://doi.org/10.2307/1218190
Wonderlin, N. E., Rumfelt, K. y White, P. J. (2019). Associations between nocturnal moths and flowers in urban gardens: evidence from pollen on moths. The Journal of the Lepidopterists’ Society, 73, 173–176. https://doi.org/10.18473/lepi.73i3.a6