Karen Ayala-Galván a, *, José Manuel Gutiérrez-Salcedo a y Jose Ernesto Mancera-Pineda b
a Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andréis”, Grupo de Investigación en Taxonomía, Sistemática y Ecología Marina, Calle 25 Núm. 2-55, Playa Salguero, Santa Marta D.T.C.H., Magdalena, Colombia
b Universidad Nacional de Colombia, Grupo de Investigación en Modelación de Ecosistemas Costeros, Carrera 45 Núm. 26-85, Ciudad Universitaria, Teusaquillo, Bogotá D.C., Colombia
*Autor para correspondencia: ayalakarenc08@gmail.com (K. Ayala-Galván)
Resumen
Para las aguas oceánicas del Caribe colombiano existe un número limitado de publicaciones sobre la composición específica del fitoplancton, la mayoría es literatura gris. Hasta la fecha, se reportan para el Caribe colombiano 328 especies de diatomeas y 185 especies de dinoflagelados, que son principalmente registros en aguas neríticas. Con el fin de ampliar el conocimiento de la riqueza y aumentar el listado taxonómico existente en aguas oceánicas, se analizó la composición fitoplanctónica en la provincia oceánica del Caribe central colombiano, en un área estratégica que comprende 35,874 km2, representa 7.5% de las aguas oceánicas y se ubica frente a la influencia del río Magdalena. Para esto, se recolectaron 108 muestras entre 2015 y 2017 con botellas Niskin a 10, 80 y 250 m, y arrastres verticales con redes de 20 µm de poro de malla en los primeros 50 m. Se identificaron 287 taxones pertenecientes a dinoflagelados, diatomeas, cianobacterias, clorofitas, silicoflagelados, cocolitofóridos, criptofitas, carofitas y bigiros, encontrando mayor riqueza de dinoflagelados (61.32%) y diatomeas (30.64%). El listado taxonómico comprende 184 especies, 74 nuevos registros para la cuenca del Caribe colombiano; se incrementa la composición específica para dinoflagelados en 27.03% y para diatomeas en 2.44%.
Palabras clave: Comunidad fitoplanctónica; Mesoescala; Zona oceánica; Listado taxonómico
Phytoplanktonic richness and new records of dinoflagellates, diatoms, coccolithophorids and bigyrids in oceanic waters of the Colombian Caribbean
Abstract
For the oceanic waters of the Colombian Caribbean there is a limited number of publications on the specific composition of phytoplankton, most of which are in gray literature. To date, 328 species of diatoms and 185 species of dinoflagellates have been reported for the Colombian Caribbean, mainly from neritic waters. In order to expand the knowledge of the richness and increase the existing taxonomic list in oceanic waters, the phytoplankton composition was analyzed in the oceanic province of the central Colombian Caribbean, in a strategic area that comprises 35,874 km2, represents 7.5% of the oceanic waters and is located in front of the influence of the Magdalena River. For this, 108 samples were collected between 2015 and 2017 with Niskin bottles at 10, 80 and 250 m, and vertical trawls with 20 µm mesh pore nets in the first 50 m. A total of 287 taxa belonging to dinoflagellates, diatoms, cyanobacteria, chlorophytes, silicoflagellates, coccolithophorids, cryptophytes, carophytes and bygira were identified, finding greater richness of dinoflagellates (61.32%), and diatoms (30.64%). The taxonomic list includes 184 species, with 74 new records reported for the Colombian Caribbean basin, increasing the specific composition for dinoflagellates by 27.03% and for diatoms by 2.44%.
Keywords: Phytoplankton community; Mesoscale; Oceanic zone; Taxonomic listing
Introducción
El fitoplancton se ha estudiado a lo largo de la historia en diferentes lugares del mundo y se reconoce como el principal productor primario de los ambientes marinos. Sin embargo, su análisis es un reto debido a que es una comunidad dinámica y su composición, densidad y distribución pueden variar drásticamente con el tiempo, desde variabilidad decenal (Henson et al., 2009), interanual (Westberry et al., 2016), estacional (Holligan y Harbour, 1977), y hasta ciclos de marea (Davidson et al., 2013). A pesar de ser objetivo de muchas investigaciones, su conocimiento en las provincias neríticas y oceánicas de diferentes latitudes es muy irregular, lo que no es ajeno al mar Caribe colombiano.
Ubicado en la parte más interna de la cuenca semicerrada del Caribe, el mar Caribe colombiano posee aguas de gran extensión, con 30,219 km2 de aguas costeras y 501,935 km2 de aguas oceánicas (INVEMAR, 2015). Estas últimas tienen un sistema complejo y se ven afectadas en la parte central por una convergencia de procesos como el clima, corrientes y giros marinos, eventos de surgencia, y un dominio costero que incide en las descargas continentales principalmente del río Magdalena, que dan lugar a la modificación de los reguladores ambientales y a la disposición de recursos, los cuales son determinantes en la composición, estructura y biomasa fitoplanctónica (Álvarez-León et al., 1995; Andrade y Barton, 2005; Bernal et al., 2006; Ricaurte-Villota y Bastidas-Salamanca, 2017).
La gran extensión de aguas oceánicas y los diferentes procesos que influyen en ellas dificultan operacionalmente los muestreos y aumentan los costos de estudio, éste es uno de los motivos por los cuales los análisis de fitoplancton marino se encuentran seccionados en diferentes áreas y se encuentran enfocados, principalmente, a una escala local (> 1 km) (Ávila-Silva, 2018; Ayala-Galván et al., 2017, 2018, 2021; Campos-González, 2007; Garay et al., 1988; Garrido-Linares, Alonso-Carvajal, Gutiérrez-Salcedo et al., 2014; Garrido-Linares, Alonso-Carvajal, Rueda et al., 2014; INVEMAR et al., 2017; INVEMAR-ANH, 2012; Ricaurte-Villota et al., 2018; Téllez et al., 1988; Vides y Alonso, 2016); con excepción de algunos análisis que se han realizado a gran escala (> 1,000 km) como los de INVEMAR-ANH (2008), INVEMAR-ANH (2010), Lozano-Duque et al. (2010a), Salón (2013) y Ayala-Galván y Gutiérrez-Salcedo (2019). Aunque los objetivos de estos estudios incluyen caracterizaciones, descripción de los atributos ecológicos e identificación de patrones espaciales o temporales, la información se encuentra restringida debido a que la mayoría de trabajos se encuentran en literatura gris, con algunas excepciones (Ayala-Galván et al., 2022; Garay et al., 1988; Lozano-Duque et al., 2010a). En este contexto, se ha identificado que la mayoría de trabajos del fitoplancton marino en aguas oceánicas provienen de estudios técnicos entre la alianza institucional entre el Instituto de Investigaciones Marinas y Costeras (INVEMAR) y la Agencia Nacional de Hidrocarburos (ANH) de Colombia, por lo que se espera dar mayor visibilidad a esta información, enfocando el objetivo de este trabajo en conocer la riqueza del fitoplancton marino en aguas oceánicas.
Materiales y métodos
El área de estudio comprende 27 sitios de muestreo que se encuentran ubicados en la provincia oceánica de la región central de la cuenca del Caribe colombiano, sobre el abanico sedimentario del Magdalena (Molina et al., 1994), frente al litoral costero comprendido entre los departamentos de Sucre y Magdalena. Tiene un área total de 35,874 km2 con una distancia mínima de la costa de aproximadamente 20 km y máxima de 296 km y con una profundidad entre 400 y 4,500 m (fig. 1).
Para la recolecta de muestras y datos se realizaron 3 campañas de muestreo en los años 2015, 2016 y 2017, que para los análisis corresponden a sectores (tabla 1). En cada estación se realizó un arrastre vertical con una red cónica de 2.2 m de longitud, con diámetro de boca de 0.58 m y 20 µm de poro de malla (tabla 2). El material biológico recolectado se almacenó en contenedores de plástico de 500 ml y se fijó con formalina neutralizada con bórax (tetraborato de sodio) quedando una solución final concentrada al 4% (Boltovskoy, 1981). Adicionalmente, en cada estación se muestrearon 3 profundidades, de las cuales 2 pertenecen a la zona epipelágica (ep) y corresponden a las masas de agua: agua superficial del Caribe (ASC) y agua subsuperficial subtropical (ASS); y una pertenece a la zona mesopelágica (mp) que corresponde a la masa de agua ASS (tabla 2). Para ésto, se realizó el lance de una roseta oceanográfica equipada con botellas Niskin de 10 L de capacidad, de los cuales se almacenaron 800 ml de agua en contenedores de plástico forrados con vinipel negro (para evitar la penetración de la luz) y se les adicionó 8 ml de lugol ácido en proporción 1:100.
Tabla 1
Coordenadas geográficas de las estaciones de muestreo de la comunidad fitoplanctónica en el Caribe central colombiano. Época climática (Pujos et al., 1986): inicio (+) final (–) foco (*).
| Sector | Época | Estación | Fecha | Coordenadas decimales de la estación | |
| (día-mes-año) | Latitud | Longitud | |||
| Central | Lluvia (–) Seca (+) | 409 | 19/11/2015 | 12.0833330 | -74.12500000 |
| 412 | 21/11/2015 | 12.4166670 | -74.37500000 | ||
| 414 | 22/11/2015 | 12.2500000 | -74.62500000 | ||
| 416 | 24/11/2015 | 12.0833330 | -74.87500000 | ||
| 418 | 25/11/2015 | 12.4166670 | -74.87500000 | ||
| 421 | 29/11/2015 | 11.9166670 | -75.12500000 | ||
| 425 | 01/12/2015 | 12.0833330 | -75.37500000 | ||
| 431 | 02/12/2015 | 11.7500000 | -75.62500000 | ||
| 433 | 12/12/2015 | 11.5833330 | -75.87500000 | ||
| Externo | Seca (–) | 435 | 09/04/2016 | 12.9166670 | -74.12500000 |
| 437 | 10/04/2016 | 12.5833330 | -74.12500000 | ||
| 444 | 12/04/2016 | 12.5833330 | -74.62500000 | ||
| 446 | 14/04/2016 | 12.7500000 | -74.87500000 | ||
| 451 | 15/04/2016 | 12.4211390 | -75.10350000 | ||
| 456 | 17/04/2016 | 12.9166670 | -75.37500000 | ||
| 459 | 18/04/2016 | 12.7500000 | -75.62500000 | ||
| 462 | 19/04/2016 | 12.4166670 | -75.87500000 | ||
| 466 | 20/04/2016 | 12.0833330 | -75.62500000 | ||
| 467 | 21/04/2016 | 12.0833330 | -75.87500000 | ||
| Interno | Lluvia (*) | 555 | 23/09/2017 | 11.3242194 | -74.77517500 |
| 557 | 24/09/2017 | 11.2579280 | -75.31736700 | ||
| 559 | 02/10/2017 | 11.9754720 | -74.05918300 | ||
| 561 | 03/10/2017 | 11.8466639 | -74.39910556 | ||
| 564 | 04/10/2017 | 11.9823806 | -74.99378333 | ||
| 566 | 07/10/2017 | 11.5472722 | -75.18444444 | ||
| 567 | 26/09/2017 | 11.7407390 | -75.39539700 | ||
| 570 | 08/10/2017 | 11.4804944 | -75.83584722 |
Tabla 2
Información asociada a las 108 muestras en el área de estudio.
| Año | Sector | Núm. de estaciones | Análisis | Método | Profundidad (metros) | Núm. de muestras |
| 2015 | Central | 9 | Cualitativo | Red | 20 – 0 m | 9 |
| Cuantitativo | Botella | ASC-ep (10 m) | 27 | |||
| ASS-ep (80 m) | ||||||
| ASS-mp (250 m) | ||||||
| 2016 | Externo | 10 | Cualitativo | Red | 20 – 0 m | 10 |
| Cuantitativo | Botella | ASC-ep (10 m) | 30 | |||
| ASS-ep (80 m) | ||||||
| ASS-mp (250 m) | ||||||
| 2017 | Interno | 8 | Cualitativo | Red | 50 – 0 m | 8 |
| Cuantitativo | Botella | ASC-ep (30m) | 24 | |||
| ASS-ep (80m) | ||||||
| ASS-mp (250m) |
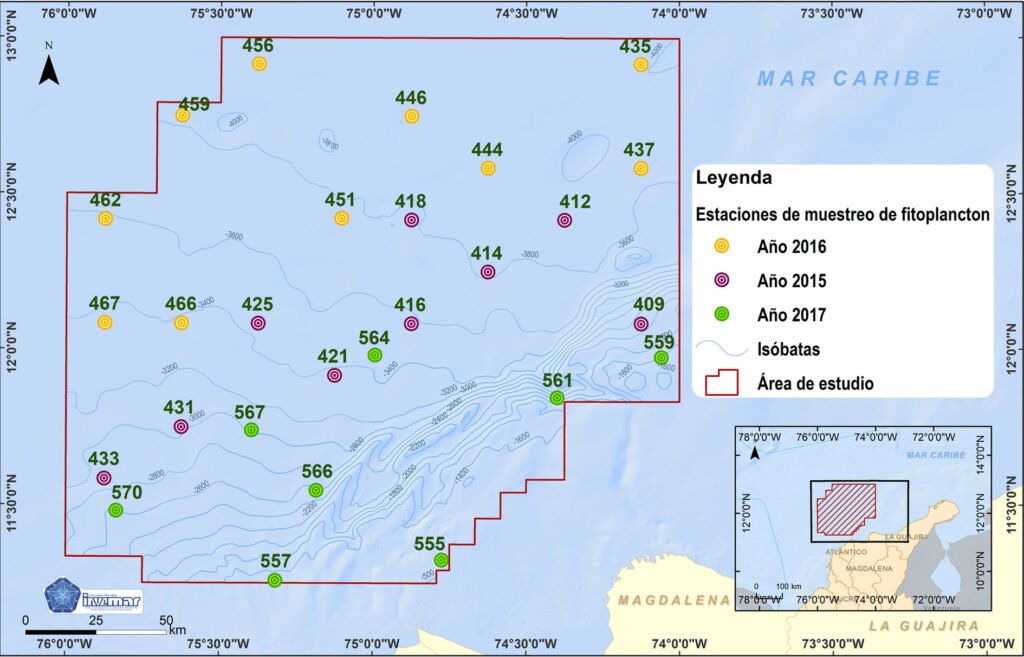
Figura 1. Área de estudio, ubicada en el centro de la cuenca del Caribe colombiano. Fuente: Laboratorio de sistemas de información – LabSIS/ INVEMAR.
Las muestras de red se revisaron por alícuotas (0.125 ml) mediante una gráfica de morfoespecies acumulada (Ramírez, 1999). Las muestras de botella se revisaron con el método Utermöhl, que se encuentra detallado en el manual de fitoplancton de Edler y Elbrächter (2010). Las células se observaron en un microscopio invertido marca Leica Microsystems modelo DMi1, con objetivos de 20X, 40X y 63X, las fotografías se tomaron con una cámara Leica Microsystems MC120 HD y fueron procesadas con el software de adquisición de imágenes LAS EZ. La identificación se realizó por morfología al nivel más bajo posible siguiendo las claves taxonómicas de Cupp (1943), Wood (1963), Taylor (1976), Balech (1988), Round (1990), Tomas (1997), Vidal (2010), Hoppenrath et al. (2009), entre otras. La información taxonómica se tabuló y actualizó siguiendo la nomenclatura de la base de datos mundial de algas AlgaeBase (Guiry y Guiry, 2025). Luego de la identificación y análisis, todas las muestras biológicas se depositaron en la colección de plancton del Museo de Historia Natural Marina de Colombia MAKURIWA.
Con el fin de generar una descripción completa a nivel de composición, se unificaron las matrices de presencia de las muestras con red y de botellas Niskin. Se realizó una descripción general de las categorías taxonómicas encontradas y de la riqueza a nivel horizontal. Así mismo, se describió la riqueza por grupo fitoplanctónico y solo en el caso de los 2 géneros más representativos (Tripos Bory, 1823 y Chaetoceros Ehrenberg, 1844) se detalló la variación horizontal. Además, se mencionan las especies frecuentes y raras para el área de estudio. Finalmente, al inventario se le realizó la verificación de registros nuevos de especies basados en listados previos para el Caribe colombiano.
La riqueza de especies (S) se calculó con el programa Primer V7 (Clarke y Gorley, 2015) y las salidas gráficas con el programa Ocean Data View, a las que se les realizó una interpolación de variación de datos DIVA (Schlitzer, 2022). Para esta última se consideró cada estación como una réplica aleatoria, teniendo en cuenta que, las características conservativas que separan las masas de agua oceánicas del Caribe central colombiano se dan de forma estratificada (Dorado-Roncancio et al., 2022).
Resultados
Mediante los muestreos con redes y botellas Niskin, en el Caribe central colombiano se registraron en total 287 taxones fitoplanctónicos, que se distribuyeron en 90 géneros, 60 familias, 37 órdenes, 13 clases y 8 phyla (Dinoflagellata, Heterokontophyta, Cyanobacteria, Chlorophyta, Haptophyta, Cryptista, Charophyta y Bigyra). El listado taxonómico se encuentra detallado en la tabla 3; 89% de las identificaciones se llevó a los 2 niveles taxonómicos más bajos, 64% se identificó a nivel de especie (184 taxones) y 25% a género (71 taxones), mientras que otro 11% estuvo en los demás niveles (32 taxones).
El número de taxones por estación osciló entre 74 y 149. Las mayores riquezas se registraron en las estaciones paralelas y más cercanas a la costa (570, 561, 566, 557, 559, 555), se reconocieron entre 130 y 149 taxones, y se observaron menores riquezas en las estaciones centrales ubicadas al oriente (418, 414, 416, 412, 421), con 74 a 88 taxones (fig. 2).
De los grupos fitoplanctónicos hallados en el Caribe central colombiano, los dinoflagelados y las diatomeas representaron 91.98% de la riqueza total. Los dinoflagelados mostraron mayor riqueza con 61.32% (S = 176), seguido de las diatomeas con 30.66% (S = 88). Con menores riquezas se encontraron las cianobacterias con 4.53% (S = 13), las clorofitas con 1.39% (S = 4), los silicoflagelados con 0.70% (S = 2), mientras que las carofitas, criptofitas, cocolitofóridos y bigiros, presentaron cada uno, una riqueza de 0.35% (S = 1).
El género con mayor riqueza fue Tripos Bory, 1823 del grupo de los dinoflagelados con 14.29% (S = 41), éste presentó por estación entre 8 y 22 taxones y horizontalmente mostró un aumento de riqueza hacia aguas más oceánicas (fig. 3A). Seguido, se encontró Chaetoceros Ehrenberg, 1844 del grupo de las diatomeas con 7.32% (S = 21), que presentó por estación entre 1 y 6 taxones y horizontalmente mostró una disminución de riqueza hacia aguas más oceánicas (fig. 3B). Otros géneros con riquezas representativas incluyeron a los dinoflagelados Protoperidinium Bergh, 1881con 3.83% (S = 11), Ornithocercus Stein, 1883 con 3.14% (S = 9), Prorocentrum Ehrenberg, 1834 con 3.14% (S = 9), Phalacroma F. Stein, 1883 con 2.79% (S = 8), Histioneis Stein, 1883con 2.79% (S = 8), Dinophysis Ehrenberg, 1839 con 2.79%(S = 8) y las diatomeas Rhizosolenia Brightwell, 1858 nom. et typ. cons., con 2.79% (S = 8), los demás géneros mostraron riquezas inferiores a 2%.
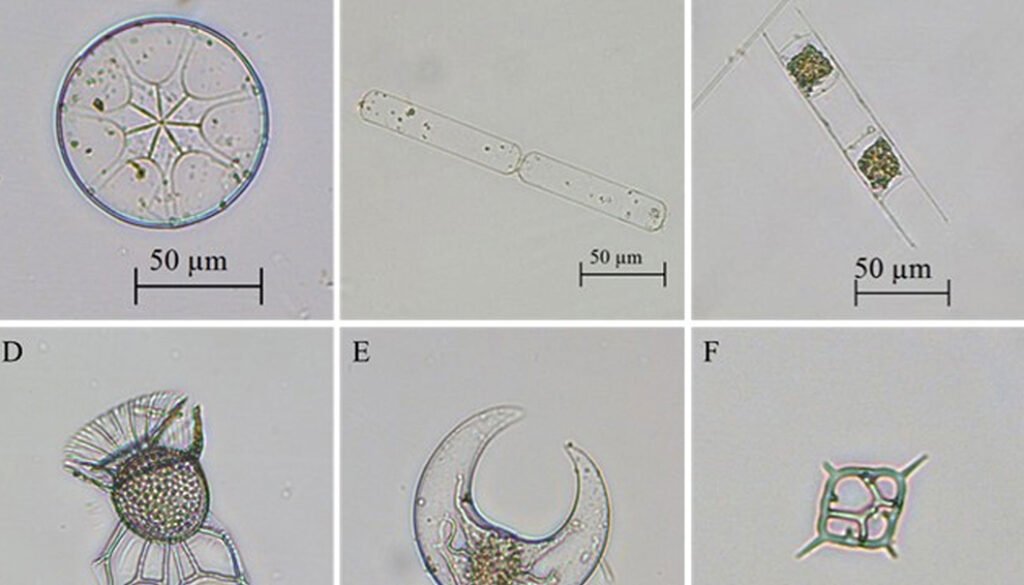
Con una frecuencia superior a 80%, en las estaciones se registraron las especies de diatomeas: Asterolampra marylandica Ehrenberg, 1844 (fig. 4A), Cerataulina pelágica (Cleve) Hendey, 1937 (fig. 4B), Chaetoceros lorenzianus Grunow, 1863, C. peruvianus Brightwell, 1856, Hemiaulus hauckii Grunow ex Van Heurck, 1882 (fig. 4C), H. chinensis Greville, 1865, Pseudosolenia calcar-avis (Schultze) B.G. Sundström, 1986, Thalassionema frauenfeldii (Grunow) Tempère et Peragallo, 1910; los dinoflagelados: Ornithocercus magnificus F. Stein, 1883 (fig. 4D), Oxytoxum laticeps J. Schiller, 1937, Podolampas elegans F. Schütt, 1895, P. palmipes F. Stein, 1883, Prorocentrum compressum (Bailey) T.H. Abé ex J.D. Dodge, 1975, Pyrocystis lunula (F. Schütt) F. Schütt, 1896 (fig. 4E), P. pseudonoctiluca Wyville-Thompson, 1876, Tripos extensus (Gourret) F. Gómez, 2021, T. setaceus (Jørgesen) F. Gómez, 2013, T. teres (Kofoid) F. Gómez, 2013, T. trichoceros (Ehrenberg) Gómez, 2013, Karlodinium sp. J. Larsen, 2000, Gyrodinium sp. Kofoid et Swezy, 1921, nom. cons. y el silicoflagelado Dictyocha fibula Ehrenberg, 1839 (fig. 4F).
Tabla 3
Listado taxonómico y autoridades del fitoplancton marino encontrado en aguas oceánicas del Caribe central colombiano. * Nuevo registro de especie; ** nuevo registro de género; + nuevo registro de categorías superiores (familia, orden, clase, phylum). BT, Recolectada en muestra de botella; RD, recolectada en muestra de red. ^, Estatus taxonómico sin resolver.
| Tabla 3 Listado taxonómico y autoridades del fitoplancton marino encontrado en aguas oceánicas del Caribe central colombiano. * Nuevo registro de especie; ** nuevo registro de género; + nuevo registro de categorías superiores (familia, orden, clase, phylum). BT, Recolectada en muestra de botella; RD, recolectada en muestra de red. ^, Estatus taxonómico sin resolver. |
| Diatomeas céntricas |
| Asterolampra marylandica Ehrenberg, 1844 | BT | RD |
| Asteromphalus elegans Greville, 1859 * | BT | RD |
| Asteromphalus heptactis (Brébisson) Ralfs, 1861 | RD |
| Bacteriastrum delicatulum Cleve, 1897 | BT | RD |
| Cerataulina bicornis (Ehrenberg) Hasle, 1985 * | RD |
| Cerataulina pelagica (Cleve) Hendey, 1937 | BT | RD |
| Chaetoceros affinis Lauder, 1864 | BT | RD |
| Chaetoceros atlanticus Cleve, 1873 | BT |
| Chaetoceros coarctatus Lauder, 1864 | BT | RD |
| Chaetoceros curvisetus Cleve, 1889 | BT | RD |
| Chaetoceros dadayi Pavillard, 1913 * | BT | RD |
| Chaetoceros danicus Cleve, 1889 | BT |
| Chaetoceros decipiens Cleve, 1873 | BT | RD |
| Chaetoceros didymus Ehrenberg, 1845 | BT |
| Chaetoceros diversus Cleve, 1873 | BT | RD |
| Chaetoceros laciniosus F. Schütt, 1895 | BT | RD |
| Chaetoceros lorenzianus Grunow, 1863 | BT | RD |
| Chaetoceros messanensis Castracane, 1875 | BT |
| Chaetoceros peruvianus Brightwell, 1856 | BT | RD |
| Climacodium frauenfeldianum Grunow, 1868 * | RD |
| Coscinodiscus gigas Ehrenberg, 1841| RD |
| Dactyliosolen blavyanus (H. Peragallo) Hasle, 1975 * | BT | RD |
| Dactyliosolen mediterraneus (H. Peragallo) H. Peragallo, 1892 | BT |
| Eucampia cornuta (Cleve) Grunow, 1883 | BT |
| Guinardia cylindrus (Cleve) Hasle, 1996 | BT | RD |
| Guinardia flaccida (Castracane) H. Peragallo, 1892 | BT | RD |
| Guinardia striata (Stolterfoth) Hasle, 1996 | BT | RD |
| Hemiaulus hauckii Grunow ex Van Heurck, 1882 | BT | RD |
| Hemiaulus membranaceus Cleve, 1873 | BT | RD |
| Hemiaulus chinensis Greville, 1865 | BT | RD |
| Leptocylindrus danicus Cleve, 1889 | BT | RD |
| Melosira inflexa (Roth) Guiry, 2019 | BT | RD |
| Neocalyptrella robusta (G. Norman ex Ralfs) Hernández-Becerril et Meave, 1997 | BT | RD |
| Planktoniella sol (G. C. Wallich) Schütt, 1892 | BT | RD |
| Pseudoguinardia recta Stosch, 1986 * | BT | RD |
| Pseudosolenia calcar-avis (Schultze) B. G. Sundström, 1986 | BT | RD |
| Rhizosolenia clevei Ostenfeld, 1902 | BT | RD |
| Rhizosolenia debyana H. Peragallo, 1892 * | RD |
| Skeletonema costatum (Greville) Cleve, 1873 | BT | RD |
| Trieres chinensis (Greville) Ashworth et E. C. Theriot, 2013 | RD |
| Cyclotella sp. (Kützing) Brébisson, 1838, nom. et typ. cons. | BT |
| Lithodesmium sp.Ehrenberg, 1839 | BT | RD |
| Bacteriastrum spp. Shadbolt, 1853 | BT | RD |
| Chaetoceros spp. Ehrenberg, 1844 | BT | RD |
| Coscinodiscus spp. Ehrenberg, 1839, nom. et typ. cons. | BT | RD |
| Proboscia spp. Sundström, 1986 | BT | RD |
| Rhizosolenia spp. Brightwell, 1858, nom. et typ. cons. | BT | RD |
Diatomeas pennadas |
| Asterionellopsis glacialis (Castracane) Round, 1990 | BT | RD |
| Cylindrotheca closterium (Ehrenberg) Reimann et J. C. Lewin, 1964 | BT | RD |
| Haslea wawrikae (Husedt) Simonsen, 1974 | BT | RD |
| Lioloma pacificum (Cupp) Hasle, 1996 | BT | RD |
| Mastogloia rostrata (Wallich) Hustedt, 1933 * | BT | RD |
| Thalassionema frauenfeldii (Grunow) Tempère et Peragallo, 1910 | BT | RD |
| Thalassionema nitzschioides (Grunow) Mereschkowsky, 1902 | BT | RD |
| Diploneis sp. Ehrenberg ex Cleve, 1894 | BT |
| Fragilaria sp. Lyngbye, 1819 | BT | RD |
| Gyrosigma sp. Hassall, 1845, nom. cons. | BT |
| Pseudo-nitzschia sp. H. Peragallo, 1900 | BT | RD |
| Tryblionella sp. W. Smith, 1853 | BT |
| Haslea sp. Simonsen, 1974 | BT | RD |
| Navicula spp. Bory, 1822 | BT | RD |
| Nitzschia spp. Hassall, 1845, nom. cons. | BT | RD |
Dinoflagelados tecados |
| Amphisolenia bidentata B. Schröder, 1900 | RD |
| Amphisolenia bifurcata G. Murray et Whitting, 1899 | RD |
| Amphisolenia globifera F. Stein, 1883 | RD |
| Amphisolenia schauinslandii Lemmermann, 1899 * | BT | RD |
| Amphisolenia schroederi Kofoid, 1907 * | RD |
| Centrodinium maximum Pavillard, 1930 * | ** | RD |
| Centrodinium punctatum (Cleve) F. J. R. Taylor, 1976 * | ** | RD |
| Ceratocorys armata (Schütt) Kofoid, 1910 | RD |
| Ceratocorys horrida Stein, 1883 | RD |
| Citharistes apsteinii F. Schütt, 1895 * | RD |
| Citharistes regius Stein, 1883 * | RD |
| Cladopyxis brachiolata F. Stein, 1883 | RD |
| Corythodinium biconicum (Kofoid) F. J. R. Taylor, 1976 * | BT | RD |
| Corythodinium constrictum (F. Stein) F. J. R. Taylor, 1976 * | BT | RD |
| Corythodinium milneri (G. Murray et Whitting) F. Gómez, 2017 | BT | RD |
| Corythodinium tesselatum (F. Stein) Loeblich Jr. et Loeblich III, 1966 * | BT | RD |
| Corythodinium robustum (Kofoid et J. R. Michener) F. Gómez, 2017 * | RD |
| Dinophysis apicata (Kofoid et Skogsberg) Abé, 1967 * | RD |
| Dinophysis capitulata Balech, nom. inválido. 1967 ^ | RD |
| Dinophysis exigua Kofoid et Skogsberg, 1928 * | BT | RD |
| Dinophysis hastata F. Stein, 1883 | RD |
| Dinophysis hindmarchii (G. Murray et Whitting) Balech, 1967 * | RD |
| Dinophysis ovum F. Schütt, 1895 * | RD |
| Dinophysis parvula (F. Schütt) Balech, 1967 * | BT | RD |
| Dinophysis schuettii G. Murray et Whitting, 1899 * | BT | RD |
| Dinophysis caudata Kent, 1881 | RD |
| Gonyaulax birostris Stein, 1883 * | BT | RD |
| Gonyaulax pacifica Kofoid, 1907 * | RD |
| Histioneis biremis F. Stein, 1883 * | RD |
| Histioneis costata Kofoid et J. R. Michener, 1911 * | RD |
| Histioneis crateriformis Stein, 1883 * | RD |
| Histioneis depressa J. Schiller, 1928 * | RD |
| Histioneis longicollis Kofoid, 1907 * | RD |
| Histioneis mediterranea J. Schiller, 1928 * | RD |
| Histioneis milneri G. Murray et Whitting, 1899 * | RD |
| Histioneis paraformis (Kofoid et Skogsberg) Balech, 1971 * | RD |
| Ornithocercus carolinae Kofoid, 1907 * | RD |
| Ornithocercus heteroporus Kofoid, 1907 | RD |
| Ornithocercus magnificus F. Stein, 1883 | BT | RD |
| Ornithocercus quadratus Schütt, 1900 | RD |
| Ornithocercus skogsbergii T. H. Abé, 1967 * | RD |
| Ornithocercus splendidus F. Schütt, 1892 | RD |
| Ornithocercus steinii Schütt, 1900 | RD |
| Ornithocercus thumii (A. W. F. Schmidt) Kofoid et Skogsberg, 1928 | RD |
| Oxytoxum elongatum E. J. F. Wood, 1963 * | BT | RD |
| Oxytoxum laticeps J. Schiller, 1937 * | BT |
| Oxytoxum mitra (F. Stein) Schröder, 1906 * | BT | RD |
| Oxytoxum sceptrum (F. Stein) Schröder, 1900 * | BT | RD |
| Oxytoxum scolopax F. Stein, 1883 | BT | RD |
| Phalacroma circumcinctum Kofoid et J. R. Michener, 1911 * | RD |
| Phalacroma cuneus F.Schütt, 1895 | RD |
| Phalacroma doryphorum F. Stein, 1883 | BT | RD |
| Phalacroma expulsum (Kofoid et J. R. Michener) Kofoid et Skogsberg, 1928 * | RD |
| Phalacroma mitra F. Schütt, 1895 | RD |
| Phalacroma oxytoxoides (Kofoid) F. Gomez, P. Lopez-Garcia et D. Moreira, 2011 | BT | RD |
| Phalacroma rapa F. Stein, 1883 | RD |
| Phalacroma scrobiculatum (Balech) Díaz-Ramos et G. J. Estrella, 2000 * | RD |
| Podolampas bipes F. Stein, 1883 | RD |
| Podolampas elegans F. Schütt, 1895 | BT | RD |
| Podolampas palmipes F. Stein, 1883 | BT | RD |
| Podolampas reticulata Kofoid, 1907 | RD |
| Podolampas spinifera Okamura, 1912 | BT | RD |
| Prorocentrum compressum (Bailey) T. H. Abé ex J. D. Dodge, 1975 | BT | RD |
| Prorocentrum concavum Y. Fukuyo, 1981 * | BT | RD |
| Prorocentrum dentatum F. Stein, 1883 | BT |
| Prorocentrum micans Ehrenberg, 1834 | RD |
| Prorocentrum rostratum F. Stein, 1883 * | BT |
| Protoperidinium cf. cassum (Balech) Balech, 1974 | RD |
| Protoperidinium cf. oviforme (P. J. L. Dangeard) Balech, 1974 | RD |
| Protoperidinium cf. sphaeroideum (Mangin) Balech, 1974 | RD |
| Protoperidinium elegans (Cleve) Balech, 1974 | RD |
| Protoperidinium oceanicum (Vanhöffen) Balech, 1974 | RD |
| Pyrocystis fusiformis C. W. Thomson, 1876 | RD |
| Pyrocystis hamulus var. Inaequalis Schröder, 1906 | RD |
| Pyrocystis lanceolata Schröder, 1900 * | RD |
| Pyrocystis lunula (F. Schütt) F. Schütt, 1896 * | BT | RD |
| Pyrocystis pseudonoctiluca Wyville-Thompson, 1876 * | BT | RD |
| Pyrocystis robusta Kofoid, 1907 | RD |
| Pyrophacus steinii (Schiller) Wall et Dale, 1971 | RD |
| Schuettiella mitra (Schütt) Balech, 1988 * | ** | RD |
| Spiraulax jolliffei (G. Murray y Whitting) Kofoid, 1911 | RD |
| Triadinium polyedricum (Pouchet) J. D. Dodge, 1981 | RD |
| Tripos arcuatus (Gourret) F. Gómez, 2021 | RD |
| Tripos arietinus (Cleve) F. Gómez, 2021 | RD |
| Tripos azoricus (Cleve) F. Gómez, 2013 | BT | RD |
| Tripos belone (Cleve) F. Gómez, 2021 | RD |
| Tripos bigelowii (Kofoid) F. Gómez, 2013 | RD |
| Tripos brevis (Ostenfeld et Johannes Schmidt) F. Gómez, 2021 | RD |
| Tripos candelabrum (Ehrenberg) F. Gómez, 2013 | RD |
| Tripos carriensis (Gourret) Hallegraeff et Huisman, 2013 | BT | RD |
| Tripos dens (Ostenfeld et Johannes Schmidt) F. Gómez, 2013 | RD |
| Tripos digitatus (F.Schütt) F. Gómez, 2013 | RD |
| Tripos extensus (Gourret) F. Gómez, 2021 | RD |
| Tripos falcatus (Kofoid) F. Gómez, nom. inval. 2013 ^ | RD |
| Tripos furca (Ehrenberg) F. Gómez, 2013 | BT | RD | RD |
| Tripos fusus (Ehrenberg) F. Gómez, 2013 | BT | RD |
| Tripos geniculatus (Lemmermann) F. Gómez, 2021 | RD |
| Tripos gibberus (Gourret) F. Gómez, 2021 | RD |
| Tripos gracilis (Pavillard) F. Gómez, 2013 | RD |
| Tripos gravidus (Gourret) F. Gómez, 2013 | RD |
| Tripos hexacanthus (Gourret) F. Gómez, 2013 | RD |
| Tripos inflatus (Kofoid) F. Gómez, 2013 | RD |
| Tripos karstenii (Pavillard) F. Gómez, 2021 | RD |
| Tripos lanceolatus (Kofoid) F. Gómez, 2013 * | RD |
| Tripos limulus (Pouchet) F. Gómez, 2021 | RD |
| Tripos longirostrum (Gourret) Hallegraeff et Huisman 2020 | RD |
| Tripos lunula (Schimper ex Karsten) F. Gómez, 2013 | RD |
| Tripos macroceros (Ehrenberg) Hallegraeff et Huisman, 2020 | BT | RD |
| Tripos massiliensis (Gourret) F. Gómez, 2021 | RD |
| Tripos muelleri Bory, 1826 | RD |
| Tripos pentagonus (Gourret) F. Gómez, 2021 | BT | RD |
| Tripos pulchellus (Schröder) F. Gómez, 2021 | RD |
| Tripos ranipes (Cleve) F. Gómez, 2013 | RD |
| Tripos reflexus (Cleve) F. Gómez, 2013 | RD |
| Tripos robustus (Ostenfeld et Johannes Schmidt) F. Gómez, 2021 | RD |
| Tripos schroeteri (B.Schröder) F. Gómez, 2013 * | RD |
| Tripos setaceus (Jørgesen) F. Gómez, 2013 | BT | RD |
| Tripos tenuis (Ostenfeld et Johannes Schmidt) Hallegraeff et Huisman, 2020 | RD |
| Tripos teres (Kofoid) F. Gómez, 2013 | BT | RD |
| Tripos trichoceros (Ehrenberg) Gómez, 2013 | BT | RD |
| Tripos volans (Cleve) F. Gómez, 2021 | RD |
| Tripos vultur Cleve, 1900 | RD |
| Alexandrium sp. Halim, 1960 | RD |
| Blepharocysta sp. Ehrenberg, 1873 | RD |
| Heterocapsa sp. F. Stein, 1883 | BT | RD |
| Scrippsiella sp. Balech, 1965, nom. cons. | BT | RD |
| Amphidoma sp. F. Stein, 1883 ** | BT | RD |
| Azadinium spp. Elbrächter et Tillmann, 2009 ** | BT | RD |
| Prorocentrum spp. Ehrenberg, 1834 | BT | RD |
| Ornithocercus spp. Stein, 1883 | RD |
| Protoperidinium spp. Bergh, 1881 | BT | RD |
| Gonyaulax spp. Diesing, 1866 | BT | RD |
| Tripos sp. Bory, 1823 | RD |
Dinoflagelados atecados |
| Asterodinium gracile Sournia, 1972 * | BT |
| Brachidinium capitatum F. J. R. Taylor, 1963 * | ** | BT |
| Ceratoperidinium margalefii A. R. Loeblich III, 1980 * | ** | BT |
| Karenia papilionacea A. J. Haywood et K. A. Steidinger, 2004 * | BT |
| Kofoidinium pavillardii J. Cachon et M. Cachon, 1967 * | ** | RD |
| Pronoctiluca spinifera (Lohmann) Schiller, 1932 | BT |
| Pseliodinium fusus (F. Schütt) F. Gómez, 2018 | BT |
| Torodinium robustum Kofoid et Swezy, 1921 * | BT |
| Torodinium teredo (Pouchet) Kofoid et Swezy, 1921 * | BT |
| Gyrodinium sp. Kofoid et Swezy, 1921, nom. cons. | BT |
| Karlodinium sp. J. Larsen, 2000 ** | BT |
| Cucumeridinium spp. F. Gómez, P. López-García, H. Takayama et D. Moreira, 2015 ** | RD |
| Karenia spp. Gert Hansen et Moestrup, 2000 | BT | RD |
| Kofoidinium sp. Pavillard, 1929 ** | BT |
Cianobacterias |
| Merismopedia elegans A. Braun ex Kützing, 1849 | RD |
| Oscillatoria limosa C. Agardh ex Gomont, 1892 | RD |
| Richelia intracellularis J. Schmidt, 1901 | BT | RD |
| Komvophoron sp. Anagnostidis et Komárek, 1988 | RD |
| Planktothrix sp. Anagnostidis et Komárek, 1988 | RD |
| Pseudanabaena sp. Lauterborn, 1915 | RD |
| Trichodesmium sp. Ehrenberg ex Gomont, 1892, nom. cons. | BT | RD |
Clorófitas |
| Pyramimonas longicauda L.Van Meel, 1969 | BT |
| Tetradesmus lagerheimii M. J. Wynne et Guiry, 2016 | RD |
| Desmodesmus sp. (Chodat) S. S. An, T.Friedl et E. Hegewald, 1999 | BT | RD |
| Pediastrum sp. Meyen, 1829 | RD |
Silicoflagelados |
| Dictyocha fibula Ehrenberg, 1839 | BT | RD |
| Octactis octonaria (Ehrenberg) Hovasse, 1946 | BT | RD |
Carófita |
| Staurastrum sp. Meyen ex Ralfs, 1848 | RD |
Cocolitofórido |
| Scyphosphaera apsteinii Lohmann, 1902 * | BT | RD |
Criptófita |
| Cryptomonadaceae Ehrenberg, 1831 | BT |
Bigiro |
| Solenicola setigera Pavillard, 1916 * | ** | + | BT |
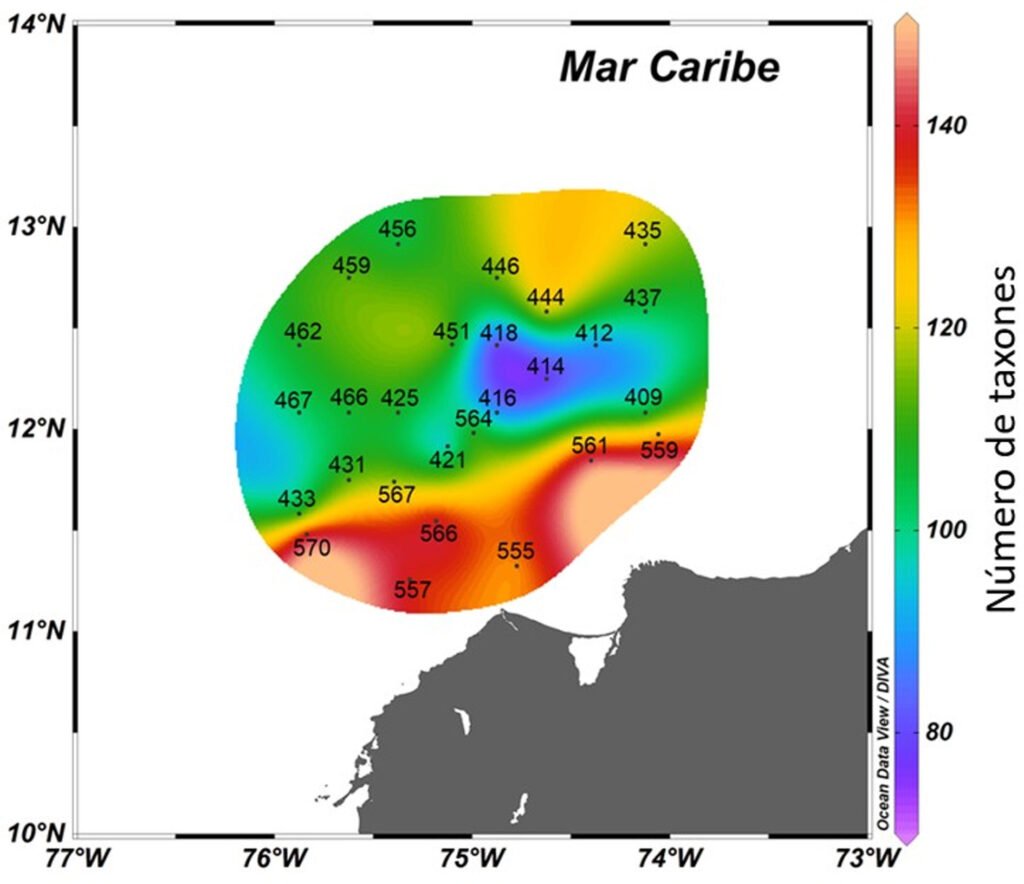
Figura 2.Distribución de la riqueza total del fitoplancton marino en el Caribe central colombiano a partir de las muestras de red y botella.
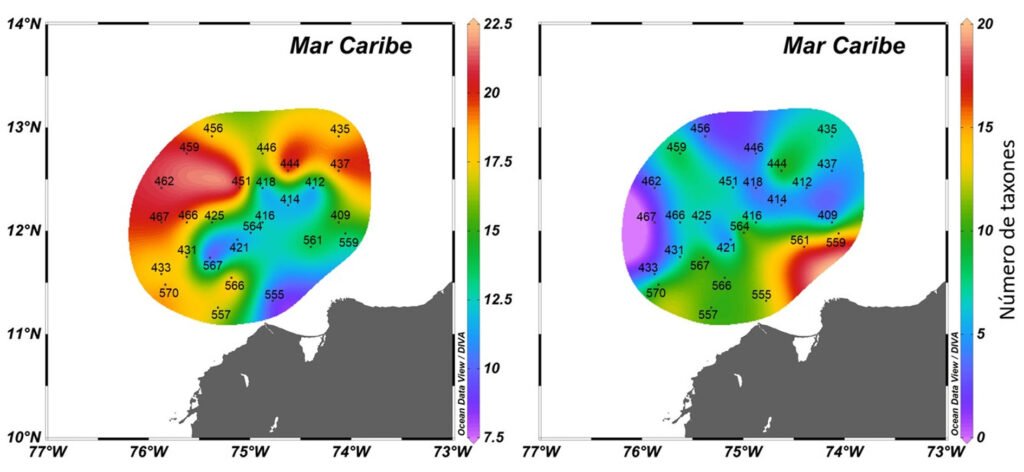
Figura 3.Distribución de la riqueza de especies de los 2 géneros más representativos en el Caribe central colombiano a partir de las muestras de red y botella. A, Dinoflagelados Tripos; B, diatomeas Chaetoceros.
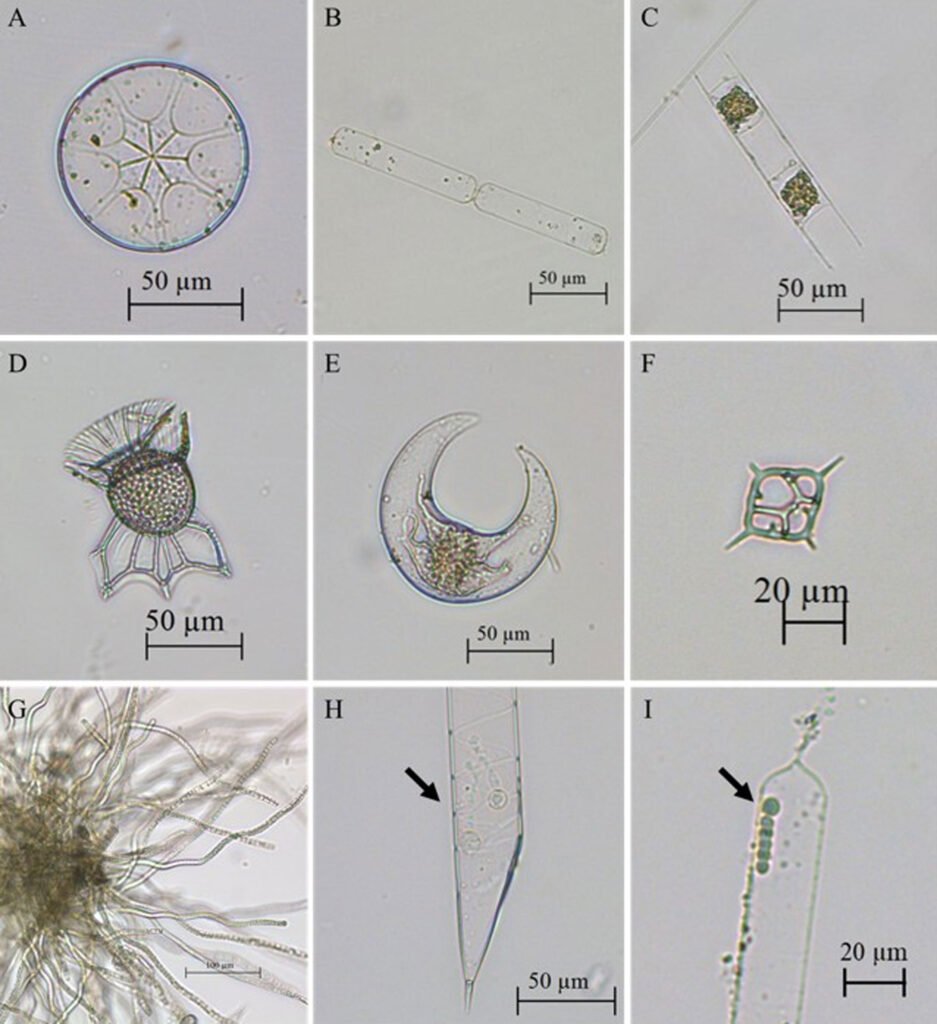
Figura 4. Especies frecuentes registradas en el Caribe central colombiano recolectadas a partir de las muestras de red y botella. A, Asterolampra marylandica (diatomea); B, Cerataulina pelagica (diatomea); C, Hemiaulus hauckii (diatomea); D, Ornithocercus magnificus (dinoflagelado); E, Pyrocystis lunula (dinoflagelado); F, Dictyocha fibula (silicoflagelado); G, Trichodesmium sp. (cianobacteria); H, Richelia intracellularis (cianobacteria) en simbiosis con Rhizosolenia clevei (diatomea);I, Richelia intracellularis (cianobacteria) en simbiosis con Guinardia cylindrus (diatomea).
Por su parte, se registraron 36 taxones raros (registrados en una sola estación) dentro de los que se encuentran los dinoflagelados Amphisolenia bifurcata G. Murray et Whitting, 1899, Brachidinium capitatum F.J.R. Taylor, 1963, Centrodinium maximum Pavillard, 1930, Ceratoperidinium margalefii A.R. Loeblich III, 1980, Citharistes apsteinii F. Schütt, 1895, Corythodinium robustum (Kofoid et J.R. Michener) F. Gómez, 2017, Dinophysis hastata F. Stein, 1883 (fig. 5A), Histioneis biremis F. Stein, 1883, H. crateriformis Stein, 1883, Phalacroma circumcinctum Kofoid et J.R. Michener, 1911, Phalacroma mitra F. Schütt, 1895 (fig. 5B), Prorocentrum rostratum F. Stein, 1883, Pyrocystis lanceolata Schröder, 1900, Tripos arietinus (Cleve) F. Gómez, 2021 (fig. 5C), T. belone (Cleve) F. Gómez, 2021, T. bigelowii (Kofoid) F. Gómez, 2013 (fig. 5D), T. digitatus (F. Schütt) F. Gómez, 2013, T. lanceolatus (Kofoid) F. Gómez, 2013, T. longirostrum (Gourret) Hallegraeff et Huisman, 2020, Kofoidinium sp. Pavillard, 1929, 2 morfoespecies del género Cucumeridinium F. Gómez, P. López-García, H. Takayama et D. Moreira, 2015, y 3 taxones posiblemente del orden Gymnodiniales; también se encontraron las diatomeas Cerataulina bicornis (Ehrenberg) Hasle, 1985, Chaetoceros messanensis Castracane, 1875 (fig. 5E), Trieres chinensis (Greville) Ashworth et E.C. Theriot, 2013 (fig. 5F), Gyrosigma sp. Hassall, 1845, nom. cons.;las cianobacterias Merismopedia elegans A. Braun ex Kützing, 1849, Planktothrix sp. Anagnostidis et Komárek, 1988, Pseudanabaena sp. Lauterborn, 1915, Komvophoron sp. Anagnostidis et Komárek, 1988; las clorofitas Tetradesmus lagerheimii M.J. Wynne et Guiry, 2016,y Pediastrum sp. Meyen, 1829y la carofita Staurastrum sp. Meyen ex Ralfs, 1848.
Con la revisión de los listados de Lozano-Duque et al. (2010b, 2011) y los trabajos publicados posteriormente por Lozano-Duque et al. (2010a), Vidal y Lozano-Duque (2011), Dimar-CIOH (2011), Ayala et al. (2011), Hoyos-Acuña et al. (2019), De la Hoz y Betancur (2019) y Córdoba-Mena et al. (2020) se calcularon en total 328 especies de diatomeas y 185 especies de dinoflagelados; se identificaron en el presente trabajo 74 registros nuevos para el Caribe colombiano que corresponden a 50 especies y 9 géneros de dinoflagelados, 8 especies de diatomeas, 1 especie de cocolitofóridos y 1 phylum, 1 clase, 1 orden , 1 familia, 1 género y 1 especie de bigiros (tabla 3; fig. 6). Se encontró que los géneros con mayor número de nuevos registros para el Caribe colombiano fueron Histioneis Stein, 1883 con 8 especies (fig. 7A-H), Dinophysis Ehrenberg, 1839con 6 especies, Corythodinium Loeblich et A.R. Loeblich, 1966; Oxytoxum Stein, 1883 y Phalacroma F. Stein, 1883con 4 especies cada uno, Pyrocystis Wyville-Thompson, 1876con 3 especies y Tripos (Ehrenberg) F. Gómez, 2013; Torodinium Kofoid et Swezy, 1921; Ornithocercus Stein, 1883; Gonyaulax Diesing, 1866; Citharistes Stein, 1883; Prorocentrum Ehrenberg, 1834; Centrodinium Kofoid, 1907y Amphisolenia Stein, 1883con 2 especies cada uno.
Discusión
La composición específica de las masas de agua reflejó las condiciones del medio, mostrando a las diatomeas y a los dinoflagelados como los grupos representativos, estos últimos los que presentaron mayor riqueza de especies. Estos 2 grupos fitoplanctónicos son dominantes en el mar Caribe y en el Caribe colombiano (Lozano-Duque, Medellín-Mora et al., 2010; Lozano-Duque et al., 2011; Okolodkov, 2003). Las especies de dinoflagelados son consideradas comunes en aguas oceánicas (Okolodkov, 2003), ya que gracias a su fisiología presentan bajos requerimientos de nutrientes y una nutrición variada (autótrofa, heterótrofa y mixotrófica), que les permite adaptarse a aguas oligotróficas (Gamboa-Márquez et al., 1994; Licea et al., 1995), como son las aguas oceánicas del Caribe colombiano (Corredor, 1979); por su riqueza y distribución, reflejan su adaptación a las condiciones del mar abierto (López y Caballero, 1997; Margalef, 1969). Así mismo, diferentes trabajos lo han reportado como el grupo dominante en aguas oceánicas del Caribe colombiano (Ayala-Galván et al., 2018, 2021; Garrido-Linares, Alonso-Carvajal, Rueda et al., 2014; INVEMAR et al., 2017; Lozano-Duque et al., 2010a; Ricaurte-Villota et al., 2018).

Figura 5.Especies raras registradas en el Caribe central colombiano recolectadas a partir de las muestras de red y botella. A, Dinophysis hastata (dinoflagelado); B, Phalacroma mitra (dinoflagelado); C, Tripos arietinus (dinoflagelado); D, Tripos bigelowii (dinoflagelado); E, Chaetoceros messanensis (diatomea); F, Trieres chinensis (diatomea).
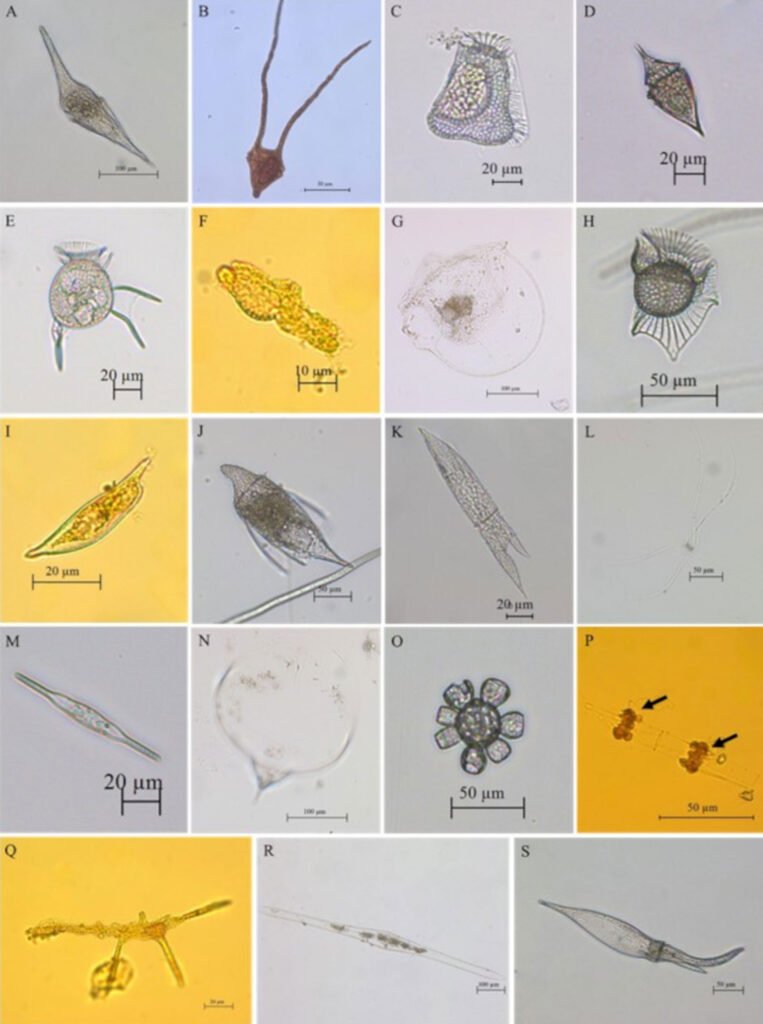
Figura 6. Nuevos registros de especies para el Caribe colombiano recolectados a partir de las muestras de red y botella. A, Centrodinium maximum (dinoflagelado);B, Ceratoperidinium margalefi (dinoflagelado); C, Citharistes apsteinii (dinoflagelado); D, Corythodinium biconicum (dinoflagelado);E, Dinophysis schuettii (dinoflagelado);F, Karenia papilionácea (dinoflagelado);G, Kofoidinium pavillardii (dinoflagelado);H, Ornithocercus carolinae (dinoflagelado);I, Prorocentrum rostratum (dinoflagelado);J, Shuettiella mitra (dinoflagelado);K, Tripos lanceolatus (dinoflagelado);L, Chaetoceros dadayi (diatomea);M, Mastogloia rostrata (diatomea); N, Rhizosolenia debyana (diatomea);O, Scyphosphaera apsteinii (cocolitofórido);P, Solenicola setigera (bigiro);Q, Brachidinium capitatum (dinoflagelado);R, Pyrocystis lanceolata (dinoflagelado);S, Tripos schroeteri (dinoflagelado).
Por su parte, las diatomeas son consideradas más comunes en aguas neríticas (Castillo, 1984; Corchuelo y Moreno, 1983), ya que requieren mayor cantidad de nutrientes y carecen de estructuras especializadas para movilizarse activamente, dependiendo así de los cambios fisicoquímicos diarios de la columna del agua para modificar su posición (Torres y Estrada, 1997). Por ello, han sido reportadas como el grupo dominante en la provincia nerítica de diferentes países (Delgado y Chang, 2010; Loza-Álvarez et al., 2018; Troccoli-Ghinaglia et al., 2004) al igual que en el Caribe colombiano (Franco-Herrera, 2006; Franco-Herrera y Torres-Sierra, 2007; Franco-Herrera et al., 2006; Gavilán et al., 2005; Ramírez-Barón et al., 2010), reflejando su adaptación a condiciones de mayor turbulencia, ya que las favorece a disminuir su sedimentación, y a su vez, se benefician por el aumento en la concentración de nutrientes (Margalef, 1978).
Del grupo de los dinoflagelados, el género Tripos presentó la mayor riqueza, con especies que formaron cadenas de 2 hasta 14 células, como es el caso de algunas especies recolectadas con red como: T. gibberus (Gourret) F. Gómez, 2021 (2 células), T. dens (Ostenfeld et Johannes Schmidt) F. Gómez, 2013 (3 células), T. ranipes (Cleve) F. Gómez, 2013 (4 células) y T. vultur Cleve, 1900(14 células). La formación de cadenas les permite mayor flotabilidad en la zona fótica, generando cadenas más largas en zonas donde la turbulencia es menor (Vargas-Montero et al., 2008). Por lo que estas formaciones están reflejando la estabilidad de la columna de agua, principalmente en el sector externo donde fueron más comunes. La riqueza de Tripos fue mayor hacia aguas más oceánicas, confirmando lo planteado por Lozano-Duque et al. (2010a), quienes teniendo en cuenta estaciones ubicadas a lo largo de un transecto del suroccidente al nororiente a la costa Caribe colombiana, mostró que las aguas oceánicas favorecían la presencia de dinoflagelados, principalmente de este género.
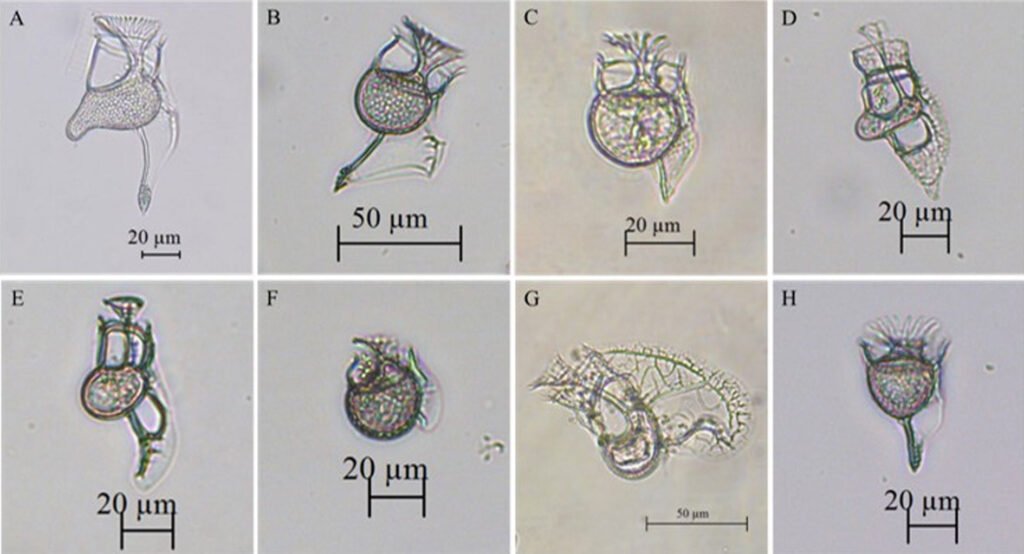
Figura 7. Nuevos registros del género Histioneis para el Caribe colombiano recolectados a partir de las muestras de red y botella. A, Histioneis biremis; B, H. costata; C, H. crateriformis; D, H. depressa; E, H. longicollis; F, H. mediterránea; G, H. milneri; H, H. paraformis.
La presencia de otros géneros de dinoflagelados tecados como Protoperidinium, Ornithocercus, Prorocentrum, Phalacroma, Histioneis y Dinophysis es común en aguas tropicales (Hallegraeff y Jeffrey, 1984; López y Caballero, 1997). Además, indica las estrategias de adaptación que presentan algunos de estos géneros como el tamaño, cuernos y aletas, para asegurar una mayor superficie de absorción, disminuyendo la velocidad de caída y creando dificultad de pastoreo por niveles tróficos superiores (Garay et al., 1988; Hallegraeff y Jeffrey, 1984). Por su parte, aunque el reporte de géneros de dinoflagelados atecados se ve limitado a nivel de caracterización (por su coraza débil) debido a que las técnicas de fijación como formol y lugol dificultan su preservación e identificación (Lalli y Parsons, 1997), se lograron registrar 11 géneros para este grupo. Los géneros de dinoflagelados atecados son conocidos en aguas tropicales, con estudios que se enfocan en análisis moleculares, morfológicos y ecológicos (Escobar-Morales y Hernández-Becerril, 2015; Gómez, 2003, 2005; Gómez y Furuya, 2007; Gómez et al., 2015; Maciel-Baltazar y Hernández-Becerril, 2013), sin embargo, este grupo es mucho menos conocido y estudiado en comparación con los dinoflagelados tecados. Para el Caribe colombiano se encuentran pocos registros resaltando los reportes de los géneros Torodinium Kofoid et Swezy, 1921, Asterodinium Sournia, 1972, Karenia Gert Hansen et Moestrup, 2000, Gyrodinium Kofoid et Swezy, 1921, nom. cons. (Ayala-Galván et al., 2022) y Pronoctiluca Fabre-Domergue, 1889 (Ayala-Galván et al., 2022; Hoyos-Acuña et al., 2019).
Por otra parte, del grupo de las diatomeas, el género Chaetoceros expuso la mayor riqueza;esta diatomea planctónica es un género ampliamente distribuido, es común en ambientes marinos en todo el mundo, ya sea en aguas neríticas u oceánicas, con solo unas pocas especies de ambientes continentales o estuarinos (Sunesen et al., 2008), algunas de sus especies son cosmopolitas (Li et al., 2017) y la mayoría son euritérmicas, eurihalinas y producen hipnosporas (Calderón, 1986), lo que les otorga amplias posibilidades de supervivencia incluso en condiciones adversas (Pitcher, 1990). En este estudio, Chaetoceros disminuyó su riqueza hacia aguas más oceánicas, mostrando que se ven favorecidas con la cercanía hacia aguas neríticas, lo que puede reflejar como esta diatomea se beneficia a mayor turbulencia y concentración de nutrientes (Margalef, 1978), que en este caso estarían dadas en la parte interna del área de estudio, por las descargas continentales del río Magdalena (Restrepo, 2014; Restrepo et al., 2006, 2015).
También se observó la presencia de otros géneros de diatomeas con formas coloniales unidas por prolongacionescomo Skeletonema Greville, 1865, nom. et typ. cons., Pseudo-nitzschia H. Peragallo, 1900, Hemiaulus Heiberg, 1863, nom. cons.y géneros con formas cilíndricas y alargadas como Rhizosolenia; estas formaciones son estrategias que permiten aumentar la relación superficie-volumen mejorando la flotabilidad y favoreciendo la resistencia al hundimiento haciendo que se mantengan en la capa superficial de la columna de agua (Garay et al., 1988).
Con menor riqueza se encontró al grupo de las cianobacterias, con representantes coloniales y filamentosas como: Richelia intracellularis J. Schmidt, 1901, Merismopedia elegans, Oscillatoria limosa C. Agardh ex Gomont, 1892, Planktothrix sp. Anagnostidis et Komárek, 1988, Pseudanabaena sp. Lauterborn, 1915 y Trichodesmium sp.Ehrenberg ex Gomont, 1892, nom. cons.Este grupo es considerado con baja riqueza y frecuencia en aguas marinas en comparación con aguas continentales (Margalef, 1991); sin embargo, estas algas son de gran importancia en ecosistemas oligotróficos (Campos-González, 2007), ya que son capaces de fijar nitrógeno molecular (N2) (Rippka et al., 1979; Stewart, 1980). Las cianobacterias han representado menos de 2% de la composición específica frente al mar Caribe centro de Colombia (Franco-Herrera y Torres-Sierra, 2007), destaca también su baja riqueza en la región insular, pero con altas densidades del género Oscillatoria Vaucher ex Gomont, 1892 (Campos-González, 2007; Garay et al., 1988; INVEMARANH, 2012; Téllez et al., 1988). Este grupo ha mostrado en la provincia nerítica mayor densidad durante la época lluviosa, con representantes estuarinos como Merismopedia Meyen, 1839, Anabaena Bory ex Bornet et Flahault, 1886, nom. cons., Nostoc Vaucher ex Bornet et Flahault, 1886y Oscillatoria Vaucher ex Gomont, 1892(Franco-Herrera et al., 2006).
El género Trichodesmium sp. (fig. 4G) y la especie Richelia intracellularis (fig. 4H, I) presentaron en este estudio una frecuencia de aparición de 78% y 55%, respectivamente,y se consideran relevantes en la composición que presenta el Caribe central colombiano debido a que éstos son los organismos fijadores de N2 (diazótrofos) más importantes de los ambientes pelágicos en los océanos del mundo, pues son responsables de ~ 63% de la fijación de N2 en la zona pelágica (Kulkarni et al., 2010).
Por otra parte, se registraron grupos del fitoplancton marino menos representativos en cuanto a diversidad como los cocolitofóridos (Sournia, 1995; Young et al., 2003), los silicoflagelados (Hernández-Becerril y Bravo-Sierra, 2001; Throndsen, 1997) y grupos más comunes en aguas continentales como las clorofitas (Ehrenberg, 1841), las criptofitas (Cerino y Zingone, 2007) y las carofitas (Brook, 1965). En el área solo se registró a Scyphosphaera apsteinii Lohmann, 1902como representante de los cocolitofóridoscon una frecuencia de aparición de 52% y más común hacia aguas más oceánicas. Los cocolitofóridos pueden encontrarse tanto en aguas neríticas como oceánicas, y la mayoría de sus especies se dan en mares cálidos; mientras que los silicoflagelados, con pocas especies conocidas, generalmente son más abundantes en aguas frías (Lalli y Parsons, 1997). Los cocolitofóridos han mostrado mayor riqueza en aguas oceánicas de otros países como Cuba, donde se encontraron 20 especies (Loza-Álvarez y Lugioyo-Gallardo, 2009) o en el golfo de México con 29 taxones (Gaarder y Hasle, 1971). Para los silicoflagelados solo se registraron 2 representantes, Dictyocha fibula con una frecuencia de aparición de 100% y Octactis octonaria (Ehrenberg) Hovasse, 1946,con 22%, aunque esta última no estuvo presente en el sector externo. Estas especies también han sido registradas para el Pacífico colombiano (Peña y Pinilla, 2002).
Por su parte, las clorofitas y las carofitas son grupos normalmente de aguas continentales o estuarinas que se encontraron en bajas frecuencias y densidades en la provincia oceánica, reflejando la influencia de aguas continentales por corrientes locales principalmente en el sector interno, donde, la especie más común fue la clorofita Pyramimonas longicauda L. Van Meel, 1969. Estos grupos también se han registrado en aguas neríticas y oceánicas del Caribe colombiano con baja representatividad, como se ha demostrado en los estudios de Tigreros (2001) y Franco-Herrera y Torres-Sierra (2007).
En este estudio se encontraron asociaciones simbióticas como la de Solenicola setigera Pavillard, 1916con Dactyliosolen mediterraneus (H. Peragallo) H. Peragallo, 1892, la cualno había sido reportada para el Caribe colombiano. El bigiro S. setigera frecuentemente se encuentra adherido a las valvas de D. mediterraneus, sin embargo, también se puede encontrar formando colonias aisladas (Gómez, 2007; Valencia, 2013), lo que indicaría en ciertos momentos limitaciones de compuestos nitrogenados, especialmente de nitratos (Meave-del Castillo et al., 2012). Otras asociaciones encontradas fueron las de Richelia intracellularis con Guinardia cylindrus (Cleve) Hasle, 1996,o R. intracellularis con Rhizosolenia clevei Ostenfeld, 1902, las cuales ya habían sido reportadas para el Caribe colombiano en el Área de Régimen Común Colombia – Jamaica (INVEMAR-ANH, 2012), Cayo Serranilla (Ricaurte-Villota et al., 2018) y al norte de La Guajira (Ayala-Galván et al., 2018). Se conoce que los hospedadores más comunes de R. intracelularis son diatomeas de los géneros Rhizosolenia, Hemiaulus y Guinardia H. Peragallo, 1892 (Kulkarni et al., 2010). Sin embargo, esta simbiosis es más frecuente con las especies R. clevei y G. cylindrus que se encuentran en aguas tropicales (Hallegraeff y Jeffrey, 1984), así como se pudo observar en este estudio donde fue común encontrar a R. intracellularis con R. clevei. En general, este tipo de asociaciones simbióticas son conocidas y han sido registradas en los mares mundiales (Gárate-Lizárraga y Muñetón-Gómez, 2009; Gómez et al.,2005; Hallegraeff y Jeffrey, 1984; Margalef, 1961; Taylor, 1982; Valencia, 2013). La importancia de éstas en el ambiente marino radica en que pueden beneficiar tanto al huésped como al simbionte mediante el intercambio mutuo de nutrientes orgánicos e inorgánicos (Hallegraeff y Jeffrey, 1984).
La frecuencia de algunas especies encontradas se relaciona con su distribución y amplios rangos de tolerancia, Chaetoceros lorenzianus, C. peruvianus, Cerataulina pelágica, Pseudosolenia calcar-avis, Pyrocystis lunula, Ornithocercus magnificus, Tripos extensus, T. teres, T. trichoceros y Podolampas elegans se consideran cosmopolitas de aguas templadas y cálidas; Hemiaulus hauckii y H. chinensis cosmopolitas de aguas cálidasy Dictyocha fibula cosmopolita euroica(Margalef, 1961). Por su parte, los taxones raros o poco comunes representaron 12.54% de las especies identificadas, 25 de los 36 taxones con un solo registro fueron de dinoflagelados, y mostraron una mayor diversidad en aguas oceánicas, generando un aporte significativo a la estructura fitoplanctónica del Caribe central colombiano.
Al comparar el número de taxones encontrados (176 dinoflagelados y 88 diatomeas) con los registros del Gran Caribe, donde se encuentran alrededor de 1,083 especies de diatomeas (305 diatomeas céntricas y 778 diatomeas pennadas) (Navarro y Hernández-Becerril, 1997) y 404 especies de dinoflagelados (Wood, 1968), el presente trabajo representa, aproximadamente, 17.75% del total de especies conocidas de estos 2 grupos en el Gran Caribe. Al compararlos con los registros del mar Caribe colombiano, donde se han encontrado para aguas oceánicas y costeras un total de 312 especies de diatomeas pertenecientes a 106 géneros y 169 especies de dinoflagelados de 32 géneros (Lozano-Duque et al., 2010b, 2011), el presente trabajo representa aproximadamente 51.46% del total de especies registradas en estudios del mar Caribe colombiano. De lo anterior, si se tiene en cuenta la composición específica, este trabajo generó un aumento para los dinoflagelados de 27.03% (50 especies) y para las diatomeas de 2.44% (8 especies). Cabe anotar que las especies de dinoflagelados Tripos falcatus (Kofoid) F. Gómez, nom. inval. 2013 y Dinophysis capitulata Balech, nom. inválido. 1967, hasta la fecha tampoco se han registrado en el Caribe colombiano, sin embargo, no se incluyeron como nuevos registros debido a que sus estatus taxonómicos están bajo evaluación (Guiry y Guiry, 2025).
Uno de los registros más relevantes fue el de Solenicola setigera, debido a que es un registro nuevo desde la categoría taxonómica de phylum (Bigyra). Este phylum comprende generalmente organismos parásitos o simbiontes. Para aguas oceánicas del Caribe colombiano no se encontraron artículos científicos que confirmen la presencia de éstos. Sin embargo, para Colombia se encontró el registro del phylum asociado con la especie parásita Blastocystis hominis Brumpt 1912 en 2 conjuntos de datos en GBIF (Global Biodiversity Information Facility), publicados por el Instituto Nacional de Salud (Duque et al., 2022, 2023). En cuanto a S. setigera, esun protista marino colonial distintivo y muy extendido (Buck y Bentham, 1998) que no tenía definida su posición filogenética, la cual fue aclarada por Gómez et al. (2011).
Respecto al hallazgo de Scyphosphaera apsteinii, cabe mencionar que esta especie no se encontró registrada en artículos científicos para el Caribe colombiano. Sin embargo, se registra previamente en 2 conjuntos de datos en GBIF que pertenecen a las expediciones de Seaflower del Proyecto Colombia BIO (Ayala-Galván, 2018; Ayala-Galván y Dorado-Roncancio, 2021). Además, el género se encuentra en el listado para aguas oceánicas del Caribe colombiano realizado por Ayala-Galván et al. (2022).
Los resultados obtenidos sugieren que aún queda mucho por explorar respecto a la riqueza de especies en el Caribe colombiano. La información limitada disponible en aguas oceánicas puede estar relacionada con que la mayoría de estudios realizados proviene de cruceros ocasionales. Esta falta de estudios persistentes impide un conocimiento detallado de la composición específica del fitoplancton marino de aguas oceánicas, ya que estas comunidades pueden variar en diferentes escalas temporales (Davidson et al., 2013; Henson et al., 2009; Holligan y Harbour, 1977; Westberry et al., 2016).
El alto número de registros nuevos encontrados podría atribuirse, en parte, a que los resultados de este trabajo respondieron a un análisis a mesoescala, el cual no se había realizado antes para este grupo biológico en un área que representó 7.5% de las aguas oceánicas del Caribe colombiano. Así como a la ubicación del área de estudio, ya que, aunque en su totalidad pertenece a la zona oceánica, abarca estaciones en un gradiente latitudinal que se extiende desde cercanías con la zona nerítica hacia aguas más oceánicas (factor horizontal), con lo que se incrementó la probabilidad de detectar especies raras y menos frecuentes. Además, el esfuerzo de muestreo a 3 profundidades (factor vertical) permitió una mayor captura de organismos, incluyendo aquellos que habitan en diferentes masas de agua como el ASC y el ASS.
En conclusión, estos hallazgos revelan de forma general una alta riqueza fitoplanctónica en aguas oceánicas del Caribe colombiano, la cual fue mayor hacia el sector interno en aguas más cercanas a la costa, probablemente por la influencia del río Magdalena. La riqueza también se vio reflejada en los nuevos registros de dinoflagelados, diatomeas, cocolitofóridos y bigiros, que contribuyeron significativamente al conocimiento de la biodiversidad en el área, especialmente por el primer reporte del phylum Bigyra, así como el alto porcentaje de nuevos registros de dinoflagelados, que confirman su relevancia en aguas costa afuera. Estos resultados destacan la importancia de realizar estudios de composición taxonómica, análisis espaciales a mayor escala (mesoescala > 100 km y macroescala > 1,000 km), que permitan un mayor conocimiento de las comunidades fitoplanctónicas en este complejo ecosistema marino.
Agradecimientos
Se agradece a al Instituto de Investigaciones Marinas y Costeras (INVEMAR) y a la Agencia de Nacional de Hidrocarburos (ANH) de Colombia, por la financiación de los proyectos “Línea base ambiental de los bloques COL 1 y COL 2 en la cuenca sedimentaria del Caribe colombiano fase II temática 1 (convenios 290-2015 y 167 -2016)” y “Estudio técnico ambiental de línea base en el área de evaluación COL 3 sobre la cuenca sedimentaria del Caribe colombiano (convenio 379-2017)”. Esta publicación corresponde a la contribución Núm. 1399 del INVEMAR. Además, damos un sentido agradecimiento al profesor Luis Alfonso Vidal Velásquez (Q. E. P. D.), por su asesoría en la confirmación de las identificaciones. Finalmente, agradecemos a los revisores anónimos por sus valiosos comentarios y sugerencias, los cuales contribuyeron a mejorar este manuscrito.
Referencias
Álvarez-León, R., Aguilera-Quiñones, J., Andrade-Amaya, C. A. y Nowak, P. (1995). Caracterización general de la zona de surgencia en la Guajira colombiana. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales, 19, 679–694.
Andrade, C. A. y Barton, E. D. (2005). The Guajira upwelling system. Continental Shelf Research, 25, 1003–1022. https://doi.org/10.1016/j.csr.2004.12.012
Ávila-Silva, M. Y. (2018). Caracterización del ensamblaje de dinoflagelados en un sector oceánico del Caribe colombiano en la época de lluvias mayor (2015) y seca mayor (2016) (Tesis, Biología). Facultad de Ciencias Básicas, Universidad del Magdalena. Santa Marta, Colombia.
Ayala, C., Martínez, P. A., Méndez, A. y Vidal, L. A. (2011). Primer registro del dinoflagelado Neoceratium digitatum (Schütt) Gómez, Moreira y López-García 2009 (Dinophyceae), en aguas del Caribe colombiano. Biota Colombiana, 12, 145–148.
Ayala-Galván, K. (2018). Composición del fitoplancton en Isla Cayo de Serranilla en la Reserva de Biosfera – Seaflower (Versión 1) [Conjunto de datos]. Instituto de Investigaciones Marinas y Costeras. https://doi.org/10.15472/2bekzn
Ayala-Galván, K. y Dorado-Roncancio, F. (2021). Composición del fitoplancton en la Isla Cayos de Serrana en la Reserva de Biosfera – Seaflower [Conjunto de datos]. Instituto de Investigaciones Marinas y Costeras. https://doi.org/10.15472/hna7kq
Ayala-Galván, K., Dorado, F. y Escarria, E. (2018). Caracterización de comunidades biológicas A. Plancton. En M. Vides y D. Alonso (Eds.), Estudio técnico ambiental de línea base en el área de evaluación COL 10, extremo norte del Caribe colombiano. Informe Técnico Final(pp. 103–173). Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 340-2018).
Ayala-Galván, K., Dorado, F. y Escarria, E. (2021). Plancton. En M. Vides y D. Alonso (Eds.), Estudio técnico ambiental en áreas de interés del Caribe y Pacífico colombiano como apoyo al crecimiento sostenible del sector de hidrocarburos costa afuera – fase 2021. Informe Técnico Final(pp. 121–196). Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 265-2021).
Ayala-Galván, K., Dorado, F., Escarria, E., Gutiérrez, J., Contreras, K., Cárdenas, A. et al. (2017). Caracterización de comunidades biológicas. En M. Vides, M. Santos-Acevedo y D. Alonso (Eds.), Estudio técnico ambiental de línea base en el área de evaluación COL 3 sobre la cuenca sedimentaria del Caribe colombiano. Informe Técnico Final (pp. 98–260). Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 379-2017).
Ayala-Galván, K. y Gutiérrez-Salcedo, J. M. (2019). Comunidades biológicas: plancton. En M. Vides y D. Alonso (Eds.), Integración, análisis y diagnóstico de información de línea base ambiental de la cuenca Caribe como apoyo a nuevas a fronteras del desarrollo del sector de hidrocarburos costa afuera. Informe Técnico Final (pp. 209–256). Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 399-2019).
Ayala-Galván, K., Gutiérrez-Salcedo, J. M. y Montoya-Cadavid, E. (2022). Fitoplancton de la provincia oceánica del mar Caribe colombiano. Diez años de historia. Biota Colombiana, 23, e903. https://doi.org/10.21068/2539200X.903
Balech, E. (1988). Los dinoflagelados del Atlántico sudoccidental. Publicación especial del Instituto Español de Oceanografía. Consejo Regional de Asturias.
Bernal, G., Poveda, G., Roldan, P. y Andrade, C. (2006). Patrones de variabilidad de las temperaturas superficiales del mar en la Costa Caribe colombiana. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 30, 195–208. https://doi.org/10.18257/raccefyn.30(115).2006.2240
Boltovskoy, D. (1981). Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Mar del Plata, Argentina: INIDEP (Instituto Nacional de Investigación y Desarrollo Pesquero).
Brook, A. J. (1965). Planctonic algae as indicators of lakes types with special reference to the Desmidiaceae. Limnology and Oceanography, 10, 403–411. https://doi.org/10.4319/lo.1965.10.3.0403
Buck, K. R. y Bentham, W. N. (1998). A novel symbiosis between a cyanobacterium, Synechococcus sp., an aplastidic protist, Solenicola setigera, and a diatom, Leptocylindrus mediterraneus, in the open ocean. Marine Biology, 132, 349–355. https://doi.org/10.1007/s002270050401
Calderón, E. (1986). Las diatomeas en el plancton de los esteros de la rada de Tumaco (Pacífico colombiano), con observaciones ecológicas y biogeográficas (Tesis, Biología Marina). Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano.
Campos-González, E. (2007). Fitoplancton de las islas de Providencia y Santa Catalina, Caribe colombiano (Tesis, Biología Marina) Facultad de Ciencias Naturales Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano.
Castillo, F. (1984). Fitoplancton del Pacífico colombiano como indicador de masas de agua (ERFEN IV). Biología Pesquera, 13, 67–70.
Cerino, F. y Zingone, A. (2007). Decrypting cryptomonads: a challenge for molecular taxonomy. En J. Brodie y J. Lewis (Eds.), Unravelling the algae: the past, present, and future of algal systematics (pp. 197–214). Systematics Association Special Volume Series, 75. Boca Raton: CRC Press.
Clarke, K. y Gorley, R. N. (2015). PRIMER (Plymouth routines in multivariate ecological research) v7. User manual/tutorial. PRIMER-E, Plymouth Marine Laboratory.
Corchuelo, M. y Moreno, G. (1983). Contribución al conocimiento del fitoplancton y algunos tintínidos del Pacífico colombiano (Tesis, Biología Marina). Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano.
Córdoba-Mena, N., Florez-Leiva, L., Atehortúa, L. y Obando, E. (2020). Changes in phytoplankton communities in a tropical estuary in the Colombian Caribbean Sea. Estuaries and Coasts, 43, 2106–2127. https://doi.org/10.1007/s12237-020-00750-z
Corredor, J. E. (1979). Phytoplankton response to low level nutrient enrichment through upwelling in the Columbian Caribbean Basin. Deep Sea Research Part A: Oceanographic Research Papers, 26, 731–741. https://doi.org/10.1016/0198-0149(79)90010-4
Cupp, E., (1943). Marine plankton diatoms of the west coast of North America. Bulletin of the Scripps Institution of Oceanography of the University of California, 5, 1–238.
Davidson, K., Gilpin, L. C., Pete, R., Brennan, D., McNeill, S., Moschonas, G. et al. (2013). Phytoplankton and bacterial distribution and productivity on and around Jones Bank in the Celtic Sea. Progress in Oceanography, 117, 48–63. https://doi.org/10.1016/j.pocean.2013.04.001
De la Hoz, L. A. y Betancur, S. P. (2019). Nuevo registro de la especie Cladopyxis hemibrachiata del grupo dinoflagelado para la reserva de la biosfera de Seaflower, Caribe colombiano. Boletín Científico CIOH, 38, 41–43. https://doi.org/10.26640/22159045.2019.466
Delgado, L. E. y Chang, F. (2010). La comunidad microalgal durante el verano 2006. Instituto del Mar Perú, 36, 3–4.
Dimar-CIOH. (2011). Catálogo de fitoplancton de la Bahía de Cartagena, Bahía Portete y Agua de Lastre. Dirección General Marítima Centro de Investigaciones Oceanográficas e Hidrográficas del Caribe. Serie de Publicaciones Especiales CIOH, 5. https://doi.org/10.26640/52.2011
Dorado-Roncancio, E. F., Medellín-Mora, J., Mancera-Pineda, J. E. y Pizarro-Koch, M. (2022). Copepods of the off-shore waters of Caribbean Colombian Sea and their response to oceanographic regulators. Journal of the Marine Biological Association of the United Kingdom, 101, 1129–1143. https://doi.org/10.1017/S0025315422000133
Duque, S., Arévalo-Jamaica, A., Gunturiz-Albarracín, M. L., Figueroa-Velandia, S. y López-Hernández, R. G. (2022). Colección de giardiasis del Instituto Nacional de Salud (Versión 1.1) [Conjunto de datos]. Instituto Nacional de Salud. Dataset/ Occurrence. https://doi.org/10.15472/68g8jh
Duque, S., Arévalo-Jamaica, A., Gunturiz-Albarracín, M. L., Figueroa-Velandia, S. y López-Hernández, R. G. (2023). Biobanco de parásitos intestinales del Instituto Nacional de Salud (Versión 1.2) [Conjunto de datos]. Instituto Nacional de Salud. Dataset/Occurrence. https://doi.org/10.15472/zoth79
Edler, L. y Elbrächter, M. (2010). The Utermöhl method for quantitative phytoplankton analysis. Microscopic and Molecular Methods for Quantitative Phytoplankton Analysis, 110, 13–20.
Ehrenberg, C. G. (1841). Verbreitung und Einflus des mikroskopischen Lebens in Sud-und Nord-Amerika. Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin, Physik. Kl., 1841, 291–445.
Escobar-Morales, S. y Hernández-Becerril, D. U. (2015). Free-living marine planktonic unarmoured dinoflagellates
from the Mexican tropical Pacific. Acta Botanica Mexicana, 110, 93–123. https://doi.org/10.1515/bot-2014-0049
Franco-Herrera, A. (2006). Variación estacional del fitoplancton y mesozooplancton e impacto de herbivoría de Eucalanus subtenuis, Giesbrecht, 1888 (Copepoda: Eucalanidae) en el Caribe colombiano (Tesis doctoral, en Oceanografía). Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción. Chile.
Franco-Herrera, A., Castro, L. y Tigreros, P. (2006). Plankton dynamics in the south-central Caribbean Sea: strong seasonal changes in the Coastal Tropics Sytems. Caribbean Journal of Science, 42, 24–28.
Franco-Herrera, A. y Torres-Sierra, E. A. (2007). La comunidad fitoplanctónica en el evento de surgencia frente al mar Caribe centro de Colombia. Actualidades y Divulgación Científica, 10, 159–172. https://doi.org/10.31910/rudca.v10.n1.2007.578
Gaarder, K. R. y Hasle, G. R. (1971). Coccolithophorids of the Gulf of Mexico. Bulletin of Marine Science, 21, 519–544.
Gamboa-Márquez, J. F., Sánchez-Suárez, I. G. y La Barbera-Sánchez, A. (1994). Dinoflagelados (Pyrrophyta) del Archi-
piélago Los Roques (Venezuela): familias Prorocentraceae y Ostreopsidaceae. Acta Científica Venezolana, 45, 140–152.
Gárate-Lizárraga I. y Muñetón-Gómez M. (2009). Primer registro de la diatomea epibionte Pseudohimantidium pacificum y de otras asociaciones simbióticas en el golfo de California. Acta Botanica Mexicana, 88, 31–45. https://doi.org/10.21829/abm88.2009.311
Garay, J., Castillo, F., Andrade, C., Aguilera, J., Niño, L., De La Pava, M. et al. (1988). Estudio oceanográfico del área insular y oceánica del Caribe colombiano – archipiélago de San Andrés y Providencia y cayos vecinos. Boletín Científico CIOH, 9, 3–73. https://doi.org/10.26640/01200542.8.3_73
Garrido-Linares, M., Alonso-Carvajal, D., Gutiérrez-Salcedo, J. M., Montoya-Cadavid, E., Rodríguez, A., Bastidas, M. et al. (2014). Línea base ambiental preliminar del bloque de exploración de hidrocarburos Guajira Offshore 3 en el Caribe colombiano. Informe técnico Final. Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 171–2013).
Garrido-Linares, M., Alonso-Carvajal, D., Rueda, M., Ricaurte, C., Polanco, A., Cárdenas, A. et al. (2014). Línea base ambiental preliminar de los bloques de exploración de hidrocarburos Caribe colombiano: fase COL 4 y COL 5. Informe técnico Final Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis (Convenio 188–2014).
Gavilán, M., Cañón, M. y Tous, G. (2005). Comunidad fitoplanctónica de la Bahía de Cartagena y en las aguas de lastre de buques de tráfico internacional. Boletín Científico CIOH, 23, 60–75. https://doi.org/10.26640/01200542.23.60_75
Gómez, F. (2003). New records of Asterodinium Sournia (Brachidiniales, Dinophyceae). Acta Botanica Croatica, 62, 85–92. https://doi.org/10.1127/0029-5035/2003/0077-0331
Gómez, F. (2005). Is Karenia a synonym of Asterodinium-Brachidinium (Gymnodiniales, Dinophyceae)? Vie et Milieu, 55, 237–242.
Gómez, F. (2007). The consortium of the protozoan Solenicola setigera and the diatom Leptocylindrus mediterraneus in the Pacific Ocean. Acta Protozoologica, 46, 15–24.
Gómez, F. y Furuya, K. (2007). Kofoidinium, Spatulodinium and other kofoidiniaceans (Noctilucales, Dinophyceae) in the Pacific Ocean. European Journal of Protistology, 43, 115–124. https://doi.org/10.1016/j.ejop.2006.12.002
Gómez, F., Furuya, Y. y Takeda, S. (2005). Distribution of the Cyanobacterium Richelia intracellularis as an epiphyte of the diatom Chaetoceros compresssus in the Western Pacific Ocean. Journal of Plankton Research, 27, 323–330. https://doi.org/10.1093/plankt/fbi007
Gómez, F., López-García, P., Takayama, H. y Moreira, D. (2015). Balechina and the new genus Cucumeridinium gen. nov. (Dinophyceae), unarmored dinoflagellates with thick cell coverings. Journal of Phycology, 51, 1088–1105. https://doi.org/10.1111/jpy.12346
Gómez, F., Moreira, D., Benzerara, K. y López-García, P. (2011). Solenicola setigera is the first characterized member of the abundant and cosmopolitan uncultured marine stramenopile group MAST-3. Environmental Microbiology, 13, 193–202. https://doi.org/10.1111/j.1462-2920.2010.02320.x
Guiry, M. D. y Guiry, G. M. (2025). AlgaeBase. Publicación electrónica mundial, Universidad Nacional de Irlanda, Galway. Consultado el 24 de febrero de 2025 en https://www.algaebase.org
Hallegraeff, G. M. y Jeffrey, S. W. (1984). Tropical phytoplankton species and pigments of continental shelf waters of north and north-west Australia. Marine Ecology Progress Series, 20, 59–74.
Henson, S. A., Dunne, J. P. y Sarmiento, J. L. (2009). Decadal variability in North Atlantic phytoplankton blooms. Journal of Geophysical Research: Oceans, 114, C04013. https://doi.org/10.1029/2008JC005139
Hernández-Becerril, D. U. y Bravo-Sierra, E. (2001). Planktonic silicoflagellates (Dictyochophyceae) from the Mexican Pacific. Botanica Marina, 44, 417–423. https://doi.org/10.1515/BOT.2001.050
Holligan, P. M. y Harbour, D. S. (1977). The vertical distribution and succession of phytoplankton in the western English Channel in 1975 and 1976. Journal of the Marine Biological Association of the United Kingdom, 57, 1075–1093. https://doi.org/10.1017/S002531540002614X
Hoppenrath, M., Elbrächter, M. y Drebes, G. (2009). Marine phytoplankton. Stuttgart:Kleine SenckenbergReihe.
Hoyos-Acuña, J. J., Salón-Barros, J. C. y Mancera-Pineda, J. E. (2019). Aspectos morfológicos y primer registro del dinoflagelado Pronoctiluca spinifera en el Caribe colombiano. Acta Biológica Colombiana, 24, 264–274. https://doi.org/10.15446/abc.v24n2.70179
INVEMAR (Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis). (2015). Informe del estado de los ambientes y recursos marinos y costeros en Colombia: Año 2014. Serie de Publicaciones Periódicas Núm. 3. Santa Marta, Colombia: INVEMAR.
INVEMAR (Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis)-ANH (Agencia Nacional de Hidrocarburos). (2008). Especies, ensamblajes y paisajes de los bloques marinos sujetos a exploración de hidrocarburos. Informe técnico final. Santa Marta, Colombia: Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis.
INVEMAR (Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis)-ANH (Agencia Nacional de Hidrocarburos). (2010). Especies, ensamblajes y paisajes de los bloques marinos sujetos a exploración de hidrocarburos – Fase II – Caracterización de la megafauna y el plancton del Caribe colombiano. Informe Técnico Final. Santa Marta, Colombia: Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis.
INVEMAR (Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis)-ANH (Agencia Nacional de Hidrocarburos). (2012). Línea base ambiental en el Área de Régimen Común Jamaica – Colombia como aporte al aprovechamiento sostenible de los recursos marinos compartidos. Informe técnico final. Santa Marta, Colombia: Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis.
INVEMAR (Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis), CORALINA (Corporación para el Desarrollo Sostenible del Archipiélago de San Andrés, Providencia y Santa Catalina), UNIANDES (Universidad De Los Andes) y UPB (Universidad Pontificia Bolivariana). (2017). Evaluación física y biológica de los ambientes profundos de la isla Cayos de Serrana en la Reserva de Biósfera – Seaflower. Informe Técnico Final. Expedición Científica Seaflower en Isla Cayo Serrana. Santa Marta, Colombia: Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis.
Kulkarni, V. V., Chitari, R. R., Narale, D. D., Patil, J. S. y Anil, A. C. (2010). Occurrence of cyanobacteria-diatom symbiosis in the Bay of Bengal: implications in biogeochemistry. Current Science, 99, 6–25.
Lalli, C. y Parsons, T. R. (1997). Biological oceanography: an introduction (2nd Ed.). Elsevier Butterworth-Heinemann.
Li, Y., Boonprakob, A., Gaonkar, C. C., Kooistra, W. H., Lange, C. B., Hernández-Becerril, D. et al. (2017). Diversity in the globally distributed diatom genus Chaetoceros (Bacillariophyceae): three new species from warm-temperate waters. Plos One, 12, e0168887. https://doi.org/10.1371/journal.pone.0168887
Licea, S., Moreno, J. L., Santoyo, H. y Figueroa, G. (1995). Dinoflagelados del golfo de California. La Paz, México:Universidad Autónoma de Baja California Sur.
López, N. O. y Caballero, O. G. (1997). Dinoflagelados del mar peruano como indicadores de masas de agua durante los años 1982 a 1985. Boletín Instituto del Mar del Perú, 16, 1–60.
Loza-Álvarez, S., Benavides-Morera, R., Brenes-Rodríguez, C. L. y Saxon, D. B. (2018). Phytoplankton structure in dry and rainy seasons in the gulf of Papagayo, Costa Rica. Journal of Marine and Coastal Sciences, 10, 9–30. https://doi.org/10.15359/revmar.10-2.1
Loza-Álvarez, S. y Lugioyo-Gallardo, G. M. (2009). Diversidad del microfitoplancton en las aguas oceánicas alrededor de Cuba. Revista Ciencias Marinas y Costeras, 1, 29–47. https://doi.org/10.15359/revmar.1.2
Lozano-Duque, Y., Medellín-Mora, J. y Navas, G. R. (2010). Contexto climatológico y oceanográfico del mar Caribe colombiano. Biodiversidad del margen continental del Caribe colombiano. Santa Marta, Colombia:Serie de publicaciones especiales INVEMAR.
Lozano-Duque, Y., Vidal, L. A. y Navas, G. R. (2011). Lista de especies de dinoflagelados (Dinophyta) registrados en el mar Caribe colombiano. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 40, 361–380.
Lozano-Duque, Y., Vidal, L. A. y Navas, G. R. (2010a). La comunidad fitoplanctónica en el mar Caribe colombiano. Biodiversidad del margen continental del Caribe colombiano. Serie de publicaciones especiales INVEMAR Núm. 20.
Lozano-Duque, Y., Vidal, L. A. y Navas, G. R. (2010b). Listado de diatomeas (Bacillariophyta) registradas para el Mar Caribe colombiano. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 39, 83–116.
Maciel-Baltazar, E. y Hernández-Becerril, D. U. (2013). Especies de dinoflagelados atecados (Dinophyta) de la costa de Chiapas, sur del Pacífico mexicano. Revista de Biología Marina y Oceanografía, 48, 245–259. https://doi.org/10.4067/S0718-19572013000200005
Margalef, R. (1961). Distribución ecológica y geográfica de las especies del fitoplancton marino. Investigación Pesquera, 19, 81–101.
Margalef, R. (1969). Estudios sobre la distribución a pequeña escala del fitoplancton marino. Memorias de la Real Academia de Ciencias y Artes de Barcelona, 40,3–22.
Margalef, R. (1978). Life-forms of phytoplankton as survival alternatives in an unstable environment. Oceanologica Acta, 1, 493–509.
Margalef, R. (1991). Ecología. Barcelona, España: Omega.
Meave-del Castillo, M. E., Zamudio-Reséndiz, M. E. y Castillo-Rivera, M. (2012). Riqueza fitoplanctónica de la bahía de Acapulco y zona costera aledaña, Guerrero, México. Acta Botanica Mexicana, 100, 405–487. https://doi.org/10.21829/abm100.2012.41
Molina, A., Molina, C., Giraldo, L., Parra, C. y Chevillot, P. (1994). Dinámica marina y sus efectos sobre la geomorfología del golfo de Morrosquillo. Boletín Científico CIOH, 15, 93–113. https://doi.org/10.26640/22159045.74
Navarro, J. N. y Hernández-Becerril, D. U. (1997). Check-list of marine diatoms from the Caribbean Sea. Listados Florísticos de México, 15, 1–48.
Okolodkov, Y. B. (2003). A review of Russian plankton research in the Gulf of Mexico and the Caribbean Sea in the 1960-1980s. Hidrobiológica, 13, 207–221.
Peña, V. y Pinilla, G. A. (2002). Composición, distribución y abundancia de la comunidad fitoplanctónica de la ensenada de Utría, Pacífico colombiano. Revista de Biología Marina y Oceanografía, 37, 67–81. http://dx.doi.org/10.4067/S0718-
19572002000100008
Pitcher, G. (1990). Phytoplankton see populations of the Cape Peninsula upwelling plume, with particular reference to resting spores of Chaetoceros (Bacillariophyceae) and their role in seeding upwelling waters. Estuarine, Coastal and Shelf Science, 31, 283–301. https://doi.org/10.1016/0272-7714(90)90105-Z
Ramírez, A. (1999). Ecología aplicada: diseño y análisis estadístico. Bogotá: Fundación Universidad de Bogotá Jorge Tadeo Lozano.
Ramírez-Barón, J. S., Franco-Herrera, A., García-Hoyos, L. M. y López, D. A. (2010). La comunidad fitoplanctónica durante eventos de surgencia y no surgencia, en la zona costera del departamento del Magdalena, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 39, 233–263.
Restrepo, J. C. (2014). Dinámica sedimentaria en deltas micromareales-estratificados de alta descarga: delta del río Magdalena (Colombia-Mar Caribe) (Tesis doctoral, en Ciencias del Mar). Facultad de Ciencias Básicas, Universidad del Norte. Colombia.
Restrepo, J. C., Ortiz, J. C., Otero, L. y Ospino, S. R. (2015). Transporte de sedimentos en suspensión en los principales ríos del Caribe colombiano: magnitud, tendencias y variabilidad. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 39, 527–546. https://doi.org/10.18257/raccefyn.209
Restrepo, J. D., Kjerfve, B., Hermelín, M. y Restrepo, J. C. (2006). Factors controlling sediment yield in a major South American drainage basin: the Magdalena River, Colombia. Journal of Hydrology, 316, 213–232. https://doi.org/10.1016/j.jhydrol.2005.05.002
Ricaurte-Villota, C. y Bastidas-Salamanca, M. L. (Eds.). (2017). Regionalización oceanográfica: una visión dinámica del Caribe. Serie de Publicaciones Especiales Núm.14. Santa Marta, Colombia: Instituto de Investigaciones Marinas y Costeras José Benito Vives De Andréis.
Ricaurte-Villota, C., Murcia-Riaño, M., Ayala-Galván., K., Dorado, E. F., Escarria, E. y Alonso, D. A. (2018). Evaluación física y biológica de los ambientes profundos de la isla cayo de Serranilla en la Reserva de la Biosfera – Seaflower. Expedición Científica Seaflower 2017 Isla Cayo Serranilla. Santa Marta, Colombia: Informe Técnico Final del Instituto de Investigaciones Marinas y Costeras José Benito Vives De Andréis para la Comisión Colombiana del Océano.
Rippka, R. Deruelles, J., Waterbury, J. B., Herdman, M. y Stanier, R. Y. (1979). Generic assignments, strain histories and properties of pure cultures of cyanobacteria. Microbiology, 111, 1–61. https://doi.org/10.1099/00221287-111-1-1
Round, F. (1990). Diatoms: the biology and morphology of the genera. Cambridge: Cambridge University Press. https://doi.org/10.1017/S0025315400059245
Salón, J. C. (2013). Caracterización de la comunidad fitoplanctónica en áreas oceánicas del Caribe colombiano durante la época seca del año 2011 (febrero y marzo) (Tesis, Biología). Facultad de Ciencias Básicas, Universidad del Magdalena. Santa Marta, Colombia.
Schlitzer, R. (2022). Ocean data view. https://odv.awi.de
Sournia, A. (1995). Red tide and toxic marine phytoplankton of the world ocean: and inquiry into biodiversity. En P. Lassus et al. (Eds.), Harmful marine algal blooms (pp. 103–112). París, Francia: Lavoisier.
Stewart, W. D. P. (1980). Some aspects of structure and function in N2-fixing cyanobacteria. Annual Review of Microbiology, 34, 497–536. https://doi.org/10.1146/annurev.mi.34.100180.002433
Sunesen, I., Hernández-Becerril, D. U. y Sar, E. A. (2008). Marine diatoms from Buenos Aires coastal waters (Argentina). V. Species of the genus Chaetoceros. Revista de Biología Marina y Oceanografía, 43, 303–326. https://doi.org/10.4067/S0718-19572008000200009
Taylor, F. J. R. (1976). Dinoflagellates from the International Indian Ocean Expedition. A material collected by the R.V.” Anton Bruun” 1963-1964. Stuttgart, Alemania: Biblioteca Botánica.
Taylor, F. J. R. (1982). Symbioses in marine microplankton. Annales de l’Institut Océanographique, 58, 61–90.
Téllez, C., Márquez, G. y Castillo, F. (1988). Fitoplancton y ecología pelágica en el archipiélago de San Andrés y Providencia: Crucero Océano VI en el Caribe colombiano. Boletín Científico CIOH, 8, 3–26. https://doi.org/10.26640/22159045.26
Throndsen, J. (1997). The planktonic marine flagellates. En C. R. Tomas (Ed.), Identifying marine phytoplankton (pp. 591–729). San Diego, EUA: Academic Press.
Tigreros, P. (2001). Biodiversidad y valoración bioquímica del fitoplancton marino en ambientes costeros mesotróficos y oligotróficos tropicales, Caribe colombiano (Tesis, Biología Marina), Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano.
Tomas, C. (1997). Identifying marine phytoplankton. San Diego, EUA: Academic Press. https://doi.org/10.1017/S0025315400038959
Torres, R. y Estrada, M. (1997). Patrones de migración vertical en el plancton de un lago tropical. Hidrobiológica, 7, 33–40.
Troccoli-Ghinaglia, L., Herrera-Silveira, J. A. y Comín, F. A. (2004). Structural variations of phytoplankton in the coastal seas of Yucatan, Mexico. Hydrobiologia, 519, 85–102. https://doi.org/10.1023/B:HYDR.0000026487.78497.b6
Valencia, V. J. (2013). Variación estacional del fitoplancton en una estación nerítica del Canal de Mallorca (Mediterráneo occidental): 2000-2001 (Tesis doctoral). Departamento de Bioloxía Celular e Molecular de la Facultade de Ciencias, Universidad da Coruña. España.
Vargas-Montero, M., Bustamante, E. F., Guzmán, J. C. y Vargas, J. C. (2008). Florecimientos de dinoflagelados nocivos en la costa Pacífica de Costa Rica. Hidrobiológica, 18, 15–23.
Vidal, L. A. (2010). Manual del fitoplancton hallado en la ciénaga Grande de Santa Marta y cuerpos de agua aledaños. Fundación Universidad de Bogotá Jorge Tadeo Lozano. Bogotá, Colombia.
Vidal, L. A. y Lozano-Duque, Y. (2011). Revisión de los taxones del género Neoceratium F. Gómez, D. Moreira et P. Lópezgarcía (Dinophyceae) y primer registro de N. dens en el mar Caribe colombiano. Boletín de Investigaciones Marinas y Costeras – INVEMAR, 40, 143–183.
Vides, M. y Alonso, D. (Eds.) (2016). Línea base ambiental de los bloques COL 1 y COL 2 en la cuenca sedimentaria del Caribe colombiano – Temática 1. En M. Vides, y D. Alonso (Eds.), Levantamiento de información ambiental de sistemas marinos y costeros sobre el Caribe colombiano Fase II. Informe Técnico Final (pp. 75–160). Santa Marta, Colombia: Agencia Nacional de Hidrocarburos/ Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis(Convenios 290-2015 y 167–2016).
Westberry, T. K., Schultz, P., Behrenfeld, M. J., Dunne, J. P., Hiscock, M. R., Maritorena, S. et al. (2016). Annual cycles of phytoplankton biomass in the subarctic Atlantic and Pacific Ocean. Global Biogeochemical Cycles, 30, 175–190. https://doi.org/10.1002/2015GB005276
Wood, F. (1963). Dinoflagellates in the Australian Region. Australian Journal of Marine and Freshwater Research, 5, 171–352. https://doi.org/10.1071/MF9540171
Wood, F. (1968). Dinoflagellates of the Caribbean Sea and adjacent areas. Coral Gables, FL: University of Miami Press.
Young, J. R., Geisen, M., Cros, L., Kleijne, A., Probert, I. y Ostergaard, J. B. (2003). A guide to extant coccolithophore taxonomy. Journal of Nannoplankton Research, Special Issue, 1, 1–132. https://doi.org/10.58998/jnr2297