The pallida group of Phyllophaga (Coleoptera: Melolonthidae) in Oaxaca: new records and description of a new species
Axel Teodoro Cortes-Dávila a, Salvador Lozano-Trejo a, Andrés Ramírez-Ponce b y Jesús Alberto Cruz-López c, *
a Instituto Tecnológico del Valle de Oaxaca, División de Estudios de Posgrado e Investigación, Ex-hacienda de Nazareno, Agencia de Policía de Nazareno Xoxo, Centro, 71233 Santa Cruz Xoxocotlán, Oaxaca, México
b Instituto de Ecología A.C., Red de Biodiversidad y Sistemática, Carretera Antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
c Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Campo Experimental Valles Centrales de Oaxaca, Melchor Ocampo Núm. 7, Santo Domingo Barrio Bajo, 68200 Villa de Etla, Oaxaca, México
*Autor para correspondencia: thelyphonidito@gmail.com (J.A. Cruz-López).
Recibido: 24 febrero 2025; aceptado: 23 julio 2025
http://zoobank.org/urn:lsid:zoobank.org:pub:927D7BB0-0BC3-4C5F-8EA1-E2F61BEC7254
Resumen
Uno de los grupos de especies pertenecientes al género Phyllophaga subgénero Phytalus que han recibido especial atención, es el grupo pallida. Actualmente, este grupo está conformado por 12 especies, de las cuales, ninguna se ha reportado para el estado de Oaxaca. En el presente trabajo, se reporta la presencia de este grupo para Oaxaca por primera vez, con base en la revisión del material depositado en el Laboratorio de Entomología Agrícola del Campo Experimental Valles Centrales de Oaxaca – INIFAP. Se aportan nuevos registros para Phyllophaga (Phytalus) dieteriana Deloya et Morón, 1998 y se describe a Phyllophaga (Phytalus) psittacina sp. nov., con base en ejemplares adultos de ambos sexos provenientes de Santa María Tecomavaca, en la Reserva de la Biosfera Tehuacán-Cuicatlán.
Palabras clave: Phytalus; Agave; Selva baja caducifolia; Reserva de la Biosfera Tehuacán-Cuicatlán
Abstract
One of the species groups belonging to the genus Phyllophaga, subgenus Phytalus that has received special attention is the pallida group. Currently, this group includes 12 species, of which none of them has been reported for Oaxaca State. Based on the review of the material deposited in the Laboratorio de Entomología Agrícola of the Campo Experimental Valles Centrales de Oaxaca – INIFAP, we report the presence of this group for the first time for Oaxaca. We provide new records for Phyllophaga (Phytalus) dieteriana Deloya & Morón, 1998, and the description of Phyllophaga (Phytalus) psittacina sp. nov., based on specimens of both sexes from Santa María Tecomavaca, in the Tehuacán-Cuicatlán Biosphere Reserve.
Keywords: Phytalus; Agave; Low deciduous forest; Tehuacán-Cuicatlán Biosphere Reserve
Introducción
El género Phyllophaga Harris, 1827 es uno de los grupos más diversos de la tribu Melolonthini (Coleoptera: Melolonthidae: Melolonthinae), agrupa a un total de 782 especies conocidas en América (Allsopp y Schoolmeesters, 2024). Actualmente, la taxonomía del género está sustentada en caracteres morfológicos externos, principalmente de la morfología de las uñas (Morón, 2015a, b). Sin embargo, estudios sobre la filogenia de Phyllophaga han demostrado que el esquema taxonómico actual debe ser redefinido con base en combinación de caracteres morfológicos que respalden grupos monofiléticos (Rivera-Gasperín y Morón, 2013, 2017a, b). En este sentido, el subgénero Phytalus Erichson, 1847 se reconoce por el ápice de las uñas profundamente hendido o bífido (Morón, 1986). Sin embargo, este subgénero es uno de los que requiere mayor atención taxonómica para el adecuado sustento de sus respectivos grupos. Actualmente, dentro de Phytalus se reconocen 8 grupos de especies, de los cuales solo 3 han sido revisados, teniendo en cuenta las aproximaciones filogenéticas mencionadas anteriormente (Morón, 2006, 2018).
Uno de éstos, el grupo pallida, está conformado por 12 especies distribuidas en los estados de Chihuahua, Colima, Guerrero, Jalisco, Michoacán, Morelos, Nayarit, Puebla, Sinaloa y Sonora, a lo largo de la vertiente del Pacífico, principalmente sobre la provincia biogeográfica Tierras Bajas de Pacífico sensu Morrone et al. (2017). Este grupo puede ser reconocido por tener cuerpo alargado, ovalado, con una longitud de 10 a 15 mm, color pardo rojizo a amarillo, pronoto ligeramente más ancho que la cabeza, antenas formadas por 10 artejos, con los antenómeros tercero al quinto cortos, maza antenal masculina más larga o de igual longitud que el funículo, pronoto y élitros glabros, espolones metatibiales articulados y dentículo inferior de las uñas tarsales de mayor o de similar longitud que el dentículo superior (Morón, 1986, 2006; Romero-López y Morón, 2017). Las especies de este grupo se han recolectado en matorrales xerófilos, bosques espinosos o en bosques tropicales caducifolios, generalmente a no más de 1,000 m snm; son especies poco abundantes, que son atraídas a la luz fluorescente blanca y luz negra (Morón, 2006; Romero-López y Morón, 2017).
De acuerdo con la lista de especies de Phyllophaga reportadas para Oaxaca (Hernández-Cruz et al., 2016), ninguna de las especies del grupo pallida ha sido registrada. Durante la revisión del material depositado en el Laboratorio de Entomología Agrícola del INIFAP – Oaxaca, se hallaron ejemplares de Phyllophaga (Phytalus) dieteriana Deloya et Morón, 1998, que representan el registro más austral para México. Adicionalmente, durante un muestreo de melolóntidos en la Reserva de la Biosfera de Tehuacán-Cuicatlán se recolectaron ejemplares de Phyllophaga (Phytalus) psittacina sp. nov., especie que es descrita a continuación con base en ejemplares de ambos sexos.
Materiales y métodos
Los ejemplares tipo se encuentran depositados en la Colección Entomológica del Instituto de Ecología, A.C. (IEXA), Xalapa, Veracruz y en la Colección Nacional de Insectos (CNIN), Instituto de Biología-UNAM, México. Material adicional se encuentra depositado en la Colección Entomológica del Campo Experimental Valles Centrales de Oaxaca (INIFAP). Los ejemplares de P. (Phytalus) psittacina sp. nov., fueron capturados mediante un muestreo aleatorio realizado durante agosto del 2023 y muestreos semanales realizados de febrero del 2024 a enero del 2025, en una parcela de agave espadín Agave angustifolia Haw. localizada en vegetación de selva baja caducifolia, bosque de cactáceas y matorral xerófilo. Para la captura de los ejemplares se utilizó una trampa de luz blanca led de impacto modificada para colectar escarabajos adultos, la cual se ubicó en el centro de la parcela de cultivo. La fuente de luz fue una lámpara de luz blanca led recargable de 36 W. La trampa utilizada se modificó a partir de la trampa de luz tipo embudo propuesta por Morón y Terrón (1988), cambiando al embudo por una pantalla de mica plástica transparente en forma de cruz, de 40 cm de diámetro por 50 cm de alto. El recipiente colector consistió en un bote circular de plástico con capacidad de 20 L, el cual contenía 10 L de solución de agua y jabón como lo sugiere Aragón-García et al. (2018), con la finalidad de romper la tensión superficial del agua y permitir que los ejemplares se hundan en la solución. La trampa estuvo activa desde las 19:00 hasta las 00:00 hrs. Los ejemplares de P. (Phytalus) dieteriana fueron capturados mediante un esfuerzo comunitario entre un técnico promotor de campo y productores de la comunidad adscritos al programa federal Sembrando Vida del municipio de Tezoatlán de Segura y Luna, en Oaxaca. La recolecta de estos ejemplares consistió en la participación ciudadana como parte de las actividades entre los productores, para que, de manera general, conozcan a los insectos asociados con el cultivo de maíz.
Posterior a la recolecta de los ejemplares, éstos fueron etiquetados y transportados al Laboratorio de Entomología Agrícola del INIFAP – Oaxaca para el subsecuente montaje en alfileres entomológicos de acuerdo con los lineamientos descritos por Márquez-Luna (2005). La extracción y montaje de genitales masculinos siguió el procedimiento descrito por Gutiérrez-Carranza (2023). Para la extracción de las placas genitales femeninas se tomó en cuenta, parcialmente, el protocolo de Gutiérrez-Carranza (2023), con la excepción de que estas estructuras fueron limpiadas a mano del tejido adicional, las placas genitales inferiores se separaron entre sí para poder observar a detalle los márgenes completos y, finalmente, estas estructuras fueron preservadas en un microvial con alcohol junto con la respectiva hembra. Todos los ejemplares (n = 10) fueron disecados.
Para la identificación de los ejemplares recolectados, se utilizaron las claves para el reconocimiento de subgéneros y grupos de especies de Morón (1986), así como la monografía del grupo pallida realizada por Morón (2006), también se revisaron las descripciones originales de las especies del grupo descritas en trabajos diferentes a los mencionados: Morón (1992), Deloya y Morón (1998) y Romero-López y Morón (2017). El criterio para reconocer a esta especie como una nueva perteneciente al grupo pallida, fue con base en la revisión de los trabajos citados, así como la comparación detallada tanto de los genitales masculinos y femeninos.
Para la toma de fotografías, se utilizó una cámara Color CMOS C-Mount Microscope Camera, adaptada a un estereoscopio Jewelry Gem Zoom Stereo Microscope con el programa AmScope v. 3.1. Para corregir los efectos de la iluminación artificial se utilizó el domo de iluminación LED armable para fotografía científica y microscópica recomendado por Kawada y Buffington (2016). Se tomaron fotografías a diferentes profundidades, las cuales posteriormente fueron ensambladas mediante el programa Helicon Focus v. 6.7.1.
La terminología usada para la descripción taxonómica de los adultos fue tomada de Morón (2006), la cual es acorde con el grupo de especies tratadas en el presente trabajo. Para establecer la variación, todos los ejemplares (n = 10) fueron medidos.
Resultados
Phyllophaga (Phytalus) dieteriana Deloya et Morón, 1998
Figs. 1, 8
Resumen taxonómico
Distribución conocida. Esta especie ha sido registrada en Morelos y Puebla, en ecosistemas de bosque tropical caducifolio y matorral crasicaule ubicados entre 940 y 1,600 m snm (Morón, 2006).
Registros nuevos.Diecinueve ♂♂, 4 ♀♀ (INIFAP-Oax), México: Oaxaca: Tezoatlán de Segura y Luna, San Isidro el Naranjo (17°36’21.6” N, 97°47’24” O), 27/junio/2022, Col. C. A. Cruz-López. 2 ♀ (INIFAP-Oax), México: Oaxaca: Tezoatlán de Segura y Luna, Tezoatlán centro (17°38’49.2” N, 97°49’1.2” O), 27/junio/2022, Col. C. A. Cruz-López. 2 ♂♂ (INIFAP-Oax) México: Oaxaca: Tezoatlán de Segura y Luna, Juquila de León (17°22’58.8” N, 97°28’8.4” O), 27/junio/2022, Col. C. A. Cruz-López.
Comentarios taxonómicos
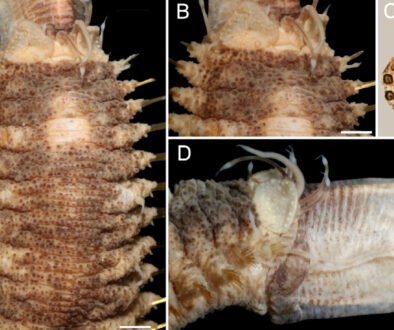
Esta especie es fácilmente reconocible dentro del resto del grupo pallida ya que los machos presentan la espuela metatibial inferior muy recurvada (fig. 1B) y la parte distal de los parámeros con numerosas estrías transversales (fig. 1C).

Phyllophaga (Phytalus) psittacina sp. nov.
https://zoobank.org/urn:lsid:zoobank.org:act:F9A4EBC3-67CA-4E61-A7D6-F421DF338E14
Figs. 2-8.
Descripción. Holotipo: (♂, IEXA) con etiqueta roja. Longitud total 19.0 mm, ancho máximo 6.0 mm. Cabeza y pronoto pardo rojizos, élitros, patas y abdomen de color amarillo pajizo brillante (fig. 2A, B). Clípeo semitrapezoidal, con ápice redondeado, ligeramente bilobulado y borde anterior poco elevado; 3.2 veces más ancho que largo; disco clipeal glabro, convexo, con puntos circulares profundos, irregularmente distribuidos (figs. 2A, 3A). Sutura fronto-clipeal bien marcada, ligeramente sinuada. Frente glabra, 2.0 veces más ancha que larga, en sus 2/3 anteriores casi plana con puntos circulares profundos grandes y puntos circulares pequeños irregularmente distribuidos; tercio posterior completamente liso, con muy pequeños puntos someros (figs. 2A, 3A).

Antenas con 10 artejos; segundo artejo más largo y ancho que los artejos III, IV y V, siendo éstos más pequeños, con longitud similar y una proyección anterior semicónica; artejos VI y VII similares en largo y ancho al segundo artejo, y con una proyección anterior semicónica (fig. 3A). Maza antenal más larga que el flagelo (0.9:0.5), formada por 3 lamelas cubiertas con sensilas finas y algunas sedas erectas esparcidas. Anchura dorsal de cada ojo equivalente a 30% de la distancia interocular. Canto ocular corto y estrecho, con 10 sedas (fig. 3A).
Pronoto 1.6 veces más ancho que largo; relación anchura máxima de cabeza-anchura máxima de pronoto de 0.6:1; relación distancia interocular-anchura máxima de pronoto de 0.3:1.
Disco pronotal glabro, con puntos circulares moderadamente profundos, irregularmente esparcidos, más densos hacia la porción media basal. Ángulos anteriores y posteriores obtusos, muy prominentes (figs. 2B, 3A). Bordes laterales levemente redondeados, angulados en su porción central; mitad anterior ligeramente angulada y mitad posterior casi recta; márgenes laterales crenulados en toda su longitud, sobre todo en la mitad anterior (figs. 2B, 3A). Margen basal bien delimitado cerca de ángulos posteriores y ligeramente difuso en parte central (fig. 3A). Escutelo más ancho que largo, con pocos puntos someros dispuestos irregularmente (fig. 3A).
Élitros 3.9 veces más largos que anchos, glabros, con textura punteada de manera irregular pero densa. Reborde de la epipleura muy estrecho, que se desvanece a la altura del propigidio, con sedas cortas muy esparcidas. Callos humerales anteriores prominentes y redondeados; callos posteriores amplios, redondeados, poco prominentes. Alas metatorácicas completamente desarrolladas (fig. 2A, B).

Quinto esternito abdominal poco más largo que el cuarto, con área media central excavada, punteada-rugosa, y algunas sedas erectas cerca del borde posterior, flanqueado por rebordes redondeados transversales (fig. 4A). Placa anal corta, cóncava, con reborde basal transversal y 6 sedas finas cerca de borde posterior.
Protibias más cortas que el tarso respectivo (1:1.3); borde externo con 3 procesos dentiformes, el apical más largo y angosto, ligeramente recurvado, el intermedio grande y ancho, el proximal corto y redondeado (fig. 3A). Espolón protibial ligeramente curvo y aguzado, poco más corto que el segundo protarsómero. Mesotibias con quilla media, setífera transversal oblícuamedia en cara externa bien marcada, precedida por quilla prebasal incompleta. Espolones mesotibiales articulados, rectos, aguzados; externo ligeramente más corto que el interno. Metatibias poco más cortas que tarsos respectivos (1:1.2), con quilla setífera transversal oblicua en tercio distal de la cara externa. Ambos espolones metatibiales articulados; espolón superior más ancho que inferior, poco recurvado, con ápice redondeado, flabelado; espolón inferior recurvado, poco más corto que el superior, con ápice redondeado; espolón superior más largo que primer metatarsómero y el inferior tan largo como éste (fig. 5A). Uñas tarsales profundamente hendidas; dentículo superior de igual longitud que el inferior, ligeramente más estrecho. (fig. 3B).
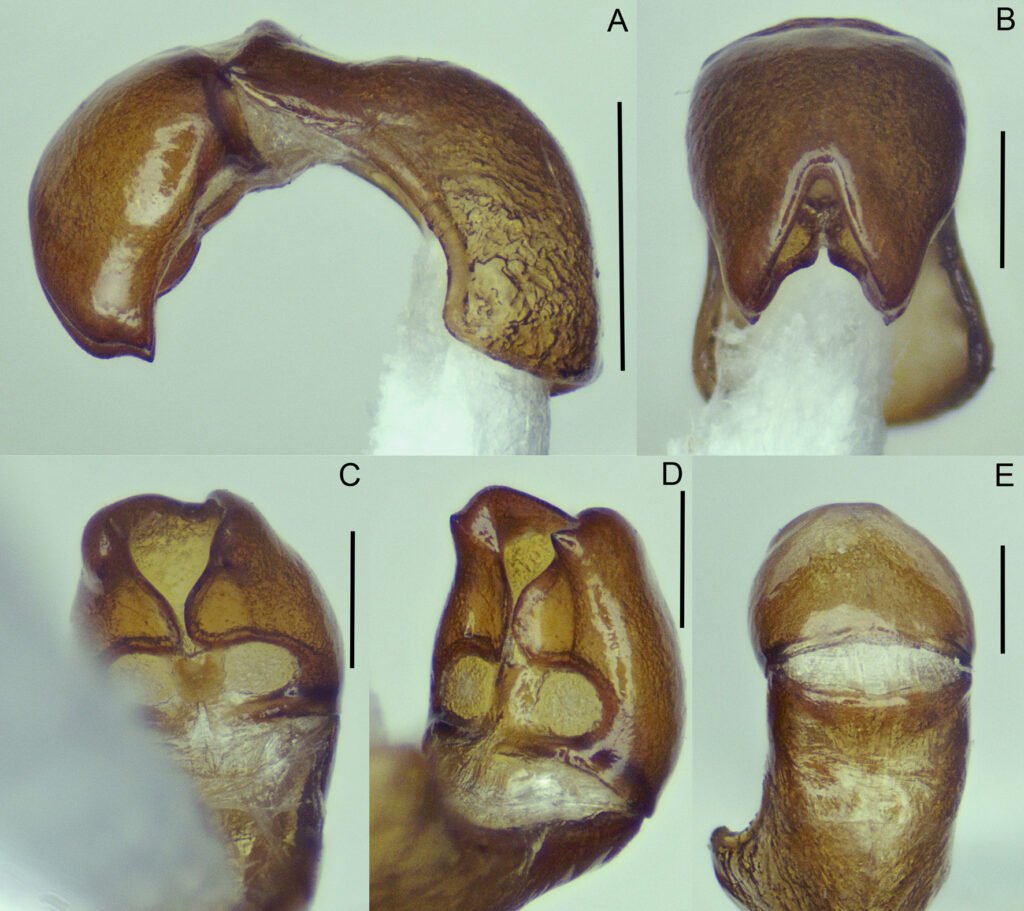
Cápsula genital masculina con parámeros completamente fusionados en la falobase; extremos apicales punteados y ligeramente divergentes, formando una estructura semicónica, recurvada; ventralmente cada parámero con proyección excavada central que convergen en la parte media, y en la parte basal con una concavidad circular que en conjunto asemejan a un número “8” (fig. 6). Superficie del tectum ampliamente cóncava. Edeago carece de estructura de soporte esclerosada y de ornamentos conspicuos.
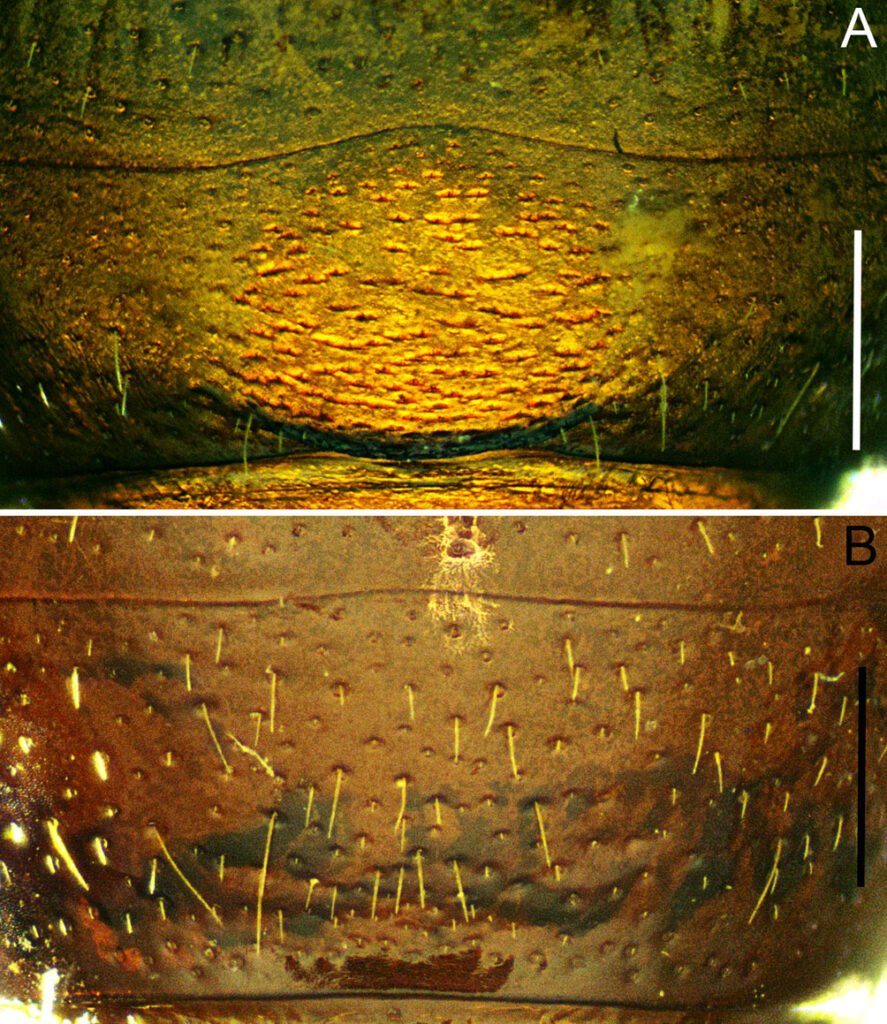
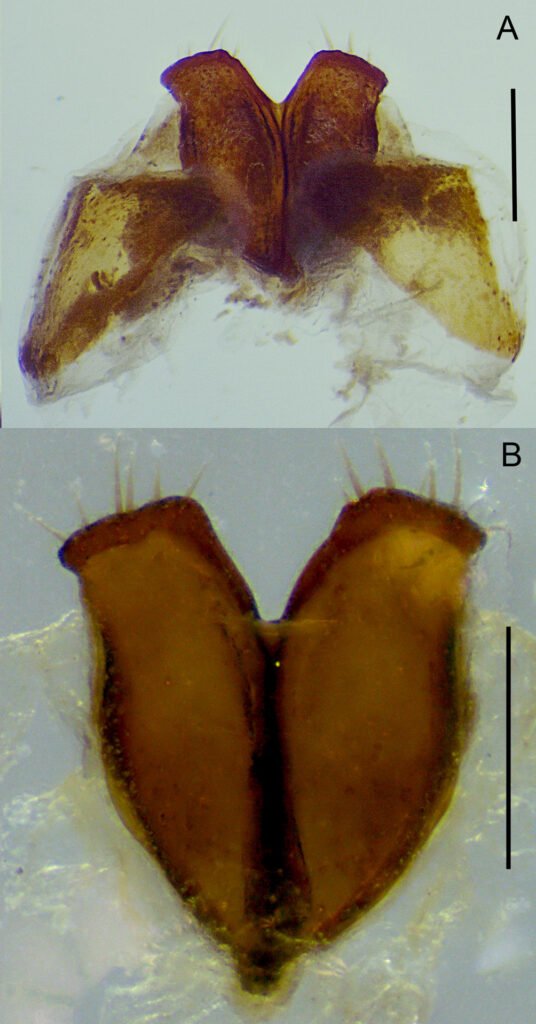
Hembra (paratipo IEXA). Muy similar al macho, sin dimorfismo sexual notorio. De tamaño similar al macho, proporciones de las patas similares, abdomen ligeramente más ensanchado y longitud de la maza antenal ligeramente más corta (fig. 2C, D). En cuanto a los espolones metatibiales, el externo tiene casi la misma longitud que el interno, y ambos son apicalmente espatulados (fig. 5B). El carácter sexual más distintivo es la ornamentación del esternito abdominal V, el cual no presenta ningún tipo de rebordes ni ornamentaciones, solo se encuentra cubierto por pocas sedas, esparcidas (fig. 4B). Las placas genitales superiores son alargadas, en forma de lanceta, fusionadas en casi toda su longitud y terminando en un ápice agudo inferior. Por la parte superior, estas placas están ligeramente divergentes, con los bordes engrosados y ligeramente dirigidos hacía la parte ventral, con 6 sedas apicales. Placas inferiores menos esclerosadas, de forma semitriangular y envuelven la mitad inferior de las placas superiores (fig. 7).
Variación. Ambas hembras (n = 2) exhiben tamaños similares, que son ligeramente más grandes que el macho (longitud: 20 mm). Los machos (n = 8) presentan tamaños y proporciones muy similares.
Diagnosis. Esta especie puede ser reconocida de las restantes del grupo pallida por la siguiente combinación de caracteres morfológicos: uñas con dentículo inferior de longitud similar al superior (fig. 3B); maza antenal de similar longitud que el escapo (fig. 3A); quinto esternito abdominal con reborde marcado, en forma de media luna, abarcando más de la mitad del ancho del segmento (fig. 4A); ápices de los parámeros divergentes, con bordes ventrales con concavidad media (fig. 6); placas genitales inferiores fusionadas, en forma de lanceta, con ápices divergentes (fig. 7).

Resumen taxonómico
Material examinado (n = 10): holotipo (♂, IEXA). México: Oaxaca: Santa María Tecomavaca (17°57’46.8” N, 97°01’12” O), 24/agosto/2024, Col. Cortes-Dávila, A. T. 1♂ paratipo (IEXA) con los mismos datos que el holotipo. Un ♂, 2 ♀♀ (IEXA) paratipos con los mismos datos de colecta, pero con fecha del 12/agosto/2023. Un ♂ paratipo (IEXA) con los mismos datos de colecta, pero con fecha del 03/agosto/2024. Dos ♂♂, 1 ♂ y 1 ♂ paratipos (CNIN) con los mismos datos de colecta, pero con las siguientes fechas: 17/agosto/2024, 29/agosto/2024 y 31/agosto/2024, respectivamente.
Etimología. El nombre específico se refiere a la similitud de los parámeros con el pico de la guacamaya verde Ara militaris (Linnaeus, 1766), ave perteneciente al orden Psittaciformes. Adicionalmente, la localidad tipo pertenece al santuario de la guacamaya verde, en la Reserva de la Biosfera Tehuacán-Cuicatlán.
Distribución. Esta especie solo se conoce de la localidad tipo (fig. 8).
Historia natural. Se observó a los escarabajos adultos de P. (Phytalus) psittacina sp. nov. volar y posarse durante la noche en las copas de los árboles de las especies Prosopis laevigata (Humb. et Bonpl. ex Willd) (mezquite blanco), Acacia farnesiana (L.) Willd (huizache) y Citrus aurantifolia (Christm.) Swingle (limón). También se observó que los escarabajos adultos suelen llevar a cabo sus vuelos nupciales en parcelas de cultivo de agave espadín, presumiblemente para alimentarse de las flores o copular en estas plantas. Esta especie convive con los siguientes Rhizotrogina: Phyllophaga (Phyllophaga) lenis (Horn, 1887) y Listrochelus cuicatecus (Morón y Aragón, 1997).
Comentarios taxonómicos
Dentro del grupo pallida, P. (Phytalus) psittacina sp. nov. Es similar a P. (Phytalus) huiteaca Morón, 2006y P. (Phytalus) dieteriana, en la forma del cuerpo, el cual es de tamaño mediano y proporcionalmente esbelto, con una longitud entre 10 a 15 mm, el color pardo rojizo a amarillo, pronoto ligeramente más ancho que la cabeza, antenas formadas por 10 artejos, del tercer al quinto antenómero cortos, maza antenal masculina más larga o de igual longitud que el funículo, pronoto y élitros glabros. En cuanto a la forma de la cápsula genital, P. (Phytalus) psittacina sp. nov. es similar a P. (Phytalus) huiteaca, ya que ambas especies poseen una concavidad media en la parte ventral de los parámeros, sin embargo, en P. (Phytalus) huiteaca los márgenes ventrales que prosiguen de esta concavidad divergen notablemente hasta converger en los ápices, lo cual es inverso en P. (Phytalus) psittacina sp. nov. Desafortunadamente, se desconoce la hembra de P. (Phytalus) huiteaca por lo que las placas genitales no pueden compararse. En cuanto a la morfología genital de la hembra, esta tiene una configuración única entre las especies del grupo, donde las placas genitales inferiores en su parte superior, tienen ligera similitud con aquellas de Phyllophaga (Phytalus) reyesiana, Morón 1992, con los bordes ligeramente divergentes y ornamentados con sedas.
Discusión
De acuerdo con Morón et al. (2014), la abundancia de escarabajos melolóntidos puede categorizarse de acuerdo con el número de ejemplares capturados por métodos convencionales para el grupo. En este sentido, a lo largo del año 2024, se recolectó un total de 7 ejemplares de P. (Phytalus) psittacina sp. nov., todos machos, por lo que esta especie puede considerarse como escasa dentro del rango de clasificación. Las únicas 2 hembras conocidas fueron recolectadas en muestreos aleatorios previos durante el 2023, realizados con la idea de tener una aproximación de la fauna de la zona de estudio. Por otro lado, P. (Phytalus) dieteriana se considera como una especie con abundancia baja (27 ejemplares) en la población reportada como nuevo registro en Oaxaca. Para esta especie, de igual manera la mayor cantidad de ejemplares recolectados fueron machos. La abundancia de los ejemplares de las especies del grupo parece ser baja, capturándose no más de 35 ejemplares por especie (Morón, 2006).
Diversos estudios faunísticos enfocados a la riqueza, diversidad y abundancia de escarabajos melolóntidos en Mesoamérica reportan la presencia de un número variable de especies del género Phyllophaga, así como de otros géneros relacionados de la subtribu Rhizotrogina (e.g., Chlaenobia Blanchard, 1850 y Listrochelus Blanchard, 1850). Los datos de riqueza oscilan entre 4 y 24 especies de Phyllophaga (Aragón-García et al., 2008; Castro-Ramírez et al., 2005; Cuate-Mozo et al., 2016; Delgado et al., 2012; Deloya et al., 1995; Doskocil et al., 2008; Mateos-Escudero et al., 2021; Márquez-Manzano et al., 2023; Ramírez-Ponce et al., 2009). En la localidad tipo de P. (Phytalus) psittacina sp. nov., se está realizando un monitoreo de escarabajos melolóntidos que son atraídos a la luz tipo led blanca. Sorpresivamente, para esta zona, a lo largo de un monitoreo sistemático durante todo el 2024 (además de recolectas aleatorias durante el 2023), solo 3 especies de Rhizotrogina han sido capturadas: P. (Phytalus) psittacina sp. nov. (7 ejemplares), P. (Phyllophaga) lenis (15 ejemplares) y L. cuicatecus (142 ejemplares), consideradas como especies con abundancia moderada y alta, respectivamente. Estos muestreos se realizaron en 3 parcelas diferentes, que abarcan un área aproximada de 2.6 Km2. Morón et al. (2014) mencionan que en ambientes cálido-húmedos y cálido-secos predominan las especies con abundancias moderadas o bajas, como se observa en ambas especies de Phyllophaga. De igual manera, los trabajos enfocados en riqueza y abundancia, indican que existe una menor riqueza de especies en ambientes agrícolas en comparación con ambientes no perturbados, y a su vez, especies con abundancia alta y muy alta en el caso de escarabajos con hábitos alimenticios rizófagos. En la zona de estudio, los muestreos se están realizando en una parcela de agave, por lo que el tipo de ambiente cálido-seco (matorral xerófilo), más la presencia de cultivos agrícolas perennes, pueden ser los factores determinantes para la poca riqueza y abundancia, por lo menos de las especies de Rhizotrogina.
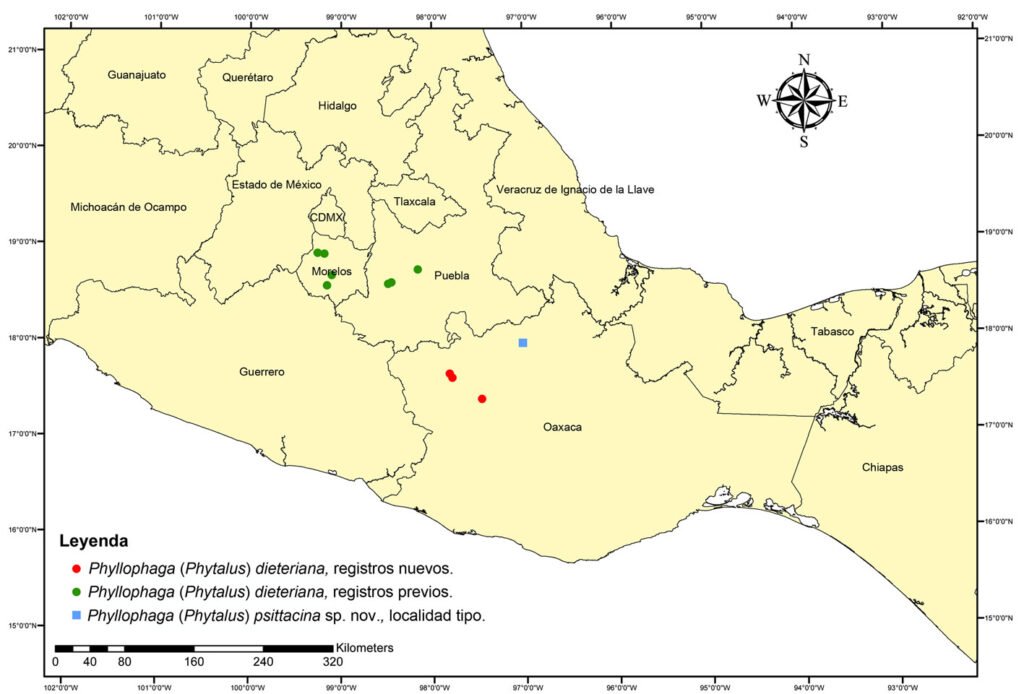
Con respecto a las restantes especies del grupo pallida, todas ellas se distribuyen en ambientes cálido-secos, abarcando matorrales xerófilos, bosques espinosos y bosques tropicales caducifolios, lo que nos indica la preferencia de estas especies por estos ambientes. La mayoría de las especies de este grupo se distribuye a lo largo de la vertiente del Pacífico, abarca casi en su totalidad a la provincia biogeográfica Tierras Bajas del Pacífico, con excepción de Phyllophaga (Phytalus) pallida (Horn, 1885) y Phyllophaga (Phytalus) sonora Saylor, 1939, las cuales se distribuyen entre los límites al norte de las provincias Tierras Bajas del Pacífico y Sonora (sensu Morrone, 2019; Morrone et al., 2017). Cabe resaltar el caso excepcional de P. (Phytalus) dieteriana, que es la única especie que se distribuye en el centro del país, en Morelos y Puebla, en la parte central de la provincia biogeográfica Cuenca del Balsas, incluyendo los nuevos registros reportados en el presente trabajo. Con la adición de P. (Phytalus) psittacina sp. nov., esta especie se distribuye en la provincia biogeográfica Valle de Tehuacán-Cuicatlán (sensu Rzedowski, 1978), la cual corresponde a la provincia más pequeña, de acuerdo con el criterio de Rzedowski. Sin embargo, de acuerdo con la propuesta de Morrone (2019), el área de distribución geográfica de la especie nueva, corresponde a los límites más hacia el centro-sur de la provincia Cuenca del Balsas. También Morrone (2019) indica que esta provincia se encuentra estrechamente relacionada con las Tierras Bajas del Pacífico, lo cual explicaría la distribución geográfica del grupo pallida. Fitogeográficamente, por lo menos la flora de Asteraceae del Valle de Tehuacán-Cuicatlán se relaciona con las de otras regiones áridas y semiáridas de la provincia Cuenca del Balsas y Tierras Bajas del Pacífico (Villaseñor, 1990); así como ambas provincias comparten un gran número de taxones endémicos de la familia Burseraceae (Becerra y Venable, 1999).
Agradecimientos
El primer autor agradece al Consejo Nacional de Humanidades, Ciencias y Tecnologías (Conahcyt), actualmente Secretaría de Ciencia, Humanidades, Tecnología e Innovación (Secihti), por la beca 1320122 y al Instituto Tecnológico del Valle de Oaxaca (ITVO) por su apoyo a la investigación. Este trabajo fue financiado por el Conahcyt, bajo el proyecto número 320715: “Modelo predictivo como estrategia de control de la gallina ciega (Phyllophaga spp.) con base en información climática y del microhábitat en el suelo en sistemas de mono- y policultivos de maíz nativo en Oaxaca”, apoyo otorgado al autor de correspondencia (JACL). Agradecemos el respaldo durante el trabajo de campo a los productores, por facilitar el acceso a sus parcelas donde se realizaron los muestreos. También agradecemos a César Augusto Cruz López, por su apoyo durante la recolecta de melolóntidos en la región de la Mixteca, Oaxaca. De igual manera, agradecemos a los estudiantes que nos apoyaron con la toma de fotografías y las recolectas en campo, especialmente a Eunice Raquel Avendaño Zavaleta (UMAR) y a Marlon Federico Cortes Dávila (UDEA). Finalmente agradecemos a 2 revisores anónimos quienes dieron acertadas sugerencias a la versión previa del manuscrito.
Referencias
Allsop, P. G. y Schoolmeesters, P. (2024). All genera of the world: Subfamilies Prototroginae, Cretoscarabaeinae, Dynamonodinae, Electrorubesopsinae, Phaenomeridinae, Orphninae, Allidiostomatinae, Aclopinae, Lichniinae, Melolonthinae, Oncerinae, Podolasiinae, Sericinae, Sericoidinae (Animalia: Arthropoda: Insecta: Coleoptera: Scarabaeidae). Megataxa, 12, 104–175. https://doi.org/10.11646/megataxa.12.
Aragón-García, A., Nochebuena-Trujillo, C. D., Morón, M. A. y López-Olguín, J. F. (2008). Uso de trampas de luz fluorescente para el manejo de la gallina ciega (Coleoptera: Melolonthidae) en maíz (Zea mays L.) Agrociencia, 42, 217–223.
Aragón-García, A., Pérez-Torres, B., Aragón-Sánchez, M., Cuate-Mozo, V. A., López-Olguín, J. F. y Lugo-García, G. L. (2018). Estrategias agroecológicas para el control de gallina ciega en cultivos agrícolas. En M. B. Nájera R. y Aragón-García, G. (Eds.), Diversidad, ecología y manejo de insectos rizófagos (pp. 135–147). Ciudad de México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias/ La Benemérita Universidad Autónoma de Puebla.
Barria, M. D., Clavijo-Bustos, J. y Ramírez-Ponce, A. (2022). A new species of Phyllophaga (s. str.) schizorhina species group (Coleoptera: Scarabaeidae: Melolonthinae: Rhizotrogini) from Panama. Faunitaxys, 10, 1–5. https://doi.org/10.57800/faunitaxys-10(58)
Becerra, X. J. y Venable, L. (1999). Nuclear ribosomal DNA and its implications for evolutionary trends in Mexican Bursera (Burseraceae). American Journal of Botany, 86, 1047–1057. https://doi.org/10.2307/2656622
Castro-Ramírez, A. E., Delfín-González, E. H., Parra-Tabla, V. y Morón, M. A. (2005). Fauna de melolóntidos (Coleoptera: Scarabaeoidea) asociados al maíz (Zea mays L.) en los Altos de Chiapas, México. Folia Entomológica Mexicana, 44, 339–365.
Cuate-Mozo, V. A., Aragón-García, A., Pérez-Torres, B. C., López-Olguín, J. F., Morón, M. A. y Rojas-Martínez, R. I. (2016). Manejo del complejo gallina ciega (Coleoptera: Melolonthidae) asociado al cultivo de amaranto (Amaranthus hypochrondriacus L.) en Puebla, México. Agrociencia, 50, 889–900.
Delgado, L., Mora-Aguilar, E. F. y Escobar-Hernández, F. (2012). Scarabaeoidea (Coleoptera) of the municipality of Xalapa, Veracruz, Mexico: Inventory and analysis. The Coleopterists Bulletin, 66, 319–332. https://dx.doi.org/10.1649/072.066.0405
Doskocil, J. P., Walker, N. R., Bell, G. E., Marek, M., Reinert, J. A. y Royer, T. A. (2008). Species composition and seasonal occurrence of Phyllophaga (Coleoptera: Scarabaeidae) infesting intensely managed bermudagrass in Oklahoma. Journal of Economic Entomology, 101, 1624–1632. https://doi.org/10.1603/0022-0493(2008)101[1624:SCASOO]2.0.CO;2
Deloya, C. y Morón, M. A. (1998). Nuevas especies de Phyllophaga Harris (Coleoptera: Melolonthidae) de Morelos, Puebla y Chiapas, México. Folia Entomológica Mexicana, 104, 109–119.
Deloya, C., Morón, M. A. y Lobo, J. M. (1995). Coleoptera Lamellicornia (Macleay, 1819) del sur del Estado de Morelos, México. Acta Zoológica Mexicana (nueva serie), 65, 1–42. https://doi.org/10.21829/azm.1995.65651653
Gutiérrez-Carranza, I. G. (2023). Protocolo para disección y montaje de luciérnagas (Coleoptera: Lampyridae). Boletín de la Asociación Mexicana de Sistemática de Artrópodos, 7, 2–6.
Hernández-Cruz, J., Morón, M. A., Sánchez-García, J. A., Martínez-Martínez, L., Jarquín-López, R. y Cerqueda-Reyes, H. (2016). Listado de especies del género Phyllophaga Harris, 1827 (Coleoptera: Melolonthidae, Melolonthinae) en el estado de Oaxaca. Entomología Mexicana (nueva serie), 3, 924–929.
Kawada, R. y Buffington, M. L. (2016). A scalable and modular dome illumination system for scientific microphotograph on a budget. Plos One, 11, e0153426. https://doi.org/10.1371/journal.pone.0153426
Mateos-Escudero, M., Guzmán-Vázquez, H. M., Lozano-Trejo, S., Sánchez-García, J. A. y Pérez-León, M. I. (2021). White grub adults associated with maize (Zea mays L.) at Zaachila, Oaxaca, Mexico. Southwestern Entomologist, 46, 709–724. https://doi.org/10.3958/059.046.0312
Márquez-Luna, J. (2005). Técnicas de colecta y preservación de insectos. Boletín Sociedad Entomológica Aragonesa, 37, 385–408.
Márquez-Manzano, J. P., Aragón-García, A., Cuate-Mozo, V. A. y Pérez-Torres, B. C. (2024). Diversidad de gallinas ciegas (Coleoptera: Melolonthidae) asociadas a pastos ornamentales de la Ciudad de Puebla, México. Entomología Mexicana, 11, 1–5.
Morón, M. A. (1986). El género Phyllophaga en México. Morfología, distribución y sistemática supraespecífica (Insecta: Coleoptera). Publicación 20. Ciudad de México: Instituto de Ecología.
Morón, M. A. (1992). Nuevas especies mexicanas del subgénero Chlaenobia de Phyllophaga (Coleoptera: Melolonthidae). Giornale Italiano di Entomologia, 6, 35–51.
Morón, M. A. (2006). Revisión de las especies de Phyllophaga (Phytalus) grupos obsoleta y pallida (Coleoptera: Melolonthidae: Melolonthinae). Folia Entomológica Mexicana, 45 (Suplemento 1), 1–104.
Morón, M. A. (2015a). Revisión del nuevo grupo de especies “guapilana” de Phyllophaga (s. str.) (Coleoptera: Melolonthidae: Melolonthinae). Boletín de la Sociedad Entomológica Aragonesa, 56, 27–38.
Morón, M. A. (2015b). Revisión del nuevo grupo de especies “quetzala” de Phyllophaga (s. str.) (Coleoptera: Melolonthidae: Melolonthinae). Elytron, 27, 3–28.
Morón, M. A. (2018). Revisión del grupo de especies “pruinosa” de Phyllophaga (Phytalus) (Coleoptera: Melolonthidae: Melolonthinae). Dugesiana, 25, 37–59.
Morón, M. A. y Terrón, R. A. (1988). Entomología práctica. Ciudad de México: Instituto de Ecología.
Morrone, J. J. (2019). Regionalización biogeográfica y evolución biótica de México: encrucijada de la biodiversidad del Nuevo Mundo. Revista Mexicana de Biodiversidad, 90, e902980. https://doi.org/10.22201/ib.20078706e.2019.90.2980
Morrone, J. J., Escalante, T. y Rodríguez-Tapia, G. (2017). Mexican biogeographic provinces: map and shapefiles. Zootaxa, 4277, 277–279. https://doi.org/10.11646/zootaxa.
4277.2.8
Morón, M. A., Nogueira, G., Rojas-Gómez, C. V. y Arce-Pérez, R. (2014). Biodiversidad de Melolonthidae (Coleoptera) en México. Revista Mexicana de Biodiversidad, 85 (Supl.), 293–302. https://doi.org/10.7550/rmb.31834
Ramírez-Ponce, A., Allende-Canseco, J. y Morón, M. A. (2009). Fauna de coleópteros lamelicornios de Santiago Xiacui, Sierra Norte, Oaxaca, México. Acta Zoológica Mexicana (nueva serie), 25, 323–343. https://doi.org/10.21829/azm.2009.252640
Rivera-Gasperín, S. L. y Morón, M. A. (2013). Análisis filogenético del subgénero Phyllophaga (Triodonyx) (Coleoptera: Melolonthidae: Melolonthinae). Revista Mexicana de Biodiversidad, 84, 802–817. https://doi.org/10.7550/rmb.34034
Rivera-Gasperín, S. L. y Morón, M. A. (2017a). Phylogenetic relationships within Phyllophaga Harris (sensu lato) (Coleoptera: Melolonthidae, Melolonthinae) with emphasis on Listrochelus Blanchard. Neotropical Entomology, 46, 1–13. https://doi.org/10.1007/s13744-017-0482-6
Rivera-Gasperín, S. L. y Morón, M. A. (2017b). Relaciones filogenéticas de las especies de Chlaenobia con otros miembros de Phyllophaga s. lato (Coleoptera: Melolonthidae: Melolonthinae). Revista Mexicana de Biodiversidad, 88, 592–607. https://doi.org/10.1016/j.rmb.2017.07.011
Romero-López, M. y Morón, M. A. (2017). Dos nuevas especies de Coleoptera Melolonthidae de la Costa Grande de Guerrero, México. Southwestern Entomologist, 42, 889–900. https://doi.org/10.3958/059.042.0327
Rzwedowski, J. (1978). Vegetación de México. Ciudad de México: Editorial Limusa.
Villaseñor, J. L. (1990). The genera of Asteraceae endemic to Mexico and adjacent regions. Aliso, 12, 685–692.