Lo pasado, pasado: actualización taxonómica y distribución geográfica de la flora vascular de la Estación de Biología Tropical Los Tuxtlas, Veracruz, México
What’s done is done: taxonomic update and geographical distribution of the vascular flora of the Los Tuxtlas Tropical Biology Station, Veracruz, Mexico
Guillermo Ibarra-Manríquez *, Guadalupe Cornejo-Tenorio y Santiago Sinaca-Colín
Universidad Nacional Autónoma de México, Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Antigua carretera a Pátzcuaro Núm. 8701, 58190 Morelia, Michoacán, México
*Autor para correspondencia: gibarra@iies.unam.mx (G. Ibarra-Manríquez)
Recibido: 21 julio 2025; aceptado: 10 octubre 2025
Resumen
El objetivo principal del presente trabajo es actualizar la nomenclatura y el inventario de las especies registradas en la Estación de Biología Tropical Los Tuxtlas (ELT), localizada en el estado de Veracruz, con base en la consulta de literatura florístico-taxonómica, ejemplares de herbario, bases de datos electrónicas y taxónomos. Se registran 934 especies, 571 géneros y 139 familias. Las 20 familias con mayor número de especies abarcan 58.8% de la flora, destacando Orchidaceae (108 especies), Asteraceae (61) y Fabaceae (58); los géneros más relevantes fueron Epidendrum (16), Piper (14) y Ficus (10). Un total de 48 familias (34.5%) y 410 géneros (71.8%) están representados por una especie. Las formas de crecimiento más frecuentes son las hierbas (453 especies, 48.5%) y árboles (259, 27.7%). Noventa y tres especies (10%) son endémicas de México. Las especies de la ELT que se comparten exclusivamente con Centroamérica son las más frecuentes (29.8%), seguidas por las que se registran conjuntamente en Centroamérica, Antillas y Sudamérica (23.2%). Se enfatiza la importancia de continuar con el inventario de esta reserva ubicada en una de las regiones con mayor tasa de deforestación en México.
Palabras clave: Endemismo; Forma de crecimiento; Hábito; Selva alta perennifolia
Abstract
The main objective of this work is to update the nomenclature and inventory of the flora of the Los Tuxtlas Tropical Biology Station, located in Veracruz State, based on floristic-taxonomic literature, herbarium specimens, electronic databases, and support of taxonomists. We registered 934 species, 571 genera, and 139 families. The 20 families with the greatest number of species comprise 58.8% of the flora, highlighting Orchidaceae (108 species), Asteraceae (61), and Fabaceae (58); the most specious genera were Epidendrum (16), Piper (12), and Ficus (10). Forty-eight families (34.5%) and 410 genera (71.8%) are represented by one species. The most common growth forms were herbs (453, 48.5%) and trees (259, 27.7%). Ninety-three species (10%) are endemic to Mexico, and 29.8% of the species are shared exclusively with Central America, followed by the area encompassing Central America, Antilles, and South America (23.2%). The importance of maintaining the inventory of this conservation area in one of Mexico’s regions with the highest rates of deforestation, is emphasized.
Key words: Endemism; Growth form; Life form; Tropical rain forest
Introducción
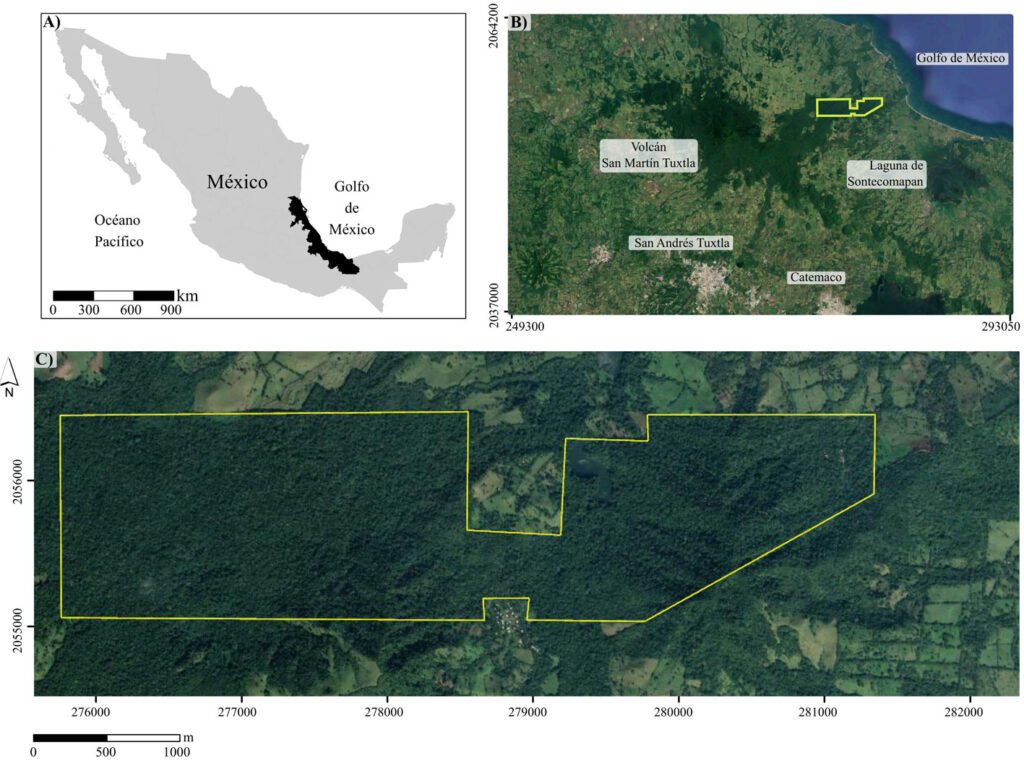
La región de Los Tuxtlas, localizada en el estado de Veracruz, forma parte de una de las áreas con mayor número de especies del bioma bosque tropical húmedo en México (Villaseñor, 2016) y fue incluida en la provincia biogeográfica de la Costa del Golfo de México por Rzedowski (1978), perteneciente al Reino Neotropical, lo que concuerda con la delimitación de este reino propuesta por Liu et al. (2023). En esta región se decretó, en 1998, la Reserva de la Biosfera Los Tuxtlas, con una extensión de 155,122-46-90 ha (Conanp, 2006). El establecimiento de esta reserva concuerda con su designación como una de las áreas prioritarias más importantes para la conservación de los bosques húmedos de México (Villaseñor et al., 2003). En la zona núcleo Volcán San Martín Tuxtla de esta reserva de la biosfera, se asienta la Estación de Biología Tropical Los Tuxtlas (ELT), perteneciente a la Universidad Nacional Autónoma de México.
De acuerdo con Reynoso et al. (2017), la ELT tiene como áreas de investigación fundamentales el inventario de las especies que protege y estudios sobre la ecología y restauración de la selva tropical húmeda de la región de Los Tuxtlas. Ambas áreas de investigación requieren conocimiento confiable sobre la identidad taxonómica de las especies que conforman su flora. En particular, la primera de ellas no ha perdido vigencia, puesto que los inventarios florísticos son un componente fundamental de agendas de investigación nacionales e internacionales (e.g., Daly et al., 2012; Villaseñor y Meave, 2022), ya que sus resultados permiten realizar distintos tipos de análisis para la obtención de patrones biogeográficos, ecológicos y evolutivos de la biodiversidad (Antonelli et al., 2023; Raven et al., 2020; Sarukhán et al., 2015; Ulloa et al., 2017; Villaseñor y Meave, 2022; Villaseñor y Ortiz, 2014).
Con base en el material de colectores botánicos pioneros como Juan Ismael Calzada, Refugio Cedillo Trigos, Guadalupe Martínez Calderón, Marino Rosas R. y Ángel Villegas Herrera, así como en el trabajo florístico, iniciado en febrero de 1982 para establecer un herbario de referencia para la ELT, Ibarra-Manríquez y Sinaca (1987) publicaron el primer listado de plantas de esta área de conservación. Posteriormente, con el objetivo de aportar datos más detallados de cada especie —e.g., nombre común, forma de crecimiento, fenología reproductiva, usos—, estos autores publicaron una lista comentada (Ibarra-Manríquez y Sinaca, 1995, 1996a, b), en la que se reportaron 940 especies y 543 géneros, agrupados en 137 familias. Un análisis de los usos que para el ser humano tiene este contingente florístico se encuentra en Ibarra-Manríquez, Ricker et al. (1997), así como de su potencial para actividades de restauración regional (Ibarra-Manríquez 2017).
Otras publicaciones que pueden citarse relacionadas con el conocimiento florístico de la ELT son las diagnosis de especies de palmas y trepadoras (Campos et al., 2004; Ibarra-Manríquez, 1988), así como de los frutos y semillas de cerca de 350 especies (Ibarra-Manríquez et al., 2015; Sánchez-Garfías et al., 1991). Más recientemente, Cornejo-Tenorio et al. (2019) publicaron una guía ilustrada que incluye 464 especies con diversas formas de crecimiento. Para toda la región de Los Tuxtlas, existe un manual de determinación de especies de árboles (Vázquez et al., 2010), así como el trabajo de Villaseñor et al. (2018), en el que se analizan distintos aspectos de la flora y que incluye una lista de 2,548 especies.
En el presente siglo, han ocurrido avances sustanciales en el conocimiento florístico y taxonómico de las plantas neotropicales. Por ejemplo, hace todavía un par de décadas habría sido difícil pensar que se contaría con un listado de la flora mexicana (Villaseñor, 2016) y, menos probable aún, con un inventario florístico para todo el continente americano (Ulloa et al., 2017). Estos progresos han sido impulsados, entre otros aspectos, por el desarrollo de bases electrónicas que manejan un gran cúmulo de datos (e.g., POWO, 2025; Tropicos, 2025), en combinación con la conformación del Angiosperm Phylogeny Group, el cual se ha abocado a la elaboración de un sistema de clasificación que refleje, cada vez con mayor precisión, las relaciones de parentesco entre los diferentes taxones de las plantas vasculares de todo el mundo (APG IV, 2016).
Como se describe en el párrafo previo, la lista aportada por Ibarra-Manríquez y Sinaca (1995, 1996a, b), la más detallada para toda la flora de la ELT, requiere una revisión nomenclatural, lo cual fue sugerido previamente por Ibarra-Manríquez (2017). En consecuencia, el presente estudio tiene como objetivos principales: 1) actualizar la nomenclatura taxonómica de las especies registradas en esta área de conservación, 2) adicionar a su inventario las especies descritas desde 1997 a la fecha y 3) documentar la forma de crecimiento, el hábito y la distribución geográfica de cada especie.
Materiales y métodos
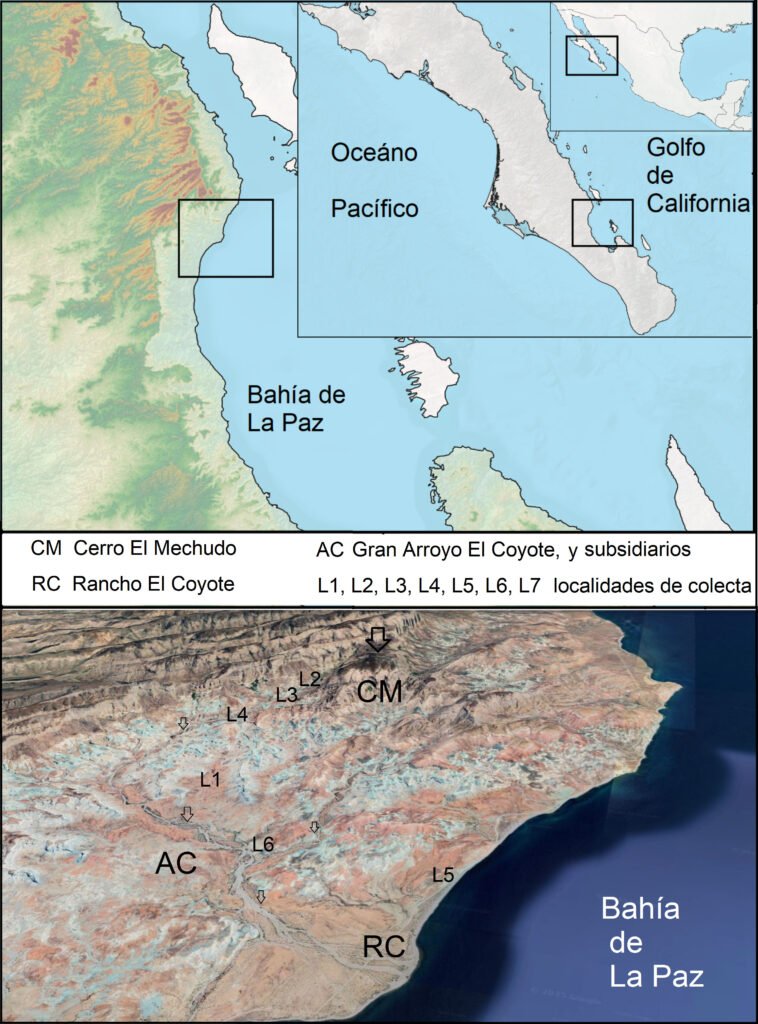
La Estación de Biología Tropical Los Tuxtlas es un área de conservación de 640 ha, con elevaciones entre 130 y 560 m (fig. 1), que pertenece al municipio de San Andrés Tuxtla, Veracruz. El relieve de la sierra de Los Tuxtlas es principalmente volcánico, cuya actividad data del Terciario; los sedimentos más antiguos (arcillas tobáceas y areniscas marinas de la formación La Laja) han sido fechados del Oligoceno (Martin-Del Pozzo, 1997). La información detallada sobre el clima de la región de Los Tuxtlas, que incluye mapas de los promedios anuales de temperatura y precipitación, puede consultarse en Gutiérrez-García y Ricker (2011). Con base en Soto y Gama (1977), se infiere que el clima en la ELT es cálido-húmedo [Af (m)], con lluvias todo el año, precipitación promedio anual entre 3,000 y 4,000 mm, precipitación del mes más seco mayor de 60 mm, lluvia invernal con respecto a la anual menor de 18%, temperatura media anual mayor de 22 oC y temperatura del mes más frío superior a 18 oC. Recientemente, Ek-Rodríguez et al. (2022) reportan para la ELT promedios anuales de temperatura (24.2 °C) y precipitación (3,433 mm), con una época seca corta (abril y mayo).
El tipo de vegetación en la ELT es la selva alta perennifolia (Miranda y Hernández, 1963), bosque tropical perennifolio (Rzedowski, 1978) o con base en la clasificación de Holdridge, bosque tropical húmedo (Ibarra-Manríquez et al., 1997; Gutiérrez-García y Ricker, 2011). Ibarra-Manríquez, Martínez-Ramos et al. (1997) enlistan las especies más frecuentes en 3 variantes del bosque tropical húmedo que difieren en fisonomía, elevación y tipos de suelo sobre los que se establecen (figs. 2-5; ver material suplementario para las autoridades taxonómicas de las especies). Los autores destacaron la presencia en el estrato bajo del bosque (1-10 m) de las palmas, particularmente de Astrocaryum mexicanum y Chamaedorea spp. Otras especies importantes de este estrato son Acalypha skutchii (Euphorbiaceae), Piper spp. (Piperaceae), Trophis mexicana (Moraceae) y otras pertenecientes a Urticaceae (Myriocarpa longipes, Urera glabriuscula y Urera simplex) y Rubiaceae (Faramea occidentalis, Palicourea faxlucens y Palicourea tetragona). En el estrato medio y alto se encuentran Bursera simaruba (Burseraceae), Calatola uxpanapensis (Metteniusaceae), Cecropia obtusifolia (Urticaceae), Croton schiedeanus (Euphorbiaceae), Ceiba pentandra (Malvaceae), Cymbopetalum baillonii (Annonaceae), Damburneya ambigens (Lauraceae), Dendropanax arboreus (Araliaceae), Garcinia intermedia (Clusiaceae), Guarea glabra (Meliaceae), Licaria velutina (Lauraceae), Omphalea oleifera (Euphorbiaceae), Pterocarpus rohrii (Fabaceae) y especies de Moraceae (Brosimum alicastrum, Ficus isophlebia, Ficus yoponensis, Poulsenia armata y Pseudolmedia glabrata. Entre las lianas destacan varias especies de Bignoniaceae (e.g., Callichlamys latifolia, Fridericia schumanniana, Tanaecium pyramidatum), así como Abuta panamensis (Menispermaceae), Forsteronia acouci (Apocynaceae) y Salacia cordata (Celastraceae). En lo que se refiere a las hierbas, ya sean terrestres, epífitas o hemiepífitas, es evidente la abundancia de especies de Acanthaceae (Aphelandra aurantiaca, Schaueria parviflora), Araceae (Anthurium spp., Dieffenbachia oerstedii, Philodendron spp., Spathiphyllum ortgiesii, Syngonium spp.), Orchidaceae (Epidendrum spp., Nidema boothii, Oncidium sphacelatum, Prosthechea cochleata) y Piperaceae (Peperomia spp.).

La vegetación cambia sus hojas de manera paulatina a lo largo del año, con algunas especies caducifolias (Ibarra-Manríquez, Martínez-Ramos et al., 1997), particular-
mente durante la época de secas, por ejemplo, Bernoullia flammea, Ceiba pentandra (ambas Malvaceae), Bursera simaruba (Burceraceae), Dussia mexicana, Erythrina folkersii, Vatairea lundelli (todas Fabaceae), Ficus isophlebia, Handroanthus guayacan (Bignoniaceae), Jacaratia dolichaula (Caricaceae) y Omphalea oleifera. La altura de los árboles del dosel puede alcanzar entre 10-20 m en las cimas de los cerros El Vigía o Cerro Azul (Lázaro Cárdenas), mientras que en sitios con menor pendiente pueden alcanzar de 30 a 40 m (Ibarra-Manríquez, Martínez-Ramos et al., 1997). Para información más detallada sobre la vegetación consultar Bongers et al. (1988), Popma et al. (1988), Manríquez, Ricker et al. (1997), Ibarra-Manríquez, Martínez-Ramos (1997), Navarrete-Segueda et al. (2021), Miranda-Gallegos et al. (2023) y Ek-Rodríguez et al. (2022, 2024, 2025).


La lista de especies para helechos y grupos afines está ordenada con base en PPG I (2016) y para las angiospermas la clasificación de APG IV (2016). Las familias, géneros y especies siguen un orden alfabético. La familia y especie con el que los integrantes de la flora fueron citados en Ibarra-Manríquez y Sinaca (1995, 1996a, b) fueron revisados y en caso de ser necesario, se actualizaron nomenclaturalmente con base en lo indicado por estudios taxonómicos (tabla 1), la revisión de las bases de datos POWO (2025) y Tropicos (2025), así como la consulta directa con taxónomos; estas fuentes de consulta fueron también usadas para indicar la distribución geográfica de cada especie.

La forma de crecimiento, hábito, altura de las especies, nombre común, así como la asociación con pastizales antropogénicos o vegetación ruderal de las especies, se derivaron de observaciones en campo realizadas de febrero de 1982 a junio de 2025, así como de la consulta de material depositado en el Herbario Nacional (MEXU) y el herbario de referencia que se encuentra en la ELT. Las formas de crecimiento y hábito siguen las definiciones de Moreno (1984). En particular, los árboles y arbustos fueron clasificados con base en su altura, ya que los primeros son plantas leñosas ≥ 3 m, mientras que los arbustos no superan este valor. En el caso de las especies con hábito trepador, las leñosas se denominan lianas, mientras que las que no presentan esta condición son trepadoras. Para las especies cuyo ejemplar tipo fue recolectado en la ELT, se indican los nombres de los colectores, el número de colecta y las siglas de los herbarios en los que se encuentran depositados el holotipo e isotipos. El listado excluye las especies cultivadas como Mangifera indica L. (Anacardiaceae) y Pachira aquatica Aubl. (Malvaceae).
Resultados
La lista compilada incluye 934 especies, 571 géneros y 139 familias (material suplementario). Entre los grupos de clasificación con jerarquía más alta (tabla 2; material suplementario), las Eudicotiledóneas son las que tienen una representación mayor respecto al número de familias (68.3%), géneros (67.4%) y especies (60.9%). Las 20 familias con mayor número de especies abarcan 59.1% de la flora, destacando Orchidaceae (108 especies), Asteraceae (61), Fabaceae (58), Rubiaceae (35) y Poaceae (28) (tabla 3). A nivel de género, los más relevantes al respecto son Epidendrum L. (16 especies), Piper L. (13), Ficus L. (10), así como Peperomia Ruiz et Pav. y Solanum L. (9 especies cada uno). Cuarenta y ocho familias (34.5%) y 410 géneros (71.8%) están representados por 1 especie. Un total de 27 especies fueron descritas como nuevas para la ciencia con base en colectas realizadas en la ELT; de 1997 a la fecha, 45 especies son integrantes adicionales de su flora (material suplementario).
Las formas de crecimiento más frecuentes fueron las hierbas (48.5%) y los árboles (27.7%); respecto al hábito de crecimiento, 77.6% de las especies son terrestres, seguidas en importancia por las trepadoras y epífitas que representan 17.3% y 16%, respectivamente (tabla 4). Las distribuciones geográficas con mayores registros de especies fueron las que se comparten exclusivamente entre México y Centroamérica (278 especies, 29.8%), ocupando el segundo sitio la agrupación formada por estas 2 áreas con Antillas y Sudamérica (217, 23.2%) (tabla 5). Catorce especies son cosmopolitas, 3 pantropicales y 14 introducidas (material suplementario). Un total de 93 especies (10%) son endémicas de México y 17 restringen su presencia a la región de Los Tuxtlas o Veracruz (tabla 6, fig. 6). Cerca de 24% de las especies se asocian con pastizales antropogénicos y vegetación ruderal (material suplementario), sin que se haya registrado su presencia en el bosque tropical perennifolio de la reserva, tanto en su fase madura como en etapas sucesionales tempranas o intermedias.
Discusión
Florística
La dominancia actual de las angiospermas entre las plantas vasculares del mundo es un hecho ampliamente documentado y se constata en el presente estudio (tabla 2), ya que engloban 91.5% de las especies, porcentaje prácticamente igual al que reportan Villaseñor et al. (2018) para toda la región de Los Tuxtlas (91.2%). El comparativo de la riqueza taxonómica reportado por Ibarra-Manríquez y Sinaca (1995, 1996a, b) y el del presente estudio no presentan diferencias cuantitativas notables a nivel de familias (139 y 138, respectivamente) ni de especies (940 y 934). Sin embargo, cualitativamente los cambios son numerosos (material suplementario). A nivel de familia, existen casos en que algunas de ellas han sido reconocidas como distintas (e.g., Phyllanthaceae, antes incluida en Euphorbiaceae; Dipentodontaceae, anteriormente en Celastraceae) o, por el contrario, como sinónimos (e.g., Asclepiadaceae de Apocynaceae; Bombacaceae y Tiliaceae de Malvaceae; Hippocrateaceae de Celastraceae; Myrsinaceae y Theophrastaceae de Primulaceae).
Tabla 1
Referencias florístico-taxonómicas consultadas para la elaboración del material suplementario. La etiqueta de varias incluye familias de helechos y licófitos.
| Familias | Referencias |
| Acanthaceae | Ramamoorthy y Uribe (1988), Daniel (2002, 2004, 2005) |
| Annonaceae | Ortiz-Rodriguez (2022), Ortiz-Rodríguez et al. (2024) |
| Apocynaceae | Morales (1997), Alvarado-Cárdenas et al. (2020) |
| Araceae | Krömer et al. (2019) |
| Arecaceae | Bacon y Bailey (2006), Henderson (2011) |
| Asteraceae | Villaseñor y Ortiz (2025) |
| Bromeliaceae | Espejo-Serna et al. (2005), Espejo-Serna y López-Ferrari (2018) |
| Celastraceae | Lombardi (2014), Biral (2021) |
| Costaceae | García-Mendoza e Ibarra-Manríquez (1991) |
| Cyperaceae | González-Elizondo et al. (2018) |
| Elaeocarpaceae | Palacios-Wassenaar y Castillo-Campos (2020) |
| Erythroxylaceae | Palacios-Wassenaar y Castillo-Campos (2019) |
| Fabaceae | Sousa y Rudd (1993), Pennington (1997), Zamora (2006), Sousa (2009, 2010), Aviles et al. (2022) |
| Gesneriaceae | Ramírez-Roa y Ibarra-Manríquez (1998), Clavijo et al. (2021), Ramírez-Roa et al. (2023) |
| Icacinaceae | Vera-Caletti y Wendt (2001) |
| Lamiaceae | Martínez-Gordillo et al. (2017) |
| Lauraceae | Rowher (1993), Lorea-Hernández (2002) |
| Loganiaceae | Islas-Hernández y Alvarado-Cárdenas (2023) |
| Malvaceae | Fryxell (1992) |
| Moraceae | Ibarra-Manríquez et al. (2012), Berg (2015), Hernández-Esquivel et al. (2020) |
| Orchidaceae | Salazar (1988) |
| Passifloraceae | Fragoso-Martínez y Castillo-Campos (2023) |
| Piperaceae | Vergara-Rodríguez et al. (2017), Callejas-Posada (2020), Carmona-Hernández et al. (2022) |
| Poaceae | Dávila et al. (2018) |
| Polygonaceae | Ancona et al. (2025) |
| Proteaceae | Edwards y Prance (2003) |
| Rubiaceae | Lorence y Nee (1987), Torres-Montúfar y Ochoterena (2013), Torres-Montúfar y Torres-Díaz (2022) |
| Sambucaceae | Villareal (2003) |
| Sapotaceae | Swenson et al. (2023) |
| Selaginellaceae | Zhou y Zhang (2023) |
| Smilacaceae | Ferrufino-Acosta (2010) |
| Thelypteridaceae | Riba (2009), Salino et al. (2015) |
| Urticaceae | Monro (2009) |
| Varias | Acebey et al. (2015), Smith y Tejero-Díez (2014), Krömer et al. (2020), Ruiz et al. (2025) |
Tabla 2
Síntesis taxonómica de la flora vascular de la Estación de Biología Tropical Los Tuxtlas.
| Taxones | Familias | Géneros | Especies |
| Lycopodiopsida | 2 | 4 | 11 |
| Polypodiopsida | 16 | 37 | 68 |
| Magnólidas | 9 | 21 | 55 |
| Monocotiledóneas | 17 | 124 | 231 |
| Eudicotiledóneas | 95 | 385 | 569 |
| Total | 139 | 571 | 934 |
Tabla 3
Familias y géneros con mayor número de especies en la zona de estudio.
| Familias | Especies | Géneros | Especies |
| Orchidaceae | 108 | Epidendrum | 16 |
| Asteraceae | 61 | Piper | 14 |
| Fabaceae | 58 | Ficus | 10 |
| Rubiaceae | 35 | Peperomia | 9 |
| Poaceae | 28 | Solanum | 9 |
| Euphorbiaceae | 26 | Eugenia | 8 |
| Araceae | 23 | Inga | 8 |
| Piperaceae | 23 | Passiflora | 8 |
| Solanaceae | 23 | Asplenium | 7 |
| Apocynaceae | 20 | Chamaedorea | 7 |
| Lauraceae | 19 | Cyperus | 7 |
| Bromeliaceae | 17 | Ocotea | 7 |
| Malvaceae | 17 | Begonia | 6 |
| Bignoniaceae | 16 | Desmodium | 6 |
| Moraceae | 16 | Lasiacis | 6 |
| Verbenaceae | 13 | Miconia | 6 |
| Arecaceae | 12 | Mikania | 6 |
| Melastomataceae | 12 | Philodendron | 6 |
| Polypodiaceae | 12 | Pleopeltis | 6 |
| Total | 539 (57.7%) | 152 (16.3%) |
Tabla 4
Número de especies de las formas de crecimiento y hábito de las plantas vasculares en la Estación de Biología Tropical Los Tuxtlas.
| Formas de crecimiento | Especies (%) | Hábito | Especies (%) |
| Árboles | 259 (27.7) | Epífitas | 149 (16) |
| Arbustos | 85 (9.1) | Hemiepífitas | 24 (2.6) |
| Helechos arborescentes | 3 (0.3) | Hemiparásitas | 3 (0.3) |
| Hierbas | 453 (48.5) | Rupícolas | 14 (1.5) |
| Palmas | 12 (1.3) | Parásitas | 1 (0.1) |
| Trepadoras leñosas (lianas) | 94 (10.1) | Terrestres | 725 (77.6) |
| Trepadoras herbáceas | 67 (7.2) | Trepadoras | 161 (17.3) |
Tabla 5
Número de especies de la flora vascular de la Estación de Biología Tropical Los Tuxtlas registradas en distintas áreas geográficas de América.
| País/región | Especies (%) |
| México | 93 (10) |
| México-Centroamérica | 278 (29.8) |
| México-Centroamérica-Antillas | 18 (1.9) |
| México-Centroamérica-Antillas-Sudamérica | 217 (23.2) |
| México-Centroamérica-Sudamérica | 198 (21.2) |
| México-Norteamérica | 1 (0.1) |
| México-Norteamérica-Centroamérica | 3 (0.3) |
| México-Norteamérica-Centroamérica | 2 (0.2) |
| México-Norteamérica-Centroamérica-Antillas-Sudamérica | 74 (7.9) |
| México-Sudamérica | 1 (0.1) |
En el material suplementario se puede revisar que 202 especies son actualmente consideradas como sinónimos y 48 han sido redeterminadas; en conjunto, representan 26.7% del total de la flora, con un promedio anual de 8.6 especies (1997-2025). En ambos casos, su clasificación actual puede incluso asociarse con distintos géneros, como lo ejemplifican Bolbitis bernoullii, sinónimo de Mickelia bernoullii (Dryopteridaceae), Oerstedianthus brevipes de Ardisia tuerckheimii (Primulaceae), Psychotria faxlucens de Palicourea faxlucens (Rubiaceae) o Rheedia edulis de Garcinia intermedia (Clusiaceae); en este rubro, destacan particularmente Bignoniaceae y Lauraceae, ya que alrededor de la mitad de sus especies fueron transferidas a otros géneros. Finalmente, se han descrito varias especies nuevas para la ciencia (material suplementario, tabla 6), que abarcan diversas formas de crecimiento y familias (e.g., Acanthaceae, Annonaceae, Gesneriaceae, Magnoliaceae, Polygonaceae, Proteaceae, Rubiaceae, Sapotaceae).
Las 15 familias con mayor número de especies concentran 52.5% del total registrado para la ELT (tabla 3) y al comparar este rubro con Villaseñor et al. (2018), nuevamente existe una coincidencia alta (50.8%). Ambos estudios concuerdan en 13 de ellas y de las 5 primeras, solo difieren en la posición particular que ocupan Orchidaceae, Asteraceae y Fabaceae. La jerarquía de estas familias se explica por su ubicación entre las más diversas de México y del continente americano (Ulloa et al., 2017; Villaseñor, 2016). Sin embargo, es conveniente considerar que 67.2 y 89.3% de las especies de Asteraceae y Poaceae, respectivamente, se registran únicamente en ambientes ruderales o pastizales de origen antropogénico (material suplementario). En el caso de los géneros con mayor diversidad, 9 de 15 concuerdan entre la región de Los Tuxtlas y el presente estudio, en particular Epidendrum (Orchidaceae), Piper y Peperomia (Piperaceae), Ficus (Moraceae), Solanum (Solanaceae) y Asplenium L. (Aspleniaceae). Los 3 primeros géneros son también encontrados entre los de mayor riqueza en México y América (Ulloa et al., 2017; Villaseñor, 2016).
En situación opuesta, 48 familias (34.5%) y 410 géneros (71.8%) tienen solo una especie en la ELT. Este resultado guarda relación con lo que se registra en México (Villaseñor, 2016), como acontece con Haemodoraceae y Lacistemataceae. Una situación análoga ocurre con numerosos géneros, entre los que pueden citarse Ampelocera Klotzsch (Ulmaceae), Aphananthe Planch. (Cannabaceae), Astrocaryum G. Mey (Arecaceae), Calophyllum L. (Calophyllaceae), Dialium L. (Fabaceae), Lunania Hook. (Salicaceae), Mosquitoxylum Krug et Urb. (Anacardiaceae), Nidema Britton et Millsp. (Orchidaceae), Ochroma Sw. (Malvaceae), Odontocarya Miers (Menispermaceae), Petrea L. (Verbenaceae), Pimenta Lindl. (Myrtaceae), Pleuranthodendron L.O. Williams (Salicaceae), Poulsenia Eggers (Moraceae), Sapindus L. (Sapindaceae), Tuxtla Villaseñor et Strother (Asteraceae) o Vatairea Aubl. (Fabaceae).
Tabla 6
Especies con distribución restringida a la región de Los Tuxtlas o al estado de Veracruz; se indica con un asterisco las que fueron descritas después de las publicaciones de Ibarra-Manríquez y Sinaca (1995, 1996a, b).
| Especies/área | Familia | Forma de crecimiento |
| Región de Los Tuxtlas | ||
| Capparidastrum tuxtlense* | Capparaceae | Árbol |
| Clethra tuxtlensis* | Clethraceae | Árbol |
| Costus dirzoi | Costaceae | Hierba |
| Drymonia mexicana* | Gesneriaceae | Arbusto |
| Hoffmannia altipetens* | Rubiaceae | Arbusto |
| Magnolia sinacacolinii* | Magnoliaceae | Árbol |
| Miconia ibarrae | Melastomataceae | Árbol |
| Mosannona depressa subsp. abscondita* | Annonaceae | Árbol |
| Piper marginecontinuum* | Piperaceae | Arbusto |
| Tridimeris tuxtlensis* | Annonaceae | Árbol |
| Veracruz | ||
| Arachnothryx pumae* | Rubiaceae | Árbol o arbusto |
| Croton sousae* | Euphorbiaceae | Árbol |
| Daphnopsis megacarpa | Thymelaeaceae | Arbusto |
| Eugenia colipensis | Myrtaceae | Árbol |
| Eugenia inirebensis | Myrtaceae | Árbol |
| Macroclinium pachybulbon | Orchidaceae | Hierba |
| Ruellia tuxtlensis | Acanthaceae | Hierba |
Formas de crecimiento y hábito
La fisonomía del bosque tropical perennifolio se debe a la abundancia y al tamaño de los árboles, primordialmente a los del estrato de mayor altura y la ELT no es la excepción al respecto (Bongers et al., 1988; Ibarra-Manríquez, Martínez-Ramos et al., 1997; Navarrete-Segueda et al., 2021). La importancia del componente arbóreo no se relaciona solo con la estructura de los bosques (e.g., contribución a la biomasa), sino también por su desempeño en aspectos funcionales, como la captura de carbono y las interacciones que mantiene con polinizadores y frugívoros (Beckman y Sullivan, 2023; Fuster, et al., 2018; Lutz et al., 2018; Ollerton, 2017; Spicer et al., 2020). Si bien en la ELT esta forma de crecimiento es relevante por su número de especies (259; 27.7%), es superada ampliamente por las hierbas (453, 48.5%).
Este patrón de dominancia del número de especies de hierbas respecto a los árboles debe destacarse en los estudios florísticos de los bosques tropicales, puesto que ha sido registrado previamente (Ibarra-Manríquez et al., 2021; Linares-Palomino et al., 2009; Meave et al., 2017; Rojas-Martínez y Flores-Olvera, 2019). A nivel de bioma, este patrón de riqueza se mantiene, ya que la proporción de hierbas y árboles es de 45% y 30%, respectivamente (Spicer et al., 2020). Para la flora de México, Villaseñor y Ortiz (2014) destacaron la predominancia de las hierbas perennes o anuales (13,408) sobre los árboles (4,044), un aspecto que había sido sugerido primeramente por Rzedowski (1991a). Como una consecuencia de lo anterior, el hábito terrestre es el preponderante en la ELT (77.6%), debido al efecto aditivo de la riqueza de las hierbas y árboles, aunado al aporte de las trepadoras, tanto leñosas como herbáceas. Para los bosques tropicales, Spicer et al. (2020) concuerdan en resaltar la dominancia de este hábito, al englobar 80% de las especies, con el remanente adscrito a las epífitas.

Distribución geográfica y endemismo
El 29.8% de la flora vascular de la ELT se comparte exclusivamente con Centroamérica, mientras que 21.2% se registra en esta área en conjunto con Sudamérica (tabla 5), posiciones que coinciden con lo reportado por Villaseñor et al. (2003) en su estudio biogeográfico de los bosques tropicales húmedos de México (31.4 y 12.7%, respectivamente). Estas afinidades biogeográficas también coinciden con Wendt (1993), quien determinó que el componente arbóreo del dosel de los bosques tropicales de México tenía sus mayores nexos con Centroamérica y con lo destacado por Rzedowski (1991a, b), en relación con las afinidades marcadamente meridionales del bosque tropical perennifolio de México.
Al respecto, es interesante destacar las distribuciones vicariantes de 4 especies, que sólo se han recolectado en la región de Los Tuxtlas y en localidades de Costa Rica (Haydenoxylon calzadae [Celastraceae], Styphnolobium parviflorum [Fabaceae] y Tuxtla pittieri [Asteraceae]) y Honduras (Justicia tuxtlensis [Acanthaceae]), lo que demanda estudios más detallados para explicarlas debidamente, ya que no parecen asociarse a una exploración deficiente de la flora, tomando en cuenta los distintos proyectos florísticos que se están implementando desde hace décadas en la región mesoamericana (e.g., Flora de Costa Rica, Flora de Nicaragua, Flora Mesoamericana).
Por otro lado, se debe discutir lo expuesto por Villaseñor et al. (2018), quienes resaltaron que 6 especies de la región de Los Tuxtlas solo se encuentran en la ELT, lo cual no es correcto para Justicia tuxtlensis, debido a su distribución vicariante previamente expuesta. Esta aseveración tampoco es válida para Capparidastrum tuxtlense (Capparaceae) y Hoffmannia altipetens (Rubiaceae), ya que han sido colectadas tanto en la ELT como en otras localidades de la región. Las 3 especies restantes carecen de registros que certifiquen su presencia en la reserva. Styrax tuxtlensis P.W. Fritsch (Styracaceae) se conoce únicamente de un registro proveniente del volcán Santa Marta, lo que hace muy improbable su presencia en la ELT. En el caso de Guadua tuxtlensis Londoño et Ruiz-Sánchez (Poaceae), es factible que pueda ser colectada en los perímetros de la ELT que colindan con pastizales para la crianza de ganado (fig. 1), ya que es uno de los tipos de vegetación en los que se le ha reportado. De igual manera, la presencia de Diospyros tuxtlensis Provance et A.C. Sanders (Ebenaceae) es viable considerando su colecta en localidades no tan lejanas al oeste de la reserva. Hasta ahora, las especies que se conocen exclusivamente de la ELT son Piper marginecontinuum (Piperaceae) y Tridimeris tuxtlensis (Callejas Posada, 2020; Ortiz-Rodríguez et al., 2024).
La flora endémica de México registrada en la ELT representa 10% del total, una cifra mayor que la sugerida por Rzedowski (1991a) para el bosque tropical perennifolio (5%), similar (9.6%) a la que reportó Wendt (1993) y menor (20.5%) que la citada en Villaseñor et al. (2003). A pesar de la discrepancia de estos valores, existe concordancia en que la región de Los Tuxtlas ha desempeñado un papel relevante como área de concentración de especies arbóreas endémicas (Wendt, 1993), junto con el norte de Oaxaca (Tuxtepec) y el SE de Veracruz (Uxpanapa). Las marcadas similitudes florísticas del bosque tropical húmedo de Veracruz son mayores con Chiapas, Oaxaca, Tabasco y Puebla (Villaseñor y Ortiz, 2025). A nivel de familia, es interesante señalar que 7 de las 8 especies registradas de Gesneriaceae son endémicas de México.
Como conclusiones generales del estudio se debe resaltar que la actualización taxonómica de la flora vascular de la ELT modifica el reconocimiento de una proporción importante de especies, géneros y familias, y por su relevancia, es una actividad que requiere de actualizaciones continuas. Lo dinámico de este proceso se refleja en la tasa de cambios nomenclaturales registrada para la reserva de 1997 a la fecha (8.6 especies anualmente). Se espera que la presente contribución facilite recabar información de diferentes áreas del conocimiento sobre las especies citadas en el material suplementario, por ejemplo, coordinar iniciativas para la restauración regional (Ibarra-Manríquez, 2017). El número de especies registrado en esta área protegida (934 especies) representa 27.8% de las 3,362 que citan Villaseñor y Ortiz (2025) para este bioma en Veracruz, un porcentaje muy importante si se considera la pequeña extensión de esta reserva (640 ha).
Se recomienda continuar con el inventario de la ELT, con el objetivo de cuantificar la composición florística actual con más detalle, que permita, entre otras cosas, detectar la abundancia de las especies y realizar actividades que promuevan su conservación, particularmente para aquellas poco abundantes o con una distribución restringida a ciertas áreas de la ELT (Ibarra-Manríquez, Martínez-Ramos et al., 1997); lo anterior podría ser más aplicable para las especies que registran un bajo número de exsiccatas (material suplementario). Sin duda alguna, esta actividad prioritaria también podría identificar especies nuevas para la ciencia, como lo demuestran los hallazgos registrados desde la década de los 80 hasta la fecha. Una evidencia que respalda lo anterior es que el material tipo de 27 especies fue recolectado dentro de los límites territoriales de la ELT (material suplementario), de las cuales 15 fueron descritas de 1997 a la fecha. Se espera que el presente estudio fomente acciones para conservar el valioso patrimonio biológico del bosque tropical húmedo que resguarda la ELT, límite más norteño de este tipo de vegetación en América. Se debe valorar aún más este papel, especialmente si se considera su localización en elevaciones bajas, que, debido a diversos factores, cada vez tiene menor extensión en la región de Los Tuxtlas (Bonilla-Moheno y Aide, 2020; von Thaden et al., 2020). También sería extremadamente valioso atemperar el deterioro biológico señalado por Ibarra-Manríquez (2017), especialmente en las partes con mayor acceso a actividades humanas.
Agradecimientos
Dos árbitros anónimos y M. Socorro González-Elizondo, en su calidad de editora asociada, aportaron valiosas sugerencias para mejorar una primera versión del presente estudio. Agradecemos a los taxónomos que amablemente revisaron las especies de las familias de su especialidad: Leonardo O. Alvarado-Cárdenas (Apocynaceae), Thomas F. Daniel (Acanthaceae), Mario Adolfo Espejo Serna (Bromeliaceae), Francisco Gerardo Lorea Hernández (Lauraceae). Se reconoce el apoyo de Armando Navarrete Segueda en la elaboración de la figura 1 y finalmente, el de María Antonieta Arizmendi Espinosa en las distintas fases editoriales para finalizar esta publicación.
Referencias
Acebey, A. R., Krömer, T., Vázquez-Torres, M. y Tejero-Díez, J. D. (2015). Helechos y licofitos de la Reserva de la Biosfera Los Tuxtlas, Veracruz, México. Botanical Sciences, 93, 1–32. https://doi.org/10.17129/botsci.124
Alvarado-Cárdenas, L. O., Lozada-Pérez, L., Islas-Hernández, C. S., Cortez, E. B., Maya-Mandujano, K. G. y Chávez-Hernández, M. G. (2020). Apocináceas de ayer y hoy. Conocimiento histórico y reevaluación de la diversidad y distribución de Apocynaceae en México. Botanical Sciences, 98, 393–416. https://doi.org/10.17129/botsci.2525
Ancona, J. J., Ortiz-Díaz, J. J. y Hernández-Ledesma, P. (2025). Eight new species of Coccoloba sect. Campderia (Polygonaceae, Eriogonoideae) from Mexico and Central America. Acta Botanica Mexicana, 132, e2435. https://doi.org/10.21829/abm132.2025.2435
Antonelli, A., Fry, C., Smith, R. J., Eden, J., Govaerts, R. H. A., Kersey, P. et al. (2023). State of the World’s plants and fungi 2023. Royal Botanic Gardens, Kew. England. https://doi.org/10.34885/wnwn-6s63
APG IV (The Angiosperm Phylogeny Group). (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society, 181, 1–20. https://doi.org/10.1111/boj.12385
Aviles, P. G., Koenen, E. J. M., Riina, R., Hughes, C. E., Ringelberg, J. J., Carnevali Fernández-Concha, G. et al. (2022). Re-establishment of the genus Pseudalbizzia (Leguminosae, Caesalpinioideae, mimosoid clade): the New World species formerly placed in Albizia. Phytokeys, 205, 371–400. https://doi.org/10.3897/phytokeys.205.76821
Bacon, C. D. y Bailey, C. D. (2006). Taxonomy and conservation: a case study from Chamaedorea alternans. Annals of Botany, 98, 755–763. https://doi.org/10.1093/aob/mcl158
Beckman, N. G. y Sullivan, L. L. (2023). The causes and consequences of seed dispersal. Annual Review of Ecology, Evolution, and Systematics, 54, 403–427. https://doi.org/10.1146/annurev-ecolsys-102320-104739
Berg, C. C. (2015). Moraceae. En G. Davidse, M. Sousa, S. Knapp y F. Chiang (Eds.), Flora Mesoamericana, Saururaceae a Zygoplyllaceae (pp. 90–116). St. Louis Missouri: Sheridan Books.
Biral, L. (2021). A new combination and a new synonym in Haydenoxylon (Celastraceae). Novon, 29, 74–76. https://doi.org/10.3417/2021646
Bongers, F., Popma, J., Meave-del Castillo, J. y Carabias, J. (1988). Structure and floristic composition of the lowland rain forest of Los Tuxtlas, Mexico. Vegetatio, 74, 55–80. https://doi.org/10.1007/BF00045614
Bonilla-Moheno, M. y Aide, T. M. (2020). Beyond deforestation: land cover transitions in Mexico. Agricultural Systems,
178, 102734. https://doi.org/10.1016/j.agsy.2019.102734
Callejas-Posada, R. (2020). Piperaceae. En G. Davidse, C. Ulloa-Ulloa, H. Hernández-Macías y S. Knapp (Eds.) Flora Mesoamericana (pp. 1–590). St. Louis Missouri: Sheridan Books.
Campos, V. A., Kelly, L. M. y Delgado, S. A. (2004). Bejucos y otras trepadoras de la Estación de Biología Tropical Los Tuxtlas, Veracruz, México. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Carmona-Hernández, O., Laccetti, L., Martínez-Hernández, M. D. J., Luna-Rodríguez, M., Fernández, M. D. S., Guerrero-Analco, J. A. et al. (2023). Plant conservation in the Mesoamerican biodiversity hotspot: a case study on the Piper genus in Veracruz (Mexico). Tropical Ecology, 64, 324–336. https://doi.org/10.1007/s42965-022-00271-9
Clavijo, L., Ramírez-Roa A. y Clark, J. L. (2021). Drymonia mexicana (Gesneriaceae), a new endemic species from Veracruz (Mexico). Journal of the Botanical Research Institute of Texas, 15, 60–63. https://doi.org/10.17348/jbrit.v15.i1.1050
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2006). Programa de conservación y manejo Reserva de la Biosfera Los Tuxtlas. México D.F.: Comisión Nacional de Áreas Naturales Protegidas.
Cornejo-Tenorio, G., Ibarra-Manríquez, G. y Sinaca-Colín, S. (2019). Flora de Los Tuxtlas. Guía Ilustrada. México D.F.: Universidad Nacional Autónoma de México.
Daly, M., Herendeen, P. S., Guralnick, R. P., Westneat, M. W. y McDade, L. (2012). Systematics agenda 2020: the mission evolves. Systematic Biology, 61, 549–552. https://doi.org/10.1093/sysbio/sys044
Daniel, T. F. (2002). New and reconsidered Mexican Acantha-
ceae IX. Justicia. Proceedings of the California Academy of Sciences, 53, 37–49.
Daniel, T. F. (2004). Further range extensions of Mexican Acanthaceae. Polibotánica, 18, 1–12.
Daniel, T. F. (2005). Catalog of Honduran Acanthaceae with taxonomic and phytogeographic notes. Contributions from the University of Michigan Herbarium, 24, 51–108.
Dávila, P., Mejía-Saulés, M. T., Soriano-Martínez, A. M. y Herrera-Arrieta, Y. (2018). Conocimiento taxonómico de la familia Poaceae en México. Botanical Sciences, 96, 462–514. https://doi.org/10.17129/botsci.1894
Edwards, K. S. y Prance, G. Y. (2003). Four new species of Roupala (Proteaceae). Brittonia, 55, 61–68. https://www.jstor.org/stable/3218415?seq=1
Ek-Rodríguez, I. L., Coates, R., Sinaca-Colín, S. e Ibarra-Manríquez, G. (2022). Liana community attributes in one of the northernmost neotropical rainforests. Botanical Sciences, 100, 353–369. https://doi.org/10.17129/botsci.2955
Ek-Rodríguez, I. L., Meave, J. A., Navarrete-Segueda, A., González-Arqueros, M. L. e Ibarra- Manríquez, G. (2024). Environmental heterogeneity influences liana community differentiation across a neotropical rainforest landscape. Ecology et Evolution, 14, e11170. https://doi.org/10.1002/ece3.11170
Ek-Rodríguez, I. L., Navarrete-Segueda, A., Siebe, C., Meave, J. A., Vela-Correa, G. e Ibarra- Manríquez, G. (2025). Relief, soil and tree community attributes jointly shape liana community structure and diversity in a Neotropical rainforest landscape. Catena, 255, 109017. https://doi.org/10.1016/j.catena.2025.109017
Espejo-Serna, A. y López-Ferrari, A. R. (2018). La familia Bromeliaceae en México. Botanical Sciences, 96, 533–554. https://doi.org/10.17129/botsci.1918
Espejo-Serna, A., López-Ferrari, A. R. y Ramírez-Morillo, I. (2005). Bromeliaceae. Flora de Veracruz. Xalapa: Instituto de Ecología, A.C. Flora de Veracruz. https://doi.org/10.21829/fv.343.2005.136
Fragoso-Martínez, I. y Castillo-Campos, G. (2023). Passifloraceae. Flora de Veracruz. Xalapa: Instituto de Ecología, A.C. Flora de Veracruz. https://doi.org/10.21829/fv.585.20
23.200
Ferrufino-Acosta, L. (2010). Taxonomic revision of the genus Smilax (Smilacaceae) in Central America and the Caribbean Islands. Willdenowia, 40, 227–280. https://doi.org/10.3372/wi.40.40208
Fuster, F., Kaiser-Bunbury, C., Olesen, J. M. y Traveset, A. (2018). Global patterns of the double mutualism pheno-
menon. Ecography, 42, 826–835. https://doi.org/10.1111/ecog.04008
Fryxell, P. A. (1992). Malvaceae. Flora de Veracruz. Xalapa: Instituto de Ecología, A.C. Flora de Veracruz. https://doi.org/10.21829/fv.420.1992.68
García-Mendoza, A. e Ibarra-Manríquez, G. (1991). A new species of Costus (Costoideae, Zingiberaceae) from Veracruz, Mexico. Annals of the Missouri Botanical Garden, 78, 1081–1084. https://doi.org/10.2307/2399745
González-Elizondo, M. S., Reznicek, A. A. y Tena-Flores, J. A. (2018). Cyperaceae in Mexico: diversity and distribution. Botanical Sciences, 96, 305–331. https://doi.org/10.17129/botsci.1870
Gutiérrez-García, G. y Martin, R. (2011). Climate and climate change in the region of Los Tuxtlas (Veracruz, Mexico): a statistical analysis. Atmósfera, 24, 347–373.
Henderson, A. (2011). A revision of Geonoma (Arecaceae). Phytotaxa, 17, 1–271. https://doi.org/10.11646/phytotaxa.
17.1.1
Hernández-Esquivel, K., Piedra-Malagón, E. M., Cornejo-Tenorio, G., Mendoza-Cuenca, L., González-Rodríguez, A., Ruiz-Sánchez, E. et al. (2020). Unraveling the extreme morphological variation in the neotropical Ficus aurea complex (subg. Spherosuke, sect. Americanae, Moraceae). Journal of Systematics and Evolution, 58, 263–281. https://doi.org/10.1111/jse.12564
Ibarra-Manríquez, G. (1988). The palms of a tropical rain forest in Veracruz, Mexico. Principes, 32, 147–155.
Ibarra-Manríquez, G. (2017). Avances en la investigación botánica en la Estación de Biología Tropical Los Tuxtlas ¿Qué hacer ahora? En V. H. Reynoso, R. I. Coates y C. M. L. Vázquez (Eds.), Avances y perspectivas en la investigación de los bosques tropicales y sus alrededores: la región de Los Tuxtlas (pp. 101–116). Ciudad de México: Instituto de Biología, Universidad Nacional Autónoma de México.
Ibarra-Manríquez, G., Cornejo-Tenorio, G., González-Castañeda, N., Piedra-Malagón, E. M. y Luna, A. (2012). El género Ficus L. (Moraceae) en México. Botanical
Sciences, 90, 389–452. https://doi.org/10.17129/botsci.472
Ibarra-Manríquez, G., Cornejo-Tenorio, G., Hernández-Esquivel, K. B., Rojas-López, M., Sánchez-Sánchez, L. (2021). Vegetación y flora vascular del ejido Llano de Ojo de Agua, Depresión del Balsas, municipio de Churumuco, Michoacán, México. Revista Mexicana de Biodiversidad, 92, e923482. https://doi.org/10.22201/ib.20078706e.2021.92.3482
Ibarra-Manríquez, G., Martínez-Morales, M. y Cornejo-Tenorio, G. (2015). Frutos y semillas del bosque tropical perennifolio. región de Los Tuxtlas. Veracruz. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Ibarra-Manríquez, G., Martínez-Ramos, M., Dirzo, M. y Núñez-Farfán, J. (1997). La Vegetación. En S. E. Gónzález, R. Dirzo y R. C. Vogt (Eds.), Historia natural de Los Tuxtlas (pp. 61–85). Ciudad de México: Universidad Nacional Autónoma de México.
Ibarra-Manríquez, G., Ricker, M., Ángeles, G., Sinaca-Colín, S. y Sinaca-Colín, M. A. (1997). Useful plants of the Los Tuxtlas rain forest (Veracruz, Mexico): considerations of their market potential. Economic Botany, 51, 362–376. https://doi.org/10.1007/BF02861046
Ibarra-Manríquez, G. y Sinaca-Colín, S. (1987). Lista florística de la Estación de Biología Tropical Los Tuxtlas. Listados Florísticos de México VII. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Ibarra-Manríquez, G. y Sinaca-Colín, S. (1995). Lista florís-
tica comentada de la Estación de Biología Tropical “Los Tuxtlas”, Veracruz, México. Revista de Biología Tropical, 43, 75–115.
Ibarra-Manríquez, G. y Sinaca-Colín, S. (1996a). Lista florística comentada de la Estación de Biología Tropical Los Tuxtlas, Veracruz. México: Mimosaceae a Verbenaceae. Revista de Biología Tropical, 44, 41–60.
Ibarra-Manríquez, G. y Sinaca-Colín, S. (1996b). Lista comentada de plantas de la Estación de Biología Tropical Los Tuxtlas, Veracruz, México (Violaceae-Zingiberaceae). Revista de Biología Tropical, 44, 427–447.
Islas-Hernández, C. S. y Alvarado-Cárdenas, L. O. (2023). Sinopsis del género Spigelia (Loganiaceae) en Norteamérica, Centroamérica y el Caribe. Acta Botanica Mexicana, 130, e2202. https://doi.org/10.21829/abm130.2023.2202
Krömer, T., Acebey, A. R., Armenta-Montero, S. y Croat, T. B. (2019). Diversity, distribution, and conservation status of Araceae in the state of Veracruz, Mexico. Annals of the Missouri Botanical Garden, 104, 10–32. https://doi.org/10.3417/2018214
Krömer, T., Espejo-Serna, A., López-Ferrari A. R., Acebey, A. R., García-Cruz, J. y Mathieu, G. (2020). Las angiospermas epífitas del estado de Veracruz, México: diversidad y distribución. Revista Mexicana de Biodiversidad, 91, e913
415. https://doi.org/10.22201/ib.20078706e.2020.91.3415
Linares-Palomino, R., Cardona, V., Hennig, E. I., Hensen, I., Hoffmann, D., Lendzion, J. et al. (2009). Non-woody life-form contribution to vascular plant species richness in a tropical American forest. Plant Ecology, 201, 87–99. https://doi.org/10.1007/s11258-008-9505-z
Liu, Y., Borregaard, M. K., Xu, X., Dimitrov, D., Pellissier, L., Shrestha, N. et al. (2023). An updated floristic map of the world. Nature Communications, 14, 2990. https://doi.org/10.1038/s41467-023-38375-y
Lombardi, J. A. (2014). Celastraceae (Hippocrateoideae e Salacioideae). Flora Neotropica, 114, 1–227.
Lorea-Hernández, F. G. (2002). La familia Lauraceae en el sur de México: diversidad, distribución y estado de conservación. Botanical Sciences, 71, 59–70. https://doi.org/10.17129/botsci.1663
Lorence, D. H. y Nee, M. (1987). Randia retroflexa (Rubiaceae), a new species from southern Mexico. Brittonia, 39, 371–375. https://doi.org/10.2307/2807136
Lutz, J. A., Furniss, T. J., Johnson, D. J., Davies, S. J., Allen, D., Alonso, A. et al. (2018). Global importance of large-diameter trees. Global Ecology and Biogeography, 27, 849–864. https://doi.org/10.1111/geb.12747
Martin-Del Pozzo, A. L. (1997). Geología. En E. Gónzález, R. Dirzo y R. C. Vogt (Eds.). Historia natural de Los Tuxtlas (pp. 25–31). Ciudad de México: Universidad Nacional Autónoma de México.
Martínez-Gordillo, M., Bedolla-García, B., Cornejo-Tenorio, G., Fragoso-Martínez, I., García-Peña, M. R., González-Gallegos, J. G. et al. (2017). Lamiaceae de México. Botanical Sciences, 95, 780–806. https://doi.org/10.17129/botsci.1871
Meave, J. A., Rincón-Gutiérrez, A., Ibarra-Manríquez, G., Gallardo-Hernández, C., Romero-Romero, M. A. (2017). Checklist of the vascular flora of a portion of the hyper-humid region of La Chinantla, Northern Oaxaca Range, Mexico. Botanical Sciences, 95, 722–759. https://doi.org/10.17129/botsci.1812
Miranda, F. y Hernández, E. (1963). Los tipos de vegetación de México y su descripción. Botanical Sciences, 28, 29–179. https://doi.org/10.17129/botsci.1084
Miranda-Gallegos, K. V., Navarrete-Segueda, A., Cortés-Flores, J., González-Arqueros, M. L., Acosta-Pérez, E. E. e Ibarra-Manríquez, G. (2023). Landscape heterogeneity drives spatial distribution of palm community in a Neotropical rainforest reserve affected by defaunation. Botanical Sciences, 101, 654–669. https://doi.org/10.17129/botsci.3204
Monro, A. K. (2009). Two new species and a nomenclatural synopsis of Myriocarpa (Urticaceae) from Mesoamerica. Novon, 19, 85–95. https://doi.org/10.3417/2006211
Morales, J. F. (1997). A synopsis of the genus Prestonia (Apocynaceae) section Tomentosae in Mesoamérica. Novon, 7, 59–66. https://doi.org/10.2307/3392074
Moreno, N. P. (1984). Glosario botánico ilustrado. México D.F.: Compañía Editorial Continental, S.A. de C.V.
Navarrete-Segueda, A., Cortés-Flores, J., Cornejo-Tenorio, G., González-Arqueros, L., Torres-García, M. e Ibarra-Manríquez, G. (2021). Timber and non-timber forest products in the northernmost Neotropical rainforest: ecological factors unravel their landscape distribution. Journal of Environmental Management, 279, 111819. https://doi.org/10.1016/j.jenvman.2020.111819
Ollerton, J. (2017). Pollinator diversity: distribution, ecological function, and conservation. Annual Review of Ecology, Evolution and Systematics, 48, 353–376. https://doi.org/10.1146/annurev-ecolsys-110316-022919
Ortiz-Rodríguez, A. E. (2022). Naming the long-known: a new species of Desmopsis (Annonaceae) endemic to Mexico. Acta Botanica Mexicana, 129, e2110. https://doi.org/10.21829/abm129.2022.2110
Ortiz-Rodríguez, A. E., Nge, F. J., Rodrígues‑Vaz, C., Soulé, V., Schatz, G. E., Martínez‑Velarde, M. F. et al. (2024). Taxonomy, systematics and conservation of the highly threatened and endemic Mexican genus Tridimeris (Annonaceae). Plant Systematics and Evolution, 310, 47. https://doi.org/10.1007/s00606-024-01929-8
Palacios-Wassenaar O. M. y Castillo-Campos, G. (2019). Erythroxylaceae. Flora de Veracruz. Xalapa. Instituto de Ecología, A.C. https://doi.org/10.21829/fv.43.2019.182
Palacios-Wassenaar O. M. y Castillo-Campos, G. (2020). Elaeocarpaceae. Flora de Veracruz. Xalapa. Instituto de Ecología, A.C. https://doi.org/10.21829/fv.489.2020.185
Pennington, T. D. (1997). The genus Inga: botany. Belgium: The Royal Botanic Gardens, Kew. Continental Printing.
Popma, J., Bongers, F. y Meave-del Castillo, J. (1988). Patterns in the vertical structure of the tropical lowland rain forest of Los Tuxtlas, Mexico. Vegetatio, 74, 81–91. https://doi.org/10.1007/BF00045615
POWO (2025). Plants of the World Online. Facilitated by the Royal Botanic Gardens, Kew. Recuperado 13 abril, 2025, de: https://powo.science.kew.org/
PPG (The Pteridophyte Phylogeny Group) 1. (2016). A community-derived classification for extant lycophytes and ferns. Journal of Systematics and Evolution, 54,
563–603. https://doi.org/10.1111/jse.12229
Ramamoorthy, T. P. y Uribe, Y. H. (1988). A new name and a new species in Mexican Ruellia (Acanthaceae). Plant Systematic and Evolution, 159, 161–163. https://doi.org/10.1007/BF00935968
Ramírez-Roa, A. e Ibarra-Manríquez, G. (1998). A new species of Solenophora (Gesneriaceae) from southeast Veracruz, Mexico. Novon, 7, 281–284. https://doi.org/10.2307/3391945
Ramírez-Roa, A., Paniagua-Ibáñez, M. y Mora-Jarvio, M. A. (2023). Gesneriaceae. Flora de Veracruz. Xalapa: Instituto de Ecología, A.C. https://doi.org/10.21829/fv.579.2023.199
Raven, P. H., Gereau, R. E., Phillipson, P. B., Chatelain, C., Jenkins, C. N. y Ulloa, U. C. (2020). The distribution of biodiversity richness in the tropics. Science Advances, 6, eabc6228. https://doi.org/10.1126/sciadv.abc6228
Reynoso, V. H., Coates, R. I. y Vázquez, C. M. L. (Eds.). (2017). Avances y perspectivas en la investigación de los bosques tropicales y sus alrededores: la región de Los Tuxtlas. Ciudad de México: Instituto de Biología, Universidad Nacional Autónoma de México.
Riba, R. (1989). A new species of Thelypteris subg. Goniopteris from the state of Veracruz, Mexico. American Fern Journal, 79, 122–124. https://doi.org/10.2307/1547294
Rojas-Martínez, C. y Flores-Olvera, H. (2019). Florística de la sierra El Pelado, Acatlán, Puebla, México. Revista Mexicana de Biodiversidad, 90, e902694. https://doi.org/10.22201/ib.20078706e.2019.90.2694
Rowher, J. G. (1993). Lauraceae: Nectandra. Flora Neotropica, 60, 1https://doi.org/10.17129/botsci.3673332.
Ruiz, G. M. G., Gómez D. J. A. y Krömer, T. (2025). Las plantas vasculares endémicas de Veracruz: análisis de 30 años de conocimiento. Botanical Sciences, 103, 876–898. https://doi.org/10.17129/botsci.3673
Rzedowski, J. (1978). Vegetación de México. México D.F.: Limusa.
Rzedowski, J. (1991a). El endemismo en la flora fanerogámica mexicana: una apreciación analítica preliminar. Acta Botanica Mexicana,15, 47–64. https://doi.org/10.21829/abm15.1991.620
Rzedowski, J. (1991b). Diversidad y orígenes de la flora fanerogámica de México. Acta Botanica Mexicana, 14, 3–21. https://doi.org/10.21829/abm14.1991.611
Salazar, G. A. (1988). Mormodes tuxtlensis, nueva especie de Veracruz, México. Orquídea (Méx.), 11, 51–62.
Salino, A., Almeida, T. E. y Smith, A. R. (2015). New combinations in Neotropical Thelypteridaceae. Phytokeys, 57, 11–50. https://doi.org/10.3897/phytokeys.57.5641
Sánchez-Garfias, B., Ibarra-Manríquez, G. y González-García, L. (1991). Manual de identificación de frutos y semillas anemócoros de árboles y lianas de la Estación “Los Tuxtlas”, Veracruz, México. Cuadernos 12. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Sarukhán, J., Urquiza-Haas, T., Koleff, P., Carabias, J., Dirzo, R., Ezcurra, E. et al. (2015). Strategic actions to value, conserve, and restore the natural capital of megadiversity countries: the case of Mexico. BioScience, 65, 164–173. https://doi.org/10.1093/biosci/biu195
Smith, A. R. y Tejero-Díez, J. D. (2014). Pleopeltis (Polypodiaceae), a redefinition of the genus and nomenclatural novelties. Botanical Sciences, 92, 43–58. https://doi.org/10.17129/botsci.29
Soto, M. y Gama, L. (1997). Climas. En E. González, R. Dirzo y R. C. Vogt (Eds.), Historia natural de Los Tuxtlas (pp. 7–23). México D.F.: Universidad Nacional Autónoma de México.
Sousa, S. M. (2009). Adiciones al género Inga (Ingeae, Mimosoideae, Leguminosae) para la Flora Mesoamericana. Acta Botanica Mexicana, 89,25–41. https://doi.org/10.21829/abm89.2009.303
Sousa, S. M. (2010). Revisión del complejo de Lonchocarpus cruentus (Leguminosae: Papilionoideae: Millettieae), con descripciónes de cinco especies nuevas. Brittonia, 62, 321–336. https://doi.org/10.1007/s12228-009-9116-6
Sousa, S. M. y Rudd, V. E. (1993). Revision del género Styphnolobium (Leguminosae: Papilionoideae: Sophoreae). Annals of the Missouri Botanical Garden, 80, 270–283. https://doi.org/10.2307/2399827
Spicer, M. E., Mellor, H. y Carson, A. P. (2020). Seeing beyond the trees: a comparison of tropical and temperate plant growth forms and their vertical distribution. Ecology, 101, e02974. https://doi.org/10.1002/ecy.2974
Swenson, U., Lepschi, B., Lowry, P. P. II, Terra-Araujo, M. H., Santos, K., Nylinder, S. et al. (2023). Reassessment of generic boundaries in Neotropical Chrysophylloideae (Sapotaceae): eleven reinstated genera and narrowed circumscriptions of Chrysophyllum and Pouteria. Taxon, 72, 307–359. https://doi.org/10.1002/tax.12894
Torres-Montúfar, A. y Ochoterena, H. (2013). Dos especies nuevas de la familia Rubiaceae de la sierra de los Tuxtlas, Veracruz, México. Revista Mexicana de Biodiversidad, 84, 1082–1089. https://doi.org/10.7550/rmb.32503
Torres-Montúfar, A. y Torres-Díaz, A. N. (2022). Las Rubiáceas de México: ¿Ya está hecho el trabajo? Botanical Sciences, 100, 446–468. https://doi.org/10.17129/botsci.2847
Tropicos. (2025). Tropicos.org. Missouri Botanical Garden. Recuperado 03 mayo, 2025, de: https://tropicos.org
Ulloa, U. C., Acevedo-Rodríguez, P., Beck, S., Belgrano, M. J., Bernal, R., Berry, P. E. et al. (2017). An integrated assessment of the vascular plant species of the Americas. Science, 358, 1614–1617. https://doi.org/10.1126/science.aao0398
Vázquez, T. M., Armenta, M. S., Campos, J. J. y Carvajal, H. C. I. (2010). Árboles de la región de Los Tuxtlas. Veracruz: Comisión Organizadora del Estado de Veracruz de Ignacio de la Llave para la Conmemoración del Bicentenario de la Independencia Nacional y del Centenario de la Revolución Mexicana/ Secretaría de Educación-Gobierno de Veracruz.
Vera-Caletti, P. y Wendt, T. (2001). Una nueva especie de Calatola (Icacinaceae) de México y Centroamérica. Acta Botanica Mexicana, 54, 39–49. https://doi.org/10.21829/abm54.2001.867
Vergara-Rodríguez, D., Mathieu, G., Samain, M. S., Armenta-Montero, S. y Krömer, T. (2017). Diversity, distribution, and conservation status of Peperomia (Piperaceae) in the state of Veracruz, Mexico. Tropical Conservation Science, 10, 1–28. https://doi.org/10.1177/1940082917702383
Villareal, Q. J. A. (2003). Sambucaceae. Flora de Veracruz. Xalapa: Instituto de Ecología, A.C./ Universidad de California, Riverside. https://doi.org/10.21829/fv.350.2003.
129
Villaseñor, J. L. (2016). Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017
Villaseñor, J. L. y Meave, J. A. (2022). Floristics in Mexico today: insights into a better understanding of biodiversity in a megadiverse country. Botanical Sciences, 100, S14–
S33. https://doi.org/10.17129/botsci.3050
Villaseñor, J. L., Meave, J. A., Ortiz, E. e Ibarra-Manríquez, G. (2003). Biogeografía y conservación de los bosques tropicales húmedos de México. En J. J. Morrone y J. Llorente (Eds.), Una perspectiva latinoamericana de la biogeografía (pp. 209–216). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Universidad Nacional Autónoma de México.
Villaseñor, J. L. y Ortiz, E. (2014). Biodiversidad de las plantas con flores (División Magnoliophyta) en México. Revista Mexicana de Biodiversidad, 85 (Suplem.), S134–S142. https://doi.org/10.7550/rmb.31987
Villaseñor, J. L. y Ortiz, E. (2025). Floristic richness comparison among the Mexican states. Revista Mexicana de Biodiversidad, 96, e965505. https://doi.org/10.22201/ib.20078706e.2025.96.5505
Villaseñor, J. L., Ortiz, E. y Campos-Villanueva, A. (2018). High richness of vascular plants in the tropical Los Tuxtlas Region, Mexico. Tropical Conservation Science, 11, 1–12. https://doi.org/10.1177/1940082918764259
von Thaden, J. J., Laborde, J., Guevara, S. y Mokondoko-Delgadillo, P. (2020). Dinámica de los cambios en el uso del suelo y cobertura vegetal en la Reserva de la Biosfera Los Tuxtlas (2006-2016). Revista Mexicana de Biodiversidad, 91, e913190. https://doi.org/10.22201/ib.20078706e.2020.91.3190
Wendt, T. (1993). Composition floristic affinities and origins of the canopy tree flora of the Mexican Atlantic slope rain forest. En T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Biological diversity of Mexico: origins and distribution (pp. 595–680). Nueva York: Oxford University Press.
Zamora, N. A. (2006). Two new species of Ormosia (Leguminosae – Papilionoideae, Sophoreae) from Mesoamérica. Edinburgh Journal of Botany, 63, 183–190. https://doi.org/10.1017/S0960428606000552
Zhou, X. M. y Zhang, L. B. (2023). Phylogeny, character evolution, and classification of Selaginellaceae (lyco-phytes). Plant Diversity, 45, 630e684. https://doi.org/
10.1016/j.pld.2023.07.003
















![Figure 3. Lateral habitus of a) Andricus protector sp. nova., b) A. formosalis [Picture obtained from Type Search of Smithsonian Entomological Collections, http://n2t.net/ark:/65665/m36fc57b94-797e-4d41-b88c-58776f4ed1d3]](https://rev-mex-biodivers.mx/wp-content/uploads/5448-Fig_3-12cm-921x1024.jpg)