
Taxonomía y Sistemática
Ecología

Evolución
How relevant is the relationship between ostiole size and wasp head shape in the Ficus-Agaonidae mutualistic interaction?
Nadia Castro-Cárdenas, Armando Navarrete-Segueda, Guillermo Ibarra-Manríquez *
Universidad Nacional Autónoma de México, Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Antigua carretera a Pátzcuaro No. 8701, Colonia Ex Hacienda de San José de La Huerta, 58190, Morelia, Michoacán, Mexico
*Corresponding author: gibarra@iies.unam.mx (G. Ibarra-Manríquez)
Received: 07 February 2024; accepted: 27 May 2024
Abstract
The mutualism between Ficus species (Moraceae) and their pollinating wasps (Agaonidae) is a widely recognized coevolutionary model. In Ficus species from the Paleotropic, it has been determined that the ostiole acts as a morphological filter that affects the head dimensions of pollinating female wasps. Here, for the first time, the allometric relationship between ostiole size (diameter and length) and the shape of the head (length/width) of pollinating wasps is quantitatively explored in 6 Neotropical Ficus species (3 sect. Americanae and 3 sect. Pharmacosycea). In the case of sect. Americanae, wasp head shape was significantly correlated only with ostiole length, while in sect. Pharmacosycea both ostiole variables were correlated with head shape. The ordination analysis (NMDS) clearly reflected associations of these traits in species for both sections. The results support what has been interpreted in previous studies as reciprocal evolution between the analyzed traits, which contribute, along with other morphological and ecological traits, to the specificity between Ficus species and their pollinating wasps.
Keywords: Mutualism; Ostiole; Pegoscapus; Tetrapus
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
¿Qué tan relevante es la relación entre el tamaño del ostíolo y la forma de la cabeza de las avispas en la interacción mutualista Ficus-Agaonidae?
Resumen
El mutualismo entre Ficus (Moraceae) y sus avispas polinizadoras (Agaonidae) es un modelo coevolutivo ampliamente reconocido. En especies de Ficus del Paleotrópico, se ha determinado que el ostíolo actúa como un filtro morfológico que afecta las dimensiones de la cabeza de las hembras polinizadoras. Por primera vez se explora, cuantitativamente, la relación alométrica entre el tamaño del ostíolo (diámetro y largo) y la forma de la cabeza (largo/ancho) de las avispas polinizadoras en 6 especies de Ficus neotropicales (3 sect. Americanae y 3 sect. Pharmacosycea). En el caso de sect. Americanae, la forma de la cabeza de las avispas se correlacionó significativa y únicamente con el largo del ostíolo, mientras que en la sect. Pharmacosycea, ambas variables del ostíolo se correlacionaron con la forma de la cabeza. El análisis de ordenación (NMDS) reflejó claramente asociaciones de estos atributos por especie para ambas secciones. Los resultados apoyan lo expuesto en estudios previos de una evolución recíproca entre los atributos analizados, lo que contribuye, en conjunto con otros atributos morfológicos y ecológicos, a la especificidad entre Ficus y sus avispas polinizadoras.
Palabras clave: Mutualismo; Ostíolo; Pegoscapus; Tetrapus
Introduction
The interaction between species of the genus Ficus L. (Moraceae) and wasps of the family Agaonidae Walker (Hymenoptera) is a classic example of a mutualistic interaction, in which the phenomena of co-diversification, co-speciation, and co-evolution are well documented (Borges, 2021; Bronstein, 1988; Jousselin et al., 2003; Rønsted et al., 2005; Wang et al., 2019; Wiebes, 1979) and is estimated to date to ca. 74.9 Ma (60.0-101.9 Ma; Cruaud et al., 2012; Zhang et al., 2019). For many years it was assumed that 1 Ficus species was pollinated exclusively by 1 wasp species (e.g., Ramírez, 1970; Wiebes, 1966, 1979), but a growing amount of evidence contradicts this assumption (Cook & Rasplus, 2003; Cook & Segar, 2010; Herre et al., 2008; Machado et al., 2005; Molbo et al., 2003; Oldenbeuving et al., 2023; Peng et al., 2008; Su et al., 2008; Weiblen, 2002).
Regardless of the degree of specificity, this ancestral and close mutualistic relationship involves complex morphological modifications (Clement et al., 2020; Galil & Eisikowich, 1968). The flowers of Ficus species are found inside an urn-shaped inflorescence (syconium). The development of the syconium traditionally has been divided into 5 phases (Galil & Eisikowich, 1968; Ibarra-Manríquez et al., 2012; Verkerke, 1989): A) floral or female, B) receptive or female, C) interfloral, D) male), and E) post floral. Pollinators can only access the flowers during phase B, through the ostiole, which is an apical opening in the syconium made up of numerous overlapping bracts (Castro-Cárdenas et al., 2022; Machado et al., 2013; van Noort & Compton, 1996; Verkerke, 1989). The ostiole plays a fundamental role in the specificity of pollinating wasps among the different sections of the genus Ficus, since it acts as a physical barrier, blocking the entry of non-pollinating wasps and/or regulating the size of the pollinating wasps that are able to reach the syconial cavity (Chen et al., 2001; Janzen, 1979; Jousselin et al., 2003; Liu et al., 2011; Ramírez, 1974; Verkerke, 1989).
One of the morphological modifications recorded for Agaonidae wasps was suggested by Ramírez (1974), who proposed that the shape of the head of female wasps presents various modifications that facilitate their passage through the ostiole, indicating that heads that are subquadrangular or subhemispherically flattened (usually as long as broad across the eyes) have been recorded in Ficus species in different groups (e.g., subgen. Ficus or the sections Americanae or Conosycea), whose syconia present spirally arranged ostiolar bracts. On the other hand, wasps with thin elongated heads have been recorded in Ficus species possessing syconia with linearly arranged ostiole bracts, which mostly point downwards (e.g., sections Galoglychia or Pharmacosycea).
van Noort & Compton (1996) evaluated the convergence in head shape between wasps from 2 subfamilies (Agaonidae and Sycoecinae), pollinators and non-pollinators, respectively, of the same Ficus species (subg. Urostigma sect. Galoglychia). These authors suggested that selection would have favored convergence in the shape of the head of both lineages of wasps, due to the pressure derived from achieving a successful entry of pollinating females into the syconium cavity. Furthermore, they emphasized that the length of the ostiole is the main factor in determining this trait in wasps, since the arrangement of the ostiole bracts in sect. Galoglychia is constant between species (Verkerke, 1989). However, the authors suggested that confirmation of their results required obtaining measurements of the ostiole during phase B of syconium development since the measurements used in the analysis were obtained from taxonomic literature. This is an important proposal, considering that there are records of Ficus species in which the size of the syconium differ among the different stages of development (Delgado-Pérez et al., 2020; Piedra-Malagón et al., 2019). Finally, Jousselin et al. (2003) reconstructed the evolution of the shape of the ostiole (spiral or linear) and the shape of the head of pollinating wasps (short or elongate) using molecular markers only (ITS and ETS) and concluded that both traits are correlated throughout the genus Ficus.
The genus Ficus is represented in the Neotropics by the subgenera Pharmacosycea (Miq.) Miq. and Spherosuke Raf. (Berg, 1989; Pederneiras et al., 2015), whose sections are endemic to the American continent (Pharmacosycea (Miq.) Griseb. and Americanae (Miq.) Corner, respecti-
vely). The diversity of section Pharmacosycea is estimated to be 20 species, which are exclusively pollinated by wasps of the genus Tetrapus Mayr 1885, whose heads are longer than wide. The sect. Americanae includes a larger number of species (ca. 120) whose pollinators belong to the genus Pegoscapus Cameron 1906, which possess subquadrangular or subhemispherical heads (Berg, 1989; Jousselin et al., 2003; Ramírez, 1974).
The main objective of the present study was to determine the relationship between the size of the ostiole in species belonging to the sections of Ficus and the shape of the heads of pollinating wasps, a relationship that has not been previously analyzed quantitatively. The inclusion of Ficus species belonging to the 2 Neotropical sections is relevant, since it will allow a further evaluation between fig and fig wasp traits from a phylogenetic context (Jousselin et al., 2003).
Materials and methods
Fieldwork was carried out in the NW portion of the Los Tuxtlas region in the state of Veracruz, Mexico (Fig. 1). This region forms part of the Upper Tertiary and Middle Quaternary volcanic complex and is composed of basaltic andesite and basalt rock (Verma et al., 1993) and is bordered by Holocene lava flows (Nelson & Gonzalez-Caver, 1992). The study area reaches elevations between 100 and 600 m. The predominant climate is warm and humid, with rain all year round (A), an average annual temperature between 24.1 and 25 °C, and an average annual precipitation of 1,939 to 3,928 mm (Fig. 2; SMN, 2010). Rainfall is more frequent and abundant during the summer, whereas a drier season occurs between March to May, the latter being the driest month (SMN, 2010; Soto, 2004). The species richness of vascular plants documented for the Los Tuxtlas region is 2,548 species (2,391 native; 307 are endemic to Mexico), distributed in 208 families and 1,018 genera (Villaseñor et al., 2018). The families with the highest number of species are Fabaceae (212), Orchidaceae (171), Asteraceae (150), Rubiaceae (143), and Poaceae (82). Villaseñor et al. (2018) point out that the predominant biome in the region is the humid tropical forest. The location of the individuals of Ficus sampled in the present study are indicated in Figure 1.
The collection and measurement of syconia and pollinating wasps. Three species were chosen from each section of Ficus, which represented the size range of the syconia described for both sections in Mexico (Ibarra-Manríquez et al., 2012): F. apollinaris Dugand, F. insipida Willd., and F. yoponensis Desv. from sect. Phamacosycea, and F. colubrinae Standl., F. isophlebia Standl., and F. obtusifolia Kunth from sect. Americanae. Detailed descriptions and illustrations of the species can be consulted in Ibarra-Manríquez et al. (2012), Cornejo-Tenorio et al. (2019), and Hernández-Esquivel et al. (2020).
The material collected included 5 individuals per Ficus species with syconia in the development phases B and D (Galil & Eisikowitch, 1968; Ibarra-Manríquez et al., 2012). The collected syconia for phase B allowed us to measure the size of the ostiole at the time when the pollinating wasps enter the syconium, whereas for the syconium in phase D (male phase), we were able to capture the emerging pollinating wasps. In phase B syconia, the ostioles were dissected and fixed and stored in 70% ethanol. Phase D syconia were placed in airtight bags until the pollinating wasps emerged and then each wasp was collected with a small brush, fixed, and stored in 70% ethanol. Wasps were identified to genus level using identification keys (Bouček, 1993; Rasplus & Soldati, 2006) and classified into morphospecies (Fig. 3). We measured the ostioles for a total of 150 syconia and 170 individuals of pollinating wasps.

Figure 1. Study site localization and sampling area. A) Veracruz state (black area) in Mexico; B) location of the Los Tuxtlas Region (black dot) within Veracruz, Mexico; C) syconium and wasps’ collection points are shown in the Los Tuxtlas Region and a zoom of the vegetation cover is shown in areas for each species included in the study (D – I). Points were placed on base maps (OpenStreetMap and World Imagery) of ArcGIS® software.
The size of the ostiole was recorded using 3 measurements: 2 diameters of the area that is covered by the superficial ostiolar bracts (Fig. 4A, B), and the length, which indicates the distance between the internal and superficial ostiolar bracts (Fig. 4C, D). The head of pollinating wasp individuals were dissected and measured under a Zeiss stereoscopic microscope model Axio Zoom V16. We recorded the length (the distance between the posterior margin of the head and the apex of the jaw) and the width at maximum eye level (Fig. 4E, F). Both measurements allowed us to determine the shape of the wasp’s head (average head length to head width ratio), as described by van Noort & Compton (1996).
Data analysis. We calculated the Pearson correlation coefficients between diameter 1, diameter 2, and length of the ostiole. We also applied generalized linear models and carried out multiple comparisons using the ‘multcomp’ package to assess differences in ostiole diameter and Agaonidae wasps’ length/width ratio among species of each section. We performed a Nonmetric Multidimensional Scaling (NMDS) analysis to examine the multivariate relationship of the ostiole proportions (diameters and length) and head size (length and width) among species of each section of Ficus. We applied the decostand function of ‘Vegan’ to obtain a standardized matrix constructed with values to reduce the extremes values effect (Oksanen et al., 2019). We implemented NMDS with Bray-Curtis’s dissimilarity. Finally, we added convex hulls with the ordihull function of ‘vegan’ to highlight point clusters based on species. Since NMDS uses rank order information, this technique provides a highly flexible quantitative method that allows distribution-free inferences and, because it has a high flexibility in the number of observations, it is particularly useful with unbalanced experimental designs to explore the proximities and resemblances in the structure of the data among groups (Tong, 1992). Therefore, these analyses allowed us to identify the structure and association degree of ostiole-wasp heads among species of each section. All the analyses were conducted using R software.
Results
We found a positive correlation between the 2 diameters of the ostiole, both for sect. Americanae (0.99, p < 0.000) and for sect. Pharmacosycea (0.96, p < 0.001). In the latter section, a high positive correlation was also obtained between the length of the ostiole and both diameters (0.93, p < 0.000), a relationship that was lower for sect. Americanae (diameter 1, 0.37 and diameter 2, 0.39, p < 0.01). Figure 5 shows that the diameter of the ostiole differs significantly between the 3 species included in each section (Americanae, F2, 73 = 2156922, p < 0.000; Pharmacosycea, F2, 74 = 3.81, p < 0.000). The same result was found for the species from both sections when considering the length of the ostiole (Americanae, F2, 71 = 0.74, p < 0.000; Pharmacosycea, F2, 74 = 1.88, p < 0.000).
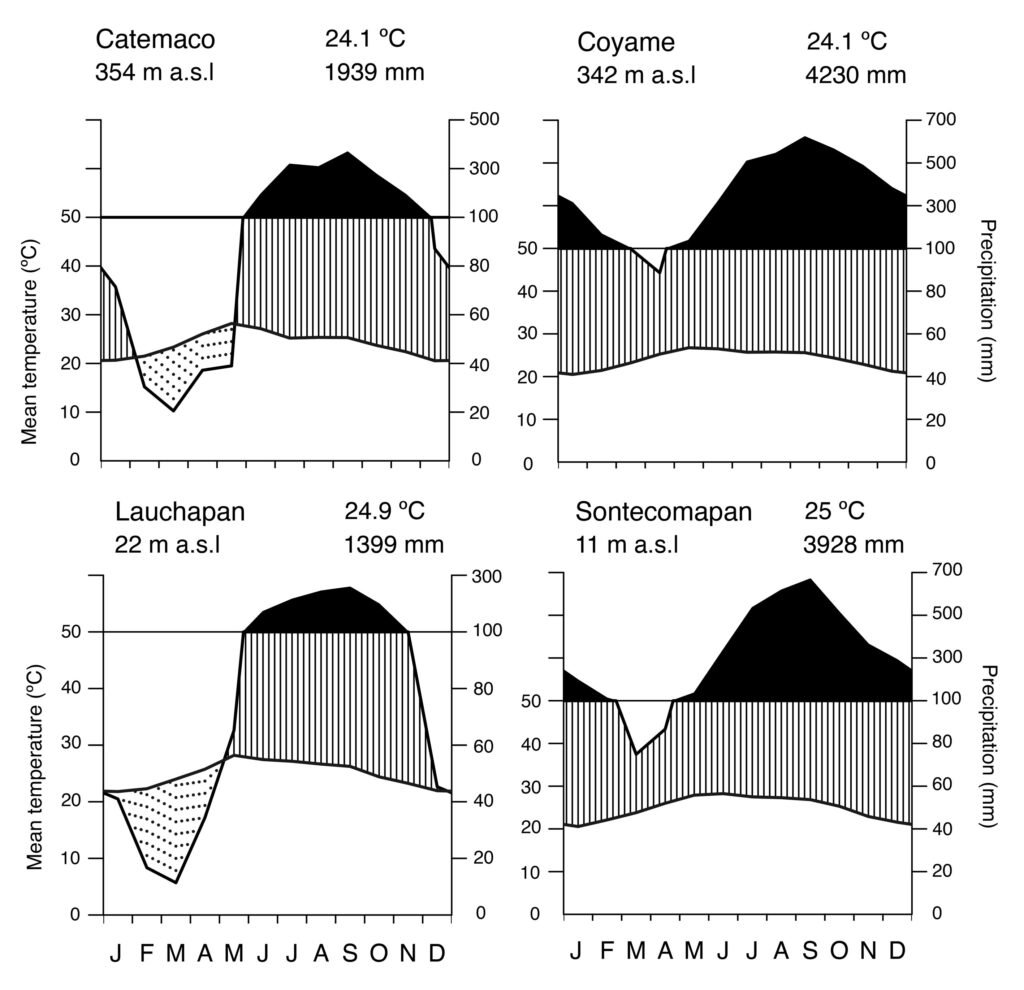
Figure 2. Ombrothermal diagrams of meteorological stations in the Los Tuxtlas Region, Veracruz. The data correspond to 30 years of records from the SMN (2010).

Figure 3. Heads of pollinating wasps. A) Pegoscapus sp. 1 (Ficus colubrinae); B) Pegoscapus sp. 2 (F. isophlebia); C) Pegoscapus sp. 3 (F. obtusifolia); D) Tetrapus sp. 1 (F. apollinaris); E) Tetrapus sp. 2 (F. insipida); F) Tetrapus sp. 3 (F. yoponensis). Scale bar: 200 μm.

Figure 4. Variables considered in the study. A-B) Frontal view of the ostiole; D1, diameter 1 and D2, diameter 2; C-D) longitudinal section of the ostiole; E-F) frontal view of the head of pollinating wasps; L, length of the head (from the protuberances of the clypeal margin to the mandible) and W, width of the head (Interocular distance). A, C) Ficus colubrinae; B) F. yoponensis; D) F. insipida; E) Pegoscapus sp. 1; F) Tetrapus sp. 1. Scale bars: a, c, d = 500 μm, b = 250 μm, e = 50 μm, f = 100 μm.

Figure 5. Diameter of the ostiole in the Americanae and Pharmacosycea sections. Syconia by species (25). Different letters indicate significant differences at a p < 0.001 level.
A positive correlation was recorded between the length and width of the head of the pollinating wasps in both genera; however, the relationship was greater in Pegoscapus than in Tetrapus (rho = 0.85 and 0.75, respectively). The wasps in this latter genus have elongated heads and differ from those recorded in the Pegoscapus species, which are subquadrangular (Fig. 6). For the case of sect. Americanae, the head proportion of F. isophlebia wasps differed significantly from F. colubrinae and F. obtusifolia (F2, 37 = 0.079, p < 0.000), while for sect. Pharmacosycea, differences were also found between the 3 species analyzed (F2, 74 = 0.291, p < 0.000) (Fig. 6).
In the correlation analysis between the size of the ostiole (diameter 1 and length) and the shape of the wasp’s head, sect. Americanae only showed significance for ostiole length (0.6, p < 0.000), while for Pharmacosycea both ostiole variables are correlated, although with low values (diameter, 0.35, p < 0.01; length – 0.25, p < 0.05). The ordination analysis (NMDS) reflects associations by species (Fig. 7). For sect. Americanae (stress = 0.01), the species with smaller ostioles (F. colubrinae and F. isophlebia) are found at 1 end of the ordination, with a greater width in the dispersion of the data for F. isophlebia. Likewise, in sect. Pharmacosycea (stress = 0.02), the species with the smallest ostiole size (F. apollinaris and F. yoponensis) are located at 1 end of the ordination, distant from F. insipida, which shows greater variation in the traits analyzed.

Figure 6. Head length/width of wasps by section. Distict letters indicate significant differences at p < 0.001 level.
Discussion
The present study is the first to quantitatively analyze the relationship between the dimensions of the ostiole and the shape of the head of pollinating wasps for the Neotropical sections of the genus Ficus and it contributes to support the reciprocal evolution in their mutualism. Here, it is important to point out that our results were obtained during phase B of syconia development, which was not the case in the study by van Noort & Compton (1996), who used measurements of syconia size from the literature. In addition to the above, Castro-Cárdenas et al. (2022) hypothesized that the ostiole could play a selective filter role that only allows the entry of a particular pollinating wasp morphospecies into the syconium, as has been suggested in previous studies (Dunn, 2020; Herre, 1989; Jandér et al., 2016; Liu et al., 2011). The differences found for the diameter and length of the ostioles among the species studied in both sections (Fig. 5) support this hypothesis.
As regards to the shape of the heads in the Agaonidae wasps proposed by Ramírez (1974), for the genera recorded in America, that information coincides with our results, since the species belonging to the genus Pegoscapus presented subquadrangular heads, while those of Tetrapus were clearly more elongated than wide (Figs. 3, 6). With respect to the 2 categories in wasp head shape (short heads, with a ratio ≥ 1; elongate, ratio ≤ 1), proposed by Jousselin et al. (2003), the ranges of variation found in the species evaluated (Americanae, 0.9-1.2; Pharmacosycea, 0.9-1.6), do not coincide exactly, although short and elongate are equivalent terms to those proposed by Ramírez (1974).
The close relationship between the metrics of the ostiole and the head of the pollinating wasps in the American sections (Fig. 7) coincides with previous studies of a reciprocal evolution between both mutualistic partners (Cook & Segar, 2010; Galil, 1977; Ramírez, 1974; Weiblen, 2002). Furthermore, interspecific variation in head shape suggests a closer modification, at the species level, in response to ostiole morphology, as has been argued in various previous studies (Cook & Rasplus, 2003; Cook & Segar, 2010; Jousselin et al., 2003; Liu et al., 2011; Ramírez, 1974; Rasplus et al., 2020; van Noort & Compton, 1996). Similar patterns have been reported for other genera of the family Agaonidae, such as Alfonsiella Waterston, Allotriozoon Grandi, Courtella Kieffer, Elisabethiella Grandi, and Pleistodontes Saunders (Dunn et al., 2008; van Noort & Compton, 1996).
The close correlation recorded between the shape of the head of the pollinating wasps and the size of the ostiole coincides with that proposed by Cruaud et al. (2012) and van Noort & Compton (1996), who indicate that these traits are part of a complex mechanism (the lock-and-key shapes of fig ostioles and wasp heads), that determines the specificity between Ficus species and their pollinating wasps. As previously mentioned, this mechanism may explain the role of the ostiole, not only as a physical filter for pollinators but also as a chemical filter, since it is associated with the emission of volatiles for the attraction of legitimate pollinating wasps (Castro-Cárdenas et al., 2022; Okamoto & Su, 2021; Wang et al., 2013). This mechanism is considerably important since it has been shown that closely related species can emit different volatile compounds to attract their pollinating wasps (Okamoto & Su, 2021; Oldenbeuving et al., 2023; Souto-Vilarós et al., 2018).

Figure 7. Grouping based on the characteristics of the diameters and length of the ostiole and the shape of the head of the wasps in the species of the Ficus sections included in the study.
A critical aspect for the advancement in the understanding of the connection between the head shape of pollinating wasps and the dimensions of the ostiole is to carry out studies with a greater geographic scope, since the taxonomy of Ficus species in the Neotropical sections is not completely resolved (Berg, 1989; Ibarra-Manríquez et al., 2012). Global studies are required to resolve the taxonomic complexes that have been detected (Berg, 2007; Hernández-Esquivel et al., 2020; Pederneiras et al., 2023). These studies need to be performed together with a precise identification of the pollinating wasps, since there is evidence of Ficus species with more than 1 wasp pollinator (Jackson et al., 2008; Machado et al., 2005; Molbo et al., 2003; Su et al., 2008), some of which can be cryptic (Haine et al., 2006; Molbo et al., 2003). Future studies where these elements can be integrated are thus required to validate and estimate the possible contribution of each trait in this intriguing mutualism.
Acknowledgements
The first author acknowledges scholarship provided by Consejo Nacional de Humanidades, Ciencias y Tecnologías (Conahcyt) and the DGAPA-UNAM (Dirección General de Asuntos del Personal Académico – Universidad Nacional Autónoma de México) for the award of a postdoctoral fellowship grant. A. Navarrete-Segueda thanks the support received from the Consejo Nacional de Humanidades, Ciencias y Tecnologías through the 2022 (1) postdoctoral fellowship grant of the “Estancias Posdoctorales por México – Académica”. We thank Ma. Guadalupe Cornejo Tenorio for her help in measuring the wasp heads and Iván Leonardo Ek Rodríguez for their collaboration in the fieldwork. We are grateful to Silvia Espinosa Matías and Orlando Hernández Cristóbal for technical support with SEM pictures. Thanks to the Laboratorio Nacional de Análisis y Síntesis Ecológica (LANASE) of the ENES Morelia, UNAM, for their microscopy facilities and the Estación de Biología Tropical de Los Tuxtlas, Instituto de Biología, UNAM, for logistical support. We appreciate the support of Rosamond Coates in translating the English version of the manuscript. Finally, we are also grateful to two reviewers for their valuable comments to improve our manuscript.
References
Berg, C. C. (1989). Classification and distribution of Ficus. Experientia, 45, 605–611. https://doi.org/10.1007/BF01975677
Berg, C. C. (2007). Proposals for treating four species complexes in Ficus subgenus Urostigma section Americanae (Moraceae). Blumea, 52, 295–312. https://doi.org/10.3767/000651907X609034
Bronstein, J. L. (1988). Mutualism, antagonism, and the fig-pollinator interaction. Ecology, 69, 1298-1302. https://doi.org/10.2307/1941287
Borges, R. M. (2021). Interactions between figs and gall-inducing fig wasps: Adaptations, constraints, and unanswered questions. Frontiers in Ecology and Evolution, 9, 685542. https://doi.org/10.3389/fevo.2021.685542
Bouček, Z. (1993). The genera of chalcidoid wasps from Ficus fruit in the New World. Journal of Natural History, 27, 173–217. http://dx.doi.org/10.1080/00222939300770071
Castro-Cárdenas, N., Vázquez-Santana, S., Teixeira, S. P., & Ibarra-Manríquez, G. (2022). The roles of the ostiole in the fig-fig wasp mutualism from a morpho-anatomical perspective. Journal of Plant Research, 135, 739–755. https://doi.org/10.1007/s10265-022-01413-9
Chen, Y.-R., Chou, L.-S., & Wu, W.-J. (2001). Regulation of fig wasps entry and egress: The role of ostiole of Ficus microcarpa L. Formosan Entomology, 21, 171–182, https://doi.org/10.6661/TESFE.2001014
Clement, W. L., Bruun Lund, S., Cohen, A., Kjellberg, F., Weiblen, G. D., & Rønsted, N. (2020). Evolution and classification of figs (Ficus) and their close relatives (Castilleae) united by involucral bracts. Botanical Journal of the Linnean Society, 193, 316–339. https://doi.org/10.1093/botlinnean/boaa022
Cook, J. M., & Rasplus J.-Y. (2003). Mutualists with attitude: Coevolving fig wasps and figs. Trends in Ecology & Evolution, 18, 241–248. https://doi.org/10.1016/S0169-5347(03)00062-4
Cook, J. M., & Segar, S. T. (2010). Speciation in fig wasps. Ecological Entomology, 35, 54–66. https://doi.org/10.1111/j.1365-2311.2009.01148.x
Cruaud, A., Ronsted N., Chantarasuwan, B., Chou, L. S., Clement, W. L., Couloux, A. et al. (2012). An extreme case of plant-insect codiversification: figs and fig-pollinating wasps. Systematic Biology, 61, 1029–1047. https://doi.org/10.1093/sysbio/sys068
Cornejo-Tenorio, G., Ibarra-Manríquez, G., & Sinaca-Colín, S. (2019). Flora de Los Tuxtlas. Guía ilustrada. Ciudad de México: Universidad Nacional Autónoma de México.
Delgado-Pérez, G., Vázquez-Santana, S., Cornejo-Tenorio, G., & Ibarra-Manríquez, G. (2020). Morfoanatomía de las fases de desarrollo del sicono de Ficus tuerckheimii (subg. Spherosuke, sect. Americanae, Moraceae). Botanical Sciences, 98, 570–583. https://doi.org/10.17129/botsci.2631
Dunn, D. W. (2020). Stability in fig tree-fig wasp mutualisms: How to be a cooperative fig wasp. Biological Journal of the Linnean Society, 130, 1–17. https://doi.org/10.1093/biolinnean/blaa027
Dunn, D. W., Yu, D. W., Ridley, J., & Cook, J. M. (2008). Longevity, early emergence and body size in a pollinating fig wasp – Implications for stability in a fig-pollinator mutualism. Journal of Animal Ecology, 77, 927–935. https://doi.org/10.1111/j.1365-2656.2008.01416.x
Galil, J. (1977). Fig biology. Endeavour, 1, 52–56. https://doi.org/10.1016/0160-9327(77)90106-5
Galil, J., & Eisikowitch, D. (1968). On the pollination ecology of Ficus sycomorus in East Africa. Ecology, 49, 259–269. https://doi.org/10.2307/1934454
Haine, E. R., Martin, J., & Cook, J. M. (2006). Deep mtDNA divergences indicate cryptic species in a fig-pollinating wasp. BMC Evolutionary Biology, 6, 83. https://doi.org/10.1186/1471-2148-6-83
Hernández-Esquivel, K, B., Piedra-Malagón, E. M., Cornejo-Tenorio, G., Mendoza-Cuenca, L., González-Rodríguez, A., Ruiz-Sánchez, E. et al. (2020). Unraveling the extreme morphological variation in the neotropical Ficus aurea complex (subg. Spherosuke, sect. Americanae, Moraceae). Journal of Systematics and Evolution, 58, 263–281. https://doi.org/10.1111/jse.12564
Herre, E. A. (1989). Coevolution of reproductive characteristics in 12 species of New World figs and their pollinator wasps. Experientia, 45, 637–647. https://doi.org/10.1007/BF01975680
Herre, E. A., Jandér, K. C., & Machado, C. A. (2008). Evolutionary ecology of figs and their associates: recent progress and outstanding puzzles. Annual Review of Ecology, Evolution, and Systematics, 39, 439–458. https://doi.org/10.1146/annurev.ecolsys.37.091305.110232
Ibarra-Manríquez, G., Cornejo-Tenorio, G., González-Castañeda, N., Piedra-Malagón, E. M., & Luna, A. (2012). El género Ficus L. (Moraceae) en México. Botanical Sciences, 90, 389–452. https://doi.org/10.17129/botsci.472
Jackson, A. P., Machado, C. A., Robbins, N., & Herre, E. A. (2008). Multi-locus phylogenetic analysis of Neotropical figs does not support co-speciation with the pollinators: the importance of systematic scale in fig/wasp cophylogenetic studies. Symbiosis, 45, 57–72.
Jandér, K. C., Dafoe, A., & Herre, E. A. (2016). Fitness reduction for uncooperative fig wasps through reduced offspring size: A third component of host sanctions. Ecology, 97, 2491–2500. https://doi.org/10.1002/ecy.1471
Janzen, D. H. (1979). How to be a fig. Annual Review of Ecology and Systematics, 10, 13–51. https://doi.org/10.1146/annurev.es.10.110179.000305
Jousselin, E., Rasplus, J. Y., & Kjellberg, F. (2003). Convergence and coevolution in a mutualism: Evidence from a molecular phylogeny of Ficus. Evolution, 57, 1255–1269. https://doi.org/10.1111/j.0014-3820.2003.tb00334.x
Liu, C., Yang, D.-R., & Peng, Y.-Q. (2011). Body size in a pollinating fig wasp and implications for stability in a fig-pollinator mutualism. Entomologia Experimentalis et Applicata, 138, 249–255. https://doi.org/10.1111/j.1570-7458.2011.01096.x
Machado, A. F. P., de Souza, A. M., & Leitão, C. A. E. (2013). Secretory structures at syconia and flowers of Ficus enormis (Moraceae): A specialization at ostiolar bracts and the first report of inflorescence colleters. Flora, 208, 45–51. https://doi.org/10.1016/j.flora.2012.12.005
Machado, C. A., Robbins, N., Gilbert, M. T. P., & Herre, E. A. (2005). Critical review of host specificity and its coevolutio-
nary implications in the fig/fig-wasp mutualism. Proceedings of the National Academy of Sciences, 102 (suppl._1), 6558–6565. https://doi.org/10.1073/pnas.0501840102
Molbo, D., Machado, C. A., Sevenster, J. G., Keller, L., & Herre, E. A. (2003). Cryptic species of fig-pollinating wasps: Implications for the evolution of the fig-wasp mutualism, sex allocation, and precision of adaptation. Proceedings of the National Academy of Sciences, 100, 5867–5872. https://doi.org/10.1073/pnas.0930903100
Nelson, S. A., & Gonzalez-Caver, E. (1992). Geology and K-Ar dating of the Tuxtla Volcanic Field, Veracruz, Mexico. Bulletin of Volcanology, 55, 85–96. https://doi.org/10.1007/BF00301122
Okamoto, T., & Su, Z.-H. (2021). Chemical analysis of floral scents in sympatric Ficus species: highlighting different compositions of floral scents in morphologically and phylogenetically close species. Plant Systematics and Evolution, 307, 1–12. https://doi.org/10.1007/s00606-021-01767-y
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2019). Vegan: Community ecology package. In R package version 2.5-6 (p. 296). https://doi.org/10.4135/9781412971874.n145
Oldenbeuving, A., Gómez-Zúniga, A., Florez-Buitrago, X., Gutiérrez-Zuluaga, A. M., Machado, C. A., Van Dooren, T. J. M. et al. (2023). Field sampling of fig pollinator wasps across host species and host developmental phase: Implications for host recognition and specificity. Ecology and Evolution, 13, e10501. https://doi.org/10.1002/ece3.10501
Pederneiras, L. C., Carauta, J. P. P., Neto, S. R., & de Freitas, V. (2015). An overview of the infrageneric nomenclature of Ficus (Moraceae). Taxon, 64, 589–594. http://dx.doi.org/10.12705/643.12
Pederneiras, L. C., Zamengo, H. B., Plata-Castro, A. D., Romaniuc-Neto, S., & de Freitas, V. (2023). Ficus sect. Americanae ser. Kinuppii: a ramiflorous group of Neotropical fig trees. Brittonia, 75, 249-268. https://doi.org/10.1007/s12228-023-09750-2
Peng, Y. Q., Duan, Z. B., Yang, D. R., & Rasplus, J. Y. (2008). Cooccurrence of two Eupristina species on Ficus altissima in Xishuangbanna, SW China. Symbiosis, 45, 9–14.
Piedra-Malagón, E. M., Hernández-Ramos, B., Mirón-Monterrosas, A., Cornejo-Tenorio, G., Navarrete-Segueda, A., & Ibarra-Manríquez, G. (2019). Syconium development in Ficus petiolaris (Ficus, sect. Americanae, Moraceae) and the relationship with pollinator and parasitic wasps. Botany, 97, 190–203. https://doi.org/10.1139/cjb-2018-0095
Ramírez, B. W. (1970). Host specificity of fig wasps (Agaonidae). Evolution, 24, 680–691. https://doi.org/10.1111/j.1558-5646.1970.tb01804.x
Ramírez, B. W. (1974). Coevolution of Ficus and Agaonidae. Annals of the Missouri Botanical Garden, 61, 770–780. https://doi.org/10.2307/2395028
Rasplus, J.-Y., Rodriguez, L. J., Sauné, L., Peng, Y.-Q., Bain, A., Kjellberg, F. et al. (2020). Exploring systematic biases, rooting methods and morphological evidence to unravel the evolutionary history of the genus Ficus (Moraceae). Cladistics, 37, 402–422. https://doi.org/10.1111/cla.12443
Rasplus, J. Y., & Soldati, L. (2006). Familia Agaonidae. In: F. Fernández y M. J. Sharkey, (Eds.) Introducción a los Hymenoptera de la Región Neotropical (pp. 683-698). Bogotá: Sociedad Colombiana de Entomología & Universidad Nacional de Colombia.
Rønsted, N., Weiblen, G. D., Cook, J. M., Salamin, N., Machado, C. A., & Savolainen, V. (2005). 60 million years of co-divergence in the fig-wasp symbiosis. Proceedings of the Royal Society London B, 272, 2593–2599. https://doi.org/10.1098/rspb.2005.3249
SMN (Servicio Metereológico Nacional). (2010). Información climatológica por estado (document on line). Servicio Meteorológico Nacional. Available at: https://smn.conagua.gob.mx/es/informacion-climatologica-por-estado?estado=ver
Soto, M. (2004). El Clima. In S. Guevara, J. Laborde, & G. Sánchez-Río (Eds.), Los Tuxtlas. El paisaje de la sierra. Xalapa: Instituto de Ecología A.C./ Unión Europea.
Souto-Vilarós, D., Proffit, M., Buatois, B., Rindos, M., Sisol, M., Kuyaiva, T. et al. (2018). Pollination along an elevational gradient mediated both by floral scent and pollinator compatibility in the fig and fig-wasp mutualism. Journal of Ecology, 106, 2256–2273. https://doi.org/10.1111/1365-2745.12995
Su, Z. H., Iino, H., Nakamura, K., Serrato, A., & Oyama, K. (2008). Breakdown of the one-to-one rule in Mexican fig-wasp associations inferred by molecular phylogenetic analysis. Symbiosis, 45, 73–81.
Tong, S. T. Y. (1992). The use of non-metric multidimensional scaling as an ordination technique in resource survey and evaluation: A case study from southeast Spain. Applied Geography, 12, 243–260. https://doi.org/10.1016/0143-6228(92)90042-L
van Noort, S., & Compton, S. G. (1996). Convergent evolution of agaonine and sycoecine (Agaonidae, Chalcidoidea) head shape in response to the constraints of host fig morphology. Journal of Biogeography, 23, 415–424. https://doi.org/10.1111/j.1365-2699.1996.tb00003.x
Verkerke, W. (1989). Structure and function of the fig. Experientia, 45, 612–622. https://doi.org/10.1007/BF01975678
Verma, S. P., Salazar-V., A., Negendack, J. F. W., Milán, M., Navarro, L. I., & Besch, T. (1993). Características petrográfica y geoquímicas de elementos mayores del Campo Volcánico de Los Tuxtlas, Veracruz, México. Geofísica Internacional, 32, 237–248. https://doi.org/10.22201/igeof.00167169p.1993.32.2.558
Villaseñor, J. L., Ortiz, E., & Campos-Villanueva, A. (2018). High richness of vascular plants in the tropical Los Tuxtlas Region, Mexico. Tropical Conservation Science, 11, 1–12. https://doi.org/10.1177/1940082918764259
Wang, A. Y., Peng, Y.-Q., Harder, L. D., Huang, J.-F., Yang, D.-R., Zhang, D.-Y. et al. (2019). The nature of interspecific interactions and co-diversification patterns, as illustrated by the fig microcosm. New Phytologist, 224, 1304–1315. https://doi.org/10.1111/nph.16176
Wang, G., Compton, S. G., & Chen, J. (2013). The mechanism of pollinator specificity between two sympatric fig varieties: a combination of olfactory signals and contact cues. Annals of Botany, 111, 173–181. https://doi.org/10.1093/aob/mcs250
Weiblen, G. D. (2002). How to be a fig wasp. Annual Review of Entomology, 47, 299–330. https://doi.org/10.1146/annurev.ento.47.091201.145213
Wiebes, J. T. (1966). Provisional host catalogue of fig wasps (Hymenoptera, Chalcidoidea). Zoologische Verhandelingen, 83, 1–44.
Wiebes, J. T. (1979). Co-evolution of figs and their insect pollinators. Annual Review of Ecology and Systematics, 10, 1–12. https://doi.org/10.1146/annurev.es.10.110179.000245
Zhang, Q., Onstein, R. E., Little, S. A., & Sauquet, H. (2019). Estimating divergence times and ancestral breeding systems in Ficus and Moraceae. Annals of Botany, 123, 191–204. https://doi.org/10.1093/aob/mcy159
Genetic variability of the nematode Metaparasitylenchus hypothenemi (Tylenchida: Allantonematidae),natural parasite of the coffee berry borer (Coleoptera: Curculionidae: Scolytinae), using COI sequences
Marina Simota-Ruiz a, Oscar Mikery b,Juan Cisneros a, Oscar Carmona-Castro a, Alfredo Castillo-Vera a, *, Alma E. García-Morales c
a El Colegio de la Frontera Sur, Ecología de Artrópodos y Manejo de Plagas, Carretera Antiguo Aeropuerto Km 2.5, 30700 Tapachula, Chiapas, Mexico
b Ortomolecular Mexicana BC, Grupo Molecular, Investigación, Calle Fray Justo Sierra No. 9216, Colonia Marrón, 22015 Tijuana, Baja California, Mexico
c El Colegio de la Frontera Sur, Departamento de Sistemática y Ecología Acuática, Avenida Centenario Km. 5.5, 77014 Chetumal, Quintana Roo, Mexico
*Corresponding author: acastill@ecosur.mx (A. Castillo-Vera)
Received: 28 February 2024; accepted: 14 February 2025
Abstract
The nematode Metaparasitylenchus hypothenemi (Poinar) (Tylenchida: Allantonematidae) is a parasite of the coffee berry borer (Hypothenemus hampei), one of the most significant pests affecting coffee crops. This study aimed to analyze the genetic variation of M. hypothenemi using the mitochondrial cytochrome oxidase subunit I (COI) gene. Reproductive females of M. hypothenemi were extracted from parasitized wild coffee berry borers for DNA extraction, amplification, and sequencing. Phylogenetic analyses revealed 2 well-differentiated lineages and 6 haplotypes distributed across 18 populations along a 100 km transect. Global genetic diversity was moderate (Hd = 0.52 ± 0.06), with a dominant haplotype present in 16 populations and others being representative or geographically isolated. Populations showed high genetic differentiation and restricted gene flow. These findings confirm the utility of the COI gene for analyzing the genetic variation of M. hypothenemi and provide a molecular basis for future studies on its biology and management.
Keywords: Obligate endoparasite; Insect pest; Genetic variation; COI Gene; Phylogenetic tree; Genetic structure
Variabilidad genética del nemátodo Metaparasitylenchus hypothenemi (Tylenchida:Allantonematidae), parásito natural de la broca del café (Coleoptera: Curculionidae: Scolytinae) usando secuencias de COI
Resumen
El nemátodo Metaparasitylenchus hypothenemi (Poinar) (Tylenchida: Allantonematidae) es un parásito de la broca del café (Hypothenemus hampei), una de las principales plagas del cultivo de café. Este estudio tuvo como objetivo analizar la variación genética de M. hypothenemi mediante el gen mitocondrial citocromo oxidasa subunidad I (COI). Se obtuvieron hembras reproductoras de M. hypothenemi de brocas silvestres parasitadas para la extracción, amplificación y secuenciación de DNA. Los análisis filogenéticos revelaron 2 linajes bien diferenciados y 6 haplotipos distribuidos en 18 poblaciones a lo largo de un transecto de 100 km. La diversidad genética global fue moderada (Hd = 0.52 ± 0.06), con un haplotipo dominante en 16 poblaciones y otros representativos o aislados geográficamente. Las poblaciones mostraron una alta diferenciación genética y flujo genético restringido. Estos resultados confirman la utilidad del gen COI para analizar la variación genética de M. hypothenemi y proporcionan bases moleculares para futuros estudios sobre su biología y manejo.
Palabras clave: Endoparásito obligado; Plaga de insectos; Variación genética; Gen COI; Árbol filogenético; Estructura genética
Introduction
The nematode, Metaparasitylenchus hypothenemi (Poinar) (Tylenchida: Allantonematidae), is an obligate endoparasite of the coffee berry borer (CBB), Hypo-
thenemus hampei (Ferrari) (Coleoptera: Curculionidae, Scolytinae), the most important insect pest of coffee worldwide (Le Pelley, 1968). Metaparasitylenchus hypothenemi was discovered in a commercial coffee plantation in southeastern Mexico attacking H. hampei adults (Castillo et al., 2002). M. hypothenemi reduce the fecundity and longevity of the females H. hampei (Castillo et al., 2019). This parasite-host relationship highlights the importance of studying its genetic variability and understanding its ecological role. The study of genetic variability in parasitic nematodes like M. hypothenemi requires molecular tools that enable precise population characterization. Among these, the mitochondrial gene cytochrome oxidase subunit I (COI) has proven to be an efficient marker for identifying specimens, clarifying evolutionary relationships among species, and analyzing population divergence (Hebert et al., 2003; Marsjan & Oldenbroek, 2007). This marker has been successfully used to analyze population structure and infer phylogenetic relationships in related nematodes, including parasites and entomopathogens such as Heterorhabditis marelatus and Deladenus proximus (Blouin et al., 1999; Fitza et al., 2019; Hartshorn et al., 2017; Saeb & David, 2014). However, there are few nematode sequences in both the BOLD Systems database and GenBank, and those corresponding to insect-parasitic nematodes are even scarcer, with M. hypothenemi being a species without previous genetic studies. The objective of this study was to analyze the genetic variability, in terms of the phylogeny, frequency of haplotypes and genetic differentiation between popula-
tions of the nematode Metaparasitylenchus hypothenemi collected from Soconusco, the only region in the world where this nematode has been systematically recorded.
Materials and methods
Five reproductive females of M. hypothenemi were collected in each of 18 localities from the Soconusco region, Chiapas, Mexico (Table 1, Fig. 1). Reproductive females of M. hypothenemi were extracted from the abdominal cavity of H. hampei, which were obtained from 100 coffee berries collected from coffee plants per locality. Reproductive females were selected for sampling due to their larger size compared to males, which facilitated DNA extraction and ensured the viability of the samples. Moreover, their genetic material plays a key role in transmitting genetic diversity to subsequent generations (Stewart & Larsson, 2014). The nematodes were stored in 2.5 ml microtubes containing 96% alcohol at -20 °C, until molecular analysis. The samples obtained in each sampled locality were considered as a population.
DNA extraction, amplification, and sequencing. A total of 90 nematodes of M. hypothenemi were used for DNA extraction. Total DNA from each specimen was extracted from the body complete of the nematode using a standard glass fiber method (Ivanova et al., 2006). A barcode region of approximately 658 base pairs (bp) of the mitochondrial COI gene was amplified using the primers ZplankF1_t1 (5’-TGTAAAACGACGGCCAGTTCTASWAATCATAARGATATTGG-3’) and ZplankR1_t1 (5’-CAGGAAACAGCTATGACTTCAGGRTGRCCRAARAATCA-3’) (Prosser et al., 2013). The final volume of the PCR mix was 12.5 µl, containing 0.12 µl of each primer (0.01 µM), 0.6 µl of MgCl2 (50 mM), 2 µl of ultrapure water, 0.06 µl of each dNTP (0.05 mM), 1.25 µl of 10X PCR buffer, 6.25 µl of trehalose 10%, 0.06 µl of Taq DNA polymerase (5U/µl) (Platinum® Taq, Invitrogen), and 3.5 µl of DNA template (Hajibabaei et al., 2005). The PCR amplification was carried out using the following conditions: 1 min at 94°C, followed by 5 cycles of 94˚C for 40 sec, 45˚C for 40 sec and 72˚C for 1 min, followed by 35 cycles of 94˚C for 40 sec, 51˚C for 40 sec and 72˚C for 1 min, with a final extension of 72˚C for 5 minutes. PCR products were checked for quality and length using electrophoresis on ethidium bromide stained, 2% agarose gels (E-Gel 96 Invitrogen, Carlsbad, CA) and were bidirectionally sequenced by Eurofins Genomics (USA). The sequences were edited using Codon Code Aligner v. 8.0.1 (Codon Code Corporation) and uploaded to both the Barcode of Life Data System (BOLD, www.boldsystems.org) and GenBank. In BOLD, they were labeled as Parasitic Nematode of coffee berry borer (PNBC), and in GenBank, they were assigned the accession numbers MT520707 to MT520790.
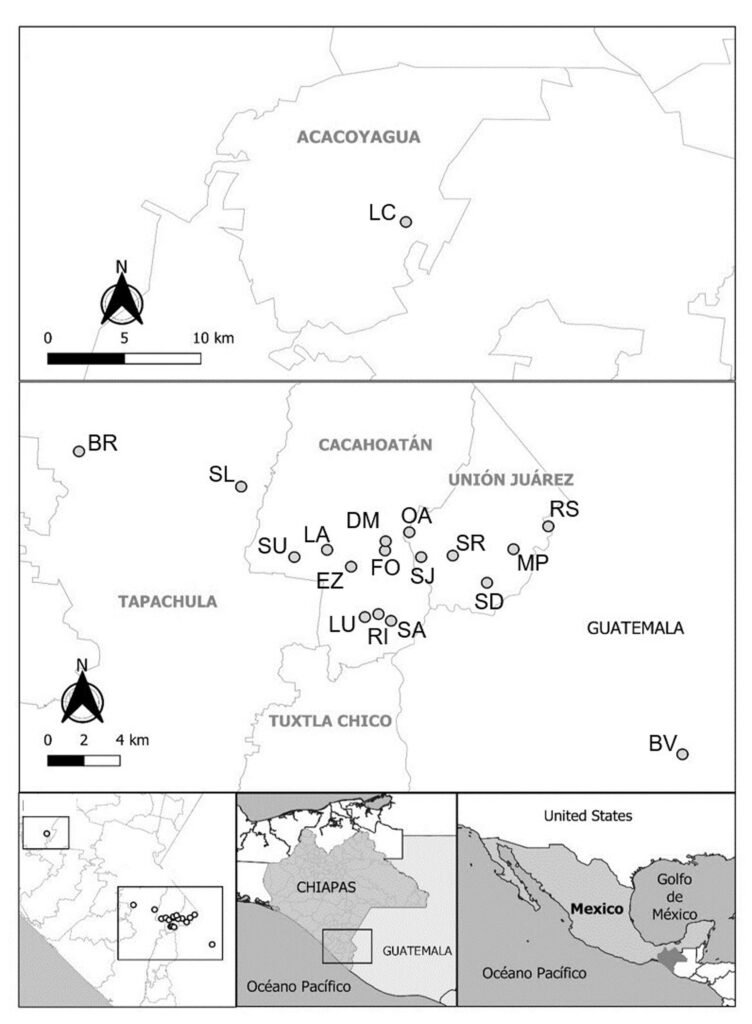
Figure 1. Geographic location of coffee plantations sampled to determine the presence of coffee berry borers infected with the nematode M. hypothenemi.
Genetic diversity and population structure. The sequences were aligned using the ClustalW algorithm in the MEGA X v. 7.0.26 (Kumar et al., 2018) software, optimizing global similarity to ensure accuracy in phylogenetic inferences. Genetic diversity was estimated by calculating the number of segregation sites (S), number of haplotypes (h), haplotype diversity (Hd), nucleotide diversity (Π) and average number of nucleotide differences (K) using the software DnaSP v. 6.12.03 (Rozas & Librado, 2009). To test the hypothesis of neutral evolution and to understand potential demographic events, such as expansion trends, Tajima’s D (Tajima, 1989) and Fu and Li’s D and F indices were estimated (Fu & Li, 1993). Genetic differentiation among populations was analyzed using the pairwise fixation index (FST). An analysis of molecular variance (AMOVA) was also performed to assess the statistical significance of FST values (Excoffier & Lischer, 2010). Two separate AMOVA analyses were conducted to determine whether genetic differentiation between these lineages was statistically significant: i) considering the populations as a panmictic group and ii) the populations were grouped based on the 2 phylogenetic lineages identified in the maximum likelihood tree. Furthermore, the number of migrants per generation (Nm), an indirect measure of gene flow between populations, was estimated. All analyses were performed using Arlequin v. 3.5 (Excoffier & Lischer, 2010). The relationship between genetic differences (FST) and geographic distances among populations was analyzed using the Mantel test (Mantel, 1967). Two matrices were compared: genetic differences between population pairs and geographic distances (in kilometers). Geographic distances were calculated using QGIS v3.10.3 software (https://qgis.org). These distances were used to perform a Mantel test to assess the potential relationship between genetic differentiation and geographic separation in the context of an isolation-by-distance pattern. The statistical analysis was conducted in R (R Core Team, 2020) using the Vegan package (Oksanen et al., 2010), with 1,000 permutations to assess significance.
Table 1
Geographical locations where CBB samples infected with M. hypothenemi were collected in Mexico and Guatemala.
| Municipality | Locality | Country | Code | Geographic coordinates | |
| Latitude | Longitude | ||||
| Tapachula | Santa Lucía | Mexico | SL | 15°04’42.5’’ | 92°13’42.5 |
| Finca Brasil | Mexico | BR | 15°05’50.3’’ | 92°18’43.1’’ | |
| Cacahoatán | Salvador Urbina | Mexico | SU | 15°02’26.9’’ | 92°12’03.9 |
| La Alianza | Mexico | LA | 15°02’40.8’’ | 92°11’03.2’’ | |
| El Zapote | Mexico | EZ | 15°02’08.4’’ | 92°10’18.7’’ | |
| La Unidad | Mexico | LU | 15°00’31.4’’ | 92°09’53.2 | |
| Dos de Mayo | Mexico | DM | 15°02’55.0’’ | 92°09’14.5’’ | |
| Faja de Oro | Mexico | FO | 15°02’56.4’’ | 92°09’14.4’’ | |
| Rosario Ixtal | Mexico | RI | 15°00’37.2’’ | 92°09’28.0’’ | |
| San Antonio | Mexico | SA | 15°00’24.2’’ | 92°09’04.7’’ | |
| Unión Juárez | Santo Domingo | Mexico | SD | 15°01’37.5’’ | 92°06’06.9’’ |
| San Rafael | Mexico | SR | 15°02’29.8’’ | 92°07’10.3’’ | |
| San Jerónimo | Mexico | SJ | 15°02’26.9’’ | 92°08’08.9’’ | |
| Monte Perla | Mexico | MP | 15°02’42.1’’ | 92°05’17.8’’ | |
| Río Suchiate | Mexico | RS | 15°03’26.1’’ | 92°04’13.2’’ | |
| Once de Abril | Mexico | OA | 15°03’14.8’ | 92°08’30.9’’ | |
| Acacoyagua | Los Cacaos | Mexico | LC | 15°23’23’’ | 92°39’13.0’’ |
| San Pablo | BuenaVista | Guatemala | BV | 14°57’53.1 | 91°59’48.7’’ |
The phylogeny of M. hypothenemi was inferred using RAxML v. 2.0. (Stamatakis, 2006). The General Time Reversible model with a proportion of invariant sites (GTR+I) was selected as the best approximation to the (TIM3+I) (-ln L 1,588.857; Delta-AIC = 0.0; AIC = 3,573.631) model obtained from the Akaike information criterion (AIC) (Akaike, 1974) analysis performed in JModelTest v. 0.1.1 (Posada, 2008). The analysis included 10,000 bootstrap replicates to ensure robust nodal support. Sequences of the nematode Howardula aoronymphium (Welch) (Tylenchida: Allantonematidae, GenBank: AY589466) was used as external group. The relationship between the identified haplotypes was analysed using a haplotype network generated in the PopART software v. 1.7 (Leigh & Bryant, 2015), applying the Median-Joining criterion.
Results
A total of 76 sequences of 560 bp from M. hypothenemi were analysed revealing 93 polymorphic sites (16.6%), whose A-T content (67.6%) was higher than the G-C content (32.4%). Global genetic diversity was moderate (Hd = 0.52 ± 0.06) (± SD) (Table 2). Ten populations presented zero diversity, while the SU and LC populations presented the highest genetic diversity from 18 populations (Table 2). The global neutrality tests were statistically significant according to Tajima values (D = -2.062, p < 0.05) and Fu and Li (D = 2.167, p < 0.02) (Table 2). Tajima and Fu and Li values were not significant inside of each population. A total of 6 haplotypes were identified, including one dominant haplotype (H1 = 50) and 4 unique ones (H3 = 2, H4 = 1, H5 = 5, and H6 = 1). The dominant haplotype was present in 16 from 18 populations sampled, while the second most common haplotype (H2 = 17) was recorded in 8 populations (Table 3).
High genetic differentiation was observed in M. hypothenemi, with a global value FST of 0.66 (p < 0.05) and a low number of migrants per generation (Nm = 0.50). The EZ, BR, and LC populations showed greater genetic differentiation than the rest of the populations, with an average distance between these and the other populations of 1.7-66.5 km, 9.5-50 km, and 50.5-87.5 km, respectively (Table 4). The smallest geographical distance was between the FO and DM populations (0.04 km), with no genetic differentiation between them. The AMOVA analysis conducted under panmictic indicate that genetic variation was greater between populations (66.61%) than within populations (33.39%). A second AMOVA, grouping populations according to the 2 phylogenetic lineages identified in the maximum likelihood tree, revealed a higher level of genetic differentiation between the lineages, with an FST of 0.99 (p < 0.01), indicating that the differentiation between the 2 lineages was statistically significant. In this second AMOVA, genetic variation was mainly distributed between lineages (99.42%) rather than within them (0.58%). The Mantel test revealed a significant correlation between the genetic pairwise distances and the geographic distances (km) among M. hypothenemi populations (r = 0.4728, p < 0.0001), consistent with a pattern of isolation by distance.
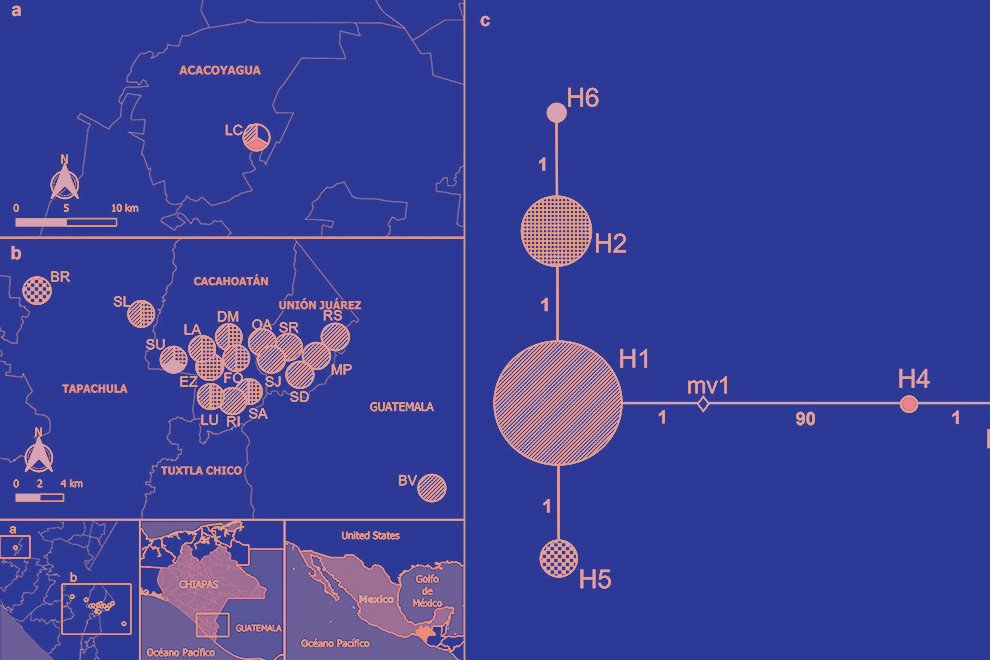
The tree topology revealed 2 independent clades with high support (> 90%). Clade I formed by 3 monophyletic groups, which corresponds to 96% of the specimens distributed in the municipalities of Tapachula, Cacahoatán, Unión Juárez, and San Pablo (Guatemala). Inside clade I, 2 subgroups were observed. The first subgroup had a bootstrap support value of 82%, while the second subgroup showed a higher support, with a bootstrap value of 99%. Clade II formed by 3 specimens belonging to the LC (Acacoyagua) population. A phylogenetic separation (16.5%) was observed between clade I and clade II specimens (Fig. 2).
The most frequent haplotype was H1, followed by H2. Both haplotypes were found in most of the studied sites, being particularly frequent in the municipalities of Tapachula, Cacahoatán, Unión Juárez, Acacoyagua, and San Pablo. On the other hand, H6 was exclusively detected in SU, in the municipality of Cacahoatán. H3 and H4 were restricted to LC, in Acacoyagua, while H5 was only found in BR, in Tapachula. The distribution of haplotypes by municipality and their frequencies are shown in Table 3. The inferred haplotype network identified H1 as the central, while the other haplotypes appeared as its derivatives. H4 diverged from H1 by 90 mutational steps, whereas H2, H5, and H6 diverged from H1 by only 1 mutational step (Fig. 3C).
Discussion
This study presents the first genetic description of M. hypothenemi populations, a nematode endoparasite of H. hampei, whose presence has only been naturally recorded in several coffee plantations in Mexico (Pérez et al., 2014). The genetic variability of M. hypothenemi suggests significant differentiation among its populations. Although not all populations exhibit the same degree of differentiation, the results support the hypothesis that this parasite is endemic to southeastern Mexico (Poinar et al., 2004). The genetic complexity of the populations of this parasite is similar to that observed in populations of endemic species (Blouin et al., 1999; Stock 2009).
This study also includes the first genetic sequences of M. hypothenemi in the BOLD System database. The COI gene has not yet been widely adopted as a tool for identifying parasitic nematode species, a high genetic structure in M. hypothenemi, an obligate parasite of H. hampei.
Table 2
Estimation of the genetic diversity in 18 populations of the nematode M. hypothenemi collected in the Soconusco region, Chiapas, Mexico.
| Population | N | S | H | Su | Hd (± SD) | Π (± SD) | K | Tajima | Fu and Li | |
| D | D | F | ||||||||
| SL | 5 | 1 | 2 | 0 | 0.600 (0.175) | 0.0010 (0.0003) | 0.600 | 1.224 | 1.224 | 1.157 |
| BR | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| SU | 4 | 2 | 3 | 2 | 0.833 (0.222) | 0.0017 (0.0006) | 1.000 | -0.709 | -0.709 | -0.604 |
| LA | 2 | 1 | 2 | 1 | 1 (0.500) | 0.0017 (0.0008) | 1 | – | – | – |
| EZ | 4 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| LU | 4 | 1 | 2 | 1 | 0.500 (0.265) | 0.0008 (0.0004) | 0.500 | -0.612 | -0.612 | -0.478 |
| DM | 5 | 1 | 2 | 1 | 0.400 (0.237) | 0.0007 (0.0004) | 0.400 | -0.816 | -0.816 | -0.771 |
| FO | 3 | 1 | 2 | 1 | 0.666 (0.314) | 0.0011 (0.0000) | 0.666 | – | – | – |
| RI | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| SA | 5 | 1 | 2 | 1 | 0.400 (0.237) | 0.0007 (0.0000) | 0.400 | -0.816 | -0.816 | -0.771 |
| SD | 2 | 0 | 1 | 0 | 0 | 0 | 0 | – | – | – |
| SR | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| SJ | 4 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| MP | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| RS | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| OA | 4 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| LC | 4 | 92 | 3 | 91 | 0.833 (0.222) | 0.0824 (0.0431) | 46.166 | -0.836 | -0.836 | -0.895 |
| BV | 5 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Total | 76 | 93 | 6 | 0 | 0.519 (0.056) | 0.0134 (0.0067) | 7.6291 | -2.0622* | 2.1674** | 0.5539 |
N, Number of sequences; S, number of segregating sites; H, number of haplotypes; Su, number of unique sites; Hd, haplotype diversity; Π, nucleotide diversity; K, average number of nucleotide differences. ±SD: Standard deviation. The D Tajima index (Tajima, 1989), D and F of Fu and Li (Fu & Li, 1993). The hyphen represents an estimate not performed due to a limited number of sequences used. * p < 0.05 ** p < 0.02.
Identifying and detecting M. hypothenemi using classical taxonomy remains challenging due to its small size and the subtlety of its morphological characteristics, requiring a fast and reliable method such as DNA barcoding (Gonçalves et al., 2021). For example, 11 new marine nematode species from the Mexican Caribbean have been identified using this technique (Martínez et al., 2020). However, the COI gene has not yet been widely used to identify parasitic nematode species. To date, only 2 species have been reported naturally parasitizing adult coffee berry borers: Panagrolaimus sp. in India (Varaprasad, 1994) and M. hypothenemi in Mexico (Castillo et al., 2002). Nevertheless, the presence of M. hypothenemi has only been detected in this region of the world, and its identification through DNA barcoding could expand our understanding of this species’ geographic range.
Molecular analyses using the COI gene identified 6 haplotypes distributed among the sampled populations, with moderate global genetic diversity (Hd = 0.52) (Wang, 2020). This level of genetic diversity, although lower than that reported for other nematodes such as Heterorhabditis bacteriophora (Hd = 0.8; Saeb & David, 2014), is notable considering the limited geographic distribution of M. hypothenemi and the environmental pressures it faces in Soconusco coffee plantations (Simota et al., 2024). However, this genetic diversity was higher compared to other studies that used 40-120 specimens per population (Klimpel et al., 2007; Powers et al., 2018), possibly due to the number of samples used per population or the high evolutionary rate of mitochondrial DNA (Avise et al., 1987; Brown et al., 1979). Therefore, our sample size may have influenced the estimation of population parameters, and a larger number of specimens per population is recommended in future studies. The observed genetic diversity reflects the adaptive capacity of populations to environmental changes or selective pressure (Clarke, 1979), key aspects for the survival of M. hypothenemi in a fragmented environment. In this sense, understanding the genetic variation of this nematode is essential for designing management and conservation strategies aimed at preserving its role as a potential biological regulator of H. hampei.
Table 3
Frequency of female haplotypes for 18 populations of the nematode Metaparasitylenchus hypothenemi collected in the Soconusco region, Chiapas, Mexico and San Pablo, Guatemala.
| Municipality | Population | *N | Haplotipe frequency |
| Tapachula | SL | 5 | H1(2), H2(3) |
| BR | 5 | H5(5) | |
| Cacahoatán | SU | 4 | H1(1), H2(2), H6(1) |
| LA | 2 | H1(1), H2(1) | |
| EZ | 4 | H2(4) | |
| LU | 4 | H1(3), H2(1) | |
| DM | 5 | H1(4), H2(1) | |
| FO | 3 | H1(2), H2(1) | |
| RI | 5 | H1(5) | |
| SA | 5 | H1(1), H2(4) | |
| Unión Juárez | SD | 2 | H1(2) |
| SR | 5 | H1(5) | |
| SJ | 4 | H1(4) | |
| MP | 5 | H1(5) | |
| RS | 5 | H1(5) | |
| OA | 4 | H1(4) | |
| Acacoyagua | LC | 4 | H1(1), H3(2), H4(1) |
| San Pablo | BV | 5 | H1(5) |
* Number of sequences used in the analysis; the number in parenthesis is the female specimens observed for each haplotype.
Selective neutrality analyses showed significant negative values at a global level, which commonly occur in populations undergoing demographic expansion (Schmidt, 2002), a process that likely began when this pest invaded Mexico in 1978 (Baker, 1984). Selective neutrality analyses revealed negative values for the DM, SA, and LC populations, while the SL population presented a positive value. Neutrality values within populations were not significant, indicating that the studied populations are not under the effects of natural selection (Schmidt, 2002). Therefore, it is feasible that the parasitism of H. hampei by M. hypothenemi represents a novel ecological interaction, as often occurs when a parasite is introduced into a new environment (Bush et al., 2001).
The determination of the origin of the parasite and the age of a parasite-host interaction is complex, due to the variety of mechanisms involved in the historical evolution of parasitism, including the possibility of an initial accidental association (Rico, 2011). The diversity of scolytines associated with coffee plantations in the Soconusco region is very high (Equihua, 1992), and H. hampei is endemic to Africa (Le Pelley, 1968), where populations can reach up to 11 million adults per hectare in mixed plantations of Robusta and Arabica coffee (Baker & Barrera, 1993). Under these conditions, it is likely that an endemic parasitic nematode from this region formed one or more new host-parasite associations with H. hampei (Bickford et al., 2007). Indeed, Poinar et al. (2004) hypothesized that M. hypothenemi first infected the insect in the New World.
Genetic differentiation analyses (FST) revealed high genetic differentiation among M. hypothenemi populations (FST = 0.66, p < 0.05), with gene flow that, in general, is very limited (Nm = 0.50), possibly due to the nematode’s dependence on host movement and the physical barriers imposed by a fragmented landscape (Ali et al., 2016; Fonseca & Netto, 2006; McGaughran et al., 2014). AMOVA confirmed that most genetic variation is found between populations (66.61%), indicating significant genetic structure and rejecting the hypothesis of panmixia. The observed level of genetic differentiation (FST = 0.66) suggests significant population structure, making panmixia unlikely. Additionally, the grouping of populations according to the 2 identified phylogenetic lineages revealed even greater genetic differentiation (FST = 0.99, p < 0.01). This high level of differentiation suggests strong genetic structuring, further reinforcing the rejection of panmixia. These findings highlight the need for further biological studies on M. hypothenemi to explore the existence of 2 lineages or even
distinct species.
Table 4
Genetic (FST) and geographic distances (km, above the diagonal in bold) calculated for 18 populations of the nematode M. hypothenemi collected in the Soconusco region, Chiapas, Mexico and San Pablo, Guatemala.
| LA | SD | EZ | LU | DM | FO | SR | SJ | MP | RI | RS | OA | SL | *BV | LC | BR | SU | SA | |
| LA | 0 | 9.36 | 1.70 | 4.54 | 3.38 | 3.39 | 7.20 | 5.40 | 10.68 | 4.82 | 12.75 | 4.82 | 6.19 | 22.67 | 64.85 | 15.38 | 1.92 | 5.59 |
| SD | 0 | 0 | 7.84 | 7.29 | 6.27 | 6.29 | 2.54 | 4.07 | 2.50 | 6.49 | 4.86 | 5.37 | 15.20 | 13.59 | 73.49 | 24.65 | 11.14 | 5.94 |
| EZ | 0.38 | 1 | 0 | 3.10 | 2.45 | 2.48 | 5.86 | 4.05 | 9.36 | 3.22 | 11.55 | 3.91 | 7.90 | 21.01 | 66.55 | 17.03 | 3.30 | 3.95 |
| LU | 0 | 0 | 0.66 | 0 | 4.59 | 4.64 | 6.2 | 4.81 | 9.42 | 0.79 | 11.82 | 5.65 | 10.51 | 19.32 | 68.99 | 19.12 | 5.39 | 1.51 |
| DM | 0 | 0 | 0.72 | 0 | 0 | 0.04 | 3.91 | 2.20 | 7.33 | 4.28 | 9.36 | 1.48 | 8.92 | 19.83 | 67.34 | 18.39 | 5.30 | 4.67 |
| FO | 0 | 0 | 0.57 | 0 | 0 | 0 | 3.92 | 2.22 | 7.32 | 4.32 | 9.35 | 1.46 | 8.91 | 19.84 | 67.31 | 18.38 | 5.32 | 4.71 |
| SR | 0.47 | 0 | 1 | 0.06 | 0 | 0.18 | 0 | 1.81 | 3.49 | 5.50 | 5.74 | 2.85 | 12.80 | 16.11 | 70.96 | 22.30 | 9.07 | 5.25 |
| SJ | 0.38 | 0 | 1 | 0 | 0 | 0.11 | 0 | 0 | 5.31 | 4.18 | 7.51 | 1.62 | 11.13 | 17.63 | 69.50 | 20.59 | 7.26 | 4.16 |
| MP | 0.47 | 0 | 1 | 0.06 | 0 | 0.18 | 0 | 0 | 0 | 8.64 | 2.41 | 6.05 | 16.04 | 13.54 | 73.70 | 25.57 | 12.56 | 8.21 |
| RI | 0.47 | 0 | 1 | 0.06 | 0 | 0.18 | 0 | 0 | 0 | 0 | 11.04 | 5.18 | 10.93 | 18.61 | 69.50 | 19.70 | 5.89 | 0.82 |
| RS | 0.47 | 0 | 1 | 0.06 | 0 | 0.18 | 0 | 0 | 0 | 0 | 0 | 7.97 | 17.76 | 13.15 | 74.73 | 27.26 | 14.66 | 10.62 |
| OA | 0.38 | 0 | 1 | 0 | 0 | 0.11 | 0 | 0 | 0 | 0 | 0 | 0 | 10.00 | 18.96 | 68.12 | 19.53 | 6.75 | 5.37 |
| SL | 0 | 0.28 | 0.19 | 0 | 0.10 | 0 | 0.5 | 0.45 | 0.5 | 0.5 | 0.5 | 0.45 | 0 | 28.72 | 58.65 | 9.52 | 5.18 | 11.72 |
| *BV | 0.47 | 0 | 1 | 0.06 | 0 | 0.18 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | 87.08 | 38.05 | 24.25 | 17.81 |
| LC | 0.52 | 0.52 | 0.66 | 0.66 | 0.70 | 0.60 | 0.70 | 0.66 | 0.70 | 0.70 | 0.70 | 0.66 | 0.70 | 0.70 | 0 | 50.05 | 63.61 | 70.31 |
| BR | 0.85 | 1 | 1 | 0.82 | 0.83 | 0.82 | 1 | 1 | 1 | 1 | 1 | 1 | 0.81 | 1 | 0.70 | 0 | 13.85 | 20.53 |
| SU | 0 | 0.31 | 0 | 0.14 | 0.24 | 0 | 0.55 | 0.5 | 0.55 | 0.55 | 0.55 | 0.5 | 0 | 0.55 | 0.66 | 0.78 | 0 | 6.71 |
| SA | 0 | 0.62 | 0 | 0.31 | 0.41 | 0.15 | 0.75 | 0.72 | 0.75 | 0.75 | 0.75 | 0.72 | 0 | 0.75 | 0.70 | 0.88 | 0 | 0 |
* Site located in San Pablo, Guatemala.
Pairwise FST values showed that some populations, such as EZ, BR, and LC, exhibit high genetic differentiation compared to other populations, despite moderate geographic distances (average of 1.7-87.5 km). This suggests that these geographic distances might be sufficient to induce isolation by distance, although the presence of specific environmental characteristics or geographic barriers could also play a role. However, the presence of one common haplotype alongside 3 highly divergent ones could indicate the existence of cryptic lineages, migration from other populations, or the persistence of ancestral genetic diversity (Blouin et al., 1995; Chávez-González et al., 2022; Nieberding et al., 2005). Further studies with a larger sample size and broader geographic coverage are needed to clarify these patterns. On the other hand, the FO and DM populations, separated by only 0.04 km, showed no genetic differentiation, suggesting a high degree of gene flow between them, likely facilitated by their geographic proximity and a more homogeneous landscape.
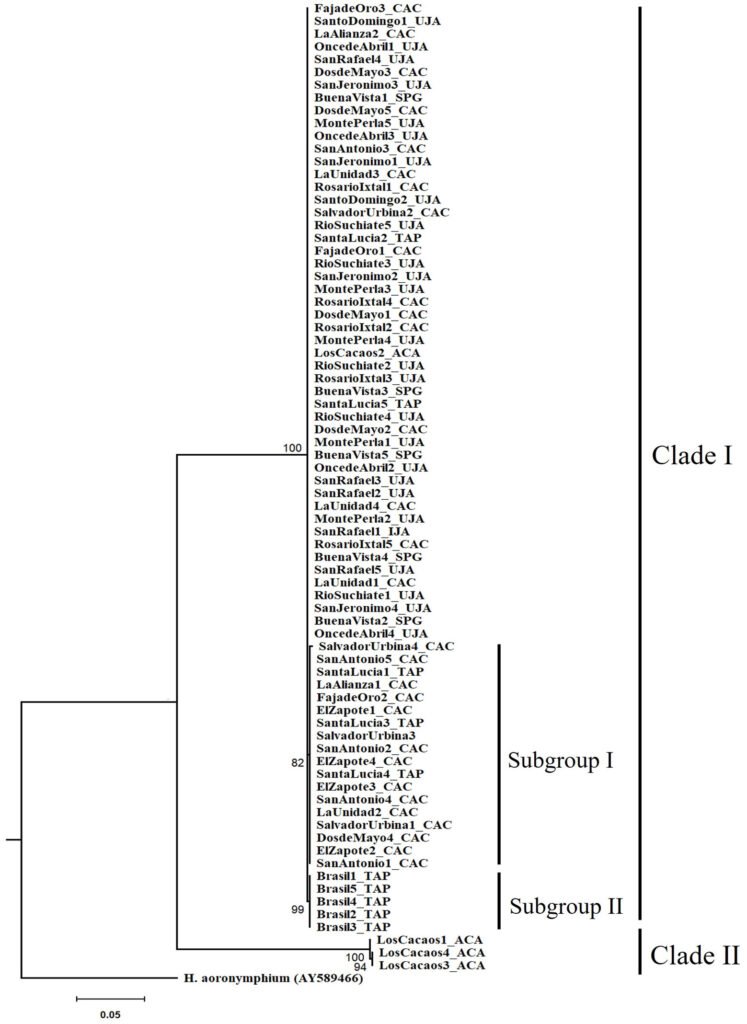
Figure 2. Phylogenetic relationships of Metaparasitylenchus hypothenemi (76 sequences) using maximum likelihood. A sequence of the parasitic nematode Howardula aoronymphium (Tylenchidae: Allantonematidae) was used as outgroup (GenBank AY589466). The scale bar represents the number of expected nucleotide substitutions per site. Municipalities: TAP, Tapachula; UJA, Unión Juárez; CAC, Cacahoatán; ACA, Acacoyagua y SPG, San Pablo Guatemala. The numbers between the nodes in the tree correspond to bootstrap values.
The high genetic differentiation detected in this study could have important implications for the conservation of M. hypothenemi. On one hand, it suggests that populations are undergoing local adaptation processes, which could result in genetically distinct lineages that might be lost if their specific habitats are not protected. The significant correlation between genetic and geographic distances (r = 0.4728, p < 0.0001) obtained through the Mantel test supports the hypothesis of a pattern of isolation by distance. However, the moderate correlation value suggests that, in addition to geographic distance, other factors such as local environmental conditions, coffee plantation management practices, or landscape fragmentation may also contribute to the observed genetic differentiation (Diniz-Filho et al., 2013).

Figure 3. a-b, Distribution of the Metaparasitylenchus hypothenemi haplotypes in the 5 municipalities from the Soconusco region, Chiapas, Mexico and the municipality of San Pablo, Guatemala; c, haplotype network development using PopART v. 1.7. Wefts of the circles represent each haplotype. The size of the circles is proportional to the frequency of the haplotype inside the populations. The numbers on the lines connecting the haplotypes represent the mutational steps. The white rhombus (mv1) represents an extinct haplotype or an unsampled point. LC, Ejido Los Cacaos; LA, La Alianza; EZ, El Zapote; LU, La Unidad; DM, Dos de Mayo; FO, Faja de Oro; RI, Rosario Ixtal, SA, San Antonio: BV, Buena Vista; SU, Salvador Urbina; SL, Santa Lucía; BR, Brasil; SD, Santo Domingo; SR, San Rafael; SJ, San Jerónimo; MP, Monte Perla; RS, Río Suchiate; OA, Once de Abril.
The presence of 2 well-differentiated clades with high phylogenetic support (> 90%) suggests complex evolutionary processes. Clade I, which includes 96% of specimens distributed in the municipalities of Tapachula, Cacahoatán, Unión Juárez, and San Pablo, also showed internal substructures, indicating genetic differentiation within these populations. The formation of these subgroups could be interpreted as a possible response to geographic isolation or ecological barriers that have favored genetic divergence among populations (Wright, 1943). On the other hand, Clade II, composed only of 3 specimens from the LC population, showed a 16.4% phylogenetic separation from Clade I. This differentiation is considerably high and exceeds the intraspecific threshold generally accepted for genetic barcoding (1-2%; Lanteri, 2007). However, studies on nematodes have reported higher genetic divergences between species, as observed in Rhabdochona spp., where genetic differentiation range from 11% to 15% (Caspeta-Mandujano et al., 2021; Santacruz et al., 2020). This suggests that further comparisons with closely related taxa are needed to determine whether this divergence corresponds to an ongoing speciation process or represents intraspecific variation. The existence of 2 well-differentiated clades raises interesting questions about the evolutionary and ecological processes shaping M. hypothenemi populations. One possibility is that these differences reflect a conserved ancestral lineage in certain geographically isolated populations, such as LC. Another possibility is that the exclusive haplotypes are the result of recent local adaptation events or genetic drift in response to landscape fragmentation (Cheptou et al., 2017; Safran & Nosil, 2012). It is also plausible that these differences reflect the presence of a different species or a cryptic species with conserved morphology but genetic divergence. To confirm the occurrence of this genetic divergence process, further genetic studies with greater representation of the isolated population, as well as additional morphological studies, would be necessary. The use of nuclear markers would be particularly useful to determine whether the observed genetic differentiation is restricted to mitochondrial DNA or also occurs at the genome-wide level.
The haplotype analysis supports the hypothesis of genetic differentiation among populations. The high frequency and wide distribution of haplotype H1 found in most of the studied sites, suggest that it may represent the ancestral haplotype and the origin of other derived haplotypes. Nevertheless, the high divergence observed between haplogroups, particularly the separation of H4 by 90 mutational steps, indicates significant genetic structuring and highlights the complexity of inferring ancestral states (Avise, 2000). Therefore, it is not possible to confirm H1 as the ancestral haplotype without additional phylogenetic or coalescent analyses. In contrast, the exclusivity of H3 and H4 in the LC population, as well as H6 in SU and H5 in BR, reflects possible geographic isolation, local adaptation, and genetic drift processes (Forster, 2004).
These patterns are consistent with the theory that M. hypothenemi populations are influenced by geographic barriers that restrict gene flow and promote differentiation among localities. The search for this parasitism in the entire study region is required to determine the possibility of a greater number of M. hypothenemi haplotypes. The greater genetic difference of M. hypothenemi was observed in the population with greater geographical isolation (100 km), suggesting that more haplotypes could be located as more sites with the presence of the parasite are detected. Consequently, a complete genetic description of the M. hypothenemi populations require of the location of new sites with presence of this parasitism, whether in the study region or other coffee-growing regions of Chiapas and Central America.
This study added 6 new geographic records for M. hypothenemi, in addition to those previously known (Pérez et al., 2015). However, we believe that the identification of new sites might be influenced by the result of random interactions caused by the transport of infested fruits with the pest and the adaptation of the parasite to local climatic conditions.
This study provides the first evidence of the American origin of this nematode. Our study also opens possibilities for future research on the genetic and geographic diversity of this species, its relationship with environmental variables. These aspects are essential for designing conservation strategies for this species and its management for the control of H. hampei, an important global pest.
Acknowledgements
Special thanks to Guadalupe Eugenia Zarza Franco for her assistance in interpreting the results, to Fernando E. Vega for the comments on the manuscript, and to Jose Higinio López Urbina for making the maps.
References
Akaike, H. (1974). A new look at the statistical model identification. IEEE Transactions on Automatic Control, 19, 716–723. https://doi.org/10.1109/TAC.1974.1100705
Ali, N., Tavoillot, J., Chapuis, E., & Mateille, T. (2016). Trend to explain the distribution of root–knot nematodes Meloidogyne spp. associated with olive trees in Morocco. Agriculture, Ecosystems and Environment, 225, 22–32. https://doi.org/10.1016/j.agee.2016.03.042
Avise, J. C. (2000). Phylogeography: the history and formation of species (Vol. 447). Cambridge, Massachusetts, London England: Harvard University Press.
Avise, J. C., Arnold, J., Ball, R. M., Bermingham, E., Lamb, T., Neige, J. E., Reeb, C. A., & Saunders, N. C. (1987). Intraspecific phylogeography: the mitochondrial DNA bridge between population genetics and systematics. Annual Review of Ecology and Systematics, 18, 489–522. https://doi.org/10.1146/annurev.es.18.110187.002421
Baker, P. S. (1984). Some aspects of the behaviour of the coffee berry borer in relation to its control in southern Mexico (Coleoptera: Scolytidae). Folia Entomológica Mexicana, 61, 9–24.
Baker, P. S., & Barrera, J. F. (1993). A field study of a population of coffee berry borer, Hypothenemus hampei (Coleoptera; Scolytidae), in Chiapas, Mexico. Tropical Agriculture, 70, 351–355.
Bickford, D., Lohman, D. J., Sodhi, N. S., Ng, P. K., Meier, R., Winker, K., Ingram, K. K., & Das, I. (2007). Cryptic species as a window on diversity and conservation. Trends in Ecology and Evolution, 22, 148–155. https://doi.org/10.1016/j.tree.2006.11.004
Blouin, M. S., Liu, J., & Berry, R. E. (1999). Life cycle variation and the genetic structure of nematode populations. Heredity, 83, 253–259. https://doi.org/10.1038/sj.hdy.6885420
Blouin, M. S., Yowell, C. A., Courtney, C. H., & Dame, J. B. (1995). Host movement and the genetic structure of populations of parasitic nematodes. Genetics, 141, 1007–1014. https://doi.org/10.1093/genetics/141.3.1007
Brown, W. M., George, M., & Wilson, A.C. (1979). Rapid evolution of animal mitochondrial DNA. Proceedings of the National Academy of Sciences, 76, 1967–1971. https://doi.org/10.1073/pnas.76.4.1967
Bush, A. O., Fernández, J. C., Esch, G. W., Seed, J. R., & Ndez, J. C. F. (2001). Parasitism: the diversity and ecology of animal parasites. Cambridge, UK: Cambridge University Press.
Castillo, A., Infante, F., Barrera, J. F., Carta, L., & Vega, F. E. (2002). First field report of a nematode (Tylenchida: Sphaerularioidea) attacking the coffee berry borer, Hypothenemus hampei (Ferrari) (Coleoptera: Scolytidae) in the Americas. Journal of Invertebrate Pathology, 79, 99–202. https://doi.org/10.1016/S00222011(02)00024-1
Castillo, A., Martínez, F., Gómez, J., Cisneros, J., & Vega, F. E. (2019). Sterility of the coffee berry borer, Hypothenemus hampei (Coleoptera: Curculionidae), caused by the nematode Metaparasitylenchus hypothenemi (Tylenchidae: Allantonematidae). Biocontrol Science and Technology, 29, 786–795. https://doi.org/10.1080/09583157.2019.1597336
Caspeta-Mandujano, J. M., Salinas-Ocampo, J. C., Suárez-Rodríguez, R., Martínez-Ramírez, C., & Matamoros, W. A. (2021). Morphological and molecular evidence for a new rhabdochonid species, Rhabdochona (Nematoda: Rhabdochonidae), parasitizing Eugerres mexicanus (Perciformes: Gerreidae), from the Lacantún River in the Biosphere Reserve of Montes Azules, Chiapas, Mexico. Revista Mexicana de Biodiversidad, 92, 01–11. https://doi.org/10.22201/ib.20078706e.2021.92.3266
Cháves-González, L. E., Morales-Calvo, F., Mora, J., Solano-Barquero, A., Verocai, G. G., & Rojas, A. (2022). What lies behind the curtain: Cryptic diversity in helminth parasites of human and veterinary importance. Current Research in Parasitology & Vector-Borne Diseases, 2, 100094. https://doi.org/10.1016/j.crpvbd.2022.100094
Cheptou, P. O., Hargreaves, A. L., Bonte, D., & Jacquemyn, H. (2017). Adaptation to fragmentation: evolutionary dynamics driven by human influences. Philosophical Transactions of the Royal Society B: Biological Sciences, 372, 20160037. https://doi.org/10.1098/rstb.2016.0037
Clarke, B. C. (1979). The evolution of genetic diversity. Proceedings of the Royal Society of London. Series B. Biological Sciences, 205, 453–474. https://doi.org/10.1098/rspb.1979.0079
Diniz-Filho, J. A. F., Soares, T. N., Lima, J. S., Dobrovolski, R., Landeiro, V. L., Telles, M. P. D. C., & Bini, L. M. (2013). Mantel test in population genetics. Genetics and Molecular Biology, 36, 475–485. https://doi.org/10.1590/S141547572013000400002
Equihua, M. A. (1992). Coleópteros Scolytidae atraídos a trampas NTP–80 en el Soconusco, Chiapas, México. Folia Entomológica Mexicana, 84, 55–66.
Excoffier, L., & Lischer, H. E. L. (2010). Arlequin suite ver 3.5: a new series of programs to perform population genetics analyses under Linux and Windows. Molecular Ecology Resources, 10, 564–567. https://doi.org/10.1111/j.
1755-0998.2010.02847.x
Fitza, K. N., Garnas, J. R., Lombardero, M. J., Ayres, M. P., Krivak–Tetley, F. E., Ahumada, R., & Slippers, B. (2019). The global diversity of Deladenus siricidicola in native and non–native populations. Biological Control, 132, 57–65. https://doi.org/10.1016/j.biocontrol.2019.01.014
Fonseca, G., & Netto, S. A. (2006). Shallow sublittoral benthic communities of the Laguna estuarine system, Brazilian Journal of Oceanography, 54, 41–54.
Forster, P. (2004). Ice ages and the mitochondrial DNA chronology of human dispersals: a review. Philosophical Transactions of the Royal Society, 359, 255–264. https://doi.org/10.1098/rstb.2003.1394
Fu, Y. X., & Li, W. H. (1993). Statistical tests of neutrality of mutations. Genetics, 133, 693–709. https://doi.org/10.1093/genetics/133.3.693
Gonçalves, L. T., Bianchi, F. M., Deprá, M., & Calegaro-Marques, C. (2021). Barcoding a can of worms: testing cox1 performance as a DNA barcode of Nematoda. Genome, 64, 705–717. https://doi.org/10.1139/gen-2020-0140
Hajibabaei, M., DeWaard, J. R., Ivanova, N. V., Ratnasingham, S., Dooh, R. T., Kirk, S. L. et al. (2005). Critical factors for assembling a high volume of DNA barcodes. Philosophical Transactions of the Royal Society B: Biological Sciences, 360, 1959–1967. https://doi.org/10.1098/rstb.2005.1727
Hartshorn, J. A., Fisher, J. R., Riggins, J. J., & Stephen, F. M. (2017). Molecular identification of Deladenus proximus Bedding, 1974 (Tylenchida: Neotylenchidae), a parasite of Sirex nigricornis (Hymenoptera: Siricidae). Nematology, 19, 15–20. https://doi.org/10.1163/15685411-00003029
Hebert, P. D., Cywinska, A., Ball, S. L., & Dewaard, J. R. (2003). Biological identifications through DNA barcodes. Proceedings of the Royal Society of London. Series B: Biological Sciences, 270, 313–321. https://doi.org/10.1098/rspb.2002.2218
Ivanova, N. V., Dewaard, J. R., & Hebert, P. D. (2006). An inexpensive, automation-friendly protocol for recovering high-quality DNA. Molecular Ecology Notes, 6, 998–1002. https://doi.org/10.1111/j.1471-8286.2006.01428.x
Klimpel, S., Kleinertz, S., Hanel, R., & Rückert, S. (2007). Genetic variability in Hysterothylacium aduncum, a raphidascarid nematode isolated from sprat (Sprattus sprattus) of different geographical areas of the northeastern Atlantic. Jounal Parasitology Research, 101, 1425–1430. https://doi.org/10.1007/s00436-007-06620
Kumar S., Stecher G., Li M., Knyaz C., & Tamura K. (2018). MEGA X: molecular Evolutionary Genetics Analysis across computing platforms. Molecular Biology Evolution, 35, 1547–1549. https://doi.org/10.1093/molbev/msy096
Lanteri, A. A. (2007). Código de barras del ADN y sus posibles aplicaciones en el campo de la entomología. Revista de la Sociedad Entomológica Argentina, 66, 15–25.
Le Pelley, R. H. (1968). Pests of coffee. London: Longmans, Green and Co.
Leigh, J. W., Bryant, D., & Nakagawa, S. (2015). POPART: full–feature software for haplotype network construction. Methods in Ecology & Evolution, 6, 1110–1116. https://doi.org/10.1111/2041-210X.12410
Mantel, N. (1967). The detection of disease clustering and a generalized regression approach. Cancer Research, 27, 209–220.
Marsjan, P. A., & Oldenbroek, J. K. (2007). Molecular markers, a tool for exploring genetic diversity. In B. Rischkowsky, & D.Pilling (Eds.), The state of the world’s animal genetic resources for food and agriculture. Rome: Food and Agriculture Organization.
Martínez, A. A., Jesús, N. D., & Leasi, F. (2020). DNA Barcoding for delimitation of putative Mexican marine nematodes species. Diversity, 12, 107. https://doi.org/10.3390/d12030107
McGaughran, A., Morgan, K., & Sommer, R. J. (2014). Environmental variables explain genetic structure in a beetle–associated nematode. Plos One, 9, 87317. https://doi.org/10.1371/journal.pone.0087317
Nieberding, C., Libois, R., Douady, C. J., Morand, S., & Michaux, J. R. (2005). Phylogeography of a nematode (Heligmosomoides polygyrus) in the western Palearctic region: persistence of northern cryptic populations during ice ages? Molecular Ecology, 14, 765–779. https://doi.org/10.1111/j.1365294X.2005.02440.x
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., O’hara, R. B., Simpson, G. L., & Wagner, H. (2010). Vegan: community ecology package. R package version 1.17–4. http://CRAN.R–project.org/package=vegan
Pérez, J., Infante, F., Poinar, G. Jr., Castillo, A., & Vega, F. E. (2015). Natural parasitism of Metaparasitylenchus hypothenemi (Tylenchida: Allantonematidae) on the coffee berry borer in Chiapas, Mexico. Biocontrol Science and Technology, 25, 608–612. https://doi.org/10.1080/09583157.2014.991910
Poinar, G. Jr., Vega, F. E., Castillo, A., Chavéz, I. E., & Infante, F. (2004). Metaparasitylenchus hypothenemi Sp. (Nematoda: Allantonematidae), a parasite of the co-ee berry borer, Hypothenemus hampei (Curculionidae: Scolytinae). Journal of Parasitology, 90, 1106–1110. https://doi.org/10.1645/GE-3369
Posada, D. (2008). Model Test: phylogenetic model averaging. Molecular Biology and Evolution, 25, 1253–1256. https://doi.org/10.1093/molbev/msn083
Powers, T., Harris, T., Higgins, R., Mullin, P., & Powers, K. (2018). Discovery and identification of Meloidogyne species using COI DNA barcoding. Journal of Nematology, 50, 399–412. https://doi.org/10.21307/jofnem-2018-029
Prosser, S., Martínez, A. A., & Elías, G. M. (2013). A new set of primers for COI amplification from freshwater microcrustaceans. Molecular Ecology Resources, 13, 151–1155. https://doi.org/10.1111/1755-0998.12132
Rico, G. (2011). The evolution of host-parasite interactions: coevolution, sexual selection and other suggested theories. Revista UDCA Actualidad and Divulgación Científica, 14, 119–130.
R Core Team (2020). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R–project.org/
Rozas, J., & Librado, P. (2009). DnaSP v. 5. A software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 25, 1451–1452. https://doi.org/10.1093/bioinformatics/btp187
Saeb, A. T., & David, S. K. (2014). Comparative estimation of genetic diversity in population studies using molecular sampling and traditional sampling methods. Biomedical Informatics, 10, 347–352. https://doi.org/10.6026/9732063
0010347
Safran, R. J., & Nosil, P. (2012). Speciation: the origin of new species. Nature Education Knowledge, 3, 17.
Santacruz, A., Ornelas-García, C. P., & De León, G. P. P. (2020). Diversity of Rhabdochona mexicana (Nematoda: Rhabdochonidae), a parasite of Astyanax spp. (Characidae) in Mexico and Guatemala, using mitochondrial and nuclear genes, with the description of a new species. Journal of Helminthology, 94, 1–11. https://doi.org/10.1017/S0022149X19000014
Simota-Ruiz, M., Castillo, A., Cisneros-Hernández, J., & Carmona-Castro, O. (2024). Predicted distribution of Metaparasitylenchus hypothenemi (Tylenchida: Allantonematidae), parasite of the coffee berry borer. Journal of Nematology, 56, 1–10. https://doi.org/10.2478/jofnem-2024-0031
Schmidt, D., & Pool, J. (2002). The effect of population history on the distribution of the Tajima’s D statistic. Population English Edition, 1, 1–8.
Stamatakis A. (2006). RAxML-VI-HPC: maximum likelihood–based phylogenetic analyses with thousands of taxa and mixed models, Bioinformatics, 22, 2688–2690. https://doi.org/10.1093/bioinformatics/btl446
Stewart, J. B., & Larsson, N. G. (2014). Keeping mtDNA in shape between generations. Plos Genetics, 10, 1–7. https://doi.org/10.1371/journal.pgen.1004670
Stock, S. P. (2009). Molecular approaches and the taxonomy of insect–parasitic and pathogenic nematodes. In S. P. Stock, J. Vandenberg, I. Glazer, & N. Boemare (Eds.), Insect pathogens: molecular approaches and techniques (pp. 71–100). Wallingford UK: CABI. https://doi.org/10.1079/9781845934781.0071
Tajima, F. (1989). Statistical method for testing the neutral mutation hypothesis by DNA polymorphism. Genetics, 123, 585–595. https://doi.org/10.1093/genetics/123.3.585
Varaprasad, K. S., Balasubramanian, S., Diwakar, B. J., & Ramarao, C. V. (1994). First report of an entomogenous nematode, Panagrolaimus sp. from coffee berry borer, Hypothenemus hampei (Ferrari) from Karnataka, India. Plant Protection Bulletin (Faridabad), 46, 34–35.
Wang, S. Q. (2020). Genetic diversity and population structure of the endangered species Paeonia decomposita endemic to China and implications for its conservation. BMC Plant Biology, 20, 1–14. https://doi.org/10.1186/s12870-020-02682-z
Wright, S. (1943). Isolation by distance. Genetics, 28, 114–138. https://doi.org/10.1093/genetics/28.2.114

Ontogenetic allometry and non-size-dependent variation of head shape in the Mexican Dusky Rattlesnake
Aldo Gómez-Benitez a, b, *, Erika Adriana Reyes-Velázquez b, c, Justin Rheubert d, Oswaldo Hernández-Gallegos c
a Universidad Autónoma Metropolitana, Unidad Lerma, División de Ciencias Biológicas y de la Salud, Departamento de Ciencias Ambientales, Av. de las Garzas No. 10, El Panteón, 52005 Lerma, Estado de México, Mexico
b Red de Investigación y Divulgación de Anfibios y Reptiles MX, Guadalupe Victoria No. 33, 56800 Ozumba de Alzate, Estado de México, México
c Universidad Autónoma del Estado de México, Facultad de Ciencias, Laboratorio de Herpetología, Instituto Literario No. 100, Colonia Centro, 50000 Toluca, Estado de México, Mexico
d University of Findlay, Department of Biology, 1000 N. Main St., Findlay, Ohio, 45840 USA
*Corresponding author: gobeal940814@gmail.com (A. Gómez-Benitez)
Abstract
The evolutionary role of ontogenetic allometry is a topic of debate, as it can act as an evolutionary constraint or as a mechanism for functional optimization. We assessed the allometric changes in head shape of Crotalus triseriatus (Wagler, 1830) to understand how ontogenetic shifts in head morphology adapts to ecological demands as it grows. The sampling was conducted in Toluca de Lerdo, Estado de México, where dorsal-view photographs of the head were taken for the 22 collected specimens. We digitized 22 landmarks that represent the C. triseriatus head shape. We calculated the common allometric component and the residual shape components (RSC). Results showed statistically significant positive allometry, considering shape as a function of size, in the head shape of C. triseriatus. The main changes include a contraction along the sagittal plane, primarily in the snout region, and a marked expansion in the posterior part of the head. Size being the main source of variation appears to be a common pattern in snakes, though the functional source of the variation may relate to the natural history aspects of each species. In C. triseriatus, these changes seem to be associated with predatory efficiency.
Keywords: Crotalus triseriatus; Common allometric component; Geometric morphometrics; Natural history; Predatory efficiency; RSC
Alometría ontogenética y variación no dependiente del tamaño en la forma de la cabeza de la Serpiente de Cascabel Transvolcánica
Resumen
El papel evolutivo de la alometría ontogenética es un tema debatido, pues puede actuar como una restricción evolutiva o como un mecanismo de optimización funcional. Evaluamos los cambios alométricos en la forma de la cabeza de Crotalus triseriatus (Wagler, 1830) para entender cómo los cambios ontogenéticos se ajustan a las demandas ecológicas a lo largo del crecimiento. El muestreo se llevó a cabo en Toluca de Lerdo, Estado de México, se tomaron fotografías dorsales de la cabeza de los 22 especímenes recolectados. Digitalizamos 22 puntos de referencia que representan la forma de la cabeza de C. triseriatus. Calculamos el componente alométrico común y los componentes residuales de la forma (CRF). Los resultados mostraron una alometría positiva estadísticamente significativa, considerando la forma como función del tamaño, en la cabeza de C. triseriatus. Los principales cambios incluyen una contracción a lo largo del plano sagital, en la región del hocico y una expansión marcada en la parte posterior de la cabeza. La talla como principal fuente de variación es un patrón común en serpientes, aunque su origen funcional puede depender de la historia natural de cada especie. En C. triseriatus, estos cambios están relacionados con la eficiencia depredadora.
Palabras clave: Crotalus triseriatus; Componente alométrico común; Morfometría geométrica; Historia natural; Eficiencia depredadora; CRF
Introduction
Allometry refers to the study of size and its biological consequences in morphology and function, typically focusing on how the proportions of body structures relate to each other at specific determined time or throughout development (Gould, 1966; Pretzsch, 2009). Modern studies of allometry are based on Huxley’s (1932) research, where he introduced the allometric equation, the concept of relative growth —different body parts grow at different rates— and hypothesized its evolutionary significance. Allometry is classified into 3 types: 1) static allometry which describes the relationship between body parts within a population at a given developmental stage, 2) evolutionary allometry which examines these relationships across populations or species, and 3) ontogenetic allometry which investigates changes in body proportions during growth, providing key insights into developmental processes (Pélabon et al., 2014). The evolutionary significance of allometry is debated, as it can act both as an evolutionary constraint, by which differential growth relationships restrict the range of phenotypic variation available for selection, and as a mechanism for functional optimization (Le Verger et al., 2023; Voje et al., 2022). While the allometric relationships observed during organisms’ development can act as evolutionary constraints, guiding species along fixed developmental trajectories (Voje et al., 2022), these same relationships are also shaped by natural selection to optimize functional traits, highlighting an adaptive dimension of allometry (Le Verger et al., 2023; Strelin & Diggle, 2022).
In reptiles, allometric patterns vary widely. In the fossorial species Cynisca leucura (Amphisbaenia), allometry acts as an evolutionary constraint, limiting cranial morphology to maintain proportions suitable for head-first digging (Hipsley et al., 2016). Sexual selection also influences allometry, as seen in Anolis species, where divergent dewlap growth trajectories are linked to reproductive pressures, though all exhibit positive allometry (Stroud et al., 2023). Similarly, in snakes of the genus Malacophagus, sexual dimorphism is reflected in distinct allometric trajectories between males and females (Dos Santos et al., 2022). In crocodilians, dietary demands drive allometry, enabling the consumption of larger prey as the animal grows (Balaguera-Reina et al., 2024; Dodson, 1975). These examples demonstrate that reptile allometry exhibits diverse patterns, making this group ideal for studying allometry. A robust method to assess the relationship between shape and size is the calculation of the Common Allometric Component (CAC), as described by Mitteroecker et al. (2004). The CAC captures allometric variation by summarizing how shape changes as a function of size across all specimens. This metric has been previously applied in reptile studies to evaluate evolutionary shifts in squamate cranial morphology during development and its relationship with whole-head integration (Hipsley & Müller, 2017; Ollonen et al., 2024), proving to be an excellent tool for studying allometry.
We selected the Mexican Dusky Rattlesnake (Crotalus triseriatus) as a study model because, as a fully terrestrial predator with clearly defined foraging and dietary habits, it offers a well‑characterized system to link ontogenetic shape changes with ecological and biotic interactions. Crotalus triseriatus (Wagler, 1830), is a medium-sized venomous snake endemic to Mexico (Fig. 1A), found in the Trans-Mexican Volcanic Belt across the states of Veracruz, Puebla, Tlaxcala, Morelos, Estado de México, and Michoacán, at elevations between 1,905 and 4,572 m asl (Campbell & Lamar, 2004; Castillo-Juárez et al., 2021). Their primary habitat is coniferous forests and oak forest (primarily pine-oak forests), grasslands, montane cloud forests, and agroecosystems (Campbell & Lamar, 2004; Castillo-Juárez et al., 2021; Gómez-Benitez, 2023). This species is diurnal to crepuscular, preying on lizards, rodents, and salamanders; additionally, C. triseriatus exhibits a distinct ontogenetic dietary shift, transitioning from ectothermic prey to mammals as the snakes grow (Mociño-Deloya et al., 2014; Ramírez-Bautista et al., 2009).
Figure 1. A, Mexican Dusky Rattlesnake at the study site in Cerrillo Piedras Blancas, Toluca de Lerdo, Estado de México, Mexico; B, location of the 22 landmarks digitized.
In the present study, we analyzed the allometric changes in head shape of C. triseriatus using geometric morphometrics, a set of multivariate statistical methods that quantify organismal shape by analyzing the Cartesian coordinates of homologous anatomical landmarks, to characterize the ontogenetic variation in head morphology of a species known for exhibiting ontogenetic shifts in its ecological interactions. Understanding these morphological changes provides valuable insights into how this species adapts to ecological demands as it grows and contributes to a greater understanding of allometry in an evolutionary sense.
Materials and methods
We conducted fieldwork in an agroecosystem located in El Cerrillo, Piedras Blancas, within the municipality of Toluca de Lerdo, Estado de México, Mexico. The study area is characterized by an arboreal stratum primarily composed of Salix babilonica, Cupressus sp. and Casuarina equisetifolia, the herbaceous stratum contains over 118 species of angiosperms (Álvarez-Lopeztello et al., 2016). The study site is disturbed due to agricultural practices (many of them unregulated), livestock, constant human presence and intentional killing of snakes. We searched for rattlesnakes in various microhabitats, including under rocks, inside and alongside a cement irrigation canal, and under polypropylene plastic sheets previously used as waterproofing membranes in agricultural activities at the site. Field researchers wore protective snake gaiters and bait gloves, and rattlesnakes were handled using herpetological hooks. The research team has a detailed snakebite emergency protocol, which includes always carrying sufficient vials of antivenom to ensure support dose administration if required. We took dorsal photographs of the collected individuals heads using a Nikon D3500 camera (settings: 1/200 shutter speed, f/22 aperture, ISO 100-400) equipped with a Nikkor 70-300 mm lens at its maximum focal length. To avoid the limitation of the lens minimum focusing distance, we used macro extension tubes. The camera was mounted on a tripod and positioned 60 cm above the specimens. Additionally, the photographs were illuminated using the camera built-in flash to ensure consistent lighting. Only one dorsal photograph of the head was taken per individual for geometric morphometric analysis. Snakes were handled following standard safety protocols: individuals were manipulated using herpetological hooks and gently positioned over a millimetric sheet, ensuring that the head lay flat and straight. When necessary, restraining tubes were used to guide the head into position. All photographs were taken in the field; specimens were not transported to the laboratory. Instead, to guarantee photograph quality, individuals were briefly placed in cloth bags and moved to a flat surface present at the study site. All individuals were sexed through hemipenes eversion, measured in SVL and released where they were captured.
Using TPSDig 2.31, we digitized 22 anatomical landmarks on the dorsal view of the head of C. triseriatus (Fig. 1B, Table 1), in duplicate. Landmarks were placed at intersections of external cranial scales to avoid invasive procedures, as all specimens were alive. These points were selected based on their anatomical relevance and their ability to capture overall head shape, with particular emphasis on regions of functional and evolutionary interest such as the snout, the orbital area, and the venom delivery system. In addition, the chosen landmarks enable the analysis of head proportions, including width and length. Because our aim was to study ontogenetic allometry, individuals were analyzed jointly regardless of age class, in order to capture variation in shape throughout development. A Procrustes superimposition was then performed in MorphoJ (Klingenberg, 2011) to remove differences in size, position, and orientation according with the methodology proposed by Dryden and Mardia (1998). The data were projected onto the tangent space of the shape space, enabling linear analysis of shape variation (Dryden & Mardia, 1998). This method retains centroid size information for subsequent analyses, such as allometry studies.
Table 1
Position of the 22 landmarks selected to represent the head shape of Crotalus triseriatus (see Fig. 1B).
| Landmarks | Description |
| 1 | Between the internasal scales, posterior to rostral |
| 2, 3 | Intersection between the first nasal and internasal scales |
| 4, 7 | Intersection between the second nasal, intercanthal and prefrontal scales |
| 5, 6 | Intersection between internasal, intercanthal and prefrontal scales |
| 8, 9 | Intersection between intercanthal, prefrontal and the first row of frontal scales |
| 10, 13 | Distal intersection between prefrontal and supraocular scales |
| 11, 12 | Intersection between prefrontal, supraocular and second row of frontal scales |
| 14, 15 | Anterior intersection of supraocular and intersupraocular scales |
| 16, 17 | Intersection between the supraocular scales and the first row of the scales in the crown of the head |
| 18, 19 | Posterior part of the most distal fourth row of the scales in the crown of the head |
| 20, 21 | Posterior part of the most distal eighth row of the scales in the crown of the head |
| 22 | Intersection between both intercanthal and first row of frontal scales |
After Procrustes superimposition, we conducted a multiple linear regression in MorphoJ with the Cartesian coordinates of the 22 landmarks (44 dependent variables: X and Y for each landmark) as the response and the log‑transformed centroid size as the predictor. This approach allowed us to quantify how head shape (landmark coordinates) changes in relation to overall head size (log‑transformed centroid size). To assess the statistical power of our regression analysis, we conducted a power analysis using the pwr package (Champely, 2020) in R (R Core Team, 2021). Results were considered significative at an α = 0.05.
To assess the changes related to size in C. triseriatus, and the non-size-dependent variation, we employed the CAC and the residual shape components (RSC). The CAC was calculated conducting a linear regression of shape as a function of size (Mitteroecker et al., 2004). The RSC represents the variation in shape that is not attributable to size. The residuals obtained during the linear regression were analyzed using Principal Component Analysis (PCA) to extract RSC (Mitteroecker et al., 2004). To correctly display the changes detected with the CAC and RSC, we calculated the Jacobian expansion factor using PAST4 version 4.17 (Hammer et al., 2001). This calculation involves deriving a Jacobian matrix from a thin-plate spline deformation (or warp), which quantifies local shape changes by relating the derivatives of the deformed configuration to a consensus configuration, or from smaller to bigger individuals in the case of CAC. The expansion factor, determined as the determinant of the Jacobian matrix, reflects the local area distortion resulting from the deformation, providing insight into the degree of expansion or contraction across regions of the shape.
Finally, we plotted the CAC against log-transformed centroid size and against the RSC. We also calculated the standard deviation to understand the patterns of variation related to allometry and non-size-dependent factors. These exploratory analyses allow us to visualize the relationships between size and shape variations, and how non-allometric factors contribute to morphological changes in C. triseriatus.
Results
We collected a total of 22 individuals, including 13 juveniles and 9 adults, based on SVL, including 7 females and 15 males. The multiple linear regression results show a significant relationship between head shape and log centroid size (R2 = 0.4992, p = 0.0122), indicating a positive allometry (Fig. 2A). Our statistical power analysis revealed that the regression model had a power of 0.993, indicating a high resolution of our model with a 99.3% probability of detecting a significant relationship between head shape and log centroid size in C. triseriatus. In other words, there is a very low probability (0.7%) of committing a Type II error (Whitlock & Schluter, 2008).
The CAC analysis (Fig. 2A) revealed the following changes in the head shape of C. triseriatus: a contraction between the internasal scales and the rostral, resulting in a more square-shaped snout in adults than in juveniles (landmarks 1-3); a contraction of the prefrontal scales over the intercanthals, reducing the proportion of space they occupy (landmarks 8, 9, and 22); a slight expansion on both sides of the intra supraocular scales (landmarks 8, 11, and 14 on the right side, and landmarks 9, 12, and 15 on the left side); another significant contraction in the scales at the crown of the head, right in the center at the level of the back of the supraocular scales (landmarks 16 and 17); and finally, the most notable expansion in the anterior sector of the head (landmarks 18-21) (Fig. 2A).
To interpret the variation not related to size in the head shape of C. triseriatus, we used the first 3 RSCs, as these explained 66.30% of the variation (RSC1 = 37.44%, RSC2 = 15.73%, RSC3 = 13.13%). The principal sources of variation in RSC1 are an expansion of the prefrontal scales to the external edges (landmarks 10-13), a significant contraction between the first and fourth row of scales on the crown of the head (landmarks 16-19), and the most important source of variation in this component was an expansion in the posterior sector of the head (landmarks 20 and 21) (Fig. 3), similar to the pattern observed in the CAC (Fig. 2B). In RSC2, 3 important expansions occur throughout the head of C. triseriatus: one in the intercanthal scales (landmarks 5, 6, 8, 9, and 22), a second in the supraocular scales (landmarks 10, 11, 14, and 16 on the right side and landmarks 12, 13, 15, and 17 on the left side of the head), and the last one in the middle of the head in the scales of the crown (Fig. 3). Lastly, in RSC3, an important expansion occurs at the center of the snout (landmarks 1-9), delimited on both sides by a contraction in the prefrontal scales (landmarks 4, 11, and 10 on the right side and landmarks 7, 12, and 13 on the left side); another important expansion occurs in the first 4 rows of the scales on the crown of the head (landmarks 16-19), followed posteriorly by a contraction (landmarks 20 and 21) (Fig. 3).
The standard deviations of the CAC (σ = 0.0288) and the first 3 RSCs (RSC1 σ = 0.0356, RSC2 σ = 0.0231, RSC3 σ = 0.0211) indicate that there are sources of variation in the head shape of C. triseriatus that are significant just as the size-related variation, particularly those contained in RSC1 (Fig. 3).
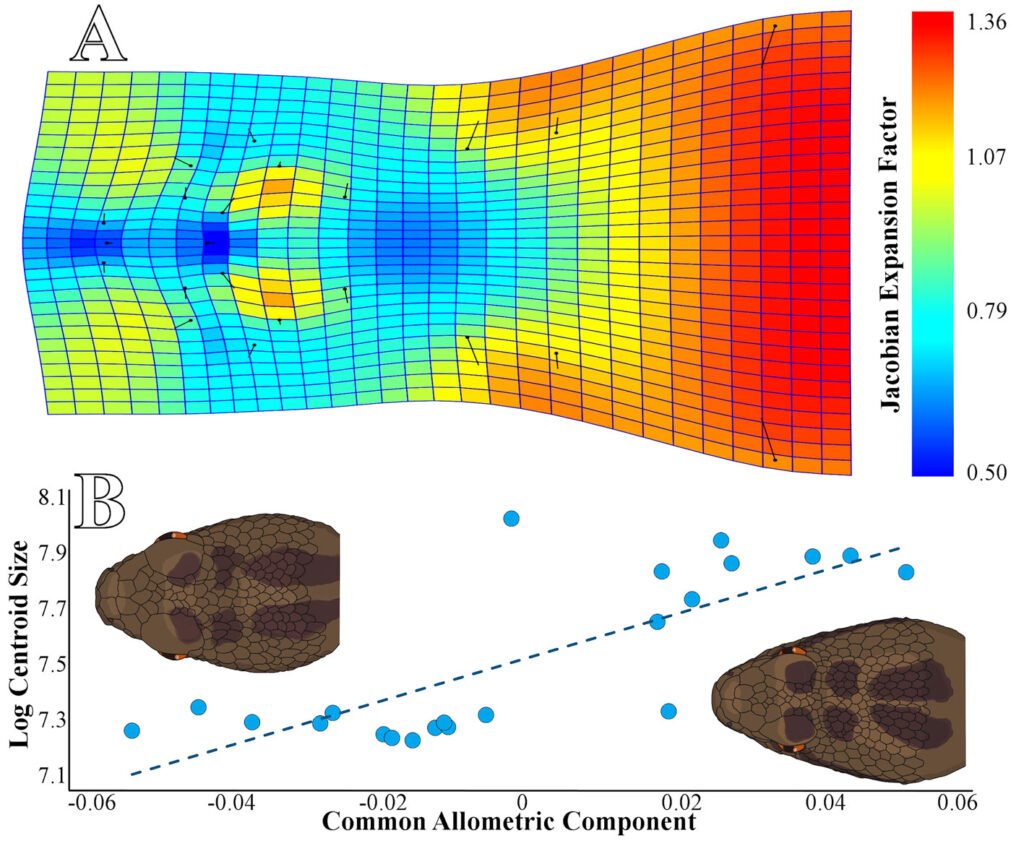
Figure 2. A, thin plate spline graph and Jacobian expansion factor explaining the allometric changes in the head shape of Crotalus triseriatus; B, Common allometric pattern in the head shape of Crotalus triseriatus and a graphic scheme of the main changes between young individuals and adults.
Discussion
According to our results, Crotalus triseriatus exhibits positive allometry in head shape, with important ontogenetic changes occurring throughout the entire head. Our analysis revealed that the CAC explains approximately 49.92% of the variation in head shape of C. triseriatus, indicating that size is a major source of variation. This appears to be a common pattern in snakes (Abegg et al., 2020; Lucchini et al., 2020; Murta-Fonseca & Fernandes, 2016), though the specific ways in which the head shape varies can differ within species. In C. triseriatus, the primary expansions occur in the posterior region of the head, a pattern consistent with other viperids (Lucchini et al., 2020), while contractions are observed mainly along the sagittal plane. In contrast, species from other families display more prominent snout expansions and modifications in the mid anterior-posterior section of the head (Abegg et al., 2020; Murta-Fonseca & Fernandes, 2016). These disparities may be attributed to the natural history of different species, as allometric trajectories are shaped by ecological factors such as diet or microhabitat preferences (Kaliontzopoulou et al., 2012; Simonsen et al., 2017). In snakes for which allometry in head shape has been analyzed through geometric morphometrics, it has been shown that semi-fossorial and aquatic habits primarily drive changes in the mid-section of the head (Abegg et al., 2020; Murta-Fonseca & Fernandes, 2016). In contrast C. triseriatus, a completely terrestrial species (Campbell & Lamar, 2004), shows more pronounced changes in the posterior part of the head. This suggests that environmental factors may impact head shape modifications in species adapted to different habitats, concretely in C. triseriatus, recent work on multiple populations has confirmed a significant environment–head shape association within this species (Caballero‑Viñas et al., 2025).
In C. triseriatus, the allometric changes observed in the snout may also be related to ontogenetic dietary shifts. Neonates primarily consume ectothermic prey, such as amphibians and lizards, while adults predominantly prey on mammals (Mociño-Deloya et al., 2014). Ontogenetic cranial changes associated with diet are well-documented in snakes, as these modifications are necessary to develop a wider gape and enhanced jaw musculature for prey capture (Patterson et al., 2021; Vincent et al., 2007). Such changes highlight the importance of head shape adaptations throughout an organism life to optimize survival. The greater expansion in the posterior part of the head likely reflects the development of venom glands and the muscularis compressor glandulae, which in adults may occupy a proportionally larger area of the head. Further studies conducting a direct anatomical assessment of allometric changes in the venom delivery system though dissection, are required to confirm that relationship. This anatomical adaptation likely enhances predatory efficiency, allowing adults to capture and subdue larger prey (such as mammals) as they grow. The hypothesis that ontogenetic dietary shifts or broader predatory requirements are the primary drivers of allometric variation in C. triseriatus is further supported by evidence that in Crotalus, allometry in head shape is linked to the kinematics of predatory strikes, specifically, maximum strike velocity (positive allometry) and the proportion of the body involved in the strike, as well as timing variables (negative allometry), change as rattlesnakes grow (LaDuc, 2003).
Figure 3. Thin plate spline graph and Jacobian expansion factor explaining the 3 first residual shape components of the head in Crotalus triseriatus and graphs of CAC vs. RSC.
The residual shape components in C. triseriatus head shape, which account for the remaining 50.07% variation that is not explained by size, highlights significant shape differences unrelated to size. This suggests that while size is a key factor, other important sources of variation influence head morphology. In amphibians and reptiles, head shape variation has been linked to factors such as phylogenetic history, habitat use (Openshaw & Keogh, 2014), sexual dimorphism (Alarcón-Ríos et al., 2017), and dietary or ecological interactions (Alarcón-Ríos et al., 2017; Segall et al., 2020; Urošević et al., 2014). This raises a fundamental question: if allometry explains a significant portion (half) of head shape variation in C. triseriatus and this is driven by predatory requirements, is it not ultimately ecology that explains this variation more than size by itself? In other words, do ecological interactions adapt to changes in size, or does size adapt to ecological niches available? The answer lies in a bidirectional relationship. Ecological interactions can shape allometric trajectories (Maestri et al., 2015); that is, certain traits may adapt to available resources, predation pressures, or competition as an organism grows, thus growth itself is limited by ecological constraints. However, allometry often acts as an evolutionary constraint, limiting morphological variation by imposing functional requirements (Huxley, 1932). In C. triseriatus, the strong correlation between size and head shape likely reflects functional limitations, particularly regarding prey capture and venom delivery. These evolutionary constraints imply that although head shape evolves in response to ecological pressures, these changes are not entirely free to vary but are shaped by underlying allometric relationships that ensure functionality. Further research into the “what came first?” question is necessary to better understand the role of allometry as an evolutionary constraint and the extent to which ecology constrains allometry.
The allometric changes in the head shape of C. triseriatus demonstrated to be a major source of variation in this species, highlighting the importance of allometry as an evolutionary constraint. In a predator such as rattlesnakes, predatory efficiency is closely linked to morphological adaptations, particularly in the head and jaw regions. Our findings suggest that ontogenetic changes in head shape are not merely a consequence of growth but instead reflect functional adjustments necessary for successful predation. As individuals grow, their ability to capture and process larger prey increases, which likely enhanced survival, just as has been stated in crocodilians (Barrios-Quiroz et al., 2012; Falcón-Espitia & Jerez, 2021). Moreover, the observed posterior expansion of the head in C. triseriatus, coupled with the contractions along the sagittal plane, could underscore the specialized adaptations linked to venom delivery and jaw musculature development. These morphological adjustments not only facilitate the consumption of larger mammalian prey but may also influence predator-prey dynamics and human-snake interactions by modulating strike performance and venom efficiency. Understanding these allometric trajectories is therefore crucial for both ecologically informed management of rattlesnake populations and for mitigating human-wildlife conflict.
Acknowledgements
This study was conducted under the Semarnat permit SGPA/DGVS/10352/21. We are also grateful to Conahcyt for the doctoral scholarship awarded to AGB. Finally, we thank the students of the Herpetology Laboratory for their support during fieldwork.
References
Abegg, A., Passos, P., Mario-da-Rosa, C., Azevedo, W., Malta-Borges, L., & Bubadué, J. (2020). Sexual dimorphism, ontogeny and static allometry of a semi-fossorial snake (genus Atractus). Zoologischer Anzeiger, 287, 95–104. https://doi.org/10.1016/j.jcz.2020.05.008
Alarcón-Ríos, L., Velo-Antón, G., & Kaliontzopoulou, A. (2017). A non-invasive geometric morphometrics method for exploring variation in dorsal head shape in urodeles: Sexual dimorphism and geographic variation in Salamandra salamandra. Journal of Morphology, 278, 475–485. https://doi.org/10.1002/jmor.20643
Álvarez-Lopeztello, J., Rivas-Manzano, I. V., Aguilera-Gómez, L. I., & González-Ledesma, M. (2016). Diversity and structure of a grassland at El Cerrillo, Piedras Blancas, Estado de México, Mexico. Revista Mexicana de Biodiversidad, 87, 980–989. https://doi.org/10.1016/j.rmb.2016.06.006
Balaguera-Reina, S. A., Mason, B. M., Brandt, L. A., Hernández, N. D., Daykin, B. L., McCaffrey, K. L. et al. (2024). Ecological implications of allometric relationships in American alligators (Alligator mississippiensis). Scientific Reports, 14, 6140. https://doi.org/10.1038/s41598-024-56798-5
Barrios-Quiroz, G., Casas-Andreu, G., & Escobedo-Galván, A. H. (2012). Sexual Size dimorphism and allometric growth of Morelet’s crocodiles in captivity. Zoological Science, 29, 198–203. https://doi.org/10.2108/zsj.29.198
Caballero-Viñas, C., Arenas, S., Jaramillo-Alba, J. L., Pérez-Mendoza, H. A., Manjarrez, J., Domínguez-Vega, H. et al. (2025). Mexican dusky rattlesnakes (Crotalus triseriatus) on Mexican sky islands: morphometric variation and operative temperature relationships with local environmental variables. Biologia, 80, 1389–1406. https://doi.org/10.1007/s11756-025-01905-8
Campbell, J. A., & Lamar, W. W. (2004). The venomous reptiles of the western hemisphere. Ithaca, New York: Comstock Publishing Associates.
Castillo-Juárez, J. L., Vásquez-Cruz, V., Taval-Velázquez, L. P., Avalos-Vela, R., & Lara-Hernández, F. A. (2021). Notas de distribución e historia natural de Crotalus triseriatus (Viperidae) en la región de las altas montañas, Veracruz y en el estado de Puebla. Revista Latinoamericana de Herpetología, 4, 133–139. https://doi.org/10.22201/fc.25942158e.2021.02.213
Champely, S. (2020). pwr: Basic Functions for Power Analysis. Université de Lyon, Lyon. Retrieved 13 may, 2025 from: https://cran.r-project.org/web/packages/pwr/index.html
Dodson, P. (1975). Functional and ecological significance of relative growth in Alligator. Journal of Zoology, 175, 315–355. https://doi.org/10.1111/j.1469-7998.1975.tb01405.x
Dos Santos, M. M., Klaczko J., & da Costa-Prudente, A. L. (2022). Sexual dimorphism and allometry in Malacophagus snakes (Dipsadidae: Dipsadinae). Zoology (Jena), 153, 126026. https://doi.org/10.1016/j.zool.2022.126026
Dryden, I. L., & Mardia, K. V. (1998). Statistical shape analysis. Chichester, England: Wiley.
Falcón-Espitia, N., & Jerez, A. (2021). The skull of Caiman crocodilus fuscus: Allometric andontogenetic shifts. Acta Biológica Colombiano, 27, 458–463. https://doi.org/10.15446/abc.v27n3.90810
Gómez-Benitez, A. (2023). Inestabilidad en el desarrollo y canalización de una comunidad de reptiles en un hábitat perturbado (Ph.D. Thesis). Facultad de Ciencias, Universidad Autónoma del Estado de México. Estado de México, Mexico.
Gould, S. J. (1966). Allometry and size in ontogeny and phylogeny. Biological Review, 41, 587–640. https://doi.org/10.1111/j.1469-185X.1966.tb01624.x
Hammer, Ø., Harper, D. A. T., & Paul, D. R. (2001). Past: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4, 1–9.
Hipsley, C. A., & Müller, J. (2017). Developmental dynamics of ecomorphological convergence in a transcontinental lizard radiation. Evolution, 71, 936–948. https://doi.org/10.1111/evo.13186
Hipsley, C. A., Rentinck, M. N., Rödel, M. O., & Müller, J. (2016). Ontogenetic allometry constrains cranial shape of the head-first burrowing worm lizard Cynisca leucura (Squamata: Amphisbaenidae). Journal of Morphology, 277, 1159–1167. https://doi.org/10.1002/jmor.20564
Huxley, J. S. S. (1932). Problems of relative growth. Baltimore, Maryland: Johns Hopkins University Press.
Kaliontzopoulou, A., Adams, D. C., van der Meijden, A., Perera, A., & Carretero, M. A. (2012). Relationships between head morphology, bite performance and ecology in two species of Podarcis wall lizards. Evolutionary Ecology, 26, 825–845. https://doi.org/10.1007/s10682-011-9538-y
Klingenberg, C. P. (2011). MorphoJ: an integrated software package for geometric morphometrics. Molecular Ecology Resources, 11, 353–357. https://doi.org/10.1111/j.1755-0998.2010.02924.x
LaDuc, T. J. (2003). Allometry and size evolution in the rattlesnake, with emphasis on predatory strike performance (Ph.D. Thesis). The University of Texas at Austin, USA.
Le Verger, K., Hautier, L., Gerber, S., Bardin, J. P., Delsuc, F., González Ruiz, L. R. et al. (2023). Pervasive cranial allometry at different anatomical scales and variational levels in extant armadillos. Evolution, 78, 423–441. https://doi.org/10.1093/evolut/qpad214
Lucchini, N., Kaliontzopoulou, A., Val, G., & Martínez-Freiría, F. (2020). Sources of intraspecific morphological variation in Vipera seoanei: Allometry, sex, and colour phenotype. Amphibia-Reptilia, 42, 1–16. https://doi.org/10.
1163/15685381-bja10024
Maestri, R., Fornel, R., Freitas, T. R. O., & Marinho, J. R. (2015). Ontogenetic allometry in the foot size of Oligoryzomys flavescens (Waterhouse, 1837) (Rodentia, Sigmodontinae). Brazilian Journal of Biology, 75, 435–441. https://doi.org/10.1590/1519-6984.16613
Mitteroecker, P., Gunz, P., Bernhard, M., Schaefer, K., & Bookstein, F. L. (2004). Comparison of cranial ontogenetic trajectories among great apes and humans. Journal of Human Evolution, 46, 679–698. https://doi.org/10.1016/j.jhevol.2004.03.006
Mociño-Deloya, E., Setser, K., & Pérez-Ramos, E. (2014). Observations on the diet of Crotalus triseriatus (Mexican Dusky Rattlesnake). Revista Mexicana de Biodiversidad, 85, 1289–1291. https://doi.org/10.7550/rmb.43908
Murta-Fonseca, R., & Fernandes, D. (2016). The skull of Hydrodynastes gigas (Duméril, Bibron & Duméril, 1854) (Serpentes: Dipsadidae) as a model of snake ontogenetic allometry inferred by geometric morphometrics. Zoomorphology, 135, 233–241. https://doi.org/10.1007/s00435-015-0297-0
Ollonen, J., Khannoon, E. R., Macrì, S., Vergilov, V., Kuurne, J., Saarikivi, J. et al. (2024). Dynamic evolutionary interplay between ontogenetic skull patterning and whole-head integration. Nature Ecology & Evolution, 8, 536–551. https://doi.org/10.1038/s41559-023-02295-3
Openshaw, G., & Keogh, J. (2014). Head shape evolution in monitor lizards (Varanus): Interactions between extreme size disparity, phylogeny and ecology. Journal of Evolutionary Biology, 27, 363–373. https://doi.org/10.1111/jeb.12299
Patterson, M. B., Wolfe, A. K., Fleming, P., Bateman, P., Martin, M. L., Sherratt, E. et al. (2021). Ontogenetic shift in diet of a large elapid snake is facilitated by allometric change in skull morphology. Evolutionary Ecology, 36, 489–509. https://doi.org/10.1007/s10682-022-10164-x
Pélabon, C., Firmat, C., Bolstad, G., Voje, K., Houle, D., Cassara, J. A. et al. (2014). Evolution of morphological allometry. Annals of the New York Academy of Sciences, 1320, 58–75. https://doi.org/10.1007/10.1111/nyas.12470
Pretzsch, H. (2009). Re-evaluation of allometry: State-of-the-art and perspective regarding individuals and stands of woody plants. In U. Lüttge, W. Beyschlag, B. Büdel, & D. Francis (Eds.), Progress in botany (pp. 339–369). Heidelberg, Germany: Springer.
R Core Team (2021). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. recovered 13 may, 2025 from: https://www.R-project.org/
Ramírez-Bautista, A., Hernández-Salinas, U., García-Vázquez, U. O., Leyte-Manrique, A., & Canseco-Márquez, L. (2009). Herpetofauna del valle de México: diversidad y conservación. Pachuca, Hidalgo: Universidad Autónoma del Estado de Hidalgo/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Segall, M., Cornette, R., Godoy-Diana, R., & Herrel, A. (2020). Exploring the functional meaning of head shape disparity in aquatic snakes. Ecology and Evolution, 10, 6993–7005. https://doi.org/10.1002/ece3.6380
Simonsen, M. K., Siwertsson, A., Adams, C. E., Amundsen, P. A., Præbel, K., & Knudsen, R. (2017). Allometric trajectories of body and head morphology in three sympatric Arctic charr (Salvelinus alpinus (L.)) morphs. Ecology and Evolution, 7, 7277–7289. https://doi.org/10.1002/ece3.3224
Strelin, M. M., & Diggle, P. K. (2022). Within-individual leaf allometry and the evolution of leaf morphology:
A multilevel analysis of leaf allometry in temperate Viburnum (Adoxaceae) species. Evolution & Development, 24, 145–157. https://doi.org/10.1111/ede.12414
Stroud, J. T., Petherick, A., Krasnoff, B., Walker, K., Suh, J. J., & Losos, J. B. (2023). Signal size allometry in Anolis lizard dewlaps. Biology Letters, 19, 20230160. https://doi.org/10.1098/rsbl.2023.0160
Urošević, A., Ljubisavljević, K., & Ivanović, A. (2014). Variation in skull size and shape of the Common wall lizard (Podarcis muralis): Allometric and non-allometric shape changes. Contributions to Zoology, 83, 67–77. https://doi.org/10.1163/18759866-08301003
Vincent, S., Moon, B. R., Herrel, A., & Kley, N. (2007). Are ontogenetic shifts in diet linked to shifts in feeding mechanics? Scaling of the feeding apparatus in the banded watersnake Nerodia fasciata. Journal of Experimental Biology, 210, 2057–2069. https://doi.org/10.1242/jeb.02779
Voje, K. L., Bell, M. A., & Stuart, Y. E. (2022). Evolution of static allometry and constraint on evolutionary allometry in a fossil stickleback. Journal of Evolutionary Biology, 35, 423–438. https://doi.org/10.1111/jeb.13984
Whitlock, M. C., & Schluter, D. (2008). The analysis of biological data. New York: Roberts and Company Publishers.

Biogeografía
Distribución de Ormosia macrocalyx en México y delimitación de sus áreas de ocupación
Georgina Vargas-Simón a, b, Manuel Lorenzo Núñez-Piedra c, Marivel Domínguez-Domínguez d, *, Wiliam René Alegría-González a y Pablo Martínez-Zurimendi b, e
Georgina Vargas-Simón a, b, Manuel Lorenzo Núñez-Piedra c, Marivel Domínguez-Domínguez d, *,
Wiliam René Alegría-González a y Pablo Martínez-Zurimendi b, e

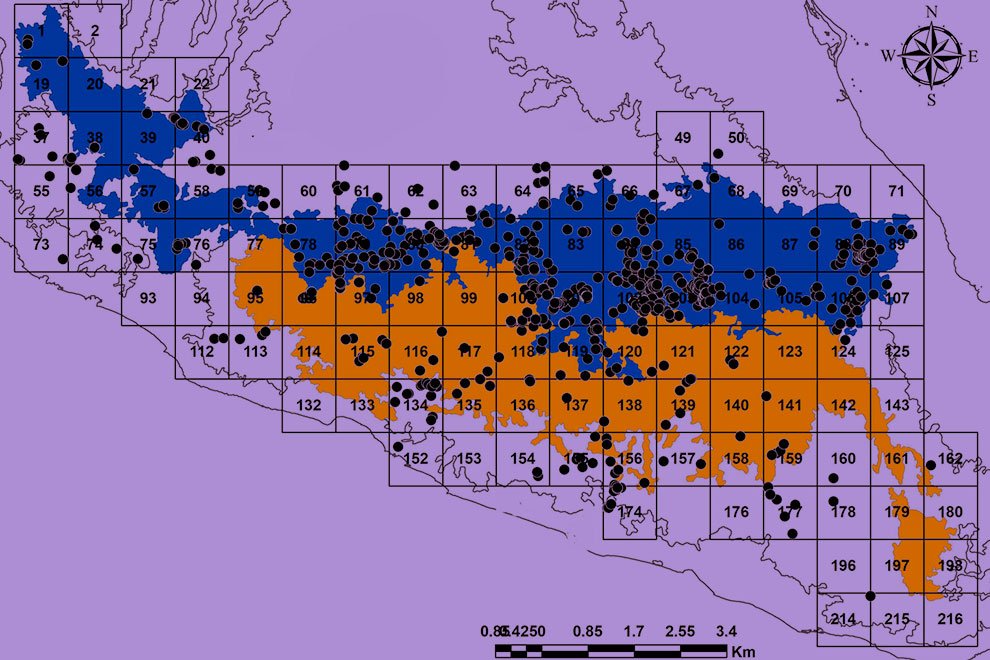







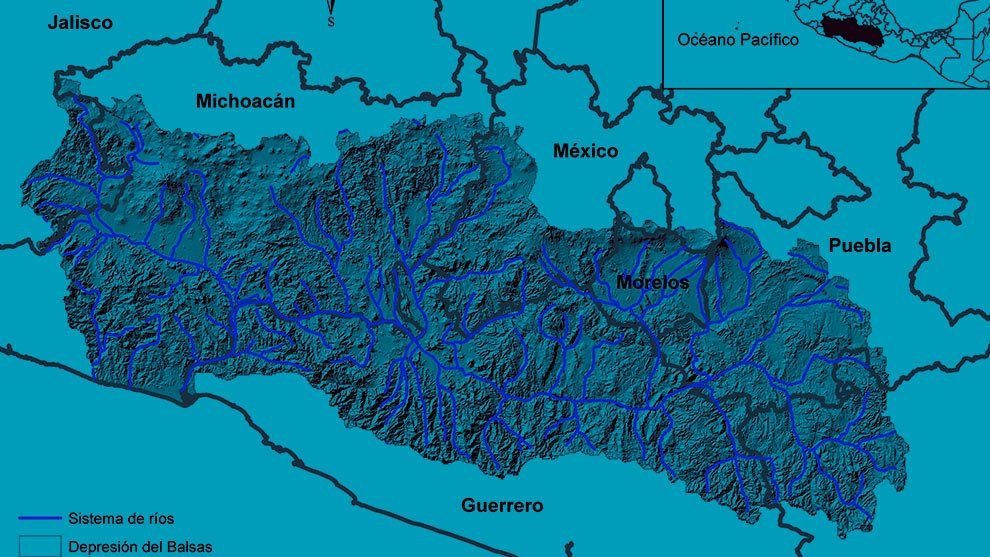

Effects of climate change and species distribution modeling of Loxosceles (Araneae: Sicariidae) from Central Mexico
Mayra R. Cortez-Roldán a, Alejandro Valdez-Mondragón b, *
a Universidad Autónoma de Tlaxcala, Centro Tlaxcala de Biología de la Conducta, Posgrado en Ciencias Biológicas, Carretera Federal Tlaxcala-Puebla, Km. 1.5, 90062 Tlaxcala, Tlaxcala, Mexico
b Centro de Investigaciones Biológicas del Noroeste S.C., Programa Académico de Planeación Ambiental y Conservación, Colección de Aracnología, Km. 1 Carretera a San Juan de La Costa “El Comitán”, 23205 La Paz, Baja California Sur, Mexico
*Corresponding author: lat_mactans@yahoo.com.mx (A. Valdez-Mondragón)
Received: 11 October 2023; accepted: 19 March 2024
Abstract
With 40 of the 149 described species, Mexico harbors the highest diversity of the spider genus Loxosceles. However, knowledge about these spiders’ distribution patterns in a climate change (CC) context is poorly known. In this study, the distributions of 4 species from Central Mexico, Loxosceles malintzi, L. misteca, L. tenochtitlan and L. zapoteca, were estimated and evaluated based on species distribution modeling (SDM) and the possible effects of CC. Two future scenarios were simulated (years 2050 and 2080) to show possible increases or reductions in species distributions. The most important variables that influence the distribution of the species were: isothermality, seasonality of temperature, and precipitation. In the CC scenarios, some species showed a possible increase, specifically, Loxosceles malintzi with an increase in its distribution of 79% by 2050 and 66% by 2080, whereas L. misteca was projected to increase its distribution by 28% for 2050 and 38% for 2080. However, a decrease in the distribution of L. tenochtitlan by 51% for 2050 and 38% for 2080 was projected, as well as a 45% decrease by 2050 and a 40% decrease by 2080 for L. zapoteca.
Keywords: Violin spiders; Climatic variables; Biogeographic provinces; Future scenarios
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Efectos del cambio climático y modelado de distribución de especies de Loxosceles (Araneae: Sicariidae) del centro de México
Resumen
Con 40 de 149 especies descritas, México alberga la mayor diversidad de arañas del género Loxosceles. Sin embargo, el conocimiento sobre los patrones de distribución en un contexto de cambio climático (CC) es poco conocido. Se estimaron y evaluaron las distribuciones de 4 especies del centro de México, Loxosceles malintzi, L. misteca, L. tenochtitlan y L. zapoteca, con base en el modelado de distribución de especies (MDE) y posibles efectos del CC. Se simularon 2 escenarios futuros (años 2050 y 2080) para mostrar posibles incrementos o reducciones en las distribuciones de las especies. Las variables más importantes que influyen en la distribución son: la isotérmia, la estacionalidad de la temperatura y las precipitaciones. En los escenarios de CC algunas especies mostraron un posible aumento, Loxosceles malintzi tuvo un aumento proyectado en su distribución de 79% para 2050 y de 66% para 2080, mientras que L. misteca tuvo un aumento de 28% para 2050 y de 38% para 2080. Sin embargo, se proyectó una disminución en la distribución de L. tenochtitlan de 51% para 2050 y de 38% para 2080, así como una disminución de 45% para 2050 y de 40% para 2080 para L. zapoteca.
Palabras clave: Arañas violinistas; Variables climáticas; Provincias biogeográficas; Escenarios futuros
Introduction
In North America, the spider genus Loxosceles Heineken and Lowe, 1832 (family Sicariidae Keyserling, 1980) are commonly known as “violin spiders”, “recluse spiders”, or “brown recluse spiders”. The current diversity comprises 149 described species, being one of the spider genera responsible for serious medical problems worldwide due to their venomous bites (Manríquez & Silva, 2009; Ramos-Rodríguez & Méndez, 2008; Sandidge & Hopwood, 2005; Swanson & Vetter, 2009; Vetter, 2008, 2015; Vetter & Bush, 2002; Vetter et al., 2003; WSC, 2024). Recent reviews of the medical aspects regarding Loxosceles bites have revealed that, despite frequent and numerous publications, only 11% of reported bites were verified, and skin necrosis developed in three-quarters of these cases (Taucare-Ríos et al., 2018).
Mexico boasts the highest diversity of violin spiders, with 40 species officially recognized, 38 native species and 2 introduced: Loxosceles reclusa Gertsch & Mulaik, 1940 and Loxosceles rufescens (Dufour, 1820) (Gertsch 1958, 1973; Gertsch & Ennik 1983; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, Solís-Catalán et al., 2018; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018). Some North American synanthropic species, such as L. reclusa from the southern USA, have been widely studied for their biological, medical, and physiological aspects, with their abundances, natural history, and even distributions being analyzed and modeled (Sandidge & Hopwood, 2005; Saupe et al., 2019; Swanson & Vetter, 2009; Vetter, 2005, 2008; Vetter & Barger, 2002; Vetter & Bush, 2002; Vetter et al., 2003). However, these aspects remain poorly studied or not assessed in Mexican species. To date, all 38 states of Mexico have records of at least 1 native or introduced species of Loxosceles. The highest diversity of Loxosceles species in Mexico is mainly concentrated in the northern regions of the country, characterized by warm, dry regions such as deserts and xerophytic shrublands, with the Baja California Peninsula being the most diverse region in the country. The group’s diversity tends to decrease in the southern regions of the country where the habitat is more tropical and sub-tropical, such as in the Yucatán Peninsula which has the lowest species diversity in the country (Navarro-Rodríguez & Valdez-Mondragón, 2020; Valdez-Mondragón, 2020; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, Solís-Catalán et al., 2018; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018; Valdez-Mondragón et al., 2019).
In recent years, climate change (CC) has been accelerated by anthropogenic processes mainly related to the intensification of greenhouse gases (Compagnucci, 2011). The resulting effects on ecosystem processes have led to changes in the distributions of species worldwide, which can be observed in 3 main response patterns: 1) species maintain their areas of distribution (Stranges et al., 2019; Uribe-Botero. 2015); 2) species’ areas of distribution will decrease, and in extreme cases, species might become extinct (Araújo et al., 2006; Romo et al., 2013); and 3) species will expand their geographical distributions (Boorgula et al., 2020; Martínez et al., 2024; Peterson, 2009), which has been even proposed with Loxosceles spiders from North America by Saupe et al. (2011) and also for cosmopolite species such as L. rufescens by Taucare-Ríos et al. (2018). Ecological niche models (ENM) and species distribution models (SDM) have been used to observe and assess the effects of CC (past and future) on species (Costa et al., 2002; Mota-Vargas et al., 2019; Peterson, 2009; Yáñez-Arenas et al., 2016). These methodologies have also been used to assess the potential risks associated with distribution expansions under future climate scenarios of disease-transmitting species (vectors), or those that can cause envenomation/poisoning in humans such as venomous snakes, scorpions or even violin spiders (Brooker et al., 2002; Foley et al., 2008; Lira et al., 2020; Martínez et al., 2024; Saupe et al., 2011; Taucare-Ríos et al., 2018; Yáñez-Arenas et al., 2016).
Climate change is expected to have profound effects on the distribution of venomous species worldwide, including reductions in the biodiversity and changes in patterns of envenomation of humans and even domestic animals (Martínez et al., 2024). Recent studies have projected future changes in species distributions as a consequence of CC, resulting in an increase or decrease of environmentally suitable areas. Vector-associated diseases such as leishmaniasis in Brazil (Lutzomyia, Peterson & Shaw [2003]), malaria in Africa (Anopheles, Peterson [2009]), Chagas in the Americas (Triatoma, Garza et al. [2014]), and Lyme disease and encephalitis in Europe (ticks of the genera Ixodes, Dermacentor, and Rhipicephalus, Gray et al. [2009]) have all been studied under the context of potential CC impacts of their host species’ distributional changes. In the case of venomous animals, ENM research has addressed evolutionary processes such as ecological niche conservatism/divergence between phylogenetically related species. Warren et al. (2008) and Taucare-Ríos (2017) applied such methods to Loxosceles spiders, while Planas et al. (2014) and Taucare-Ríos et al. (2018) used ENM to estimate diversity and observe the evolutionary processes that favored the diversification of L. rufescens in the Mediterranean, as well as the invasion potential of ecological niches globally. The only Loxosceles species from North America to be studied using ENM is L. reclusa, which causes the highest number of necrotic wounds induced by spiders in the USA. Saupe et al. (2011) investigated this species’ present and future distribution patterns and the medical implications within the Unites States.
In Mexico, studies focused on characterizing the ecological niches of Loxosceles species are scarce and often uninformative, especially with regards to species’ distribution areas. In the state of Guerrero, the genus’ distribution covers the entire state; however, no precise information exists on the environmental variables that influence distributions at the species level (Dzul-Manzanilla et al., 2014). The geographical distribution of the genus within Mexico has been shown to be influenced by some bioclimatic variables such as vegetation type, seasonality of temperature, annual temperature range, and isothermality (Cortez-Roldán, 2018; Valdez-Mondragón et al., 2019). At the genus level, SDMs show that Loxosceles is distributed across all biogeographic provinces except for the Sierra Madre Occidental, Soconusco, and Oaxaca (Cortez-Roldán, 2018). However, the broad scale of these analyses may lead to inaccurate or misinterpreted generalizations when assessing patterns and processes at the species level.
In recent years, scientific research on the genus Loxosceles from Mexico has been carried out mainly under an integrative taxonomy approach to describe and delimit species (Navarro-Rodríguez, 2019; Solís-Catalán, 2020; Valdez-Mondragón et al., 2019). However, some aspects such as the effect of CC on the distribution, biogeography, and diversity of these spiders remains unknown. The objective of this work is to estimate the current species distributions and future potential distributions of 4 Loxosceles species from the Central region of Mexico, considering 2 future climate change scenarios to identify possible changes in future distributions.
Materials and methods
Georeferenced localities were obtained from the Colección Nacional de Arácnidos (CNAN) (https://www.ibdata.abaco3.org/web/; https://datosabiertos.unam.mx/), Institute of Biology, Universidad Nacional Autónoma de México (IBUNAM), Mexico City, and Laboratorio de Aracnología (CARCIB), Centro de Investigaciones Biológicas del Noroeste (CIBNOR), La Paz, Baja California Sur, Mexico. To select the species used in the analyses, the following 2 criteria were considered: 1) species inhabiting Central Mexico that have previously been delimited and identified under morphological and molecular evidence (Navarro-Rodríguez, 2019; Navarro-Rodríguez & Valdez-Mondragón, 2020; Solís-Catalán, 2020; Valdez-Mondragón et al., 2019), which represents species with distributions covering the states with the highest population density (INEGI, 2020), as well as the states with the highest number of confirmed cases of loxoscelism from Mexico (Dr. Héctor Cartas, pers. comm.); and 2) adult specimens accurately identified to species level, the species identification using only juvenile specimens is not possible because the sexual primary structures such as male palps and female genitalia in adults are necessary for species identification. For identification of specimens collected and deposited at the CARCIB, dissections of male palps and female seminal receptacles were carried out in 80% ethanol, with tissue around the seminal receptacles cleaned using potassium hydroxide (KOH-10%) for 1 minute. Specimens were identified using the taxonomic keys for North American species by Gertsch and Ennik (1983) and literature of described species from Mexico by Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán (2018), Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán (2018), Valdez-Mondragón et al. (2019). A total of 55 records were used for the 4 analyzed species (Table 1): Loxosceles tenochtitlan Valdez-Mondragón & Navarro-Rodríguez, 2019 (20 records); Loxosceles malintzi Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez & Solís-Catalán, 2018 (19 records); Loxosceles misteca Gertsch, 1958 (8 records), and Loxosceles zapoteca Gertsch, 1958 (8 records). Field trips were carried out from 2016 to 2020 in Mexico City, Guerrero, Estado de México, Morelos, Puebla, and Tlaxcala to collect additional biological material.
The accessibility area (M) sensu Soberón (2010) of the 4 species was delimited based on all records of each species using the biogeographic provinces proposed by Morrone et al. (2017): the Trans-Mexican Volcanic Belt Province (TVB) and the Balsas Basin Province (BBP). The accessibility area M corresponds to the region that has been accessible to the species for relevant periods (Barve et al., 2011; Mota-Vargas et al., 2019; Ortega-Andrade et al., 2015).
Table 1
Species and records of Loxosceles distributed in the Central region of Mexico and used in this study.
| Species | Author(s) & years | Records | States* | Reference** |
| Loxosceles malintzi | Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez & Solís-Catalán, 2018 | 19 | Gro, Mor, Pue | CARCIB, CNAN |
| Loxosceles misteca | Gertsch, 1958 | 8 | Gro, Mor | CNAN, CARCIB |
| Loxosceles tenochtitlan | Valdez-Mondragón & Navarro-Rodríguez, 2019 | 20 | Cdmx, Mex, Tlax | CARCIB, CNAN |
| Loxosceles zapoteca | Gertsch, 1958 | 8 | Gro | CNAN, CARCIB |
We downloaded a set of bioclimatic variables from Cuervo-Robayo et al. (2020) (http://geoportal.conabio.gob.mx/metadatos/doc/html/b19802009gw.html) (Table 2) with a time interval of 1980-2009 and a resolution of 30 seconds (~ 1 km2) to avoid temporality errors with our occurrence data (data between 2010 and 2020) (Mota-Vargas et al., 2019). Four variables that presented spatial errors were excluded from the 19 bioclimatic variables following Escobar et al. (2014): mean temperature of the wettest quarter (BIO8), mean temperature of the driest quarter (BIO9), precipitation of the warmest quarter (BIO18), and precipitation of the coldest quarter (BIO19). Consequently, we used a total of 15 bioclimatic variables (Table 1). The criteria to select the variables was implemented by statistical methods and previous knowledge regarding the species’ ecology and biology. Pearson’s correlation analysis was performed for each species, and bioclimatic variables that showed a correlation r > 0.8 were discarded to avoid an overfit of the models and to reduce the performance of extrapolation (Steen et al., 2017). Variable subsets were created for each species using the R studio v.1.2.5042 “Kuenm” package (Cobos et al., 2019; Marques et al., 2020). For the transfer of the models, 2 CC scenarios were considered: representative concentration pathway (RCP) 4.5 optimal scenario (years 2050 and 2080) and 8.5 catastrophic scenario (2050, 2080) (S1). The RCP provides lower (RCP 4.5) and upper data for future potential greenhouse gas emissions (RCP 8.5). These scenarios were selected because they have been used previously to assess impact, vulnerability, and adaptation in previous studies on Mexican and Central American taxa (Fernández et al., 2016). The global circulation model from which the scenarios were obtained is the MIROC-5, which has been used in several arthropods groups and performs well in projections to future climate change scenarios (Liu & Shi, 2020; Mammola et al., 2018; Peterson et al., 2017; Romero et al., 2018; Roslin et al., 2017). Future climate data was downloaded in a resolution of 30 seconds (~ 1 km2) from CC, Agriculture, and Food Security (CCAFS) (https://ccafs-climate.org/).
Table 2
Environmental variables used in the ecological niche models (Cuervo-Robayo et al., 2020). Bold font indicates those variables used to run the models.
| Variable | Description of variables |
| BIO1 | Annual mean temperature |
| BIO2 | Mean diurnal range |
| BIO3 | Isothermally |
| BIO4 | Temperature seasonality |
| BIO5 | Max temperature of warmest month |
| BIO6 | Min temperature of coldest month |
| BIO7 | Temperature annual range |
| BIO10 | Mean temperature of warmest quarter |
| BIO11 | Mean temperature of coldest quarter |
| BIO12 | Annual precipitation |
| BIO13 | Precipitation of wettest month |
| BIO14 | Precipitation of driest month |
| BIO15 | Precipitation seasonality |
| BIO16 | Precipitation of wettest quarter |
| BIO17 | Precipitation of driest quarter |
We used the Maxent v.3.3.3 (Maximum Entropy Algorithm) (Phillips et al., 2004) program to the modeling. Maxent predicts probability values (thresholds) of habitat suitability in the study area on a scale from 0 (least suitable) to 1 (most suitable). The parameters for each model were explored in the “Kuenm” package on R studio (Marques et al., 2020). Significance, performance (omission rate), and model complexity were used to choose the optimal parameter settings among the candidate models (Marques et al., 2020). All possible combinations of linear (l), quadratic (q), product (p), threshold (t) and hinge (h) feature types were tested, as well as the regularization multiplier (0.1, 0.3, 0.5, 0.7, 1.0, 5.0, and 10.0) (Marques et al., 2020). For the regularization multipliers a combination of 7 values was used, these influence the level of focus or how closely the obtained output distribution fits. Values < 1.0 produce distributions that are more adjusted to the presence records and, on the other hand, using values > 1.0 produce a more widespread and less localized prediction. Using combinations of the regularization multiplier allows obtaining from simple to more complex models (Phillips et al., 2006). Models were built using all possible combinations between the 16 and 42 subsets of environmental variables.
We evaluated significance (partial ROC) (Peterson et al., 2008), performance (omission error) of E = 5%, and model complexity under Akaike information criterion (AICc) for each candidate model to select the optimal parameter (Warren & Seirfet, 2011). With the optimal models, 10 replications were performed by Bootstrapping with logistic outputs. Logistic models show the probability that the species is present, conditional on environmental variables (Phillips & Dudik, 2008). In cases where there was more than 1 candidate model, the median of all replications was used to obtain the final model and a consensus map was created from the medians.
The models generated by Maxent are expressed in probabilistic values of environmental suitability. Therefore, consensus maps were reclassified in QGIS v.3.8 Zanzibar to create binary maps of potential distributions (0 absence-1 presence) (Costa et al., 2002; Jiménez-García & Peterson, 2019; Waltari & Guralnick, 2009). For the binary maps, we used the “minimum training presence threshold,” a threshold for which at least 1 known presence per species was found. Finally, we calculated the percentage of change in suitable habitat comparing present and future projections in QGIS.
The multivariate environmental similarity surface (MESS) was calculated to quantify the degree of extrapolation for determining the novelty of future climatic conditions relative to current conditions in the calibration area. MESS analyses help predict areas where strict extrapolation may occur (e.g., transfer areas with environmental conditions outside the range of training data). Higher values reflect greater uncertainty, and so caution must be taken when interpreting such areas, as they could be considered an overprediction of the models (Barbosa et al., 2009; Elith et al., 2010) (S2). The analysis was evaluated in the Ntbox package in R Studio (Osorio-Olvera et al., 2020).
Results
The SDM with the best statistical evaluations were obtained for each species (Figs. 1-4). A total of 1,360 models (L. malintzi) and 3,570 models (L. misteca, L. tenochtitlan, and L. zapoteca) were created using different configurations of regularization multiplier and response type, with 16 and 42 environmental data subsets (Table 3). The SDM for the 4 species comprise distributions within the following biogeographic provinces: Trans-Mexican Volcanic Belt (TVB), Balsas Basin (BBP), Chihuahuan Desert (CDP), and Sierra Madre del Sur (SMS) (Figs. 1-4).
Loxosceles malintzi has a potential distribution covering the BBP and SMS biogeographic provinces. These provinces span the states of Morelos, Puebla, Guerrero, Oaxaca, Estado de México, and Michoacán (Fig. 1). The environmental variables that most influenced the models were mean temperature of warmest quarter (BIO10) and precipitation of wettest quarter (BIO16), with 60.2% and 21.1%, respectively (Table 4). The potential distribution of L. misteca is recovered within the biogeographic provinces of BBP, SMS and TVB, including Michoacán, Morelos, Guerrero, and Puebla (Fig. 2). Precipitation of the wettest month (BIO13) had a contribution of 37.2% in the creation of the models (Table 4). Loxosceles tenochtitlan has a potential distribution that includes the provinces of CDP and TVB, including Estado de México, Mexico City, Puebla, Hidalgo, Querétaro, and Guanajuato (Fig. 3). The variable with the greatest contribution to the model was the precipitation of driest month (BIO14) with a 41.8% contribution (Table 4). Finally, L. zapoteca has a potential distribution within the BBP, SMS, and TVB provinces in Guerrero, Morelos, Puebla, Estado de México, and Michoacán (Fig. 4). Similar to L. tenochtitlan, the precipitation of the driest month (BIO14) had the highest contribution to the model at 46.8% (Table 4).

Figures 1-2. Species distribution modeling of Loxosceles species from the Central Mexico region under the Maxent algorithm. 1, Loxosceles malintzi, total distribution: 43,825.508 km2; 2, Loxosceles misteca, total distribution: 71,997.320 km2. Biogeographic provinces by Morrone et al. (2017) (black lines).
In transferring the SDM towards the 2 future scenarios, no significant changes in distributions were observed between the RCP 4.5 (2050 and 2080) and RCP 8.5 (2050 and 2080) scenarios in all 4 species (Figs. 5-12, S1). According to the results obtained for the 4 species analyzed in both scenarios, the RCP 4.5 (2050) scenario showed the lowest future environmental conditions, while the RCP 8.5 (2080) scenario had the highest (Figs. 5-12).

Figures 3-4. Species distribution modeling of Loxosceles species from the Central Mexico region under the Maxent algorithm. 3, Loxosceles tenochtitlan, total distribution: 28,836.642 km2; 4, Loxosceles zapoteca, total distribution: 57,911.413 km2. Biogeographic provinces by Morrone et al. (2017) (black lines).
Future distributions of L. malintzi in both scenarios (2050 and 2080) are projected to fall mainly within the BBP province (Figs. 5, 6). By 2050, an increase in the appropriate environmental conditions is projected to the southwest of the BBP including the northern SMS province (Fig. 5), whereas by 2080 a decrease in the species’ distribution is modelled with respect to the current environmental conditions (Fig. 6).

Figures 5-6. Potential distribution of Loxosceles malintzi under future scenarios. 5, Year 2050 (RCP 4.5); 6, year 2080 (RCP 8.5). Biogeographic provinces (Morrone et al., 2017). The plots show the percentage of decrease, increase, and persistence of the current distribution under future climate scenarios.
In both scenarios, a possible decrease between 15-25%, and an increase between 65-80% is observed in the potential distribution, which lies mainly inside the BBP province. Loxosceles malintzi also is projected to persist in environmentally suitable ranges of between 5-10% for both scenarios. The SDM of L. misteca for 2050 shows an increase of 28% towards the northwestern region of the Pacific Lowlands Province (PLP), a zone that is more susceptible to climate change (Fig. 7). In 2080, the projected distribution covers the same areas as the 2050 scenario, while showing a possible tendency to increase 38% towards the southeast of the distribution in the PLP (Fig. 8). The model for L. misteca shows a possible decrease of 13-15% in areas of optimal future environmental conditions, so this species may not have its distribution affected in either climate change scenario, as it shows a potential persistence of 45-47% of its current distribution (Figs. 7, 8).

Figures 7-8. Potential distribution of Loxosceles misteca under future scenarios. 7, Year 2050 (RCP 4.5); 8, year 2080 (RCP 8.5). Biogeographic provinces by Morrone et al. (2017). The plots the percentage of decrease, increase, and persistence of the current distribution under the climate scenarios.
The potential future distributions of L. tenochtitlan under the 2050 and 2080 scenarios cover a greater proportion of areas within the TVB, with changes in distribution appearing to the southwest of the CDP (Figs. 9, 10). These changes under future conditions show similarities to the current conditions, such that the 2 climate change scenarios show considerable areas where adequate environmental conditions could persist for the distribution of the species (20-30%). For L. tenochtitlan, the SDM shows a possible increase of 25-35% in its area of distribution under future projections; however, there is also a possibility of a decrease in the future distribution with respect to the current distribution between 35-50% (Figs. 9, 10). Therefore, this species could restrict its distribution to environmentally stable areas under both climate change scenarios (Figs. 9, 10). For L. zapoteca, both climate change scenarios, 2050 and 2080, suggest that environmental conditions present in the current SDM could be maintained, resulting in a projected increase of 5-10% in its distribution under future environmental conditions (Figs. 11, 12). However, it could also present a decrease between 40-45% in its distribution, so this species could be restricted to environmentally stable areas representing between 45-50% of its current distribution under both climate change scenarios (Figs. 11, 12).
Discussion
Species Distribution Modeling (SDM) has been a powerful approach for understanding how abiotic factors such as temperature, precipitation, and seasonality impact the biogeographic limits of different lineages or species (Graham et al., 2004; Wiens & Graham, 2005). The SDM in this study showed considerable utility in recognizing potential regions where the 4 analyzed species of Loxosceles may be distributed presently and under future scenarios considering different CC scenarios.
The potential distributions of the 4 focal Loxosceles species are mainly affected by the temperature seasonality, isothermality, precipitation seasonality, and precipitation of the wettest quarter. In previous works on Loxosceles spiders, these 4 variables have been shown to influence the spiders’ life cycle, distribution, and survival, increasing populations and food availability throughout the seasons (Canals et al., 2016; Cruz-Cárdenas et al., 2014; Ferreti et al., 2018; Planas et al., 2014; Saupe et al., 2011).
Table 3
Performance metrics of the configuration of the best models for each of the 4 Loxosceles species of the Central Mexican region.
| Species | Model configuration | p-value p ROC | Omission error (5%) | Delta AICc | Threshold |
| Loxosceles malintzi | M_0.1_F_lqp_Set_2 M_1_F_lqp_Set_13 M_1_F_lqp_Set_3 | 0.0 0.0 0.0 | 0.0 0.0 0.0 | 0.000 1.908 1.908 | 0.096 0.037 0.037 |
| Loxosceles misteca | M_0.1_F_lqp_Set_11 M_0.1_F_lqp_Set_4 | 0.0 0.0 | 0.0 0.0 | 0.00 1.989 | 0.293 0.108 |
| Loxosceles tenochtitlan | M_0.3_F_lq_Set_21 | 0.0 | 0.0 | 0.0 | 0.288 |
| Loxosceles zapoteca | M_1_F_l_Set_19 | 0.0 | 0.0 | 0.000 | 0.020 |
These environmental variables have similarly been important factors in the distribution of other arachnid species, such as harvestmen and mygalomorph spiders (Ferreti et al., 2018; Simó et al., 2014). However, the use of few environmental variables for an ecological niche characterization could generate a slightly restrictive environmental space, causing an over-prediction of potential distribution areas. Therefore, the biology of the species must be considered when choosing environmental variables, including their dispersal capacity, as was proposed by Mota-Vargas et al. (2019). The possible changes of the 4 variables mentioned above under future CC scenarios for the Loxosceles species analyzed, might impact the seasonal life cycle, their dispersal capacity, reproductive seasonality and even the food availability when the distribution would increase (or not), having more ecological competition even with other spiders’ groups.
Table 4
Contribution of the environmental variables used in Maxent for the current distribution of Loxosceles species in the Central Mexican region.
| Variable | Contribution (%) |
| Loxosceles malintzi Mean temperature of warmest quarter (BIO10) Precipitation of wettest quarter (BIO16) Temperature annual range (BIO7) Isothermality (BIO3) | 60.2 21.1 12.5 6.2 |
| Loxosceles misteca Precipitation of wettest month (BIO13) Precipitation of driest month (BIO14) Min temperature of coldest month (BIO6) Isothermality (BIO3) Precipitation Seasonality (BIO15) | 37.2 21.5 19.6 12.2 9.5 |
| Loxosceles tenochtitlan Precipitation of driest month (BIO14) Precipitation of wettest quarter (BIO16) Precipitation Seasonality (BIO15) Min temperature of coldest month (BIO6) Max temperature of warmest month (BIO5) | 41.8 28.1 14.2 10.0 5.9 |
| Loxosceles zapoteca Precipitation of driest month (BIO14) Precipitation Seasonality (BIO15) Precipitation of wettest quarter (BIO16) Temperature Seasonality (BIO4) | 46.8 24.2 22.6 6.4 |
Of the analyzed species, L. malintzi is distributed in the warmest region in the Balsas Basin Province (BBP). This species has previously been recorded from this region by Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, and Solís-Catalán (2018) and Cortez-Roldán (2018). The climate of this area is characterized as semi-warm and sub-humid, correlated with the typical vegetation type of tropical deciduous forests (INEGI, 2017; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018; Valdez-Mondragón et al., 2019). The current distribution of L. malintzi seems to be restricted mainly to sites with high temperatures (22-32 °C), and a stable zone within the BBP is observed under both scenarios for this species (Fig. 1). Loxosceles misteca has a distribution that covers the western region of the BBP, with most records being from karstic caves located in dry and tropical forests, including deciduous forests (Navarro-Rodríguez, 2019; Valdez-Mondragón et al., 2019). Variations in surface temperature and humidity directly influence the availability of food inside such caves, making these variables important factors in the distribution of the species (Cruz-Cárdenas et al., 2014; Mammola et al., 2018). Loxosceles zapoteca has previously been reported in deciduous forests and xeric scrublands within the BBP by Cortez-Roldán (2018), as has L. malintzi and L. misteca. Although these 3 species occupy the same area of distribution, their ecological niches are different, providing specific information to characterize and generate their SDMs that perform better for each species. The SDMs proposed by Cortez-Roldán (2018) for L. malintzi, L. misteca, and L. zapoteca show distributions in the BBP, which is corroborated with the SDMs generated herein.

Figures 9-10. Potential distribution of Loxosceles tenochtitlan under future scenarios. 9, Year 2050 (RCP 4.5); 10, year 2080 (RCP 8.5). Biogeographic provinces by Morrone et al. (2017). The plots the percentage of decrease, increase, and persistence of the current distribution in the climate scenarios.
In the case of L. tenochtitlan, the distribution is unique since this species has synanthropic habits and is associated with human buildings (Valdez-Mondragón et al., 2019). This species is distributed across the Central region of Mexico, encompassing the TVB with a mean elevation of 2,500 m asl. The environmental conditions associated with this species are characterized by temperate and pine-oak forests with temperatures between 20-30 °C and rainfall between 500 and 850 mm per year (Conagua, 2019; Cortez-Roldán, 2018; Juárez-Sánchez, 2019; Navarro-Rodríguez, 2019; Solís-Catalán, 2020; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, Solís-Catalán et al., 2018; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018). Loxosceles malintzi and L. misteca have also been reported in synanthropic environments (Figs. 30-32). In the case of L. malintzi, records have been taken near human settlements, specifically inside houses, between stacked concrete blocks, and in stored objects, near native vegetation (deciduous forest or dry tropical forest) (Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018). Loxosceles misteca has similarly been recorded within human settlements, leading Dzul-Manzanilla et al. (2014) and Cortez-Roldán (2018) to consider it a synanthropic species. Because of this, factors such as urbanized environments and anthropogenic activities must be considered in the preparation of SDMs (Desales-Lara et al., 2013; Maldonado et al., 2016; Quijano-Ravel & Ponce-Saavedra, 2016; Rodríguez-Rodríguez et al., 2015).

Figures 11-12. Potential distribution of Loxosceles zapoteca under future scenarios. 11, Year 2050 (RCP 4.5); 12, year 2080 (RCP 8.5). Biogeographic provinces by Morrone et al. (2017). The plots the percentage of decrease, increase, and persistence of the current distribution under the climate scenarios.
Several species of the genus Loxosceles from North and South America show a high association with human settlements (Cortez-Roldán, 2018; Fischer & Vasconcelos-Neto, 2005; Sandidge & Hopwood, 2005; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, Solís-Catalán et al., 2018; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018; Vetter & Barger, 2002). Undisturbed areas within and around homes, such as basements and storage areas that provide less variable temperature and humidity, can provide optimal conditions for the spiders’ potential prey and therefore can help establish spider populations within human settlements (Cortez-Roldán, 2018; Juárez-Sánchez, 2019; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, Solís-Catalán et al., 2018; Valdez-Mondragón, Cortez-Roldán, Juárez-Sánchez, & Solís-Catalán, 2018). Saupe et al. (2011) hypothesized that urbanization could modify the distribution of Loxosceles species, since a change in natural areas brings changes in temperature and precipitation within urban areas as well. Within other Loxosceles species, anthropogenic activities have been observed to aid the expansion of ranges (e.g., L. rufescens and L. reclusa, both introduced species in Mexico). Planas et al. (2014) and Taucare-Ríos et al. (2018) demonstrated that the potential for L. rufescens to expand to a global distribution is mainly determined by anthropogenic activities.
The possibility that urbanization has modified the distribution of L. malintzi, L. misteca,and L. tenochtitlan cannot be ruled out since similar cases have been observed with other species in which a change in natural areas modifies the temperature and precipitation within urban areas (Ferrelli et al., 2016; Granados, 2011; Saupe et al., 2011). However, the MDE showed the presence of these species in the BBP and TVB zones, provinces whose physiographic, environmental, and biological characteristics allow for the establishment of L. malintzi, L. misteca, L. tenochtitlan, and L. zapoteca (Figs. 30-33).
The SDMs provide a prediction of the potential distribution with respect to current environmental conditions; however, predictions to the future become more ambiguous. Species have been shown to respond to climatic changes throughout their evolutionary histories, and these rates of change are of primary concern for the future distribution of wild species (Peterson & Vieglais, 2001; Root et al., 2003; Walther et al., 2002). Within Loxosceles, Saupe et al. (2011) suggested that the distribution of L. reclusa, a widespread species from southern USA and introduced in northern Mexico, will be affected by climate change.
According to the analyzed species herein, there is a probability that in future scenarios (years 2050 and 2080) the potential distributions of L. misteca and L. malintzi will increase towards southern latitudes into areas where temperatures are projected to increase, allowing the establishment of new populations and further risks of loxoscelism accidents in the future. These potential changes in environmental conditions to the south in the neotropical region have been previously documented to affect other arachnids, such as scorpions of medical-toxicological importance in South America and Mexico (Martínez et al., 2018; Ureta et al., 2020). The effects of CC on L. reclusa suggest a displacement towards northern latitudes in North America and an expansion towards the east and west, where conditions will resemble those of their current niche. This implies that this species will have the capacity to colonize new areas, thereby increasing the risk of human-spider interaction in new regions of the USA (Saupe et al., 2011). The SDMs generated herein differ from those of Saupe et al. (2011) with respect to the projected increase in areas of distribution to the north. This could be due to the fact that the global circulation models (GCM) used with L. reclusa are based on high population growth rates, changes in land use, and energy. In comparison, the MCG MIROC-5 model used in the present work improves the simulation of the average climate, variability, and CC predictions due to anthropogenic radiative forcing that presents corrections in the precipitation parameters (Watanabe et al., 2010).
Future models for L. tenochtitlan and L. zapoteca show a decreasing tendency in geographic range in comparison with the areas predicted by current models, with distributional changes concentrated in the Chihuahuan Desert (CDP) (L. tenochtitlan) and TVB (L. zapoteca) biogeographic provinces restricting the distribution of both species for the years 2050 and 2080. This region is expected to increase in temperature during this time, reducing the suitable sites for these species. At the beginning of the 20th century, temperature was observed to rise non-uniformly and at an accelerated scale, influencing patterns of temperature and precipitation, both important environmental determinants for species distributions (Cuervo-Robayo et al., 2020; Houghton et al., 2001; Solomon et al., 2007). As adequate environmental conditions decrease, species distributions are consequently reduced (Romo & García-Barros, 2013; Romo et al., 2006). The reduction in the distributions of medically important species could have an important impact since it would entail a reduction in the areas with possible envenomation accidents for humans (Hosseinzadeh, 2020; Lira et al., 2020; Ureta et al., 2020).
Several studies have assessed the potential impact of climate change on the geographic ranges of organisms, with studies on arachnids particularly focusing on ticks (Dermacentor and Ixodes) (Boorgula et al., 2020; Gray et al., 2009) and scorpions (Tityus, Odontobuthus and Centruroides) (Hosseinzadeh, 2020; Lira et al., 2020; Martínez et al., 2018; Ureta et al., 2020). Modifications in geographic distributions could be due to variations in future environmental conditions, such as the isothermality, seasonality of temperature, or seasonal precipitation. However, as mentioned by Romo et al. (2013) and worth consideration here, the existence of environmentally suitable areas does not guarantee the survival of a species. Other factors must be considered, such as dependence on a specialized habitat or microhabitat, which would alter the response capacity to climate change (Bravo-Cadena et al., 2011). Similarly, the ability to disperse or colonize new areas is an important factor in a species’ ability to respond to changes (Bravo-Cadena et al., 2011; Pecl et al., 2017; Yáñez-Arenas et al., 2016). Species with greater dispersal capacity and greater niche width (eurytopic) will have a better response to climate change scenarios by increasing populations and geographic distribution (Bravo-Cadena et al., 2011; Martínez-Meyer et al., 2004; Parra-Olea et al., 2005; Vié et al., 2009). However, species with reduced dispersal capacity and limited niche width (stenotopic), such as Loxosceles spiders, will be drastically affected by climate change, reducing populations and geographic distribution areas (Bravo-Cadena et al., 2011; Hill et al., 2002; Schramm et al., 2021; Vié et al., 2009). In this way, low dispersal capacity is a limiting factor in these spiders’ ability to respond to environmental changes. Although larger geographic areas with adequate conditions may arise in future CC scenarios, these may be inaccessible to the spiders, restricting their geographic distribution (McMahon et al., 2011; Pearson & Dawson, 2003).
With regard to the geographical distribution of the Loxosceles species analyzed, 3 response patterns to climate change are proposed: 1) an increase in the occupancy capacity of new areas with optimal conditions for distribution (increase, L. misteca and L. malintzi); 2) a species will present adequacy to the new environmental conditions, so their distribution will not change (persistence, L. misteca, L. malintzi, and L. zapoteca); and 3) barring expansion or persistence, a species will undergo a reduction in the optimal areas for its survival (decrease, L. tenochtitlan and L. zapoteca), and in very extreme cases, the species could become locally extinct.
Loxosceles spiders are ectothermic organisms with a wide range of thermal tolerance, which could allow for adaptability to climate changes through physiological processes (e.g., temperature regulation). A tolerance to temperatures between 4.5-43.5 °C has been reported in Loxosceles species from North and South America (e.g., L. reclusa and L. intermedia Mello-Leitão, 1934 and L. laeta Nicolet, 1849) (Bonnet, 1996; Canals et al., 2016; Magnelli et al., 2016; Sandidge & Hopwood, 2005; Vetter, 2008, 2015). As such, future generations of the analyzed species herein would be expected to respond to temperature regulation (physiological adaptation), making individuals more tolerant of new climatic conditions in future environments as proposed by Saupe et al. (2011), Uribe- Botero (2015), Stranges et al. (2019), and Ryding et al. (2021).
Projections of climate change scenarios should be taken with caution since there may be variability and uncertainty in climatic conditions associated with the GCM (Collevatti et al., 2013; Chefaoui & Serrão, 2017; Elith & Leathwick, 2009; Nogués-Bravo, 2009; Owens et al., 2013). The Multivariate Environmental Similarity Surface Analysis (MESS) does not show different climatic conditions (not analogous) for the calibration area of the models in the different climate change scenarios in this research (S2). However, we observed in the northern region of Mexico where future climatic conditions could be non-analogous that the values of some bioclimatic variables in the GCM might be more extreme than in those variables used to calibrate the model (Guevara et al., 2019).
The magnitude of CC effects on areas of distribution is not only determined by ecological conditions, but also possibly influenced by socioeconomic factors such as migration, human settlements, and change in land use (Gray et al., 2009). Studies on the influence of climate change on the future distributions of species are relevant to the ecology of zoonotic diseases or in regard to envenomations/poisonings by animals of medical-toxicological importance (Boorgula et al., 2020; Saupe et al., 2011).
Acknowledgements
The first author thanks the Master’s Program at the Centro Tlaxcala de Biología de la Conducta (CTBC), Universidad Autónoma de Tlaxcala, Tlaxcala City, and the Consejo Nacional de Humanidades, Ciencias y Tecnologías (Conahcyt) for scholarship support while completing a Master’s Degree in Biological Science. The second author thanks the program “Jóvenes investigadores por México (ex Cátedras Conahcyt)” and Conahcyt for scientific support for the project No. 59. The second author also thanks SEP-Conahcyt for financial support of the project of Basic Science (Ciencia Básica) 2016, No. 282834. We also thank Edmundo González Santillán and Oscar F. Francke (ex-curator) of the Colección Nacional de Arácnidos (CNAN), Instituto de Biología, UNAM, for providing specimen loans. We are grateful to Brett O. Butler for the English language review of the manuscript, and to the reviewers for their comments and suggestions that improved the manuscript. We thank various people who donated specimens and assisted in field collection efforts. Specimens were collected under Scientific Collector Permit FAUT-0309 from the Secretaría de Medio Ambiente y Recursos Naturales (Semarnat), Mexico, provided to Alejandro Valdez-Mondragón.
References
Araújo, M. B., Thuiller, W., & Pearson, R. G. (2006). Climate warming and the decline of amphibians and reptiles in Europe. Journal of Biogeography, 33, 1712‒1728. https://doi.org/10.1111/j.1365-2699.2006.01482.x
Barbosa, A. M., Real, R., & Vargas, J. M. (2009). Transferability of environmental favourability models in geographic space: the case of the Iberian desman (Galemys pyrenaicus) in Portugal and Spain. Ecological Modelling, 220, 747‒754. https://doi.org/10.1016/j.ecolmodel.2008.12.004
Barve, N., Barve, V., Jiménez-Valverde, A., Lira-Noriega, A., Maher, S. P., & Peterson, A. T. (2011). The crucial role of the accessible area in ecological niche modeling and species distribution modeling. Ecological Modelling, 222, 1810‒1819. https://doi.org/10.1016/j.ecolmodel.2011.02.011
Bonnet, M. S. (1996). The Loxosceles spider. British Homoeopathic Journal, 85, 205‒213. https://doi.org/10.1016/s0007-0785(96)80004-4
Boorgula, G. D., Peterson, A. T., Foley, D. H., Ganta, R. R., & Raghavan, R. K. (2020). Assessing the current and future potential geographic distribution of the American dog tick, Dermacentor variabilis (Say) (Acari: Ixodidae) in North America. Plos One, 15, e0237191. https://doi.org/10.1371/journal.pone.0237191
Bravo-Cadena, J., Sánchez-Rojas, G., & Gelviz-Gelviz, S. M. (2011). Estudio de la distribución de las especies frente al cambio climático. Cuadernos de Biodiversidad, 35, 12‒18. https://doi.org/10.14198/cdbio.2011.35.03
Brooker, S., Hay, S. I., & Bundy, D. A. (2002). Tools from ecology: ¿useful for evaluating infection risk models? Trends in Parasitology, 18, 70–74. https://doi.org/10.1016/S1471-4922(01)02223-1
Canals, M., Taucare-Ríos, A., Solís, R., & Moreno, L. (2016). Dimorfismo sexual y morfología funcional de las extremidades de Loxosceles laeta (Nicolet, 1849). Gayana (Concepción), 80, 161‒168. http://dx.doi.org/10.4067/S0717-65382016000200161
Chefaoui, R. M., & Serrão, E. A. (2017). Accounting for uncertainty in predictions of a marine species: integrating population genetics to verify past distributions. Ecological Modelling, 359, 229‒239. https://doi.org/10.1016/j.ecolmodel.2017.06.006
Cobos, M. E., Peterson, A. T., Osorio-Olvera, L., & Jiménez-García, D. (2019). An exhaustive analysis of heuristic methods for variable selection in ecological niche modeling and species distribution modeling. Ecological Informatics, 53, 100983. https://doi.org/10.1016/j.ecoinf.2019.100983
Collevatti, R. G., Terribile, L. C., de Oliveira, G., Lima-Ribeiro, M. S., Nabout, J. C., & Rangel, T. F. (2013). Drawbacks to paleodistribution modelling: the case of South American seasonally dry forests. Journal of Biogeography, 40, 345‒358. https://doi.org/10.1111/jbi.12005
Compagnucci, R. H. (2011). Historia del cambio climático o calentamiento global. Contribuciones Científicas GAEA, 23, 13‒19.
Conagua (Comisión Nacional del Agua). (2019). Reporte del clima en México: reporte anual 2019. Coordinación General del Servicio Meteorológico Nacional de la Comisión Nacional del Agua Tlalpan, Ciudad de México.
Cortez-Roldán, M. R. (2018). Arañas de importancia médica: distribución y modelaje de nicho ecológico de las especies de arañas violinistas del género Loxosceles Heineken y Lowe, 1832 (Araneae, Sicariidae) de México (Bachelor’s Thesis). Facultad de Agrobiología, UAT, Tlaxcala, México.
Costa, J., Peterson, A. T., & Beard, C. B. (2002). Ecologic niche modeling and differentiation of populations of Triatoma brasiliensis Neiva, 1911, the most important Chagas’ disease vector in northeastern Brazil (Hemiptera, Reduviidae, Triatominae). American Journal of Tropical Medicine and Hygiene, 67, 516‒520. https://doi.org/10.4269/ajtmh.2002.67.516
Cruz-Cárdenas, G., López-Mata, L., Villaseñor, J. L., & Ortiz, E. (2014). Potential species distribution modeling and the use of principal component analysis as predictor variables. Revista Mexicana de Biodiversidad, 85, 189‒199. https://doi.org/10.7550/rmb.36723
Cuervo-Robayo, A. P., Ureta, C., Gómez-Albores, M. A., Meneses-Mosquera, A. K., Téllez-Valdés, O., & Martínez-Meyer, E. (2020). One hundred years of climate change in Mexico. Plos One, 15, e0209808. https://doi.org/10.1371/journal.pone.0209808
Desales-Lara, M. A., Francke, O. F., & Sánchez-Nava, P. (2013). Diversidad de arañas (Arachnida: Araneae) en hábitats antropogénicos. Revista Mexicana de Biodiversidad, 84, 291‒305. https://doi.org/10.7550/rmb.31708
Dzul-Manzanilla, F. A., Herrera, L. H., Juárez, O. V., Leyva, E. T., Gutiérrez, C., & Castro J. T. L. (2014). Arañas de importancia médica en el estado de Guerrero. Entomología Mexicana, 1, 909‒913.
Elith, J., Kearney, M., & Phillips, S. (2010). The art of modelling range-shifting species. Methods in Ecology and Evolution, 1, 330‒342. https://doi.org/10.1111/j.2041-210X.2010.00036.x
Elith, J., & Leathwick, J. R. (2009). Species distribution models: ecological explanation and prediction across space and time. Annual Review of Ecology, Evolution, and Systematics, 40, 677‒697. https://doi.org/10.1146/annurev.ecolsys.110308.120159
Escobar, L. E., Lira-Noriega, A., Medina-Vogel, G., & Peterson, A. T. (2014). Potential for spread of the white-nose fungus (Pseudogymnoascus destructans) in the Americas: use of Maxent and NicheA to assure strict model transference. Geospatial Health, 9, 221‒229. https://doi.org/10.4081/gh.
2014.19
Fernández, A., Zavala, J., Romero, R., Conde, A. C., & Trejo, I. (2016). Actualización de los escenarios de cambio climático para estudios impactos, vulnerabilidad y adaptación en México y Centroamérica. CDMX: Centro de Ciencias de la Atmosfera, UNAM. https://doi.org/10.7818/ecos.2016.25-1.20
Ferrelli, F., Bustos, M. L., & Piccolo, M. C. (2016). La expansión urbana y sus impactos sobre el clima y la sociedad de la ciudad de Bahía Blanca, Argentina. Estudios Geográficos, 281, 469–489. https://doi.org/10.3989/estgeogr.201615
Ferretti, N. E., Arnedo, M., & González, A. (2018). Impact of climate change on spider species distribution along the La Plata River basin, southern South America: projecting future range shifts for the genus Stenoterommata (Araneae, Mygalomorphae, Nemesiidae). Annales Zoologici Fennici, 55, 123‒133. https://doi.org/10.5735/086.055.0112
Fischer, M. L., & Vasconcellos-Neto, J. (2005). Microhabitats occupied by Loxosceles intermedia and Loxosceles laeta (Araneae: Sicariidae) in Curitiba, Paraná, Brazil. Journal of Medical Entomology, 42, 756‒765. https://doi.org/10.1603/0022-2585(2005)042[0756:moblia]2.0.co;2
Foley, D. H., Rueda, L. M., Peterson, A. T., & Wilkerson, R. C. (2008). Potential distribution of two species in the medically important Anopheles minimus complex (Diptera: Culicidae). Journal Medical Entomology, 45, 852‒860. https://doi.org/10.1603/0022-2585(2008)45[852:pdotsi]2.0.co;2
Garza, M., Feria-Arroyo, T. P., Casillas, E. A., Sanchez-Cordero, V., Rivaldi, C. L., & Sarkar, S. (2014). Projected future distributions of vectors of Trypanosoma cruzi in North America under climate change scenarios. Plos Neglected Tropical Diseases, 8, e2818. https://doi.org/10.1371/journal.pntd.0002818
Gertsch, W. J. (1958). The spider genus Loxosceles in North America, Central America, and the West Indies. American Museum Novitates, 1907, 1‒46.
Gertsch, W. J. (1967). The spider genus Loxosceles in South America (Araneae, Scytodidae). Bulletin of the American Museum of Natural History, 136, 117‒174.
Gertsch, W. J. & Ennik, F. (1983). The spider genus Loxosceles in North America, Central America, and the West Indies (Araneae, Loxoscelidae). Bulletin of the American Museum of Natural History, 175, 264‒360.
Graham, C. H., Ferrier, S., Huettman, F., Moritz, C., & Peterson, A. T. (2004). New developments in museum-based informatics and applications in biodiversity analysis. Trends in Ecology & Evolution, 19, 497‒503. https://doi.org/10.1016/j.tree.2004.07.006
Granados, J. L. S. (2011). Efectos del crecimiento urbano sobre el sistema climático en la Región Paso del Norte (1975 y 2010). 200 años de urbanización en México. Memorias del XII Seminario-Taller Internacional de la Red Mexicana de Ciudades hacia la Sustentabilidad. Santiago, 16-17 de agosto 2011.
Gray, J. S., Dautel, H., Estrada-Peña, A., Kahl, O., & Lindgren, E. (2009). Effects of climate change on ticks and tick-borne diseases in Europe. Interdisciplinary Perspectives on Infectious Diseases, 2009, 593232. https://doi.org/10.1155/
2009/593232
Guevara, L., Morrone, J. J., & León-Paniagua, L. (2019). Spatial variability in species’ potential distributions during the last glacial maximum under different global circulation models: Relevance in evolutionary biology. Journal of Zoological Systematics and Evolutionary Research, 57, 113‒126. https://doi.org/10.1111/jzs.12238
Hill, J. K., Thomas, C. D., Fox, R., Telfer, M. G., Willis, S. G., & Asher, J. (2002). Responses of butterflies to twentieth century climate warming: implications for future ranges. Proceedings of the Royal Society of London. Series B: Biological Sciences, 269, 2163‒2171. https://doi.org/10.1098%2Frspb.2002.2134
Hosseinzadeh, M. S. (2020). Potential distribution and effects of climate change on the risk of scorpion sting with endemic and medically important scorpion Odontobuthus doriae (Thorell, 1876) (Arachnida: Scorpionidae: Buthidae) in Iran. Zoology and Ecology, 30, 109‒115. https://doi.org/10.35513/21658005.2020.2.4
Houghton, J. T., Ding, Y. D. J. G., Griggs, D. J., Noguer, M., van der Linden, P. J., & Dai, X. (2001). Climate change 2001: the scientific basis. The Press Syndicate of the University of Cambridge.
INEGI (Instituto Nacional de Estadística y Geografía). (2017). Guía para la interpretación de cartografía: uso del suelo y vegetación. Escala 1:250 000: serie VI. Instituto Nacional de Estadística y Geografía. México.
INEGI (Instituto Nacional de Estadística y Geografía). (2020). Censo de población y vivienda 2020. Retrieved from Instituto Nacional de Estadística y Geografía on: 12/05/2024. https://www.inegi.org.mx/programas/ccpv/2020/
Jiménez-García, D., & Peterson, A. T. (2019). Climate change impact on endangered cloud forest tree species in Mexico. Revista Mexicana de Biodiversidad, 90, e902781. https://doi.org/10.22201/ib.20078706e.2019.90.2781
Juárez-Sánchez, A. R. (2019). Arañas de importancia médica: estudio ultra morfológico de estructuras somáticas y diagnósticas de arañas violinistas del género Loxosceles Heineken & Lowe, 1832 (Araneae, Sicariidae) de México (Bachelors’ Thesis). Facultad de Agrobiología, UAT, Tlaxcala, México.
Lira, A. F. D. A., Badillo-Montaño, R., Lira-Noriega, A., & de Albuquerque, C. M. R. (2020). Potential distribution patterns of scorpions in north-eastern Brazil under scenarios of future climate change. Austral Ecology, 45, 215‒228. https://doi.org/10.1111/aec.12849
Liu, Y., & Shi J. (2020). Predicting the Potential Global Geographical Distribution of Two Icerya Species under Climate Change. Forests, 11, 684. https://doi.org/10.3390/f11060684
Magnelli, L. M., Peña, H. E., Castillo, G. A. & Ortiz, C. R. (2016). Loxoscelismo local y sistémico. Acta Médica Grupo Ángeles, 14, 36‒38.
Maldonado, C.J., Gutiérrez, C.D.A., & Ponce-Saavedra, J. (2016). Comparación de la riqueza de arañas saltarinas (Araneae: Salticidae) en dos sitios contrastantes en grado de antropización en Morelia Michoacán, México. In REFAMA Libro de Resúmenes del II Congreso de Fauna Nativa en Ambientes Antropizados. Red Temática Biología, Manejo y Conservación de Fauna Nativa en Ambientes Antropizados. Querétaro, Qro. México.
Mammola, S., Goodacre, S. L., & Isaia, M. (2018). Climate change may drive cave spiders to extinction. Ecography, 41, 233‒243. http://dx.doi.org/10.1111/ecog.02902
Manríquez, J. J., & Silva, S. (2009). Loxoscelismo cutáneo y cutáneo-visceral: Revisión sistemática. Revista Chilena de Infectología, 26, 420‒432. http://dx.doi.org/10.4067/S0716-10182009000600004
Marques, R., Krüger, R. F., Peterson, A. T., de Melo, L. F., Vicenzi, N., & Jiménez-García, D. (2020). Climate change implications for the distribution of the babesiosis and anaplasmosis tick vector, Rhipicephalus (Boophilus) microplus. Veterinary Research, 51, 1‒10. https://doi.org/10.1186/s13567-020-00802-z
Martínez, P. A., Andrade, M. A., & Bidau, C. J. (2018). Potential effects of climate change on the risk of accidents with poisonous species of the genus Tityus (Scorpiones, Buthidae) in Argentina. Spatial and Spatio-Temporal Epidemiology, 25, 67‒72. https://doi.org/10.1016/j.sste.2018.03.002
Martínez, P. A., da Fonseca-Teixeira, I. B, Siqueira-Silva, T., da Silva, F. F., Gonzaga-Lima, L. A., Chaves-Silveira, J. et al. (2024). Climate change-related distributional range shifts of venomous snakes: a predictive modelling study of effects on public health and biodiversity. The Lancet Planetary Health, 8,163‒171. https://doi.org/10.1016/S2542-5196(24)00005-6
Martínez-Meyer, E., Peterson, A. T., & Hargrove, W. W. (2004). Ecological niches as stable distributional constraints on mammal species, with implications for Pleistocene extinctions and climate change projections for biodiversity. Global Ecology and Biogeography, 13, 305‒314. https://doi.org/10.1111/j.1466-822X.2004.00107.x
McMahon, S. M., Harrison, S. P., Armbruster, W. S., Bartlein, P. J., Beale, C. M., & Edwards, M. E. (2011). Improving assessment and modelling of climate change impacts on global terrestrial biodiversity. Trends in Ecology & Evolution, 26, 249‒259. https://doi.org/10.1016/j.tree.2011.02.012
Morrone, J. J., Escalante, T., & Rodríguez-Tapia, G. (2017). Mexican biogeographic provinces: Map and shapefiles. Zootaxa, 4277, 277‒279. http://dx.doi.org/10.11646/zootaxa.4277.2.8
Mota-Vargas, C., Encarnación-Luévano, A., Ortega-Andrade, H. M., Prieto-Torres, D. A., Peña-Peniche, A., & Rojas-Soto, O. R. (2019). Una breve introducción a los modelos de nicho ecológico. La biodiversidad en un mundo cambiante: fundamentos teóricos y metodológicos para su estudio. Ciudad de México: Universidad Autónoma del Estado de Hidalgo/ Libermex.
Navarro-Rodríguez, C. I., & Valdez-Mondragón, A. (2020). Description of a new species of Loxosceles Heineken & Lowe (Araneae, Sicariidae) recluse spiders from Hidalgo, Mexico, under integrative taxonomy: morphological and DNA barcoding data (CO1+ ITS2). European Journal of Taxonomy, 704, 1‒30. https://doi.org/10.5852/ejt.2020.704
Navarro-Rodríguez, C. I. (2019). Delimitación de las especies mexicanas de arañas del género Loxosceles Heineken y Lowe (Araneae, Sicariidae) del Centro Occidente de México con evidencia molecular y morfológica (M. Sc. Thesis). Centro Tlaxcala de Biología de la Conducta, Universidad Autónoma de Tlaxcala, Tlaxcala, México.
Nogués-Bravo, D. (2009). Predicting the past distribution of species climatic niches. Global Ecology and Biogeograph, 18, 521‒531. https://doi.org/10.1111/j.1466-8238.2009.00476.x
Ortega-Andrade, H. M., Prieto-Torres, D. A., Gómez-Lora, I., & Lizcano, D. J. (2015). Ecological and geographical analysis of the distribution of the mountain tapir (Tapirus pinchaque) in Ecuador: importance of protected areas in future scenarios of global warming. Plos One, 10, e0121137. http://dx.doi.org/10.1371/journal.pone.0121137
Osorio-Olvera, L., Lira-Noriega, A., Soberón, J., Peterson, A. T., Falconi, M., Contreras-Díaz, R. G. et al. (2020). ntbox: an R package with graphical user interface for modelling and evaluating multidimensional ecological niches. Methods in Ecology and Evolution, 11, 1199‒1206. https://doi.org/10.1111/2041-210X.13452
Owens, H. L., Campbell, L. P., Dornak, L. L., Saupe, E. E., Barve, N., & Soberón, J. (2013). Constraints on interpretation of ecological niche models by limited environmental ranges on calibration areas. Ecological modelling, 263, 10‒18. https://doi.org/10.1016/j.ecolmodel.2013.04.011
Parra-Olea, G., Martínez-Meyer, E., & de León, G. P. P. (2005). Forecasting climate change effects on salamander distribution in the highlands of Central Mexico 1. Biotropica: The Journal of Biology and Conservation, 37, 202‒208. https://doi.org/10.1111/j.1744-7429.2005.00027.x
Pearson, R. G., & Dawson, T. P. (2003). Predicting the impacts of climate change on the distribution of species: ¿are bioclimate envelope models useful? Global Ecology and Biogeography, 12, 361‒371. https://doi.org/
10.1046/j.1466-822X.2003.00042.x
Pecl, G. T., Araújo, M. B., & Bell, J. D. (2017). Biodiversity redistribution under climate change: impacts on ecosystems and human well-being. Science, 355, eaai9214. https://doi.org/10.1126/science.aai9214
Peterson, A. T. (2009). Shifting suitability for malaria vectors across Africa with warming climates. BMC Infectious Diseases, 9, 59. https://doi.org/10.1186/1471-2334-9-59
Peterson, A., & Vieglais, D. (2001). Predicting species invasions using ecological niche modeling: new approaches from bioinformatics attack a pressing problem. Bioscience, 51, 363–371. https://doi.org/10.1641/0006-3568(2001)051[0363:PSIUEN]2.0.CO;2
Peterson, A. T., & Shaw, J. (2003). Lutzomyia vectors for cutaneous leishmaniasis in southern Brazil: ecological niche models, predicted geographic distributions, and climate change effects. International Journal of Parasitology, 33, 919‒931. https://doi.org/10.1016/s0020-7519(03)00094-8
Peterson, A. T., Campbell, L. P., Moo-Llanes, D. A., Travi, B., González, C., & Ferro, M. C. (2017). Influences of climate change on the potential distribution of Lutzomyia longipalpis sensu lato (Psychodidae: Phlebotominae). International Journal of Parasitology, 47, 667‒674. https://doi.org/10.1016/j.ijpara.2017.04.007
Peterson, A. T., Stewart, A., Mohamed, K. I., & Araújo, M. B. (2008). Shifting global invasive potential of European plants with climate change. Plos One, 3,e2441. https://doi.org/10.1371/journal.pone.0002441
Phillips, S. J., & Dudík, M. (2004). A maximum entropy approach to species distribution modeling. Proceedings of the 21st International Conference on Machine Learning. Baniff, Canada.
Phillips, S. J., & Dudík, M. (2008). Modeling of species distributions with Maxent: new extensions and a comprehensive evaluation. Ecography, 31, 161‒175. https://doi.org/10.1111/j.0906-7590.2008.5203.x
Phillips, S., Anderson, R., & Sphapire, R. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190, 231‒259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
Planas, E., & Ribera, C. (2014). Uncovering overlooked island diversity: colonization and diversification of the medically important spider genus Loxosceles (Arachnida: Sicariidae) on the Canary Islands. Journal of Biogeography, 41, 1255‒1266. http://dx.doi.org/10.1111/jbi.12321
Quijano-Ravell, A., & Ponce-Saavedra, J. (2016). Géneros de saltícidos (Arachnida: Salticidae: Araneae) urbanos de “Ciudad Caucel”, comisaría de Mérida, Yucatán, México. In REFAMA Libro de Resúmenes del II Congreso de Fauna Nativa en Ambientes Antropizados. Red Temática Biología, Manejo y Conservación de Fauna Nativa en Ambientes Antropizados. Querétaro, Qro. México.
Ramos-Rodríguez, H. G., & Méndez, J. D. (2008). Necrotic araneism. A review of the Loxosceles genus. I. General aspects, distribution and venom composition. Advances in Environmental Biology, 2, 9‒19.
Rodríguez-Rodríguez, S. E., Solís-Catalán, K. P., & Valdez-Mondragón, A. (2015). Diversity and seasonal abundance of anthropogenic spiders (Arachnida: Araneae) in different urban zones of the city of Chilpancingo, Guerrero, Mexico. Revista Mexicana de Biodiversidad, 86, 962‒971. https://doi.org/10.1016/j.rmb.2015.09.002
Romero, G. Q., Gonçalves-Souza, T., Kratina, P., Marino, N. A., Petry, W. K., & Sobral-Souza, T. (2018). Global predation pressure redistribution under future climate change. Nature Climate Change, 8, 1087‒1091. https://www.nature.com/articles/s41558-018-0347-y
Romo, H., García-Barros, E., & Munguira, M. L. (2006). Distribución potencial de trece especies de mariposas diurnas amenazadas o raras en el área ibero-balear (Lepidoptera: Papilionoidea & Hesperioidea). Boletín Asociación Española de Entomología, 30, 25‒49.
Romo, H., Sanabria, P., & García-Barros, E. (2013). Predicción de los impactos del cambio climático en la distribución sobre las especies de Lepidoptera. El caso del género Boloria Moore, 1900 en la península Ibérica (Lepidoptera: Nymphalidae). SHILAP Revista de Lepidopterología, 41, 267‒286.
Root, T. L., Price, J. T., Hall, K. R., Schneider, S. H., Rosenzweig, C., & Pounds, J. A. (2003). Fingerprints of global warming on wild animals and plants. Nature, 421, 57‒60. https://doi.org/10.1038/nature01333
Roslin, T., Hardwick, B., Novotny, V., Petry, W. K., Andrew, N. R., & Asmus, A. (2017). Higher predation risk for insect prey at low latitudes and elevations. Science, 356, 742‒744. https://doi.org/10.1126/science.aaj1631
Ryding, S., Klaassen, M., Tattersall, G. J., Gardner, J. L. & Symonds, M. R. (2021). Shape-shifting: changing animal morphologies as a response to climatic warming. Trends in Ecology & Evolution, 36, 1036‒1048. https://doi.org/10.1016/j.tree.2021.07.006
Sandidge, J. S., & Hopwood, J. L. (2005). Brown recluse spiders: a review of biology, life history and pest management. Transactions of the Kansas Academy of Science, 108, 99‒108. http://dx.doi.org/10.1660/0022-8443(2005)108[0099:BRSARO]2.0.CO;2
Saupe, E. E., Papes, M., Selden, P. A., & Vetter, R. S. (2011). Tracking a medically important spider: climate change, ecological niche modeling, and the brown recluse (Loxosceles reclusa). Plos One, 6, 17‒31. https://doi.org/10.1371/journal.pone.0017731
Schramm, F. D., Valdez-Mondragón, A., & Prendini, L. (2021). Volcanism and palaeoclimate change drive diversification of the world’s largest whip spider (Amblypygi). Molecular Ecology, 30, 2872‒2890. https://doi.org/10.1111/mec.15924
Simó, M., Guerrero, J. C., Giuliani, L., Castellano, I., & Acosta, L. E. (2014). A predictive modeling approach to test distributional uniformity of Uruguayan harvestmen (Arachnida: Opiliones). Zoological Studies, 53, 1‒13. http://dx.doi.org/10.1186/s40555-014-0050-2
Soberón, J. M. (2010). Niche and area of distribution modeling: a population ecology perspective. Ecography, 33, 159‒167. http://dx.doi.org/10.1111/j.1600-0587.2009.06074.x
Solís-Catalán, K. P. (2020). Análisis morfométrico de estructuras sexuales y somáticas de las especies mexicanas de arañas del género Loxosceles Heineken y Lowe (Araneae, Sicariidae) del Centro-Occidente de México (M. Sc. Thesis). Centro Tlaxcala de Biología de la Conducta, Universidad Autónoma de Tlaxcala, Tlaxcala, México.
Solomon, S., Manning, M., Marquis, M., & Qin, D. (2007). Climate change 2007-the physical science basis: working group I contribution to the fourth assessment report of the IPCC. Vol. 4. London: Cambridge University Press.
Steen, V., Sofaer, H. R., Skagen, S. K., Ray, A. J., & Noon, B. R. (2017). Projecting species’ vulnerability to climate change: ¿which uncertainty sources matter most and extrapolate best? Ecology and Evolution, 7, 8841‒8851. https://doi.org/10.1002/ece3.3403
Stranges, S., Cuervo-Robayo, A. P., Martínez-Meyer, E., Morzaria-Luna, H. N., & Reyes-Bonilla, H. (2019). Distribución potencial bajo escenarios de cambio climático de corales del género Pocillopora (Anthozoa: Scleractinia) en el Pacífico oriental tropical. Revista Mexicana de
Biodiversidad, 90, 1‒16. https://doi.org/10.22201/ib.20078
706e.2019.90.2696
Swanson, D. L., & Vetter, R. S. (2009). Loxoscelism. Clinics in Dermatology, 24, 213‒221. https://doi.org/10.1016/j.clindermatol.2005.11.006
Taucare-Ríos, A., Nentwig, W., Bizama, G., & Bustamante, R. O. (2018). Matching global and regional distribution models of the recluse spider Loxosceles rufescens: to what extent do these reflect niche conservatism? Medical and Veterinary Entomology, 32, 490‒496. https://doi.org/10.1111/mve.12311
Ureta, C., González, E. J., Ramírez-Barrón, M., Contreras-Félix, G. A., & Santibáñez-López, C. E. (2020). Climate change will have an important impact on scorpion’s fauna in its most diverse country, Mexico. Perspectives in Ecology and Conservation, 18, 116‒123. https://doi.org/10.1016/j.pecon.2020.04.003
Uribe-Botero, E. (2015). El cambio climático y sus efectos en la biodiversidad en América Latina. Santiago de Chile: UNCEPAL.
Valdez-Mondragón, A. (2020). Expedición a Baja California para colecta de arañas violinistas. Boletín de la Asociación Mexicana de Sistemática de Artrópodos (AMXSA), 4, 11‒16.
Valdez-Mondragón, A., Cortez-Roldán, M. R., Juárez-Sánchez, A. R., Solís-Catalán, K. P., & Navarro-Rodríguez, C. I. (2018). Arañas de importancia médica: arañas violinistas del género Loxosceles en México, ¿qué sabemos acerca de su distribución y biología hasta ahora? Boletín de la Asociación Mexicana de Sistemática de Artrópodos (AMXSA), 2, 14‒24.
Valdez-Mondragón, A., Cortez-Roldán, M. R., Juárez-Sánchez, A. R., & Solís-Catalán, K. P. (2018). A new species of Loxosceles Heineken & Lowe (Araneae, Sicariidae), with updated distribution records and biogeographical comments for the species from Mexico, including a new record of Loxosceles rufescens (Dufour). Zookeys, 802, 39‒66. https://doi.org/10.3897/zookeys.802.28445
Valdez-Mondragón, A., Navarro-Rodríguez, C. I., Solís-Catalán, K. P., Cortez-Roldán, M. R., & Juárez-Sánchez, A. R. (2019). Under an integrative taxonomic approach: the description of a new species of the genus Loxosceles (Araneae, Sicariidae) from Mexico City. Zookeys, 892, 93–133. https://doi.org/10.3897/zookeys.892.39558
Vetter, R. S. (2005). Arachnids submitted as suspected brown recluse spiders (Araneae: Sicariidae): Loxosceles spiders are virtually restricted to their known distributions but are perceived to exist throughout the United States. Journal of Medical Entomology, 42, 512‒521. https://doi.org/10.1093/jmedent/42.4.512
Vetter, R. S. (2008). Spiders of the genus Loxosceles (Araneae, Sicariidae): a review of biological, medical and psychological aspects regarding envenomations. Journal of Arachnology, 36, 150‒163. http://dx.doi.org/10.1636/RSt08-06.1
Vetter, R. S. (2015). The brown recluse spider. Ithaca and London: Cornell University Press/ Comstock Publishing Associates.
Vetter, R. S., & Barger, D. K. (2002). An infestation of 2,055 brown recluse spiders (Araneae: Sicariidae) and no envenomations in a Kansas home: implications for bite diagnoses in nonendemic areas. Journal of Medical Entomology, 39, 948‒951. https://doi.org/10.1603/0022-2585-39.6.948
Vetter, R. S., & Bush, S. P. (2002). Reports of presumptive brown recluse spider bites reinforce improbable diagnosis in regions of North America where the spider is not endemic. Clinical Infectious Diseases, 35, 442‒445. https://doi.org/10.1086/341244
Vetter, R. S., Cushing, P. E., Crawford, R. L., & Royce, L. A. (2003). Diagnoses of brown recluse spider bites (loxoscelism) greatly outnumber actual verifications of the spider in four western American states. Toxicon, 42, 413‒418. https://doi.org/10.1016/s0041-0101(03)00173-9
Vié, J. C., Hilton-Taylor, C., & Stuart, S. N. (2009). Wildlife in a changing world: an analysis of the 2008 IUCN Red List of threatened species. Gland, Switzerland. IUCN.
Waltari, E., & Guralnick, R. P. (2009). Ecological niche modelling of montane mammals in the Great Basin, North America: examining past and present connectivity of species across basins and ranges. Journal of Biogeography, 36, 148‒161. http://dx.doi.org/10.1111/j.1365-2699.2008.01959.x
Walther, G. R., Post, E., Convey, P., Menzel, A., Parmesan, C., & Beebee, T. J. (2002). Ecological responses to recent climate change. Nature, 416, 389‒395. http://dx.doi.org/
10.1038/416389a
Warren, D. L., Glor, R. E., & Turelli, M. (2008). Environmental niche equivalency versus conservatism: quantitative approaches to niche evolution. Evolution: International Journal of Organic Evolution, 62,2868‒2883. https://doi.org/10.1111/j.1558-5646.2008.00482.x
Warren, D. L., & Seifert, S. N. (2011). Ecological niche modeling in Maxent: the importance of model complexity and the performance of model selection criteria. Ecological Applications, 21, 335‒342. https://doi.org/10.1890/10-1171.1
Watanabe, M., Suzuki, T., O’ishi, R., Komuro, Y., Watanabe, S., Emori, S. et al. (2010). Improved climate simulation by MIROC5: Mean states, variability, and climate sensitivity. Journal of Climate, 23, 6312‒6335. https://doi.org/10.1175/2010JCLI3679.1
Wiens, J. J., & Graham, C. H. (2005). Niche conservatism: integrating evolution, ecology, and conservation biology. Annual Review of Ecology, Evolution, and Systematics, 36, 519‒539. https://doi.org/10.1146/annurev.ecolsys.36.102803.095431
World Spider Catalog (WSC). (2024). World Spider Catalog. Version 25. Natural History Museum Bern, available at http://wsc.nmbe.ch
Yáñez-Arenas, C., Peterson, A. T., Rodríguez-Medina, K., & Barve, N. (2016). Mapping current and future potential snakebite risk in the new world. Climatic Change, 134, 697‒711.

Distribution of nonindigenous Basket clams (Corbicula spp.) in Mexico
Jeremy S. Tiemann a, *, Kevin S. Cummings a, Everardo Barba-Macías b, Charles R. Randklev c
a University of Illinois, Prairie Research Institute, Illinois Natural History Survey, 1816 South Oak Street, Champaign, IL 61820 USA
b El Colegio de la Frontera Sur, Departamento de Ciencias de la Sustentabilidad, Km 15.5 Carretera Reforma s/n, Ranchería Guineo Segunda Seccion, 86280 Villahermosa, Tabasco, Mexico
c Texas A&M University, Natural Resources Institute, A&M AgriLife Research and Extension Center at Dallas, 17360 Coit Road, Dallas, Texas 75252 USA
*Corresponding author: jtiemann@illinois.edu (J.S. Tiemann)
Recieved: 19 May 2023; accepted: 19 March 2024
Abstract
Corbicula spp. are one of the most prolific aquatic invasive species in the world and can have negative effects on aquatic ecosystems. We performed qualitative field surveys, examined literature accounts and natural history museum holdings, and accessed citizen science data sources to document the distribution of Corbicula in Mexico and shared drainages. Through 26 publications (N = 127 records), 312 museum holdings, and 446 iNaturalist records, we documented 885 records pertaining to Corbicula in Mexico and shared drainages with the USA. The first record of the species in Mexico was in 1969, and it has since been reported from 26 of the 32 Mexican states and most of the major river basins throughout the country. However, we suggest Corbicula are more prevalent in Mexico than we report in this work as it is often under sampled or under reported.
Keywords: Exotic species; Invasive species; Asian clams; Bivalvia; Freshwater systems
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Distribución de almejas canasta no nativas (Corbicula spp.) en México
Resumen
Algunas especies de Corbicula son de las especies invasoras acuáticas más prolíficas del mundo y pueden tener efectos negativos en los ecosistemas acuáticos. En este trabajo, realizamos estudios de campo cualitativos, examinamos literatura y registros en museos de historia natural y, además, revisamos datos de ciencia ciudadana para documentar la distribución de Corbicula en México y cuencas compartidas con EUA. A través de 26 publicaciones (N = 127 registros), 312 registros de museos y 446 registros de iNaturalist, documentamos 885 registros pertenecientes a Corbicula en México. El primer registro en México de la especie en el país data de 1969 y, desde entonces, ha sido reportada en 26 de los 32 estados mexicanos y en la mayoría de las principales cuencas hidrográficas del país. Sin embargo, creemos que Corbicula es más prevalente en Mexico de lo que reportamos en este trabajo, ya que frecuentemente no se muestrea o no se reporta de manera suficiente.
Palabras clave: Especies exóticas; Especies invasoras; Almejas asiáticas; Bivalvia; Ambientes dulceacuícolas
Introduction
Basket clams (Cyrenidae: Corbicula spp.), also commonly known as Asian clams, are moderately sized (to 50 mm) freshwater bivalves that have become one of the most successful aquatic invasive species to spread across the globe (Pigneur, Etoundi et al., 2014; Pigneur, Falisse et al., 2014). Native to the temperate/tropical regions of Asia, Africa, and Australia, Corbicula can be found on every continent except Antarctica (Bieler & Mikkelsen, 2019; Morton, 1986; Sousa et al., 2008). Species of the Genus Corbicula have been described as hyper-invasive aliens with great biofouling capabilities (Isom, 1986). Once established, Corbicula species can rapidly become extremely abundant and often affect water supply systems, alter nutrient regimes and food web dynamics, and potentially have deleterious effects to native freshwater mussel populations (Cohen et al., 1984; Counts, 1986; Haag, 2019; Isom, 1986; Sousa et al., 2008).
Corbicula taxonomy is in flux, as is the number of species that have become established outside of its native range (Hoagland, 1986). Corbicula were first recorded in North America in British Columbia, Canada, in 1924, and has since spread throughout the continent to areas in which winter water temperatures do not fall below 2 ºC (Benson & Williams, 2021; McMahon, 1999). At least 3 Corbicula taxa have become established in North America (Haponski & Ó Foighil, 2019; Lee et al., 2005; Tiemann et al., 2017). Corbicula have been sporadically collected in Mexico, with the first occurrence reported in 1969 from an irrigation ditch just north of Cerro Prieto, south of Mexicali in Baja California (Fox, 1970). However, Corbicula were present in the Río Grande/ Río Bravo in the USA as early as 1964 (Benson & Williams, 2021). Since then, it has spread throughout Mexico (Counts, 1991; López et al., 2019; Naranjo-García & Castillo-Rodríguez, 2017). It can become the most prevalent mollusk in streams (Czaja et al., 2022; Tiemann et al., 2020), and threatens to alter biologically diverse aquatic ecosystems in Mexico (Czaja et al., 2023).
Once established, Corbicula often becomes the most abundant benthic bivalve in streams. Tiemann et al. (2020) reported densities > 200 individuals/m2 in a small stream in the Río Conchos basin in northern Mexico. Corbicula life history characteristics (e.g., early sexual maturity, high fecundity, and ability to be actively and passively dispersed) favor rapid colonization and persistence in disturbed and unstable habitats (McMahon, 2002; Minchin & Boelens, 2018; Smith et al., 1986; Thompson & Sparks, 1977; Voelz et al., 1998). We herein attempt to summarize the distribution of Corbicula species in Mexico, as was done in the USA by Benson and Williams (2021).
Materials and methods
Data for Corbicula in Mexico and the shared drainages in the USA (i.e., Río Grande and Río Colorado) were compiled from 4 sources. First, we conducted qualitative freshwater mollusk surveys in the Grande, Pánuco, Papaloapan, and Usumacinta basins in the Mexican states of Chihuahua, San Luis Potosí, Veracruz, Tabasco, and Chiapas in 2017-2022 (see Inoue et al., 2020; Kiser et al., 2022; Tiemann et al., 2020). Second, we reviewed literature accounts of Corbicula in Mexico and shared drainages (Barba-Macías & Trinidad-Ocaña, 2017; Benson & Williams, 2021; Contreras-Arquieta & Contreras-Balderas, 1999; Counts, 1991; Counts et al., 2003; Czaja et al., 2022, 2023; Davis, 1980; Dinger et al., 2005; Fox 1970, 1971; Gutiérrez-Galindo et al., 1988; Hillis & Mayden, 1985; López-López et al., 2009, 2019; Naranjo-García & Castillo-Rodríguez, 2017; Naranjo-García & Meza-Meneses, 2000; Naranjo-García & Olivera-Carrasco, 2014; Ramírez et al., 2022; Ramírez-Herrera & Urbano, 2014; Rico-Sánchez et al., 2020; Ruelas-Inzunza et al., 2007, 2009; Tiemann et al., 2020; Torres-Orozco & Revueltas-Valle, 1996; Trinidad-Ocaña et al., 2018). Third, we gathered from the following natural history museums and collections: Colección Nacional de Moluscos, Instituto de Biología, Universidad Nacional Autónoma de Mexico (CNMO); Carnegie Museum of Natural History, Pittsburgh (CM); Delaware Museum of Natural History, Wilmington (DMNH); Field Museum of Natural History, Chicago (FMNH); Florida Museum, University of Florida, Gainesville (UF); Illinois Natural History Survey, Champaign (INHS); Museum of Comparative Zoology, Harvard University (MCZ); National Museum of Natural History, Smithsonian Institution (USNM); New Mexico New Mexico Museum of Natural History and Science, Albuquerque (NMMNH); Ohio State University Museum of Biological Diversity, Columbus (OSUM); Santa Barbara Museum of Natural History (SBMNH); Strecker Museum, Baylor University, Waco, Texas (SMBU); Facultad de Ciencias Biológicas de la Universidad Juárez del Estado de Durango, Colección de Moluscos (UJMC); University of Michigan Museum of Zoology, Ann Arbor (UMMZ); and the University of Texas – El Paso Biodiversity Collections (UTEP) (most museum codes follow Sabaj [2020]). Lastly, we used data from iNaturalist (www.iNaturalist.org; accessed on 1 November 2023), which is a citizen science sourced database.
We verified or re-identified each record to the species level, if possible, from the image(s) provided on-line, by curators, or those posted on iNaturalist. We excluded those records with missing or imprecise locality data, as well as those that could not be identified (e.g., poor quality photographs) from our database. The database is archived in the Illinois Data Bank (https://doi.org/10.13012/B2IDB-9221608_V1) and is available for future studies.
Results
We found 26 publications (N = 127 records), 312 museum lots, and 446 iNaturalist records, which totaled 885 records pertaining to Corbicula in Mexico and shared drainages (684 from Mexico and 201 from the USA; Table 1). Corbicula have been collected throughout Mexico from the Río Grande and Colorado at the U.S. border southward to the Río Usumacinta basin along the Guatemalan border (Fig.1). Corbicula have been collected in a wide variety of waterbodies, including estuarine wetlands, irrigation ditches, manmade impoundments, large rivers, and headwater streams (e.g., < 2 m wide). Corbicula have been recorded from 26 of the 32 Mexican states (Table 1) and most of the major river basins (Table 2), but we feel it is highly probable that Corbicula are more prevalent in Mexico than we report as it is often under-sampled. The 6 Mexican states without verified records include: Aguascalientes, Baja California Sur, Campeche, Mexico City, Tlaxcala, and Yucatán. Citizen scientists provided 4 unique state records for Corbicula in Mexico not reported in the literature or represented in museums (Table 1). In addition, > 50% of the records were from citizen observations via iNaturalist, which demonstrates how citizen scientists can contribute important data, especially in understudied areas.
Most Corbicula accounts from Mexico are classified as either Corbicula fluminea (Müller, 1774) or simply Corbicula. However, there are at least 2 Corbicula taxa in Mexico —Corbicula fluminea (form A, white nacre) and Corbicula largillierti (Philippi, 1844) (form B, purple nacre)— as identified by Lee et al. (2005) and Tiemann et al. (2017) (Figs. 1, 2), and both can occur in the same basin, often syntopically (e.g., Río San Juan and Río Soto la Marina basin, Hillis & Mayden, 1985; Río Conchos basin, Tiemann et al., 2020). The distinguishing characteristics are subtle but more pronounced in younger individuals that become less obvious as individuals mature and become large (Tiemann et al., 2017). In young / small (< 25 mm) individuals, C. fluminea has more pronounced external ridges, yellowish periostracum, and white nacre, whereas C. largillierti has less pronounced but tighter ridges, olive periostracum, and purple nacre (Fig. 2). Because most of the specimens examined were from photographs, we could not rule out additional taxa being present in Mexico and we could not verify all records to species, especially those from the historical literature and some iNaturalist photos. We speculate that some unvouchered specimens reported as C. fluminea are likely C. largillierti.
Discussion
Determining the dispersal chronology of Corbicula in Mexico is difficult for a variety of reasons. Unlike freshwater mussels (Unionidae), which are transported within and between river systems via fishes as part of their reproductive cycle, these clams are not dependent on fishes for dispersal. The origins and ensuing dispersion pathways of Corbicula are still poorly known, but it is thought to be a combination of both human-mediated activities such as aquaria releases and bait bucket introductions, and natural dispersal such as passive drift or via intestinal passage through fishes (Gatlin et al., 2013; McMahon, 1999; Naranjo-García & Castillo-Rodríguez, 2017; Sousa et al., 2008). Another confounding factor in determining the chronology of invasion is that there are no regular systematic sampling programs in Mexico that would serve to document the arrival dates in select basins or areas of the country. The literature has also been sporadic and uneven in reporting Corbicula in Mexico. We have summarized the known records and dates of occurrence of Corbicula by major drainage basin (Table 2).
Table 1
List of Mexican states where Corbicula has been found, the year in which the species was first reported, the water body where it was found, the source (citation or museum accession number; museum codes can be found in the methods section) of the first collection, and the number of records we found. These Corbicula records, including data sources, were archived in the Illinois Data Bank (https://doi.org/10.13012/B2IDB-9221608_V1).
| State | First year reported | Waterbody | Source | Number of lots/ records |
| Baja California | 1969 | Irrigation canal, Cerro Prieto | Fox, 1970 | 36 |
| Chiapas | 2009 | Río Lacantún | CNMO 3284, Naranjo-García & Olivera-Carrasco, 2014 | 73 |
| Chihuahua | 1996 | Río Conchos | UTEP 13683, Benson & Williams, 2021 | 107 |
| Coahuila | 1976 | Irrigation canal, Municipio Juarez | UTEP 4836 | 15 |
| Colima | 2006 | Río Armería | CNMO 1720, Naranjo-García & Olivera-Carrasco, 2014 | 6 |
| Durango | 2006 | Presa La Vega, Teuchitlán | CNMO 1679, Naranjo-García & Olivera-Carrasco, 2014 | 53 |
| Estado de México | 2014 | Pond, E of Laguna de Zumpango | iNaturalist, 2023 | 8 |
| Guanajuato | 2018 | Arroyo Hondo | iNaturalist, 2023 | 4 |
| Guerrero | 2009 | Trib. Pacific, W of Petacalco and Río Atoyac | CNMO 5542 | 5 |
| Hidalgo | 2014 | Río Venados | iNaturalist, 2023 | 4 |
| Jalisco | 1981 | Trib. Lago de Chapala | UF 34919, Hillis & Mayden, 1985 | 47 |
| Michoacán | 2008 | Río Atoyac (Balsas) | CNMO 2827, Naranjo-García & Olivera-Carrasco, 2014 | 10 |
| Morelos | 2005 | Río Amacuzac | CNMO 1599 | 9 |
| Nayarit | 1969 | Playa Novillero | DMNH 92579, Hillis & Mayden, 1985 | 7 |
| Nuevo León | 1976 | Ríos Salado and San Juan | UTEP 4860, UTEP 4828 | 33 |
| Oaxaca | 1998 | Dominguillo (S San Juan Bautista Cuicatlán) | CNMO 771, Naranjo-García & Olivera-Carrasco, 2014 | 13 |
| Puebla | 2020 | Río Pantapec | iNaturalist, 2023 | 1 |
| Querétaro | 2017 | Río Jalpan | Rico-Sanchez et al., 2020 | 6 |
| Quintana Roo | 1972 | Unknown | DMNH 237279 | 2 |
| San Luis Potosí | 1993 | Río Huichihuayán | UF 211359, Benson & Williams, 2021 | 29 |
| Sinaloa | 1970 | Río Fuerte | Fox, 1971; Counts, 1991 | 37 |
| Sonora | 1970 | Río Colorado | Counts, 1991 | 28 |
| Tabasco | 2011 | Multiple locations in the Grijalva basin | Barba-Macías & Trinidad-Ocaña, 2017 | 37 |
| Tamaulipas | 1969 | Falcon Reservoir | OSUM 22683 | 41 |
| Veracruz | 1992 | Laguna de Catemaco | Torres-Orozco & Revueltas-Valle, 1996 | 71 |
| Zacatecas | 2006 | Río Juchipila | CNMO 1690, 1692, Naranjo-García & Olivera-Carrasco, 2014 | 2 |
Table 2
List of Mexican rivers/ lakes drainages (Dr.) from north to south where Corbicula spp.have been found and the year first reported. These Corbicula records, including data sources, were archived in the Illinois Data Bank (https://doi.org/10.13012/B2IDB-9221608_V1).
| Waterbody where it was first found | Year of first occurrence |
| Gulf of Mexico Basin | |
| Río Grande Dr. – Falcon Reservoir, Tamaulipas | 1969 |
| Río San Fernando, Tamaulipas | 1974 |
| Río Soto la Marina Dr – unnamed stream, Tamaulipas | 1981 |
| Río Pánuco Dr. – Río Comandante, Tamaulipas | 1990 |
| Río Tecolutla, Veracruz | 2007 |
| Río Papaloapan Dr. – Laguna de Catemaco, Veracruz | 1992 |
| Río Coatzacoalcos, Veracruz | 2005 |
| Río Usumacinta Dr. – Río Lacantún, Chiapas | 2009 |
| Colorado/Gulf of California Basin | |
| Irrigation canal, Baja California | 1969 |
| Río Yaqui, Sonora | 1970 |
| Río Fuerte, Sinaloa | 1970 |
| Pacific Coastal Basin | |
| Río San Pedro, Mezquital, Durango | 2006 |
| Playa Novillero, Nayarit | 1969 |
| Río Grande de Santiago Dr., Jalisco | 1981 |
| Río Ameca, Jalisco | 1982 |
| Río Cuitxmala, Jalisco | 1993 |
| Río Armería, Colima | 1986 |
| Río Atoyac (Balsas), Michoacán | 2008 |
| Río Amacuzac, Morelos | 2005 |
| Caribbean Basin | |
| Cozumel, Quintana Roo | 1971 |
Río Colorado Basin
Corbicula were first reported in the Colorado River at Yuma, Arizona, USA, on the California border in 1955 (Benson & Williams 2021; Counts, 1991). It was first reported from Mexico from an irrigation canal in the Colorado River basin in Baja California in 1969 (Fox 1970). However, there is a specimen (SBMNH 697249) from the Río Cihuatlán (also called the Río Chacala or Marabasco) along the Pacific Coast at Manzanillo, Colima collected in 1965. That locality is problematic, as the Río Cihuatlán does not run through Manzanillo. It does however pass through the city of Cihuatlán, Jalisco. Counts (1991) summarized the occurrences for Corbicula in Mexico and provided a new record for the Río Colorado basin from the Río Mayo (UF 247535), Sonora collected in 1972.
Río Grande del Norte Basin
Corbicula were first found in the Río Grande basin in 1969 in the Falcon Reservoir, Tamaulipas (OSUM 22683) and along the Pacific coast at Playa Novillero in Nayarit (DMNH 92579; Hillis & Mayden, 1985; Counts, 1991; Table 2) —suggesting multiple invasions have occurred, as has been reported elsewhere (Benson & Williams, 2021). Based on collections made as early as 1975 in the upper Río Grande in Texas (Davis, 1980), Benson and Williams (2021) noted that Corbicula were likely present in the states of Chihuahua and Coahuila prior to 1996. This is borne out by museum specimens from the ríos Salado (UTEP 4860) and San Juan (UTEP 4828), Nuevo León collected by A.L. Metcalf in May 1976, an irrigation canal at Municipio Villa Juárez, Coahuila in 1976, and the Río Escondido, Coahuila in 1978 (UTEP 6810). Contreras-Arquieta and Contreras-Balderas (1999) reported Corbicula as common in Presa Rodrigo Gómez in the Río Grande basin, Nuevo Léon in 1984. Tiemann et al. (2020) found live individuals of C. fluminea and C. largillierti at 10 sites in the Río Conchos (Río Grande basin), Chihuahua in May 2018.
Ríos Carrizal, Soto la Marina, etc. basins
Hillis and Mayden (1985) summarized the data to date on the presence of Corbicula in Mexico and the neotropics. In January 1984, they investigated various river systems along the Gulf Coast in northeastern Mexico for evidence of Corbicula and found populations of both the “white and purple forms” in the San Juan River (Río Grande basin), at el Castillo, Nuevo León, and an unnamed tributary of the Río Corona (Soto la Marina basin), 3 km S of Mex. Hwy. 101, Tamaulipas (Hillis & Mayden, 1985). However, they failed to find either form in the Río San Fernando, which lies between the Río San Juan and Río Soto la Marina basins. There is an unpublished record from the Río San Fernando at Mexico Highway 101/180 collected by A.L. Metcalf in May 1974 (UTEP 15126). The authors also found no evidence of Corbicula in Río Purificación, despite the presence of both species of Corbicula in the Río Corona branch of the Soto la Marina basin. Further, Hillis and Mayden (1985) found no evidence of the purple form of Corbicula south of the Río Soto la Marina basin, or of either form south of the Río Carrizal basin, even though they sampled at several sites in the ríos Pánuco, Tuxpan (= Pantepec), Nautla, Blanco, and Balsas. There are numerous records post-1985 in the Río Soto la Marina basin from Presa Vicente Guerrero and Arroyo San Felipe, the Río San Fernando in Tamaulipas, and the Río Pantepec, Veracruz, which lies between the Pánuco and Papaloapan (López-López et al., 2009).

Figure 1. Distribution of Corbicula species —Corbicula fluminea (form A; black dots) and Corbicula largillierti (form B; purple dots)— in Mexico and the Colorado and Río Grande river basins in the southern USA based upon our compilation of records as described in the Materials and methods section. These Corbicula records, including data sources, were archived in the Illinois Data Bank (https://doi.org/10.13012/B2IDB-9221608_V1).

Figure 2. The 2 Corbicula speciesin Mexico —Corbicula fluminea (Müller, 1774) (form A, left) and Corbicula largillierti (Philippi, 1844) (form B, right). Images modified from Tiemann et al. (2017).
Río Pánuco basin
Continuing south along the Gulf of Mexico coast, C. fluminea began showing up in the Río Pánuco basin from the Río Comandante, Tamaulipas in January 1990 (UF 159751; Counts, 1991), the Río Huichihuayán, San Luis Potosí in July 1993 (UF 211359; Benson & Williams 2021), and the Río Tempoal, Veracruz in February 1994 (INHS 89423). Rico-Sánchez et al. (2020) reported C. fluminea from 6 sites in the Río Pánuco basin in the Biosphere Reserve Sierra Gorda, Querétaro between February and July 2017. We (JST & KSC) collected Corbicula fluminea from 16 sites in the Río Pánuco basin, San Luis Potosí in 2017-2018.
Río Papaloapan basin
Torres-Orozco and Revueltas-Valle (1996) found several empty valves of C. fluminea in Laguna de Catemaco, Veracruz in 1992. Later, they confirmed the presence of C. fluminea at several localities along the southeastern shore of the lake: Las Margaritas, Ahuacapan, and Cuetzalapan in September 1994, which they attributed to dispersal by migratory birds (Torres-Orozco & Revueltas-Valle, 1996). Naranjo-García and Olivera-Carrasco (2014) reported C. fluminea from the Río Atoyac (Río Jamapa basin), ca. 16 km from Cordoba in August 1997 (CNMO 689). Ruelas-Inzunza et al. (2007) found C. fluminea further south in the Río Coatzacoalcos, Veracruz in 2005, and Naranjo-García and Olivera-Carrasco (2014) also reported it from the Río Coatzacoalcos in 2012 (CNMO 4009). Barba-Macías and Trinidad-Ocaña (2017) found C. fluminea at 7 sites in the Río Papaloapan basin in 2013.
Río Usumacinta basin
The first record of C. fluminea reported from the Río Usumacinta basin was from the Río Lacantún in Chiapas in 2007 and numerous other sites in or near the Reserva de la Biosfera Montes Azules in Chiapas and Tabasco from 2009-2022 (Barba-Macías & Trinidad-Ocaña, 2017; Naranjo-García & Olivera-Carrasco, 2014; Ramírez et al., 2022; CNMO Collection data). We also collected both C. fluminea and C. largillierti at 8 sites in the Río Usumacinta basin, Tabasco and Chiapas in 2019.
Pacific: Mesa Central & Balsas basins
Mesa Central and Balsas Region lies south of the Colorado and west of the Río Pánuco basins. There are numerous endorheic basins in this area (e.g., Llanos El Salado and Río Nazas). The area is largely drained by the Lerma-Santiago system. The Río Lerma mainstem is > 700 km long and empties into the Lago de Chapala, which is Mexico’s largest lake, and then into the Río Grande de Santiago, which drains into the Pacific. Comparably, the Río Balsas (also locally known as the Río Mezcala or Río Atoyac) has its headwaters in the western slope of the Continental Divide, southeast of the city of Puebla, and flows southwest where it empties into the Pacific Ocean at the border of Guerrero and Michoacán. This area is highly mountainous with the Sierra Madre Occidental reaching its southern limit here and the Río Balsas cutting through the Sierra Madre del Sur and Eje Volcánico Transversal. Corbicula fluminea first appeared along the Pacific Coast at Playa Novillero in Nayarit in 1969 (DMNH 92579; Table 2) and the Río Fuerte in Sinaloa in May 1971 (USNM 892340 and USNM 903657; Ramírez-Herrera & Urbano, 2014). There are numerous records of both C. fluminea and C. largillierti in the Mesa Central in the endorheic Nazas System, Armería, Atoyac (Balsas), Elota, Fuerte, and Río Grande de Santiago basins in the states of Durango, Guanajuato, Guerrero, Jalisco Michoacán, Morelos, Nayarit, Sinaloa, and Zacatecas. States (i.e., Baja California Sur and Yucatán) or areas with few or no records of Corbicula may be attributed to a lack of collecting or suitable habitat in those places.
Caribbean basin
There are odd records of both C. fluminea (DMNH 237279) and C. largillierti (DMNH 249472) from Cozumel, Quintana Roo in 1972. Whether they got to the island via humans, fish, or another method is unknown.
The biodiversity of some countries, like Mexico (Inoue et al., 2020; Kiser et al., 2022), is understudied and citizen scientists play an integral role in collecting data and aid in documenting new occurrences of invasive species (Barbato et al., 2021; Di Decco et al., 2021; Tiemann et al., 2022). This collaboration is critical in advancing our knowledge and conservation of our natural environment. However, as scientists, we must train and encourage citizen scientists to collect useful and verifiable data, as we discovered a misidentification error rate of ~ 10% and could not verify all Corbicula records submitted to iNaturalist due to photo quality or specimen orientation. We encourage future observers to take close-ups of both the external and internal sides of the shells to better aid in proper identification (i.e., similar to Fig. 2).
Our study was an attempt to summarize the known records of Corbicula taxa in Mexico. Given that several areas in Mexico are under sampled, it seems likely that Corbicula are established in additional areas (e.g., Pacific slope drainages) not reported here. We encourage colleagues to voucher specimens in natural history museums, as well as citizen scientists to take high quality photographs and upload them to iNaturalist with precise locality data when Corbicula are encountered, to help continue to document the spread of this invasive species in Mexico and Central America.
Acknowledgments
We thank A. Burden, E. Corona, J. de la Rosa Bolón, E. Gonzalez, P. Gonzalez, M. Hart, K. Inoue, N. Johnson, M. Larimore, T. Miller, A. Pieri, and A. Reyes-Gómez for assistance in the field; A. Benson for sharing known USGS Mexican Corbicula data; and SUP Kentucky and Kayak Huasteca, especially A. Koch, H. Warman, E. Aguado, C. Morones, and A. Reza, for providing priceless logistical support while in Mexico. E. Naranjo (CNMO); T. Pearce (CM); E. Shea and A. Kittle (DMNH); R. Bieler (FMNH); J. Slapcinsky (UF); J. Trimble (MCZ); J. Pfeiffer and Y. Villacampa (USNM); L. Frederick (NMMNH); N. Shoobs (OSUM); H. Chaney and V. Delnavaz (SBMNH); A. Bendict and C. Smith (SMBU); A. Czaja (UJMC); D. Ó Foighil and T. Lee (UMMZ); and E. Walsh and M. Zhuang (UTEP) for generously providing access to specimens and data under their care. T. Lee (UMMZ) helped confirm difficult identifications, and T. Contreras-Macbeth (Universidad Autónoma del Estado de Morelos) shared their records of Corbicula in Mexico. Partial funding was provided by a U.S. Fish & Wildlife Service grant (F17AC01008), the Mohamed bin Zayed Species Conservation Fund, and the University of Illinois’ Mexican and Mexican American Students System Initiative.
References
Barba-Macías, E., & Trinidad-Ocaña, C. (2017). Nuevos registros de la almeja asiática invasora Corbicula fluminea (Bivalvia: Veneroida: Cyrenidae) en humedales de las cuencas Papaloapan, Grijalva y Usumacinta. Revista Mexicana de Biodiversidad, 88, 450–453. https://doi.org/10.1016/j.rmb.2016.10.021
Barbato, D., Benocci, A., Guasconi, M., & Manganelli, G. (2021). Light and shade of citizen science for less charismatic invertebrate groups: quality assessment of iNaturalist nonmarine mollusc observations in central Italy. Journal of Molluscan Studies, 87, eyab033. https://doi.org/10.1093/mollus/eyab033
Benson, A. J., & Williams, J. D. (2021). Review of the invasive Asian clam Corbicula spp. (Bivalvia: Cyrenidae) distribution in North America, 1924–2019. Gainesville: U.S. Geological Survey. Scientific Investigations Report 2021–5001. https://doi.org/10.3133/sir20215001
Bieler, R., & Mikkelsen, P. M. (2019). Cyrenidae Gray, 1840, Chapter 35. In C. Lydeard, & K. S. Cummings (Eds.), Freshwater mollusk families of the World (pp. 187–192). Baltimore, Maryland: Johns Hopkins University Press.
Cohen, R. R. H., Dresler, P. V., Phillips, E. J. P., & Cory, R. L. (1984). The effect of the Asiatic clam, Corbicula fluminea, on phytoplankton of the Potomac River, Maryland. Limnology and Oceanography, 29, 170–180. https://doi.org/10.4319/lo.1984.29.1.0170
Contreras-Arquieta, A., & Contreras-Balderas, S. (1999). Description, biology, and ecological impact of the Screw Snail, Thiara tuberculata (Müller, 1774) (Gastropoda: Thiaridae) in Mexico. In R.Claudi, & J. H. Leach (Eds.), Nonindigenous freshwater organisms, vectors, biology, and impacts (pp. 151–160). Boca Raton: Lewis Press.
Counts III, C. L. (1986). The zoogeography and history of the invasion of the United States by Corbicula fluminea (Bivalvia: Corbiculidae). American Malacological Bulletin, Special Edition No., 2, 7–39.
Counts III, C. L. (1991). Corbicula (Bivalvia: Corbiculidae) Part 1. Catalog of fossil and recent nominal species. Part 2. Compendium of zoogeographic records of North America and Hawaii, 1924-1984. Tryonia, 21, 1–134.
Counts III, C. L., Villaz, J. R., & Gomez H, J. A. (2003). Occurrence of Corbicula fluminea (Bivalvia: Corbiculidae) in Panama. Journal of Freshwater Ecology, 18, 497–498.
Czaja, A., Becerra-López, J. L., Estrada-Rodríguez, J. L., Romero-Méndez, U., Cardoza-Martínez, G. F., Sáenz-Mata, J. et al. (2022). The Sabinas River basin in Coahuila, a new hotspot of molluscan biodiversity near Cuatro Ciénegas, Chihuahuan Desert, northern Mexico. Revista Mexicana de Biodiversidad, 93, 1–22. https://doi.org/10.22201/ib.20078706e.2022.93.3588
Czaja, A., Covich, A. P., Becerra-López, J. L., Cordero-Torres, D. G., & Estrada-Rodríguez, J. L. (2023). The freshwater mollusks of Mexico: can we still prevent their silent extinction? In R. W. Jones, C. P. Ornelas-García, R. Pineda-López, & F. Álvarez. (Eds.), Mexican Fauna in the Anthropocene (pp. 81–103). Cham, Switzerland: Springer Nature Switzerland AG. https://doi.org/10.1007/978-3-031-17277-9
Davis, J. R. (1980). Species composition and diversity of benthic macroinvertebrates in the upper Río Grande,
Texas. Southwestern Naturalist, 25, 137–150.
Di Decco, G. J., Barve, V., Belitz, M. W., Stucky, B. J., Guralnick, R. P., & Hurlbert, A. H. (2021). Observing the observers: how participants contribute data to iNaturalist and implications for biodiversity science. Bioscience, 71, 1179–1188. https://doi.org/10.1093/biosci/biab093
Dinger, E. C., Cohen, A. E., Hendrickson, D. A., & Marks, J. C. (2005). Aquatic invertebrates of Cuatro Cienegas, Coahuila, Mexico: natives and exotics. Southwestern Naturalist, 50,237–281.
Fox, R. O. (1970). Corbicula in Baja California. The Nautilus, 83, 145.
Fox, R. O. (1971). The Corbicula story, Chapter 3. Abstracts and Proceedings of the Fourth Annual Meeting of the Western Society of Malacologists, 4, 20.
Gatlin, M. R., Shoup, D. E., & Long, J. M. (2013). Invasive Zebra mussels (Driessena polymorpha) and Asian clams (Corbicula fluminea) survive gut passage of migratory fish species: implications for dispersal. Biological Invasions, 15, 1195–1200. https://doi.org/10.1007/s10530-012-0372-0
Gutiérrez-Galindo, E. A., Flores-Muñoz, G., & Villaescusa-Celaya, J. (1988). Chlorinated hydrocarbons in Molluscs of the Mexicali Valley and upper Gulf of California. Ciencias Marinas, 14, 91–113. https://doi.org/10.7773/cm.v14i3.599
Haag, W. R. (2019). Reassessing enigmatic mussel declines in the United States. Freshwater Mollusk Biology and Conservation, 22, 43–60. https://doi.org/10.31931/fmbc.v22
i2.2019.43-60
Haponski, A. E., & Ó Foighil, D. (2019). Phylogenomic analyses confirm a novel invasive North American Corbicula (Bivalvia: Cyrenidae) lineage. PeerJ, 7, e7484. https://10.7717/peerj.7484
Hillis, D. M., & Mayden, R. L. (1985). Spread of the Asiatic clam Corbicula (Bivalvia: Corbiculacea) into the New World tropics. Southwestern Naturalist, 30, 454–456. https://doi.org/10.2307/3671285
Hoagland, K. E. (1986). Unsolved problems and promising approaches in the study of Corbicula. American Malacological Bulletin, Special Edition No., 2, 203–209.
iNaturalist. (2023). Naturalist community: Observations of Corbicula from Mexico. Retrieved on 20 April 2023 from: www.iNaturalist.org
Inoue, K., Cummings, K. S., Tiemann, J. S., Miller, T. D., Johnson, N. A., Smith, C. H. et al. (2020). A new species of freshwater mussel in the genus Popenaias Frierson, 1927, from Gulf coastal rivers of central Mexico (Bivalvia: Unionida: Unionidae) with comments on the genus.
Zootaxa, 4816, 457–490. https://doi.org/10.11646/zootaxa.
4816.4.3
Isom, B. G. (1986). Historical review of Asiatic Clam (Corbicula) invasion and biofouling of waters and industries in the Americas. American Malacological Bulletin, Special Edition No., 2, 1–5.
Kiser, A. H., Cummings, K. S., Tiemann, J. S., Smith, C. H., Johnson, N. A., López, R. R. et al. (2022). Using a multi-model ensemble approach to determine biodiversity hotspots with limited occurrence data in understudied areas: an example using freshwater mussels in México. Ecology and Evolution, 12, e8909. https://doi.org/10.1002/ece3.8909
Lee, T., Siripattrawan, S., Ituarte, C., & Ó Foighil, D. (2005). Invasion of the clonal clams: Corbicula lineages in the New World. American Malacological Bulletin, 20, 113–122.
López, E., Garrido-Olvera, L., Benavides-González, F., Blanco-Martínez, Z., Pérez-Castañeda, R., Sánchez-Martinez, J. G. et al. (2019). New records of invasive mollusks Corbicula fluminea (Müller, 1774), Melanoides tuberculata (Müller, 1774) and Tarebia granifera (Lamarck, 1816) in the Vicente Guerrero Reservoir, Mexico. Bioinvasions Records, 8, 640–652. https://doi.org/10.3391/bir.2019.8.3.21
López-López, E., Sedeño-Díaz, J. E., Vega, P. T., & Oliveros, E. (2009). Invasive mollusks Tarebia granifera Lamarck, 1822 and Corbicula fluminea Müller, 1774 in the Tuxpam and Tecolutla rivers, Mexico: spatial and seasonal distribution patterns. Aquatic Invasions, 4, 435–450. https://doi.org/10.3391/ai.2009.4.3.2
McMahon, R. F. (1999). Invasive characteristics of the freshwater bivalve Corbicula fluminea. In R. Claudi, & J. H. Leach (Eds.), Nonindigenous freshwater organisms, vectors, biology, and impacts (pp. 315–343). Boca Raton: Lewis Press.
McMahon, R. F. (2002). Evolutionary and physiological adaptations of aquatic invasive animals: r selection versus resistance. Canadian Journal of Fisheries and Aquatic Sciences, 59, 1235–1244. https://doi.org/10.1139/f02-105
Minchin, D., & Boelens, R. (2018). Natural dispersal of the introduced Asian Clam Corbicula fluminea (Müller, 1774) (Cyrenidae) within two temperate lakes. Bioinvasions Records, 7, 259–268. https://doi.org/10.3391/bir.2018.7.3.06
Morton, B. (1986). Corbicula in Asia –an updated synthesis. American Malacological Bulletin, Special Edition No., 2, 113–124.
Naranjo-García, E., & Castillo-Rodríguez, Z. G. (2017). First inventory of the introduced and invasive mollusks in Mexico. The Nautilus, 131, 107–126.
Naranjo-García, E., & Meza-Meneses, G. (2000). Moluscos. In G. de la Lanza-Espino, S. Hernández-Pulido, & J. L. Carbajal-Pérez (Eds.), Organismos indicadores de la calidad del agua y de la contaminación (bioindicadores) (pp. 309–404). Cd. de México: Editorial Plaza y Valdés S.A. de C. V.
Naranjo-García, E., & Olivera-Carrasco, M. T. (2014). Moluscos dulceacuícolas introducidos e invasores. In R. Mendoza, & P. Koleff (Coords.), Especies acuáticas invasoras en México (pp. 337–345). Cd. de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Pigneur, L. M., Etoundi, E., Aldridge, D. C., Marescaux, J., Yasuda, N., & Van Doninck, K. (2014). Genetic uniformity and long-distance clonal dispersal in the invasive androgenetic Corbicula clams. Molecular Ecology, 23, 5102–5116. https://doi.org/10.1111/mec.12912
Pigneur, L. M., Falisse, E., Roland, K., Everbecq, E., Deliège, J. F., Smitz, J. S. et al. (2014). Impact of invasive Asian clams, Corbicula spp., on a large river ecosystem. Freshwater Biology, 59, 573–583. https://doi.org/10.1111/fwb.12286
Ramírez, C., Barba, R., Caspeta, J. M., Córdova, F., Espinosa, H., Larre, S. et al. (2022). Biota acuática de la cuenca media del río Lacantún, Chiapas y la importancia del monitoreo de largo plazo. Revista Mexicana de Biodiversidad, 93, e934844. https://doi.org/10.22201/ib.20078706e.2022.93.4844
Ramírez-Herrera, M., & Urbano, B. (2014). Moluscos invasores de México. Conabio. Biodiversitas, 112, 6–9.
Rico-Sánchez, A. E., Sundermann, A., López-López, E., Torres-Olvera, M. J., Mueller, S., & Haubrock, P. (2020). Biological diversity in protected areas: not yet known but already threatened. Global Ecology and Conservation, 22, e01006. https://doi.org/10.1016/j.gecco.2020.e01006
Ruelas-Inzunza, J., Gárate-Viera, Y., & Páez-Osuna, F. (2007). Lead in clams and fish of dietary importance from Coatzacoalcos estuary (Gulf of Mexico), an industrialized tropical region. Bulletin of Environmental Contamination and Toxicology, 79, 508–513. https://doi.org/10.1007/s00128-007-9285-5
Ruelas-Inzunza J., Spanopoulos-Zarco, P., & Páez-Osuna, F. (2009). Cd, Cu, Pb and Zn in clams and sediments from an impacted estuary by the oil industry in the southwestern Gulf of Mexico: concentrations and bioaccumulation factors. Journal of Environmental Science and Health, Part A, 44, 1503–1511. https://doi.org/10.1080/10934520903263280
Sabaj, M. H. (2020). Codes for Natural History Collections in Ichthyology and Herpetology. Copeia, 108, 593–669. https://doi.org/10.1643/asihcodons2020
Smith, L. M., Vanglider, L. D., Hoppe, R. T., Morreale, S. J., & Brisbin Jr, I. L. (1986). Effect of diving ducks on benthic food resources during winter in South Carolina, U.S.A. Wildfowl, 37, 136–141.
Sousa, R., Antunes, C. & Guilhermino, L. (2008). Ecology of the invasive Asian clam, Corbicula fluminea (Müller, 1774) in aquatic ecosystems: an overview. Annales de Limnologie – International Journal of Limnology, 44, 85–94. https://doi.org/10.1051/limn:2008017
Thompson, C. M., & Sparks, R. E. (1977). Improbability of dispersal of adult Asiatic clams, Corbicula manilensis, via the intestinal tract of migratory waterfowl. American Midland Naturalist, 98, 219–223. https://doi.org/10.2307/2424727
Tiemann, J. S., Haponski, A. E., Douglass, S. A., Lee, T., Cummings, K. S., Davis, M. A. et al. (2017). First record of a putative novel invasive Corbicula lineage discovered in the Illinois River, Illinois, USA. Bioinvasions Records, 6, 159–166. https://doi.org/10.3391/bir.2017.6.2.12
Tiemann, J. S., Inoue, K., Rodríguez-Pineda, J. A., Hart, M., Cummings, K. S., Naranjo-García, E. et al. (2020). Status of freshwater mussels (Unionidae) of the Río Conchos basin, Chihuahua, Mexico. Southwestern Naturalist, 64, 180–186. https://doi.org/10.1894/0038-4909-64.3-4.180
Tiemann, J. S., Stodola, A. P., Douglass, S. A., Vinsel, R. M., & Cummings, K. S. (2022). Nonindigenous aquatic mollusks in Illinois. Illinois Natural History Survey Bulletin, 43, 1–20. https://doi.org/10.21900/j.inhs.v43.862
Torres-Orozco, R., & Revueltas-Valle, E. (1996). New southernmost record of the Asiatic clam Corbicula flumi-
nea (Bivalvia: Corbiculidae), in Mexico. Southwestern Naturalists, 41, 60–61.
Trinidad-Ocaña, C., Juárez-Flores, J., Sánchez, A. J., & Barba-Macías, E. (2018). Diversidad de moluscos y crustáceos acuáticos en tres zonas en la cuenca del río Usumacinta, México. Revista Mexicana de Biodiversidad, 89 (Suppl.), S65–S78. https://doi.org/10.22201/ib.20078706e.2018.0.2387
Voelz, N. J., McArthur, J. V., & Rader, R. B. (1998). Upstream mobility of the Asiatic clam Corbicula fluminea: identifying potential dispersal agents. Journal of Freshwater Ecology, 13, 39–45. https://doi.org/10.1080/02705060.1998.9663589
Áreas de riqueza y centros probables de diversificación de Pinus en México
Librado Sosa-Díaz, José René Valdez-Lazalde *, Gregorio Ángeles-Pérez, Héctor Manuel de los Santos-Posadas y Lauro López-Mata
Colegio de Postgraduados, Campus Montecillo, Km. 36.5 Carr. México-Texcoco, 56264 Montecillo, Estado de México, México
*Autor para correspondencia: valdez@colpos.mx (J.R. Valdez-Lazalde)
Recibido: 10 de junio 2023; aceptado: 22 febrero 2024
Resumen
La identificación de centros de diversificación es útil para planear la conservación del germoplasma de las especies. El objetivo del estudio fue determinar las localidades que actuaron como centros de diversificación del género Pinus en México e identificar las zonas con mayor riqueza de especies de pino en la actualidad. Se construyó una base de datos de presencia (BDO) y registros fósiles (RF) para el género. A partir de ésta, se creó una malla de ~ 10 × 10 km y se determinaron centros de riqueza (CRP), centros de riqueza genética (CRG) y centros de alta diversidad (CAD) para Pinus. La coincidencia espacial de CRG, CAD y RF permitió sugerir posibles centros de diversificación de pinos (CDP). Se calculó un valor de importancia para cada CRP con base en parámetros de endemismo, rareza y riqueza de especies de pino. Se identificaron 16 CRP y 5 CDP. Los 3 CRP de mayor importancia en el país se ubican en zonas de Durango-Chihuahua (1), Coahuila-Nuevo León (2) y colindancias entre Jalisco-Zacatecas-Nayarit (3).
Palabras clave: Alta diversidad; Distribución de especies; Endemismo; Riqueza genética
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Richness areas and probable diversification centers of Pinus in Mexico
Abstract
Identifying centers of diversification is useful for species germplasm conservation planning. The study objective was to determine the localities that acted as centers of diversification of the Pinus genus in Mexico and to identify current areas with the highest pine species richness. An occurrence database (BDO) and fossil records (RF) were built for the species. From this, a mesh of ~10 × 10 km was created and Centers of Pine Richness (CRP), Centers of Genetic Richness (CRG) and Centers of High Diversity (CAD) were determined. The spatial coincidence of CRG, CAD and RF allowed us to suggest possible Centers of Pine Diversification (CDP). An importance value was calculated for each CRP based on parameters of endemism, rarity, and species richness. 16 CRP and 5 CDP were identified. The 3 most important CRPs in the country are located in areas of Durango-Chihuahua (1), Coahuila-Nuevo León (2) and the boundaries between Jalisco-Zacatecas-Nayarit (3).
Keywords: High diversity; Species distribution; Endemism; Genetic richness
Introducción
El género Pinus (Pinaceae) es el grupo de coníferas más exitoso en la actualidad (Farjon, 1996), ha colonizado y domina un gran número de ambientes en el hemisferio norte, particularmente de México (Keeley, 2012; Rueda et al., 2017). Esta diversidad de pinos mexicana ha sido documentada suficientemente en revisiones generales (Farjon, 1996; Gernandt y Pérez-de la Rosa, 2014; Sáenz-Ceja et al., 2022), monografías y listados florísticos (Farjon y Filer, 2013; Sánchez-González, 2008; Villaseñor, 2016). México es también considerado un centro secundario de diversificación de Pinus (Gernandt y Pérez-de la Rosa, 2014; Millar, 1999). Sin embargo, la evidencia de la ubicación geográfica de dichos eventos es escasa.
Un centro de diversificación secundario puede entenderse como aquella región en la que un linaje ancestral dio origen a nuevas especies o nuevos linajes de especies (Millar, 1993). La identificación de centros de diversificación es útil para la conservación del germoplasma original de las especies y para estudiar los mecanismos de selección de plantas para uso humano (Fortuny-Fernández et al., 2017) y, por lo tanto, para la toma de decisiones asociadas a la planeación de acciones y políticas para la conservación y uso de la biodiversidad (Cruz-Cárdenas et al., 2013; Riemann y Exequiel, 2007). Una vez identificado el centro de diversificación de una especie o género, es relevante medir sus parámetros de riqueza y endemismo para posibilitar su monitoreo a mediano y largo plazo (Cruz-Cárdenas et al., 2013).
Existen diversas métricas para cuantificar la riqueza biológica. Algunas de uso común son los índices de riqueza, diversidad, dominancia, complementariedad, etc. Para espacios geográficos amplios se han diseñado técnicas como el análisis de punto a cuadrícula (Hijmans et al., 2012), un enfoque ampliamente aplicado al estudio de la flora mexicana (Contreras-Medina y Luna-Vega, 2007; Cruz-Cárdenas et al., 2013; Estrada-Sánchez et al., 2019; González-Espinosa et al., 2004; Ramos-Dorantes et al., 2017; Salinas-Rodríguez et al., 2018; Villaseñor et al., 2006). Sin embargo, la combinación de medidas de diversidad y el análisis de cuadrículas para predecir la riqueza y diversidad en el espacio geográfico de especies de importancia económica y ecológica, como los pinos, ha sido poco abordado en México y el mundo.
Lo descrito anteriormente destaca la importancia de comprender los aspectos históricos y biogeográficos actuales de especies de alto valor económico como los pinos. Esta investigación contribuye a responder preguntas relevantes para México como: ¿dónde se encuentran las áreas de mayor riqueza de Pinus? ¿dónde se ubican los centros probables de diversificación de Pinus? ¿cuáles son las áreas geográficas de mayor importancia para el género? todas enmarcadas en la hipótesis: ¿es posible identificar centros de diversificación del género Pinus en México, en función de la riqueza genética, alta diversidad y registros fósiles? Los objetivos del estudio fueron: identificar las áreas de mayor riqueza de Pinus, determinar las zonas más probables de diversificación de Pinus y generar un valor de importancia basado en criterios de riqueza, endemismo y rareza de pinos para las principales áreas de riqueza del género en México.
Materiales y métodos
En este estudio, la riqueza de especies se interpreta como el conteo de especies registradas en un sitio (Magurran, 1988). La riqueza genética refiere al grado de variación del material genético entre poblaciones de una especie; se consideró como centro de riqueza genética aquellas regiones donde se concentra la mayor cantidad de poblaciones, asumiendo que las regiones con mayor número de poblaciones serán genéticamente más diversas (Conabio, 2007). Los centros de alta diversidad se entienden como aquellos sitios con valores altos de un índice de diversidad biológica. El concepto de endemismo se aplica como un indicador de restricción en la distribución geográfica de las especies.
La figura 1 esquematiza el flujo de trabajo realizado para alcanzar los objetivos del presente estudio. Los párrafos precedentes detallan los procedimientos realizados en cada una de las etapas del análisis.
Se construyó una base de registros fósiles y datos de presencia (BDO) de especies de Pinus que se distribuyen de forma natural en México. Se consultaron fuentes de datos especializadas como Global Biodiversity Information Facility (www.gbif.org/), Sistema Nacional de Información sobre Biodiversidad de México (www.snib.mx/), Red Mundial sobre Información sobre Biodiversidad (http://www.conabio.gob.mx), SEINet (www.swbiodiversity.org)
y revisión de literatura científica mediante motores de búsqueda web (e.g., Google Scholar, Springer, Scopus; con juegos de palabras: “especie”, “latitud”, “longitud”, “coordenadas”, “Pinus”, “México”) en idioma español
e inglés.
Posteriormente, se depuró la BDO eliminando datos sin coordenadas, mal georreferenciados y duplicados (de una especie) en pixeles de 1 km2. Se consideraron como válidas las entidades taxonómicas definidas en publicaciones recientes (Buck et al., 2020, 2023; Farjon, 2018; Montes et al., 2019, 2022; Pérez-de la Rosa & Gernandt, 2017; Willyard et al., 2017, 2021) y se consultaron sitios especializados (http://www.worldfloraonline.org/, https://powo.science.kew.org/) para asignar nombres intraespecíficos a cada especie. Adicionalmente, la BDO se filtró con base en el rango altitudinal reportado en la literatura para cada especie de Pinus (Farjon, 2017; Farjon y Filer, 2013), excluyendo datos cuando la combinación ambiental de esos sitios se ubicó fuera de la combinación de los mismos factores para el rango altitudinal reportado en la literatura (material suplementario: fig. S1).
Figura 1. Esquema de trabajo seguido para la identificación de centros de alta diversidad, riqueza genética y posibles centros de diversificación del género Pinus en México. Información inicial (azul), procesos y algoritmos (verde), principales configuraciones de procesos y algoritmos (naranja y morado) y productos generados (bordes redondos) durante este estudio. Los principales objetivos de la investigación se muestran con borde segmentado. Tamaño de pixel de ~ 10 x 10 km con: tipo de vecindad simple (*) y circular de un grado sexagesimal (§).
A partir de la BDO, inicialmente se realizó un análisis de “Point to grid/ Richness/ Number of different classes” con vecindad simple (~ 10 × 10 km) en el programa DIVA-GIS v. 7.5.0 (Hijmans et al., 2012), asignando a cada pixel el número de especies contabilizado dentro del mismo, lo cual constituyó la riqueza observada. Posteriormente, se identificaron y seleccionaron conglomerados de pixeles contiguos a los que se llamó centros de riqueza de pinos (CRP). Considerando que la BDO no proviene de un muestreo geográficamente uniforme, se observaron otros grupos de pixeles no contiguos donde se presentaron valores importantes de riqueza. Tales conjuntos se agruparon y se nombraron como otras zonas dispersas de riqueza de pinos (OZD). La delimitación de los CRP y OZD se realizó de forma manual mediante un sistema de información geográfica (Quantum GIS Team Development, 2019) y se numeraron de forma consecutiva solo con propósito de identificación —no representa valor de importancia. Para identificar de forma puntual pixeles de mayor riqueza, los datos de riqueza observada a nivel pixel se clasificaron en 5 estratos mediante el método de intervalos geométricos (1 = muy baja, 2 = baja, 3 = media, 4 = alta y 5 = muy alta). Los pixeles pertenecientes al estrato superior (5 = muy alta) fueron considerados los sitios con mayor riqueza de especies de pinos dentro de los CRP y OZD (fig. 2). De acuerdo con Arenas-Navarro et al. (2020), se calculó el cociente (Es) entre la riqueza observada y la riqueza estimada (estimador no paramétrico de Chao2) por pixel, como un indicador de la calidad de las celdas resultantes del análisis de punto a cuadrícula. Los estimadores no paramétricos (e.g., Chao2) tienen la particularidad de ser menos sesgados que los de tipo paramétrico (Brose et al., 2003).
Partiendo de la BDO, mediante el módulo “Point to grid/ Richness/ Number of observations” de DIVA-GIS (Hijmans et al., 2012), se realizó un análisis punto a cuadrícula para delimitar, a nivel especie, las zonas geográficas con mayor número de presencias, lo que se tradujo en zonas de mayor riqueza genética a nivel especie (Conabio, 2007; fig. 3A-D). Para ello, se utilizó una resolución espacial (tamaño de pixel) de 0.083 grados sexagesimales (~ 10 × 10 km). Para cada especie analizada, el procedimiento generó 5 estratos (intervalo igual) de abundancia de registros de presencia (fig. 3A, B). Se nombró como centro de riqueza genética (CRG) solo al estrato superior (fig. 3C), el cual se convirtió a formato binario (1 = CRG; 0 = área sin interés; fig. 3D). De esta forma se delimitó el CRG para cada especie incluida en la BDO. Finalmente, los CRG a nivel especie se sobrepusieron espacialmente para determinar los CRG a nivel género en México.
Se utilizó el índice alfa de Fisher para estimar la diversidad de especies de Pinus a nivel pixel (~ 10 × 10 km) (Fisher et al., 1943). A pesar de que alfa de Fisher (α) es poco utilizado actualmente, decidimos utilizarlo por 2 razones: no se dispuso de datos de densidad de las especies de pino a nivel localidad y a diferencia de otros índices como Shannon-Wiener, Simpson, Margalef, Menhinick, entre otros, de uso común para propósitos similares, α es poco sensible al número de individuos muestreados, a la presencia de especies raras o comunes y al tamaño del área estudiada (Magurran, 1988). Adicionalmente, a excepción de α, los índices antes mencionados son adecuados para medir la heterogeneidad de especies localmente (Peet, 1974), por lo que al manejar unidades de estudio de gran tamaño (pixel de 10 × 10 km) en este estudio, consideramos que α es el índice más adecuado para los propósitos planteados.
Las estimaciones de α a nivel pixel se realizaron mediante el programa PAST v. 4.03 (Hammer et al., 2001). Posteriormente, mediante el método de reclasificación de intervalos geométricos se definieron 5 estratos de las predicciones de α (1 = muy baja, 2 = baja, 3 = media, 4 = alta y 5 = muy alta diversidad), de los cuales solo se retuvo el estrato superior y se convirtió a formato binario para representar los centros de alta diversidad (CAD) de Pinus en México.
Los posibles CDP en México se identificaron como aquellas áreas de coincidencia espacial (intersección) entre los CRG (nivel género) y los CAD (Santillán-Fernández et al., 2021), además de la presencia cercana a estas áreas de fósiles de Pinus. Partimos del supuesto que el registro fósil en áreas de alta riqueza del género Pinus, o cerca de éstas, indica la presencia del género Pinus desde épocas ancestrales.
Se generó un valor de importancia para cada área de riqueza en función de 4 criterios: I) valor promedio de endemismo, II) número de especies que se distribuyen en el área, III) número de especies raras y IV) riqueza máxima de especies por pixel (~ 10 × 10 km). El indicador I se obtuvo utilizando el método propuesto por Kerr (1997), que es la sumatoria del inverso al número de pixeles donde aparece cada especie, obteniendo el valor final mediante el promedio de todos los pixeles del área. Este método ha sido aplicado para identificar zonas de endemismo de plantas mexicanas (Estrada-Sánchez et al., 2019; Riemann y Exequiel, 2007; Villaseñor et al., 2006). Para el indicador III, se utilizó el índice de rareza propuesto por Maciel (2021), el cual genera un valor en función del rango geográfico, especificidad de hábitat y abundancia (número de presencias de la especie por pixel, en este trabajo) de la especie (Maciel, 2021). Se utilizó la mediana del índice de rareza para definir especies raras y comunes (material suplementario: tabla S1). Para estimar los indicadores II y IV, se contó el número de taxones distribuidos en el área y el número máximo de ellos en un pixel, respectivamente. Finalmente, los criterios I, II, III y IV fueron normalizados a valores en intervalo de 0 a 1 (para cada puntaje obtenido se restó valor mínimo de ese criterio y ésto se dividió entre la diferencia del máximo y el mínimo del mismo criterio) y se sumaron para obtener un valor final de importancia para cada CRP y OZD.
Resultados
Se consideraron como válidas 48 especies del género Pinus (material suplementario: tabla S1) que se distribuyen de manera total o parcial en México. El número de registros que integraron la BDO después del proceso de limpieza fue de 32,030 (un registro por especie dentro de 1 km2), de los cuales solo 64.6% (20,709) se ubican dentro del territorio mexicano. Las fuentes que aportaron mayor cantidad de datos a la base final fueron GBIF (67.1%), SEINet (12.4%), SNIB (8.5%), literatura científica (7.1%) y un porcentaje menor para otras fuentes. Así mismo, 18.8% de las 48 especies tuvo más de 1,000 registros, 60.4% entre 100 a 1,000 registros, 6.3% entre 50 y 99, y 14.6% menos de 50 registros. La especie con más registros fue P. leiophylla (3,555 registros) y la de menos P. vallartensis (9 registros), una especie descrita recientemente en el occidente de México. El 24.3% de las presencias se registró antes de 1980, 24% entre 1981 y 2000, y el restante 58.1% entre 2001 y mediados
de 2022.
El promedio del indicador de calidad de celdas en cada CRP y OZD varió entre 0.87 y 0.98 (material suplementario: tabla S1). Los valores de riqueza por pixel variaron entre 1 y 13 (fig. 2A). Las clases alta y muy alta de riqueza observada se restringieron a zonas concretas de la sierra Madre Occidental (SMOc), sierra Madre Oriental (SMOr), sierra Madre del Sur (SMS) y sierras de Chiapas (fig. 2Aa). Los pixeles con menor riqueza observada se registraron principalmente en la periferia de los relieves antes mencionados (fig. 2A). El estrato de muy alta riqueza (estrato 5 de riqueza observada; fig. 2Aa) va de 6 a 13 especies y se ubicaron de forma muy dispersa en algunas zonas de Durango, Chihuahua, Nuevo León, Jalisco, Michoacán, México, Guerrero, Oaxaca y Chiapas (pixeles rojos, fig. 2B).

Figura 2. Riqueza observada (A), riqueza observada estratificada (Aa) y áreas de riqueza de especies de Pinus (B) en México. En la simbología de B, el número en paréntesis indica el número de especies presentes en el área definida. Por ejemplo, CRP_1 (9) indica que en el área CRP_1 se registró la presencia de 9 especies; no indica que 9 especies fueron observadas en cada pixel (~ 10 x 10 km) del área. Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
El análisis de punto a cuadrícula detectó 10 conglomerados de CRP y 6 de OZD (fig. 2B). Es importante reiterar que el número de especies mencionados en este párrafo —número entre paréntesis en la fig. 2B— no indican que tal número se observó en cada pixel que forma parte del CRP u OZD, sino que se identificó al menos un registro de cada especie en algún pixel de dicha zona. En las áreas compactas, el mayor número de especies fue 21 (CRP_2) y el menor fue 9 (CRP_1; Baja California). En la SMOc se ubicó el área de riqueza de mayor tamaño (CRP_2), mientras que en la porción michoacana de la SMS se ubicó la de menor extensión (OZD_5). En la zona centro-oriental de la FVT se identificaron 3 áreas (CRP_4, 5, 6), cuyo número de especies aumenta de 15 en la zona este a 17 en la zona oeste. En la zona media de la SMOr se identificó un área compacta (CRP_3) y 2 áreas dispersas (OZD_4 y OZD_6) en los extremos sur y norte, respectivamente. Las OZD figuran en la periferia de las áreas compactas (fig. 2B).
Las zonas dispersas (OZD) que contaron con alto número de especies fueron el oeste de la FVT (OZD_3; sur de Zacatecas, Jalisco y Nayarit; 21 especies) y el sur de la SMOr (18 especies, Querétaro, San Luis Potosí; OZD_4), mientras que la sierra sur de Michoacán (OZD_5) fue el área de pixeles dispersos con menor presencia de especies de pino (8 especies). Finalmente, algunas áreas como CRP_1, CRP_9, OZD_2 y OZD_4 tuvieron nula o muy poca presencia de pixeles de muy alta riqueza de pinos (fig. 2B).
La delimitación de la zona de mayor concentración de presencia para cada taxón en la BDO identificó el CRG para cada especie (fig. 3A-D). Los CRG identificados representan áreas pequeñas dispersas en el territorio, ubicadas principalmente en la zona sur de la SMOc y este de la FVT, la zona media de la SMOr (Coahuila y Nuevo León) y algunas áreas en las zonas montañosas de Oaxaca y Chiapas (fig. 3E-G). En algunas zonas geográficas se observaron coincidencias del CRG para más de 1 especie, siendo las más notables en el sureste de Durango (fig. 3E-G), en colindancias entre Coahuila y Nuevo León (fig. 3F) y en Chiapas (fig. 3E-G). Para las especies con presencia periférica en México (e.g., Pinus coulteri y P. lambertiana) los CRG se detectaron fuera del territorio mexicano. Por otro lado, aunque no fueron coincidentes espacialmente, estados como Oaxaca, Jalisco, Durango y Michoacán mostraron CRG para más de 1 especie. De manera contraria, aunque se presentan 9 especies en el CRP_1, solo se observó el CRG para P. quadrifolia y P. jeffreyi al igual que para el OZD_5 que únicamente representó el CRG para P. rzedowskii (fig. 3F).
Figura 3. Ejemplo de la determinación del centro de riqueza genética (CRG) para Pinus patula (A-D) y centro de riqueza genética para especies de la subsección Australes (E), Cembroides y Nelsoniae (F), Ponderosae y Strobus (G) y a nivel género (H). Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
La distribución espacial del estrato superior (estrato 5 = muy alta diversidad) de α, definido como CAD, se ubicó principalmente en zonas de la SMOc, SMOr, FVT, además de algunas secciones de la SMS y muy poca presencia en los macizos montañosos de Chiapas. De manera más puntual, la mayor cantidad de pixeles de CAD se observó en la FVT, Chihuahua, Durango y Oaxaca, otros pixeles más aislados se identificaron entre Coahuila y Nuevo León, Guerrero y Chiapas (fig. 4).
El cálculo del índice alfa de Fisher (α) por pixel mostró diferencias importantes por zona geográfica. Los valores más altos se observaron en zonas particulares de los sistemas montañosos más importantes de México (fig. 4). Los estados de Chihuahua, Durango, Nuevo León, Michoacán, Oaxaca y algunas zonas de la FVT presentaron pixeles con los valores más altos de α (fig.4). En los CRP y OZD, el promedio de α varió de 0.9 (OZD_6) a 2.3 (CRP_8). El valor máximo por pixel, α = 20, se encontró para los CRP_7 (sierra norte de Oaxaca) y CRP_4 (Michoacán), aunque Chihuahua y Durango (CRP_2) y la sierra sur de Oaxaca (CRP_8) también exhibieron valores máximos altos (α = 18.6) por pixel. Por el contrario, el valor máximo de menor magnitud de α por pixel dentro de un CRP u OZD fue de 9.3 (Baja California, Guerrero, Chiapas, San Luis Potosí y Querétaro; fig. 4). La menor variabilidad (segundo valor del paréntesis en tabla de la fig. 4) en las predicciones de α se presentó para el CRP_1 (Baja California), mientras para el CRP_8 (sierra sur de Oaxaca) se observó lo contrario.
La coincidencia espacial (intersección) de los centros de alta diversidad (CAD) y los centros de riqueza genética (CRG) de los pinos mexicanos fue evidente en algunas zonas de los principales sistemas montañosos de México (fig. 5). Lo anterior, conjuntamente con los registros de fósiles de Pinus encontrados en México, permitió la identificación de áreas que, argumentamos, tienen una alta probabilidad de haber sido centros de diversificación para Pinus en el pasado. Entre estas áreas destaca el extremo norte de la SMOc (Chihuahua y Sonora; 1), la zona media de la SMOr (sur de Coahuila, Nuevo León y Tamaulipas; 2), el centro-este de la FVT (3) y otras zonas sureñas como los macizos montañosos de Chiapas (4) y la sierra sur de Oaxaca (5). Para áreas como Baja California, sur de SMOc y oeste de la FVT no se encontró material fósil (fig. 5), aunque para las 2 últimas existe una alta coincidencia entre CAD y CRG de pinos.
Zonas de mayor importancia para Pinus en México
El cálculo de endemismo, riqueza de especies, rareza y riqueza máxima por pixel, posibilitó la asignación de un valor de importancia para cada CRP y OZD. El área ubicada en la zona media de la SMOc (CRP_2; Durango y Chihuahua) presentó el mayor número de especies (21) y riqueza máxima (13), por lo que obtuvo también el mayor valor de importancia, 3.471 (tabla 1). En orden decreciente, siguieron la zona intermedia de la SMOr (CRP_3) y la zona ubicada en el este de la FVT (OZD_3). El CRP_3 obtuvo el segundo valor más alto en los criterios de endemismo (tabla 1) y la OZD_3 presentó el mayor número de especies raras y el número máximo de especies presentes (21). El valor de importancia para dichas áreas fue 3.056 (CRP_3) y 2.601 (OZD_3).
Algunas zonas con valores medios de importancia son el CRP_4, CRP_7 y OZD_4, los cuales presentaron niveles intermedios de riqueza máxima (12, 12 y 9 especies, respectivamente) y especies raras (5 en promedio; tabla 1). Las áreas que presentaron los valores más bajos de importancia fueron las ubicadas en la sierra sur de Michoacán (OZD_5; 0.287), el noroeste de México (CRP_1; 0.635) y el sistema montañoso costero de Chiapas (OZD_2; 0.661; tabla 1). De forma general, se observaron 7 áreas (resaltadas con negritas en tabla 1) con un valor final por arriba del promedio (1.718), las cuales podrían considerarse como las áreas de mayor importancia de Pinus en México, basándose en criterios de endemismo, rareza y riqueza.
Discusión
La delimitación de los CRP tuvo como objetivo señalar las áreas de mayor riqueza de Pinus en México. Con base en las ecorregiones de Olson et al. (2001), se observó que a lo largo de la FVT existen intervenciones de bosques secos pertenecientes a la Depresión del Balsas, similar a los que separan los macizos montañosos de Chiapas (OZD_2 y CRP_10). En el sur de San Luis Potosí (SMOr), los matorrales de la meseta central y los bosques húmedos de Veracruz interrumpen la continuidad de los bosques de pino-encino. La baja presencia de celdas con presencia de pinos en estas zonas, condujo a la delimitación de los CRP y OZD expuestos en este estudio. Además, para la SMS la regionalización basada en criterios biológicos y climáticos propuesta por Morrone (2019), muestra zonas fragmentadas cuya disposición geográfica coincide parcialmente con los CRP_7, 8, 9 y OZD_1. De forma similar, la zonificación de Suárez-Mota et al. (2013) para la FVT se asemeja geográficamente a la OZD_3 y CRP_6, mientras que los centros críticos de riqueza para musgos y senecios señalados por Villaseñor et al. (2006), coinciden geográficamente con los CRP y OZD identificados para la FVT.

Figura 4. Índice alfa de Fisher (α) para especies de Pinus en México. La tabla muestra el valor promedio (máximo, desviación estándar) por pixel de α en las áreas de riqueza de especies (CRP, OZD) definidas previamente. Tamaño de pixel ~ 10 x 10 km.

Figura 5. Centros de riqueza genética (CRG), alta diversidad (CAD) y posibles centros de diversificación (indicados con elipses y números resaltados en color amarillo) de Pinus en México —las elipses y su numeración se presentan solo con fines de visualización. Las líneas que dividen el interior de México corresponden a los límites de las regiones biogeográficas contenidas.
Se identificó un número mayor de áreas de riqueza de Pinus con respecto a estudios previos (Farjon, 1996; Sáenz-Ceja et al., 2022; Sánchez-González, 2008). Esto podría explicarse por lo siguiente: 1) el propósito de este estudio fue identificar las zonas con mayor riqueza y no el patrón general de distribución del género en México; 2) los CRP fueron identificados a partir de coordenadas provenientes de colecciones biológicas y estudios científicos, lo que no garantiza su distribución geográfica uniforme y deriva en la identificación de zonas fragmentadas y de menor tamaño y 3) diferencias metodológicas (e.g., análisis de punto a cuadrícula y modelos de distribución potencial) en la determinación de las áreas de riqueza. En relación con el número de especies, también se presentaron diferencias importantes con estudios previos. Por ejemplo, para el noroeste de México (CRP_1), se han mencionado 9, 10 y 19 especies (Farjon, 1996; Sáenz-Ceja et al., 2022; Sánchez-González, 2008, respectivamente), siendo la primera y segunda similares a las 9 registradas aquí (fig. 2B), pero con diferencias en las entidades taxonómicas. Tales variaciones pueden deberse a: 1) metodología: solo se contabilizaron las especies dentro de los pixeles incluidos en CRP_1 y no para toda la península, por lo que especies como P. lagunae (Rob-Pass.) Passini no están incluidas en la cifra mencionada (9 especies); 2) taxonomía: el nivel taxonómico empleado fue especie, con base en las entidades reconocidas por Farjon (2018) y estudios recientes sobre delimitacion de especies (Buck et al., 2020, 2023; Montes et al., 2019, 2022; Willyard et al., 2017, 2021). El número de especies observado (9, 21, 17, 16) en algunas regiones como CRP_1, 2, 3 y 7 es cercano a las 7, 20, 14 y 15 mencionadas por Sáenz-Ceja et al. (2022) respectivamente, en zonas coincidentes con las áreas de riqueza mencionadas.
Tabla 1
Valores de los criterios considerados para la asignación de un valor de importancia (V.I.) para centros de riqueza de especies de Pinus (CRP) en México. En negritas se indican los 7 CRP identificados como más importantes.
| CRP | Pixeles | E* (I) | S (II) | Sr§ (III) | Rm (IV) | V.I. |
| CRP_1 | 164 | 0.309 (0.021) | 0.077 (9) | 0.250 (4) | 0.000 (5) | 0.636 (15) |
| CRP_2 | 1212 | 0.596 (0.031) | 1.000 (21) | 0.875 (9) | 1.000 (13) | 3.471 (1) |
| CRP_3 | 280 | 0.739 (0.036) | 0.692 (17) | 0.875 (9) | 0.750 (11) | 3.056 (2) |
| CRP_4 | 164 | 0.300 (0.021) | 0.692 (17) | 0.375 (5) | 0.875 (12) | 2.242 (4) |
| CRP_5 | 274 | 0.349 (0.022) | 0.615 (16) | 0.250 (4) | 0.625 (10) | 1.840 (7) |
| CRP_6 | 299 | 0.348 (0.022) | 0.538 (15) | 0.250 (4) | 0.375 (8) | 1.511 (10) |
| CRP_7 | 159 | 0.366 (0.023) | 0.615 (16) | 0.250 (4) | 0.875 (12) | 2.106 (5) |
| CRP_8 | 136 | 0.187 (0.017) | 0.615 (16) | 0.250 (4) | 0.500 (9) | 1.552 (9) |
| CRP_9 | 133 | 0.000 (0.010) | 0.462 (14) | 0.250 (4) | 0.250 (7) | 0.962 (13) |
| CRP_10 | 107 | 0.404 (0.024) | 0.308 (12) | 0.000 (2) | 0.750 (11) | 1.461 (11) |
| OZD_1 | 112 | 0.205 (0.017) | 0.538 (15) | 0.250 (4) | 0.375 (8) | 1.369 (12) |
| OZD_2 | 107 | 0.132 (0.015) | 0.154 (10) | 0.000 (2) | 0.375 (8) | 0.660 (14) |
| OZD_3 | 345 | 0.101 (0.014) | 1.000 (21) | 1.000 (10) | 0.500 (9) | 2.601 (3) |
| OZD_4 | 164 | 0.274 (0.020) | 0.769 (18) | 0.500 (6) | 0.500 (9) | 2.043 (6) |
| OZD_5 | 38 | 0.038 (0.011) | 0.000 (8) | 0.000 (2) | 0.250 (7) | 0.288 (16) |
| OZD_6 | 89 | 1.000 (0.046) | 0.077 (9) | 0.500 (6) | 0.125 (6) | 1.702 (8) |
E = Endemismo; S = número de especies; Sr = número de especies raras; Rm = riqueza máxima por pixel; V.I. = valor de importancia (el valor entre paréntesis representa el orden de importancia); * = promedio del valor de endemismo por pixel obtenido mediante el índice de endemismo propuesto por Kerr (1997); § = la determinación de una especies rara o común se realizó con base en el índice de rareza propuesto por Maciel (2021). El orden de los valores de I a IV es el valor obtenido por la normalización del criterio (valor neto obtenido del criterio).
Algunos estudios a nivel local, como el de Ramos-Dorantes et al. (2017) mencionaron 16 especies (Puebla; CRP_6), mientras que 15 fueron las registradas en este trabajo. En inventarios florísticos de áreas naturales protegidas (ANP) como la Reserva de la Biosfera Mariposa Monarca (CRP_5), Reserva Forestal Nacional y Zona de Refugio de la Fauna Silvestre Tutuaca (CRP_2), se han reportado 15 y 12 especies, que es cercano a los observado (16 y 12) en tales sitios. Así mismo, en la Reserva de la Biosfera La Sepultura (OZD_2) y la Reserva de la Biosfera Sierra Gorda (OZD_4) se mencionan 10 y 3 especies de pino, mientras que en este estudio se registraron cifras superiores (13 y 6, respectivamente). Tales discrepancias en número de especies pueden ser posibles debido a que una especie podría presentarse dentro del CRP y estar ausente dentro de la ANP. Las ANP son espacios destinados a la conservación debido a su elevada riqueza biológica (Salinas-Rodríguez et al., 2018), por lo que se considera que pueden ser un contraste adecuado para el número de especies registrado en este estudio.
Estudios locales como el de Ríos-Altamirano et al. (2016) y Martin et al. (2021) en Oaxaca (CRP_7) describen 10 y 7 especies, respectivamente; mientras que en los pixeles que abarcan tales sitios se registraron 13 y 8 especies. En el CRP_2 (SMOc), González-Elizondo et al. (2012) mencionaron 20 especies, mientras que en este trabajo se observaron 21. Lo anterior demuestra que BDO construida y los análisis subsecuentes, son una adecuada representación de la riqueza de los pinos en México.
El aporte fundamental de los resultados de este trabajo es que puede considerarse una actualización de revisiones históricas sobre la biogeografía de Pinus (a nivel especie) en México y además, señalan de forma concreta áreas con alta riqueza, excluyendo áreas con baja o nula presencia. Sin embargo, es importante considerar que, como en cualquier análisis, los resultados dependen de los datos utilizados. Esto es relevante considerando que, recientemente, se han ventilado limitaciones y sesgos espaciales, temporales y filogenéticos de las bases digitales de registros de presencia de plantas vasculares, particularmente de la base GBIF utilizada en este trabajo (Ramírez-Barahona et al., 2023), con un aporte mayoritario de los registros de aparición (60% de total). Afortunadamente, de acuerdo con estos autores, algunas zonas montañosas de México, como aquellas que asemejan el patrón de presencia de Pinus en el país (SMOr, SMOc, FVT, SMS), son zonas con bajo sesgo espacial y temporal de recolectas de plantas vasculares (ver. fig. S4 en Ramírez-Barahona et al. [2023]). Por otro lado, en los análisis se incorporaron registros de aparición de otras fuentes (40% de los registros), lo que sin duda contribuye a disminuir los sesgos inherentes de los datos de GBIF. Además, la cercanía al valor óptimo (Es = 1) de las estimaciones sobre la calidad de las celdas (Es = 0.88 a 0.98) que formaron las áreas de riqueza de pinos identificadas aquí, sugiere una calidad suficiente para el alcance de los objetivos de este estudio (Arenas-Navarro et al., 2020).
El enfoque empleado para determinar los CRG ha sido empleado para delimitar la riqueza genética de razas de maíz en México y se desconoce su utilización en árboles (Santillán-Fernández et al., 2021). Sin embargo, existen datos que de manera indirecta podrían indicar alguna relación con los CRG identificados en este estudio. Por ejemplo, para P. greggii, Parraguirre-Lezama et al. (2002) reportaron menor número de alelos y porcentaje de polimorfismo en las poblaciones del sur (Hidalgo y Querétaro) con respecto a las del norte (Coahuila y Nuevo León), estas últimas se encuentran dentro del CRG señalado para esta especie (fig. 3E). Así mismo, García-Gómez et al. (2014) estudiaron 4 poblaciones de P. johannis y encontraron mayor número de loci polimórficos en una población (Salaverna, Zacatecas) que coincide espacialmente con el CRG identificado para esta especie (fig. 3F). El polimorfismo genético, la heterocigocidad esperada y observada, y el número de alelos, son usados para denotar diferencias en el acervo genético entre poblaciones de una especie (García-Gomez et al., 2014; González-Jiménez et al., 2021; Ledig et al., 2001).
De igual manera, poblaciones con altos valores de heterocigocidad esperada y riqueza alélica de P. remota (González-Jiménez et al., 2021) y P. pinceana (Ledig et al., 2001) coinciden espacialmente con los CRG para ambas especies (Coahuila y Nuevo León), aunque los 2 estudios citados anteriormente no han tomado en cuenta el rango completo de distribución de la especie. La evidencia anterior sugiere coincidencia geográfica entre los CRG delimitados espacialmente y la diversidad genética a nivel población, aunque se necesita mayor investigación para reforzar estos hallazgos, sobre todo con especies de amplia distribución, las cuales representan al menos 50% de este estudio.
Los valores más altos de α se ubicaron principalmente en la SMOc (Durango y Chihuahua), SMOr (Coahuila y Nuevo León), en el centro-este de la FVT y macizos montañosos de Oaxaca y Chiapas (fig. 4), emulando el patrón general de distribución del género (Rzedowski, 2006; Sáenz-Ceja et al., 2022). Aunque no existen estimaciones de α en pixeles espaciales de gran tamaño (e.g. 10 × 10 km ), sí existen estimaciones en ecosistemas con presencia de pinos, pero no exclusivamente para éstos.
En bosques mixtos de pino-encino en Oaxaca (CRP_9), Aguilar-Santelises y Castillo (2013) reportaron un α de 4.55, mientras que en rodales de la misma entidad con y sin manejo silvícola (CRP_7), Luna-Bautista et al. (2015) encontraron valores promedio de 1.778. En el sur de México (Chiapas; CRP_10), Cayuela et al. (2006) estimaron α máximo de 10.6 para rodales de pino-encino. Sánchez-González y López-Mata (2005) describen promedios de 1.01 de α en un gradiente altitudinal (bosque de encino, mixto, pino-pastizales alpinos) perteneciente al CRP_5 (este del Estado de México). En las ubicaciones de los estudios mencionados anteriormente, nuestro α fue mayor al reportado por los autores: α = 5.453, 6.376, 14.1 y 2.86 en el mismo orden. El resultado de este contraste es opuesto a lo esperado, ya que los análisis en comparación incluyeron diversos géneros de plantas (e.g. Juniperus, Arbutus, Quercus, Prunus y Alnus) y, por lo tanto, un mayor recuento de especies a nivel de sitio, lo que debería resultar en un valor mayor de α. Lo anterior podría deberse a las diferencias en el tamaño del sitio analizado. Este estudio tuvo como base de análisis pixeles de ~ 10 × 10 km, lo que posibilitó que en un pixel pudieran observarse más especies y más presencias (aunque no de la misma localidad). Contrariamente, el área muestreada en los otros estudios varió de parcelas de 400 m2 a 1,000 m2 (Cayuela et al., 2006; Luna-Bautista et al., 2015; Sánchez-González y López-Mata, 2005).
El hecho de que los CRP hayan tendido un bajo promedio de α (comparado con el máximo) pudo deberse a la distribución geográfica heterogénea de los registros presencia, que refleja un bajo esfuerzo de muestreo, sobre todo en la periferia de los CRP y OZD. A pesar de lo anterior, los valores obtenidos sobre la calidad de las celdas fueron cercanos al óptimo (material suplementario: tabla S1), por lo que puede considerarse que las celdas (al menos dentro de los CRP y OZD) tuvieron la calidad suficiente para el alcance de los objetivos de este estudio. Además, aunque es evidente que existen importantes deficiencias en la información disponible sobre biodiversidad (Ramírez-Barahona et al., 2023), las colecciones biológicas son la principal fuente de información en estudios de diversidad (Arenas-Navarro et al., 2020; Ramos-Dorantes et al., 2017; Salinas-Rodríguez et al., 2018; Suárez-Mota et al., 2018). Sin embargo, es importante enfatizar que a medida que avance la recolecta y digitalización de información biológica del país, se podrán refinar las estimaciones de diversidad de pinos en sus diversas áreas de riqueza. La información biológica sobre riqueza y diversidad es fundamental para el diseño de políticas que aseguren la permanencia de especies (Riemann y Exequiel, 2007), sobre todo aquellas con alto valor económico y ecológico como los pinos.
Posterior a su origen, el género Pinus experimentó ciclos de expansión y retroceso acoplados a fluctuaciones climáticas (Millar, 1993, 1999; Stults et al., 2010). Durante este periodo, la competencia con angiospermas (Millar, 1993), la interacción y efecto del fuego (Jin et al., 2021; Keeley, 2012), estrés por sequía y tolerancia a la sombra (Rueda et al., 2017) impulsaron su ruta evolutiva. Los probables CDP en México, identificados en este estudio por la intersección de CRG, CAD y registros fósiles, aproximan la ubicación de áreas que probablemente potenciaron la amplia distribución actual del género (Farjon, 1996; Millar, 1993). Los autores desconocen la existencia de estudios específicos sobre áreas con alta probabilidad de presencia de fenómenos de diversificación de Pinus en el pasado, por tanto, estos resultados representan un aporte importante que coadyuva al entendimiento del fenómeno.
Algunos autores nombran como “centros secundarios de origen” a zonas de latitud media con alta diversidad dentro del género (Millar, 1999), siendo en épocas recientes (Mioceno, ~ 5 – 22.5 Ma) cuando se originó su diversidad actual (Farjon, 1996; Jin et al., 2021). Aunque los fósiles hallados en tierras bajas de Chiapas que datan de al menos 90 Ma (Huerta-Vergara et al., 2013) indicarían que tales regiones ya eran habitadas por pinos antiguos mucho antes de la reciente historia evolutiva del género. De acuerdo con Jin et al. (2021), la tasa neta de diversificación de Pinus ha decrecido considerablemente desde finales del Cretácico (~ 100 Ma), por lo que, de haber existido linajes de pinos en regiones como el México antiguo, su diversidad pudo haber sido más amplia que la actual. Esto último sigue siendo una incógnita puesto que el siguiente hallazgo fósil para México, encontrado en tierras bajas de Veracruz (Millar, 1993) data de mediados del Mioceno
(~ 15 Ma), justo antes del inicio de la gran radiación actual de Pinus en esta región.
Sea como centro de diversificación o centro secundario de origen, México ha sido importante en la evolución de Pinus. Las altas tasas de diversificación del género en el país fueron desencadenadas por la actividad volcánica del Paleógeno (entre 60 y 37 Ma) (Farjon, 1996). El constante levantamiento de las principales cordilleras generó diferencias altitudinales, amplia variabilidad de suelos y una paulatina aridez con la formación del altiplano mexicano, que en épocas posteriores actuó como barrera geográfica entre zonas habitables para pinos (Millar, 1993). La heterogeneidad ambiental y el aislamiento propiciaron fragmentación, divergencia y especiación de los pinos en esas épocas (Millar, 1999; Stults et al., 2010). Además, una caída abrupta de temperatura en épocas subsecuentes ocasionó la retirada de las angiospermas hacia los trópicos (Millar, 1993), lo cual fue clave para que Pinus se expandiera a menores latitudes (Keeley, 2012). En conjunto, un clima frío, disminución de competencia y una amplia variabilidad ambiental pudieron haber provocado la liberación de una cantidad importante de nichos, lo cuales fueron ocupados por los ancestros de los pinos actuales. Esto último puede respaldarse en los hallazgos de Jin et al. (2021), quienes mencionan que la evolución del nicho ecológico y variaciones fenotípicas en Pinus aumentaron considerablemente a inicios del Oligoceno (que es la época subsecuente al gran enfriamiento mencionado anteriormente).
Zonas de importancia para Pinus en México.
El alto valor de importancia para el CRP_2 (SMOc) es explicado por presentar el máximo valor en riqueza (21 especies) y riqueza máxima (13 especies por pixel), el segundo valor más alto por especies raras y el tercer valor más alto por endemismo. Tales valores de endemismo, rareza y riqueza (tabla 1) contribuyeron a clasificarlo como el CRP de mayor importancia en México. Para algunos taxones, este CRP representa la latitud máxima (e.g., P. teocote, P. oocarpa y P. pseudostrobus), mínima (P. brachyptera) y una zona de continuidad para otras (P. strobiformis, P. arizonica y P. leiophylla), además, alberga una de las 2 poblaciones conocidas de P. maximartinezii (González-Elizondo et al., 2011). En el contexto anterior, González-Elizondo et al. (2012) mencionan que Pinus es uno de los 3 géneros más abundantes de la SMOc (24 especies). Además, los bosques del CRP_2 representan una de las zonas con mayor aporte económico al sector forestal del país (Hernández-Salas et al., 2013), lo cual hace aún más evidente la importancia tanto ecológica como económica de esta área. La zona media de la SMOc (Chihuahua y Durango) representa una de las zonas de mayor prioridad para la conservación de Pinus en México (Sáenz-Ceja et al., 2022).
Se ha sugerido que la SMOr se originó hace ~ 65 Ma, aunque se han encontrado fósiles de pinos más antiguos en el sur de México (~ 90 Ma; Chiapas; Huerta-Vergara et al., 2013), por lo que durante su emergencia y las fuertes fluctuaciones climáticas subsecuentes (Millar, 1993, 1999), la SMOr pudo haber sido un refugio para los linajes de Pinus existentes y otros grupos de plantas (Salinas-Rodríguez et al., 2017), incluso atribuyéndosele el origen de la subsección Cembroides (Farjon, 1996). Lo anterior explicaría el alto valor de importancia para CRP_3 (tabla 1), además de la presencia de especies endémicas (P. nelsonii y P. culminicola) y de distribución restringida (P. remota, P. pinceana y P. greggii) en esta región. Además, la SMOr ha sido descrita como el área de mayor rareza de coníferas en México (Farjon y Filer, 2013) y una zona con elevada diversidad de encinos, cactáceas y otras plantas (Contreras-Medina y Luna-Vega, 2007; Salinas-Rodríguez et al., 2017, 2018), convirtiéndose en una importante área de riqueza, endemismo y evolución para otras especies, además de Pinus. El CRP_3 coincide espacialmente con 2 de las áreas prioritarias para la conservación de pinos de ecosistemas semiáridos y subalpinos de México (Sáenz-Ceja et al., 2022).
El alto valor de importancia para la OZD_3 (tabla 1) es explicado por una mezcla de taxones endémicos (P. maximartinezii, P. jaliscana y P. vallartensis, P. georginae), de distribución amplia (P. oocarpa, P. hartwegii, P. leiophylla, P. devoniana; material suplementario: tabla S1) y restringida (P. praetermissa, P. luzmariae), que en conjunto favorecen altos valores de endemismo, rareza y riqueza. Algunas zonas del área OZD_3 son también importantes centros de endemismo para orquídeas y plantas vasculares (Aragón-Parada et al., 2021; Estrada-Sánchez et al., 2019; Morrone, 2019; Rodríguez et al., 2018; Vargas-Amado et al., 2013, 2020) y hongos (Hernández-López et al., 2020; Rodríguez-Alcantar et al., 2019). Sin embargo, algunas de las especies de la OZD_3 (e.g., P. maximartinezii, P. jaliscana, P. praetermissa y P. vallartensis) han experimentado alteraciones significativas de hábitat en la última década (Sáenz-Ceja et al., 2022), resaltando la importancia de esta área dada la vulnerabilidad de algunas de sus especies.
Las tasas altas de humedad existentes en OZD_3, provocadas por la entrada de viento monzónico del océano Pacífico, podría ser un importante impulsor de la elevada riqueza de esta región (Rzedowski, 2006), además de una marcada complejidad topográfica ocasionada por la unión de la FVT y SMOc y de la confluencia de 4 de los 5 biomas reconocidos por Villaseñor y Ortiz (2014) para México, cuyas zonas de transición propician una elevada diversidad biológica (Cayuela et al., 2006; Sánchez-González y López-Mata, 2005). Otro factor que pudo haber desencadenado la riqueza de Pinus en OZD_3 es el vulcanismo ocurrido hace 7.5 – 5.5 Ma en el occidente de la FVT (Gómez-Tuena et al., 2005), que coincide con la edad de divergencia promedio de especies endémicas y restringidas a esta área como P. praetermissa, P. jaliscana, P. luzmariae y P. georginae (5.62 Ma en promedio; Jin et al., 2021). Así mismo, Sáenz-Ceja et al. (2022) han señalado a las sierras meridionales de Jalisco como una de las áreas de mayor rareza y endemismo de especies de pino de México.
Áreas como el CRP_10 y OZD_2 registraron puntajes bajos para I, II y III, sin embargo, presentaron cifras considerables de riqueza máxima (tabla 1). El bajo endemismo de esas áreas, comparado con otros CRP, es causado por la presencia de especies de amplia distribución (e.g. P. teocote, P. oocarpa, P. pseudostrobus). El CRP_10 ha sido reconocido como la zona de mayor riqueza de plantas vasculares del sur de México (Cruz-Cárdenas et al., 2013; González-Espinosa et al., 2004; Villaseñor y Ortiz, 2014). El hecho que estados como Chiapas posean menor riqueza de pinos, puede deberse a la competencia con plantas angiospermas que desde la antigüedad ha sido un factor decisivo en las trayectorias evolutivas de Pinus y que actualmente podría estar limitando su distribución y abundancia en esas regiones (Farjon, 1996; Keeley, 2012; Millar, 1993).
Las áreas de riqueza identificadas para Oaxaca y Guerrero (CRP_7, 8 y 9) coinciden espacialmente con algunas de las zonas de mayor riqueza de especies de pino en México señaladas por Sáenz-Ceja et al. (2022) y con la regionalización de la SMS propuesta por Morrone (2019), siendo la más importante el CRP_7. En esta región, la presencia de bosques templados y húmedos de montaña crea condiciones ambientales que favorecen la presencia de un elevado número de especies a escala local y regional (12 y 16 especies; tabla 1) (Aragón-Parada et al., 2021; Villaseñor y Ortiz, 2014), y cuyo patrón geográfico coincide espacialmente con el de especies relacionadas como bromelias y orquídeas (Estrada-Sánchez et al., 2019). Así mismo, en Oaxaca existe la mayor riqueza de gimnospermas y plantas vasculares de México (Contreras-Medina y Luna-Vega, 2007; Cruz-Cárdenas et al., 2013), por lo que algunos sitios del CRP_7 han sido señalados por ser áreas de amplia importancia biológica (Suárez-Mota et al., 2018). A ello puede anexarse la información generada en este estudio, que ubica al CRP_7 como la quinta más importante (dados los criterios aquí considerados) para el género Pinus en México.
El bajo valor de importancia para CRP_1 se debió a los bajos puntajes de II y IV (tabla 1). Lo anterior coincide con lo descrito por Contreras-Medina y Luna-Vega (2007), quienes afirmaron que dicha zona es una de las más pobres en cuanto a presencia de gimnospermas en México, aunque estudios locales han señalado sitios con alto endemismo y riqueza de plantas vasculares (Riemann y Exequiel, 2007; Rzedowski, 2006). Sin embargo, recalcamos que el bajo valor de importancia para CRP_1 no implica necesariamente pobreza biológica, sino una disminución de ésta con respecto al resto de CRP. De acuerdo con Farjon (1996), los pinos del CRP_1 migraron hacia esas zonas a finales del Terciario siguiendo patrones de diversificación, cuyos procesos de adaptación y colonización pudieron haber desencadenado mecanismos como el hábito de cono serótino (como en P. radiata; Millar, 1999) y la variación del tamaño de la hoja debido al estrés por aridez y sequía como en P. quadrifolia y P. californiarum (Axelrod, 1975). Además, el CRP_1 representa el límite latitudinal inferior para la mayoría de los pinos que ahí se presentan (e.g., P. lambertiana, P. coulteri, P. jeffreyi y P. contorta) y debido a que son las poblaciones periféricas las que mayores tasas de evolución y extinción experimentan, su conservación se vuelve más relevante (Gaston, 2003).
Por el contrario, de acuerdo con Sáenz-Ceja et al. (2022), las sierras de San Pedro Mártir y Juárez (norte de Baja California y CRP_1 en este estudio) representan un área prioritaria para conservación de pinos en México, aunque tal región no figuró entre las más importantes de este estudio. Eso puede deberse a que especies como P. jeffreyi, P. lambertiana, P. contorta y P. coulteri son señaladas como especies de alto endemismo y rareza por los autores. Mientras que aquí se utilizó el rango geográfico completo de esas especies, el cual abarca desde las sierras antes mencionadas hasta el norte de Oregón, EUA (Farjon y Filer, 2013), por lo que los valores de endemismo y rareza resultaron bajos para esas especies y que condujeron a bajos valores de importancia al CRP_1. Sin embargo, aunque no haya resultado ser un CRP de alta importancia, en la última década algunas de sus especies (e.g., P. attenuata, P. californiarum, P. coulteri, P. jeffreyi y P. quadrifolia) han experimentado la mayor disminución de hábitat secundario entre los pinos mexicanos, indicando un alto nivel de vulnerabilidad en el CRP_1 (Sáenz-Ceja et al., 2022).
De manera similar a lo descrito en párrafos anteriores, áreas geográficas coincidentes con los CRP_4, 5 y 6 han sido señalados por presentar alta riqueza de musgos (Villaseñor et al., 2006), mientras que para algunas áreas de la SMS (CRP_9, CRP_8 y OZD_1) se ha documentado alta riqueza de orquídeas y bromelias (Estrada-Sánchez et al., 2019). De la misma forma, los CRP_10, CRP_6, CRP_7, OZD_2, OZD_3 y OZD_4 coinciden espacialmente con zonas de alta riqueza de especies de árboles de los géneros Quercus, Pinus, Juniperus, Arbutus entre otros (Téllez et al., 2020). Algunas de las áreas de mayor irremplazabilidad de especies de pino señaladas por Sáenz-Ceja et al. (2022) son parcialmente coincidentes con el CRP_2, CRP_3, OZD_3, CRP_7 y OZD_4, las cuales obtuvieron los primeros 5 valores más altos de importancia de este estudio (tabla 1). Lo anterior refuerza la elevada importancia de tales áreas para el género Pinus en México.
Para concluir, el análisis realizado sugiere que los sitios más probables de diversificación del género Pinus en México corresponden a las zonas de mayor altitud ubicadas al este de la FVT (México, Puebla, Hidalgo, y sur de San Luis Potosí), el norte de la sierra Madre Oriental (sureste de Coahuila y este de Nuevo León), el norte de la sierra Madre Occidental (Chihuahua y Durango) y los sistemas montañosos del sur de Oaxaca y meseta central de Chiapas. La información generada en esta investigación proporciona una actualización a revisiones previas sobre la distribución del género y las áreas particulares donde existe mayor riqueza, endemismo y rareza de este grupo de plantas en México. En la medida que el acervo digital sobre información biológica georreferenciada actual y antigua se complemente, las áreas de riqueza y probables centros de diversificación podrán afinarse en investigaciones futuras.
Agradecimientos
Al Consejo Nacional de Humanidades, Ciencias y Tecnologías por la beca otorgada al primer autor LS-D, para desarrollar estudios doctorales en el posgrado en Ciencias Forestales del Colegio de Postgraduados, proceso del cual derivó la presente investigación.
Referencias
Aguilar-Santelises, R. y Castillo, R. F. D. (2013). Factors affecting woody plant species diversity of fragmented seasonally dry oak forests in the Mixteca Alta, Oaxaca, Mexico. Revista Mexicana de Biodiversidad, 84, 575–590. https://doi.org/10.7550/rmb.30458
Arenas-Navarro, M., Téllez-Valdés, O., López-Segoviano, G., Murguía-Romero, M. y Tello, J. S. (2020). Environmental correlates of leguminosae species richness in Mexico: quantifying the contributions of energy and environmental seasonality. Biotropica, 52, 70–80. https://doi.org/10.1111/btp.12735
Aragón-Parada, J., Rodríguez, A., Munguía-Lino, G., De-Nova, J. A., Salinas-Rodríguez, M. M. y Carrillo-Reyes, P. (2021). Las plantas vasculares endémicas de la Sierra Madre del Sur, México. Botanical Sciences, 99, 643–660. https://doi.org/10.17129/botsci.2682
Axelrod, D. I. (1975). Evolution and biogeography of Madrean-Tethyan Sclerophyll vegetation. Annals of the Missouri Botanical Garden, 62, 280–334. https://doi.org/10.2307/2395199
Brose, U., Martinez, N. D. y Williams, R. J. (2003). Estimating species richness: Sensitivity to sample coverage and insensitivity to spatial patterns. Ecology, 84, 2364–2377. https://doi.org/10.1890/02-0558
Buck, R., Ortega-Del Vecchyo, D., Gehring, C., Michelson, R., Flores-Rentería, D., Klein, B. et al. (2023). Sequential hybridization may have facilitated ecological transitions in the Southwestern pinyon pine syngameon. New Phytologist, 237, 2435–2449. https://doi.org/10.1111/nph.18543
Buck, R., Hyasat, S., Hossfeld, A. y Flores-Renteriá, L. (2020). Patterns of hybridization and cryptic introgression among one- And four-needled pinyon pines. Annals of Botany, 126, 401–411. https://doi.org/10.1093/aob/mcaa045
Cayuela, L., Golicher, D. J., Benayas, J. M. R., González-Espinosa, M. y Ramírez-Marcial, N. (2006). Fragmentation, disturbance and tree diversity conservation in tropical montane forests. Journal of Applied Ecology, 43, 1172–1181. https://doi.org/10.1111/j.1365-2664.2006.01217.x
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (2007). Elementos para la determinación de centros de origen y centros de diversidad genética en general y el caso específico de la liberación experimental de maíz transgénico al medio ambiente en México. Revista de Geografía Agrícola, 38, 121–140.
Contreras-Medina, R. y Luna-Vega, I. (2007). Species richness, endemism and conservation of Mexican gymnosperms. Biodiversity and Conservation, 16, 1803–1821. https://doi.org/10.1007/s10531-006-9072-3
Cruz-Cárdenas, G., Villaseñor, J. L., López-Mata, L. y Ortiz, E. (2013). Distribución espacial de la riqueza de especies de plantas vasculares en México. Revista Mexicana de Biodiversidad, 84, 1189–1199. https://doi.org/10.7550/rmb.31811
Estrada-Sánchez, I., García-Cruz, J., Espejo-Serna, A. y López-Ortega, G. (2019). Identification of areas of endemism in the Mexican cloud forests based on the distribution of endemic epiphytic bromeliads and orchids. Phytotaxa, 397, 129. https://doi.org/10.11646/phytotaxa.397.2.1
Farjon, A. (1996). Biodiversity of Pinus (Pinaceae) in Mexico: speciation and palaeo-endemism. Botanical Journal of the Linnean Society, 121, 365–384. https://doi.org/10.1006/bojl.1996.0041
Farjon, A. (2017). A handbook of the world’s conifers (2nd ed.). Leiden-Boston, Netherlands: Brill.
Farjon, A. (2018). Index of botanical names of pines. En A. Farjon (Eds.), Pines: drawings and descriptions of the genus Pinus (pp. 232–235). Leiden, Boston, Netherlands: Brill.
Farjon, A. y Filer, D. (2013). An atlas of the world’s conifers: an analysis of their distribution, biogeography, diversity and conservation status. Leiden, Netherlands: Brill.
Fisher, R. A., Corbet, A. S. y Williams, C. B. (1943). The relation between the number of species and the number of individuals in a random sample of an animal population. The Journal of Animal Ecology, 12, 42–58. https://doi.org/10.2307/1411
Fortuny-Fernández, N. M., Monserrat-Ferrer, M. y Ruenes-Morales, M. R. (2017). Centros de origen, domesticación y diversidad genética de la ciruela mexicana, Spondias purpurea (Anacardiaceae). Acta Botanica Mexicana, 121, 7–38. https://doi.org/10.21829/abm121.2017.1289
García-Gómez, V., Ramírez-Herrera, C., Flores-López, C. y López-Upton, J. (2014). Diversidad y estructura genética de Pinus johannis. Agrociencia, 48, 863–873.
Gaston, K. J. (2003). The structure and dynamics of geographic ranges. Oxford, New York: Oxford University Press.
Gernandt, D. S. y Pérez-de La Rosa, J. A. (2014). Biodiversidad de Pinophyta (coníferas) en México. Revista Mexicana de Biodiversidad, 85(Suppl.), S126–S133. https://doi.org/10.7550/rmb.32195
Gómez-Tuena, A., Orozco-Esquivel, M. T. y Ferrari, L. (2005). Petrogénesis ígnea de la Faja Volcánica Transmexicana. Boletín de la Sociedad Geológica Mexicana, 57, 227–283. https://doi.org/10.18268/BSGM2005v57n3a2
González-Elizondo, M., González-Elizondo, M. S., Ruacho-González, L. y Molina-Olvera, M. (2011). Pinus maximartinezii Rzed. (Pinaceae), primer registro para Durango, segunda localidad para la especie. Acta Botanica Mexicana, 96, 33–48. https://doi.org/10.21829/abm96.2011.257
González-Elizondo, M. S., González-Elizondo, M., Tena-Flores, J. A., Ruacho-González, L. y López-Enríquez, I. L. (2012). Vegetación de la Sierra Madre Occidental, México: una síntesis. Acta Botanica Mexicana, 100, 351–404. https://doi.org/10.21829/abm100.2012.40
González-Espinosa, M., Rey-Benayas, J. M., Ramírez-Marcial, N., Huston, M. A. y Golicher, D. (2004). Tree diversity in the northern Neotropics: Regional patterns in highly diverse Chiapas, Mexico. Ecography, 27, 741–756. https://doi.org/10.1111/j.0906-7590.2004.04103.x
González-Jiménez, A., Delgado-Valerio, P., Molina-Sánchez, A., Flores-López, C., Vargas-Gutiérrez, J. P. y García-Magaña, J. J. (2021). Diversidad genética en poblaciones de Pinus remota (Pinaceae) del Noreste de México: evidencias de declinamiento demográfico histórico. Acta Botanica Mexicana, 128, e1890. https://doi.org/10.21829/abm128.2021.1890
Hernández-López, L., Rodríguez-Alcántar, O., Figueroa-García, D., Reynoso Dueñas, J. J. y Arias, A. (2020). Flora y micobiota en riesgo y endémicas en el municipio San Sebastián del Oeste, Jalisco, México. Acta Botanica Mexicana, 128, e1771. https://doi.org/10.21829/abm128.2021.1771
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1–9.
Hernández-Salas, J., Aguirre-Calderón, Ó. A., Alanís-Rodríguez, E., Jiménez-Pérez, J., Treviño-Garza, E. J., González-Tagle, M. A. et al. (2013). Efecto del manejo forestal en la diversidad y composición arbórea de un bosque templado del noroeste de México. Revista Chapingo, Serie Ciencias Forestales y del Ambiente, 19, 189–199. https://doi.org/10.5154/r.rchscfa.2012.08.052
Hijmans, R. J., Guarino, L. y Mathur, P. (2012). DIVA-GIS. Ver. 7.5. A geographic information system for the analysis of species distribution data. Lima, Perú.
Huerta-Vergara, A. R., Calvillo-Canadell, L., Cevallos-Ferriz, S. R. S. y Silva-Pineda, A. (2013). Pinaceae en el cretácico del norte y sur de México: complemento a su escaso registro fósil. Paleontología Mexicana, 63, 66–78.
Jin, W. T., Gernandt, D. S., Wehenkel, C., Xia, X. M., Wei, X. X. y Wang, X. Q. (2021). Phylogenomic and ecological analyses reveal the spatiotemporal evolution of global pines. Proceedings of the National Academy of Sciences, 118, e2022302118. https://doi.org/10.1073/PNAS.2022302118
Keeley, J. E. (2012). Ecology and evolution of pine life histories. Annals of Forest Science, 69, 445–453. https://doi.org/10.1007/s13595-012-0201-8
Kerr, J. T. (1997). Species richness, endemism, and the choice of areas for conservation. Conservation Biology, 11, 1094–1100. https://doi.org/10.1046/j.1523-1739.1997.96089.x
Ledig, F. T., Capó-Arteaga, M. A., Hodgskiss, P. D., Sbay, H., Flores-López, C., Thompson Conkle, M. et al. (2001). Genetic diversity and the mating system of a rare Mexican piñon, Pinus pinceana, and a comparison with Pinus maximartinezii (Pinaceae). American Journal of Botany, 88, 1977–1987. https://doi.org/10.2307/3558425
Luna-Bautista, L., De La Rosa, P. H., Velázquez-Martínez, A., Gómez-Guerrero, A. y Acosta-Mireles, M. (2015). El sotobosque en la composición y diversidad de áreas bajo manejo forestal en Santa Catarina Ixtepeji, Oaxaca. Revista Chapingo, Serie Ciencias Forestales y del Ambiente, 21, 109–121. https://doi.org/10.5154/r.rchscfa.2014.08.037
Maciel, E. A. (2021). An index for assessing the rare species of a community. Ecological Indicators, 124, 107424. https://doi.org/10.1016/j.ecolind.2021.107424
Magurran, A. E. (1988). Ecological diversity and its measurement. Princeton: Princeton University Press. https://doi.org/10.1007/978-94-015-7358-0
Martin, M. P., Peters, C. M., Asbjornsen, H. y Ashton, M. S. (2021). Diversity and niche differentiation of a mixed pine–oak forest in the Sierra Norte, Oaxaca, Mexico. Ecosphere, 12, e03475. https://doi.org/10.1002/ecs2.3475
Millar, C. I. (1993). Impact of the Eocene on the evolution of Pinus L. Annals of the Missouri Botanical Garden, 80, 471–498. https://doi.org/10.2307/2399795
Millar, C. I. (1999). Evolution and biogeography of Pinus radiata, with a proposed revision of its Quaternary history. New Zealand Journal of Forestry Science, 29, 335–365.
Montes, J. R., Peláez, P., Moreno-Letelier, A. y Gernandt, D. S. (2022). Coalescent-based species delimitation in North American pinyon pines using low-copy nuclear genes and plastomes. American Journal of Botany, 109, 706–726. https://doi.org/10.1002/ajb2.1847
Montes, J. R., Peláez, P., Willyard, A., Moreno-Letelier, A., Piñero, D. y Gernandt, D. S. (2019). Phylogenetics of Pinus subsection Cembroides Engelm. (Pinaceae) inferred from low-copy nuclear gene sequences. Systematic Botany, 44, 501–518. https://doi.org/10.1600/036364419×15620113920563
Morrone, J. J. (2019). Regionalización biogeográfica y evolución biótica de México: encrucijada de la biodiversidad del Nuevo Mundo. Revista Mexicana de Biodiversidad, 90, e902980. https://doi.org/10.22201/ib.20078706e.2019.90.2980
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C. et al. (2001). Terrestrial ecoregions of the Worlds: a new map of life on Earth. Bioscience, 51, 933–938. https://doi.org/10.1641/
0006-3568(2001)051[0933:TEOTWA]2.0.CO;2
Parraguirre-Lezama, C., Vargas-Hernández, J., Ramírez-Vallejo, P., Azpíroz-Rivero, H. y Jasso-Mata, J. (2002). Estructura de la diversidad genética en poblaciones naturales de Pinus greggii Engelm. Revista Fitotecnia Mexicana, 25, 279–287.
Peet, R. K. (1974). The measurement of species diversity. Annual Review of Ecology and Systematics, 5, 285–307. https://doi.org/10.1146/annurev.es.05.110174.001441
Pérez-de La Rosa, J. A. y Gernandt, D. S. (2017). Pinus vallartensis (Pinaceae), a new species from Western Jalisco, Mexico. Phytotaxa, 331, 233–242. https://doi.org/10.11646/phytotaxa.331.2.7
Quantum GIS Development Team. (2019). QGIS Geographic Information System (v. 3.10.14-A Coruña). Open Source Geospatial Foundation Project. República Checa. Recuperado el 10 diciembre, 2019 de: http://www.qgis.org
Ramírez-Barahona, S., Cuervo-Robayo, A. P. y Magallón, S. (2023). Assessing digital accessible botanical knowledge and priorities for exploration and discovery of plant diversity across Mesoamerica. New Phytologist, 240, 1659-1672. https://doi.org/10.1111/nph.19190
Ramos-Dorantes, D. B., Villaseñor, J. L., Ortiz, E. y Gernandt, D. S. (2017). Biodiversity, distribution, and conservation status of Pinaceae in Puebla, Mexico. Revista Mexicana de Biodiversidad, 88, 215–223. https://doi.org/10.1016/j.rmb.2017.01.028
Riemann, H. y Exequiel, E. (2007). Endemic regions of the vascular flora of the peninsula of Baja California, Mexico. Journal of Vegetation Science, 18, 327–336. https://doi.org/10.1111/j.1654-1103.2007.tb02544.x
Ríos-Altamirano, A., Alfonso-Corrado, C., Aguirre-Hidalgo, V., Ángeles-Pérez, G., Mendoza-Díaz, M. M., Rodríguez-Rivera, V. et al. (2016). Abundancia y distribución del género Pinus en Capulálpam de Méndez, Sierra Juárez, Oaxaca. Madera y Bosques, 22, 61–74. https://doi.org/10.21829/myb.2016.2231457
Rodríguez-Alcántar, O., Figueroa-García, D. y Herrera-Fonseca, M. J. (2019). Catálogo de los hongos de San Sebastián del Oeste, Jalisco, México. Acta Botanica Mexicana, 126, e1364. https://doi.org/10.21829/abm126.2019.1364
Rodríguez, A., Castro-Castro, A., Vargas-Amado, G., Vargas-Ponce, O., Zamora-Tavares, P., González-Gallegos, J. et al. (2018). Richness, geographic distribution patterns, and areas of endemism of selected angiosperm groups in Mexico. Journal of Systematics and Evolution, 56, 537–549. https://doi.org/10.1111/jse.12457
Rueda, M., Godoy, O. y Hawkins, B. A. (2017). Spatial and evolutionary parallelism between shade and drought tolerance explains the distributions of conifers in the conterminous United States. Global Ecology and Biogeography, 26, 31–42. https://doi.org/10.1111/geb.12511
Rzedowski, J. (2006). Vegetación de México. México D.F.: Limusa.
Sáenz-Ceja, J. E., Arenas-Navarro, M. y Torres-Miranda, A. (2022). Prioritizing conservation areas and vulnerability analyses of the genus Pinus L. (Pinaceae) in Mexico. Journal for Nature Conservation, 67, 126171. https://doi.org/10.1016/j.jnc.2022.126171
Salinas-Rodríguez, M. M., Estrada-Castillón, E. y Villarreal-Quintanilla, J. A. (2017). Endemic vascular plants of the Sierra Madre Oriental, Mexico. Phytotaxa, 328, 1–52. https://doi.org/10.11646/phytotaxa.328.1.1
Salinas-Rodríguez, M. M., Sajama, M. J., Gutiérrez-Ortega, J. S., Ortega-Baes, P. y Estrada-Castillón, A. E. (2018). Identification of endemic vascular plant species hotspots and the effectiveness of the protected areas for their conservation in Sierra Madre Oriental, Mexico. Journal for Nature Conservation, 46, 6–27. https://doi.org/10.1016/j.jnc.2018.08.012
Sánchez-González, A. (2008). Una visión actual de la diversidad y distribución de los pinos de México. Madera y Bosques, 14, 107–120. https://doi.org/10.21829/myb.2008.1411222
Sánchez-González, A. y López-Mata, L. (2005). Plant species richness and diversity along an altitudinal gradient in the Sierra Nevada, Mexico. Diversity and Distributions, 11, 567–575. https://doi.org/10.1111/j.1366-9516.2005.00186.x
Santillán-Fernández, A., Salinas-Moreno, Y., Valdez-Lazalde, J. R., Bautista-Ortega, J. y Pereira-Lorenzo, S. (2021). Spatial delimitation of genetic diversity of native maize and its relationship with ethnic groups in Mexico. Agronomy, 11, 1–13. https://doi.org/10.3390/agronomy11040672
Stults, D. Z., Axsmith, B. J. y Liu, Y. S. (2010). Evidence of white pine (Pinus subgenus Strobus) dominance from the Pliocene Northeastern Gulf of Mexico Coastal Plain. Palaeogeography, Palaeoclimatology, Palaeoecology, 287, 95–100. https://doi.org/10.1016/j.palaeo.2010.01.021
Suárez-Mota, M. E., Téllez-Valdés, O., Lira-Saade, R. y Villaseñor, J. L. (2013). Una regionalización de la Faja Volcánica Transmexicana con base en su riqueza florística. Botanical Sciences, 91, 93–105. https://doi.org/10.17129/botsci.405
Suárez-Mota, M. E., Villaseñor, J. L. y Ramírez-Aguirre, M. B. (2018). Sitios prioritarios para la conservación de la riqueza florística y el endemismo de la Sierra Norte de Oaxaca, México. Acta Botanica Mexicana, 124, 49–74. https://doi.org/10.21829/abm124.2018.1296
Téllez, O., Mattana, E., Diazgranados, M., Kühn, N., Castillo-Lorenzo, E., Lira, R. et al. (2020). Native trees of Mexico: diversity, distribution, uses and conservation. PeerJ, 8, e9898. https://doi.org/10.7717/peerj.9898
Vargas-Amado, G., Castro-Castro, A., Harker, M., Vargas-Amado, M. E., Villaseñor, J. L., Ortiz, E. et al. (2020). Western Mexico is a priority area for the conservation of Cosmos (Coreopsideae, Asteraceae), based on richness and track analysis. Biodiversity and Conservation, 29, 545–569. https://doi.org/10.1007/s10531-019-01898-2
Vargas-Amado, G., Castro-Castro, A., Harker, M., Villaseñor, J. L., Ortiz, E. y Rodríguez, A. (2013). Geographic distribution and richness of the genus Cosmos (Asteraceae: Coreopsideae). Revista Mexicana de Biodiversidad, 84, 536–555. https://doi.org/10.7550/rmb.31481
Villaseñor, J. L. (2016). Catálogo de las plantas vasculares nativas de México. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017
Villaseñor, J. L., Delgadillo, C. y Ortiz, E. (2006). Biodiversity hotspots from a multigroup perspective: mosses and senecios in the Transmexican Volcanic Belt. Biodiversity and Conservation, 15, 4045–4058. https://doi.org/10.1007/s10531-005-3056-6
Villaseñor, J. L. y Ortiz, E. (2014). Biodiversidad de las plantas con flores (División Magnoliophyta) en México. Revista Mexicana de Biodiversidad, 85, 134–142. https://doi.org/10.7550/rmb.31987
Willyard, A., Gernandt, D. S., Cooper, B., Douglas, C., Finch, K., Karemera, H. et al. (2021). Phylogenomics in the Hard Pines (Pinus subsection Ponderosae; Pinaceae) confirms paraphyly in Pinus ponderosa, and places Pinus jeffreyi with the California Big Cone pines. Systematic Botany, 46, 538–561. https://doi.org/10.1600/036364421X16312067913435
Willyard, A., Gernandt, D. S., Potter, K., Hipkins, V., Marquardt, P., Mahalovich, M. F. et al. (2017). Pinus ponderosa: a checkered past obscured four species. American Journal of Botany, 104, 161–181. https://doi.org/10.3732/ajb.1600336
Chorotypes and geographic relationships among endemic species of the Transmexican Volcanic Belt, Mexico
Tania Escalante *, Leslie Madeline Elguea-Manrique, Perla Carolina Espíritu-Guerrero
Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Biología Evolutiva, Laboratorio Biogeografía de la Conservación, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de Mëxico, Mexico
*Corresponding author: tescalante@ciencias.unam.mx (T. Escalante)
Received: 27 July 2023; accepted: 5 March 2024
Abstract
The Transmexican Volcanic Belt (TVB) is a complex biogeographical province characterized by several areas of endemism and high diversity of flora and fauna produced by complex geological and evolutionary processes. Chorotypes are biogeographical patterns that occur either when 2 or more independently distributed species share the same occupied area, or even when a single species’ distribution area differs significantly from others. Here, we identified chorotypes of 167 endemic species inhabiting the TVB using geographic distribution models and quantitative methods. Of those species, 136 were included in 11 chorotypes, named I to XI. In addition, the insect Aedes niveoscotum constituted chorotype XII. The 30 remaining species did not belong to any chorotype. All chorotypes included species from different taxonomic groups, which may be due to a shared biogeographical history. The chorotypes with the highest richness were located in the central and eastern TVB, suggesting that volcano peaks and surrounding areas are important for generating the particular environmental conditions that restrict the distribution of species of different taxonomic groups.
Keywords: Biogeography; Patterns; Similarity; Species richness; Species distribution models
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Corotipos y relaciones geográficas entre especies endémicas de la Faja Volcánica Transmexicana, México
Resumen
La Faja Volcánica Transmexicana (FVT) es una provincia biogeográfica compleja caracterizada por varias áreas de endemismo y una alta diversidad de flora y fauna, producto de complejos procesos geológicos y evolutivos. Los corotipos son patrones biogeográficos que ocurren cuando 2 o más especies de distribución independiente comparten la misma área de ocupación, o incluso cuando la distribución de una única especie difiere significativamente de otras. En este manuscrito, nosotras identificamos corotipos para 167 especies endémicas que habitan la FVT usando modelos de distribución geográfica y métodos cuantitativos. A partir del total de especies, 136 estuvieron incluidas en 11 corotipos, nombrados del I al XI. Adicionalmente, el insecto Aedes niveoscotum conformó el corotipo XII. Las 30 especies restantes no pertenecieron a ningún corotipo. Todos los corotipos incluyeron especies de diferentes grupos taxonómicos, lo cual puede deberse a una historia biogeográfica común. Los corotipos con la mayor riqueza de especies estuvieron localizados en el centro y este de la FVT, sugiriendo que los picos de los volcanes y las áreas circundantes son importantes para producir las condiciones ambientales particulares que restringen la distribución de las especies de diferentes grupos taxonómicos.
Palabras clave: Biogeografía; Patrones; Similitud; Riqueza de especies; Modelos de distribución de especies
Introduction
Distributional patterns in biogeography occur when a group of species share a given geographic space; while species that are distributed independently from each other show no distributional pattern (Márquez et al., 1997). The word “chorotype” was introduced by La Greca in 1963 (La Greca, 1963, in Morrone, 2014). According to Fattorini (2016), the term chorotype was implicitly used by La Greca to refer to “chorological categories”. Years later, an equivalence between chorological category and chorotype was established (Fattorini, 2016), defining a chorotype as the coincidence between the distribution ranges of species. Numerical chorotypes were defined by Baroni-Urbani et al. (1978) as a biogeographic pattern of 2 or more species occupying a similar area (Barbosa & Estrada, 2016; Real, Guerrero, & Vargas, 1992; Vargas & Real, 1997). Moreover, according to Real et al. (1996), the distribution area of a single species can be considered a chorotype if the distribution is significantly different from the distributions of other species. Because the identification of patterns using subjective methods can lead to mistaken results (Flores et al., 2004; Jardine, 1972; Márquez et al., 1997), it has been necessary to use quantitative techniques such as the appropriate similarity indices to produce coherent and reproducible results (Márquez et al., 1997). These techniques should compare the species’ distributions and their groupings in chorotypes (Barbosa & Estrada, 2016).
Similarity among species distributions has been analyzed from different perspectives. The Jaccard index (1908) has been used to compare the presence of species between 2 communities (Mostacedo & Fredericksen, 2000), but considers only presence data; it does not take into account the double absence of species. Real, Guerrero, and Ramírez (1992), and Real and Vargas (1996) consider this an advantage because the similarity between the 2 sites is not influenced by the number of other sites studied. However, Rice and Belland (1982) discussed that high or low values of Jaccard’s index could be random. Conversely, Baroni-Urbani and Buser (1976) proposed an index considering double absences, since 2 species could be absent from a locality due to ecological and historical reasons or inadequate sampling. Moreover, shared absences between species can be interpreted as coinciding distribution limits, like biogeographic barriers (Flores et al., 2004). For this index, there is a statistical table of associated probabilities (Baroni-Urbani & Buser, 1976). Later, Buser and Baroni-Urbani (1982) and Real, Guerrero, and Ramírez (1992) suggested caution in interpreting analyses that consider double absences, since including additional localities can alter the results of the index. Therefore, Real, Guerrero, & Vargas (1992) consider to Buser and Baroni-Urbani index as a feature of a relationship in the context of all the sites analyzed.
The Transmexican Volcanic Belt (TVB) is a complex mountainous biogeographical province between the Nearctic and Neotropical regions (Morrone et al., 2017). The TVB is located between 19-20° North latitude. It spans of 1,000 km and crosses Mexico in an east-west direction. This province is characterized by several areas of endemism and a high diversity of flora and fauna, produced by complex geological and biological processes (Hernández & Carrasco, 2007; Ruggiero & Ezcurra, 2003; Suárez-Mota et al., 2013). The TVB has the most heterogeneous relief and the highest elevations in Mexico, with important changes in altitude over short distances. This results in high climatic diversity between highland and lowland areas, which promotes high species richness (Hernández & Carrasco, 2007). The highest mountains in Mexico are in the TVB, including the Pico de Orizaba (5,650 m of altitude), Popocatépetl (5,450 m), Iztaccíhuatl (5,280 m), Nevado de Toluca (4,560 m), Malinche (4,460 m) and Nevado de Colima (4,340 m) (Suárez-Mota et al., 2013).
Non-random historical relationships could explain the biogeographic patterns displayed by the species of the TVB because they evolved under similar environmental conditions (Frey, 1992). Unfortunately, environmental deterioration resulting from the expansion of human activities has a negative effect on the habitat of many species distributed in the TVB. To contribute to the knowledge of biogeographical patterns in the TVB, we aimed to identify chorotypes of endemic species of 5 different taxa (amphibians, birds, insects, mammals and plants) using species distribution models and quantitative methods.
Materials and methods
We compiled a database of 167 endemic species of the TVB belonging to 5 taxonomic groups (Supplementary material: Table S1.1): 25 species of amphibians (Flores-Villela et al., 2010); 1 bird (Navarro-Sigüenza et al., 2003; Peterson et al., 2016); 89 species of insects (GBIF, 2017; Reyes-Castillo & Morón Ríos, 2005; SNIB-Conabio, 2017), 15 mammals (Escalante, 2015); and 37 plants (Magnoliopsida) (Escalante, 2015; Hernández & Gómez-Hinostrosa, 2011, 2015; Téllez-Valdés, 2017). These taxa were selected using their data points of occurrence from a previous database (Escalante et al., 2020; Supplementary material: Fig. S1.1), where at least 50% of the presence points for each species fell within the TVB polygon (Morrone et al., 2017).
To obtain the distribution areas of species, we generated species distribution models (SDM) for the 43 species with at least 6 data points using Maxent 3.4.0 (Phillips et al., 2017). SDM allow to predict the spatial distribution of a species based on statistical relationships between their occurrences and environmental conditions, producing a comprehensive understanding of the factors that molded species presence (Elith & Leathwick, 2009; Elith et al., 2006). The species distribution models were produced as in Escalante et al. (2020). Maxent was run using the ‘dismo’ package (Hijmans et al., 2017) in R version 3.4.2 (R Core Team, 2017) and we applied the omission error threshold of E = 10 (Peterson et al., 2008) to transform model output to binary. For the other 124 species (which had 5 or fewer data points or poor model performance), the geographic distribution was obtained directly from the data points.
Each species distribution model and geographic distribution was overlapped with a 0.5° latitude-longitude grid in QGIS v. 2.18.6 (QGIS Development Team, 2016) to determine the presence of a species in each cell of the grid. We built a presence-absence matrix for all species, where a species’ presence in each grid cell was coded as ‘1’ and absence as ‘0’. Based on the presence-absence matrix of 167 species and 609 cells, we applied the Baroni-Urbani and Buser index (1976) to obtain the similarity between the distributions of each pair of species. The index is as follows:

where A is the number of cells in which species “a” is present, B is the number of cells in which species “b” is present, C is the number of cells where both species “a” and “b” are present, and D is the number of cells in which both species “a” and “b” are absent. Because the double absences could lead to apparent similarity between 2 geographic distributions, they are multiplied by the double presences (Marquez et al., 1992). This could also prevent the effect of the Wallacean shortfall —i.e., lack of distribution data; Hortal et al., 2015— on some species, particularly those whose distributions were taken directly from points rather than modeled.
We identified chorotypes using the “Rmacoqui” package (Olivero et al., 2015) in R v.1.0.143 (R Core Team, 2017). Although all processes were developed in the R script, we describe the step-by step following: first, there was a transformation of the similarity matrix into a significant similarity matrix of ‘+’, ‘-’ and ‘0’ values, following to Márquez et al. (1997). Next, a cluster analysis was performed using the UPGMA (Unweighted Pair-Group Method using Arithmetic Averages) hierarchical classification method. For each cluster, we tested for significant segregation following McCoy et al. (1986). For each bifurcation in the dendrogram, a submatrix was developed, in which there are 3 zones with values that relate the species’ distributions: 1) “AxA zone”, including the values that related the “A group”; 2) “BxB zone”, which includes the values that related to the distributions of the “B group”; and 3) “AxB zone”, where the values related the “A group” with the “B group” distributions.
To evaluate whether the degree of similarity was higher than expected at random, we applied the DW parameter (McCoy et al., 1986). DW(AxA) quantifies the degree to which the major similarities (‘+’) are greater than expected at random in the “AxA zone”, but they are not in the “AxB zone”, at the same time that the minor similarities (‘-’) are absent from “AxA zone” (Real et al., 2003). DW(BxB) is analogous to DW(AxA), and both DW parameters contain all necessary conditions to determine whether A or B distributions belong to a chorotype. Therefore, we identified a chorotype when DW(AxA) and DW(BxB) were higher than 0.447 for all geographic distributions in the group (Real et al., 2003). Moreover, we applied the additional parameter GW to evaluate whether the segregation between the A and B groups was weak (Márquez et al., 1997). Finally, we calculated the DS parameter (Real et al., 2003), which determines whether the similarity was less than expected at random in the “AxB” zone, but not in the “AxA” and “BxB” zones, as well as whether higher-than-random similarities are absent in the “AxB” zone. The statistic test for DS was GS (McCoy et al., 1986). Therefore, a group was considered a chorotype if its DW was higher than ‘0’ and its corresponding statistic GW was significant.
In connection with that, we identified the least fuzzy chorotypical clusters, where all the conditions of a chorotype are maximized; however, a chorotypical cluster is neither true nor false, but accurate to some extent (Olivero et al., 2011). Moreover, certain fuzzy clusters may be nested within others, although it is always possible to identify the non-nested fuzzy chorotypes. Therefore, we applied the following fuzzy parameters to the least fuzzy chorotypes identified the degree of membership in the intersection between 2 chorotypes that indicates pairwise coincidences in the species membership (cardinality), and the fuzzy overlap that measures the proportion of the union that is in the intersection (Olivero et al., 2011).
Finally, we projected the grid and data points with the presence of each species for each chorotype using QGIS (QGIS Development Team, 2016) to locate each chorotype in the geographic space.
Results
We obtained a significant similarity matrix for the 167 species (available as Excel file in Supplementary material or through the e-mail of the authors). According to this matrix, 11 chorotypes from 136 species could be identified, hereafter referred to as chorotypes I through XI. Moreover, 1 insect species (A. niveoscotum) was significantly different from the rest and, therefore, was assigned to its own possible chorotype (chorotype XII). The richest chorotype was VII, with 39 species containing 23% of the total species analyzed. The chorotypes with the least species were X (with 4 species, 2.39% of the total richness) and XII (1 species, 0.59%) (Table 1). Eighteen percent of the species (30) were not included in any of the chorotypes.
Table 1.
Number of species from each taxonomic group belonging to each chorotype (I-XII), total species richness, and richness as a percentage of the total species considered. The species that were not included in any chorotype are in the last row.
| Chorotype | Number of species for each taxa | Richness | Richness percentage | ||||
| Amphibians | Bird | Insects | Mammals | Plants | |||
| I | 1 | 0 | 3 | 0 | 2 | 6 | 3.6 |
| II | 0 | 0 | 4 | 0 | 3 | 7 | 4.2 |
| III | 1 | 0 | 6 | 0 | 2 | 9 | 5.4 |
| IV | 2 | 0 | 11 | 0 | 1 | 14 | 8.4 |
| V | 1 | 0 | 7 | 0 | 1 | 9 | 5.4 |
| VI | 3 | 0 | 2 | 1 | 2 | 8 | 4.8 |
| VII | 6 | 1 | 11 | 7 | 14 | 39 | 23.3 |
| VIII | 1 | 0 | 5 | 0 | 0 | 6 | 3.6 |
| IX | 0 | 0 | 22 | 2 | 2 | 26 | 15.6 |
| X | 0 | 0 | 2 | 1 | 1 | 4 | 2.4 |
| XI | 0 | 0 | 6 | 0 | 2 | 8 | 4.8 |
| XII | 0 | 0 | 1 | 0 | 0 | 1 | 0.6 |
| Remaining species | 10 | 0 | 9 | 4 | 7 | 30 | 18 |

Figure 1. Simplified general dendrogram showing all chorotypes (I-XII). See figures S2.1 to S2.12 in Supplementary material to visualize in detail all the branches of each chorotype.
The general dendrogram included 12 sub-dendrograms, representing chorotypes I-XII (Fig. 1). All sub-dendrograms are shown in the Supplementary material (Figs. S2.1-S2.12). Chorotypes I, IV, VIII, and IX were located in the central and eastern part of the TVB (Figs. 2-4), chorotypes II, III, V and XI were located in the central TVB (Figs. 2, 3). Chorotype VI is located throughout the TVB, in the western, central and eastern parts (Fig. 3). In contrast to the rest, chorotype X was only in the eastern TVB (Fig. 5), and chorotype XII was located in the western TVB (Fig. 5).
Regarding the independence test GS, all species in chorotype IX had values above 0.5, except for species 95 (Aphodius ophistius), which had the lowest value (Supplementary material: Table S1.2). Chorotype XII had the highest membership value with a value of ‘1’ in the independence test. The fuzzy parameters that refer to including species within a chorotype are shown in Table 2, while the fuzzy overlap parameters are shown in Table 3. Inclusion (degree of integration in the intersection, likewise pairwise coincidences in the membership of the species) and overlap (which measures the proportion of the union that is found in the intersection) were related because the same chorotypic pairs had the highest values of both parameters (shown in bold; Tables 2, 3). In general, when we compared the inclusion values with the overlap values, we observed that the inclusion values were higher.
Discussion
We identified biogeographic patterns corresponding to chorotypes using the Baroni-Urbani and Buser (1976) index. The double absence component of this index was useful for our study area since the TVB has large mountain chains that have influenced species’ geographic distribution patterns. Consequently, geographic isolation could explain the absence or presence of different taxonomic groups in the TVB. In our particular dataset, the grouping of chorotypes was influenced by species distribution models versus individual data points, since using models generated larger chorotypes than the data points. These biases in data are named the Wallacean shortfall, defined as the lack of knowledge about the geographical distribution of the species (Hortal et al., 2015; Lomolino, 2004). Although in the last years have been published some contributions addressing how to deal with this shortfall (v. gr. Diniz-Filho et al., 2023), more research is necessary. As a result, we recommend that future analyses use only models or only data points for all species.

Figure 2. Cells of chorotypes I (3.6% of species richness), II (4.2%) and III (5.4%).
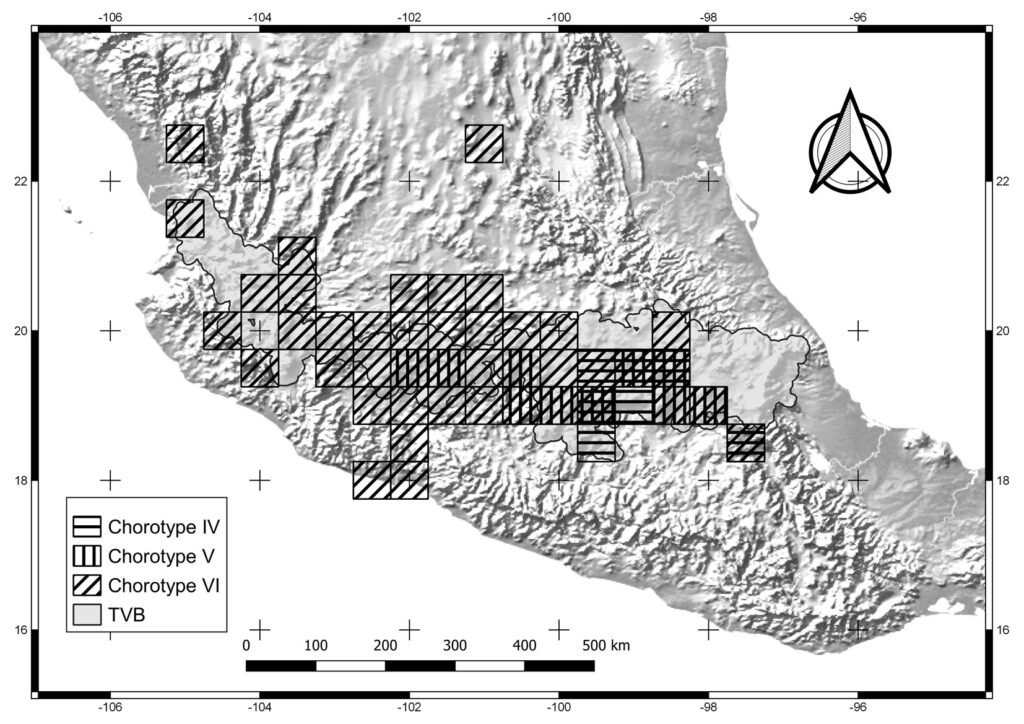
Figure 3. Cells of chorotypes IV (8.4% of species richness), V (5.4%) and VI (4.8%).

Figure 4. Cells of chorotypes VII (23.3% of species richness), VIII (3.4%) and IX (15.6%).
In general, similar analyses are generally performed within only one taxonomic group, e.g., amphibians (Flores et al., 2004; Olivero et al., 2011; Real, Guerrero, & Ramírez, 1992), plants (Gómez-González et al., 2004; Márquez et al., 1997), micro-mammals (Real et al., 2003) and birds (Real et al., 2008). Here, all 12 identified chorotypes included species from different taxonomic groups, which could be explained by similar geographic conditions resulting from a common biogeographic history of the species within a specific chorotype. Future analysis comparing other Operational Geographical Units and different scales could be necessary to evaluate the performance of the Baroni-Urbani and Buser (1976) index, which also could light about why some similar chorotypes are no grouped.

Figure 5. Cells of chorotypes X (2.4% of species richness), XI (4.8%) and XII (0.6%).
Table 2
Values that show the relationships between the chorotypes: inclusion of each chorotype regarding the rest according to cardinal parameter of fuzzy intersection between chorotypes. The bold numbers show the highest value in each column.
| Chorotypes | Values of relationship between chorotypes | |||||||||||
| CI (In) | CII (In) | CIII (In) | CIV (In) | CV (In) | CVI (In) | CVII (In) | CVIII (In) | CIX (In) | CX (In) | CXI (In) | CXII (In) | |
| CI | 1 | 0.720 | 0.803 | 0.718 | 0.742 | 0.635 | 0.595 | 0.572 | 0.580 | 0.744 | 0.697 | 0.467 |
| CII | 0.659 | 1 | 0.759 | 0.666 | 0.613 | 0.581 | 0.462 | 0.668 | 0.432 | 0.441 | 0.748 | 0.429 |
| CIII | 0.746 | 0.769 | 1 | 0.699 | 0.727 | 0.610 | 0.507 | 0.516 | 0.433 | 0.518 | 0.705 | 0.438 |
| CIV | 0.652 | 0.660 | 0.684 | 1 | 0.635 | 0.540 | 0.450 | 0.547 | 0.424 | 0.488 | 0.660 | 0.412 |
| CV | 0.605 | 0.546 | 0.639 | 0.571 | 1 | 0.663 | 0.515 | 0.537 | 0.429 | 0.566 | 0.694 | 0.484 |
| CVI | 0.417 | 0.416 | 0.431 | 0.390 | 0.534 | 1 | 0.500 | 0.541 | 0.336 | 0.432 | 0.566 | 0.688 |
| CVII | 0.679 | 0.576 | 0.623 | 0.566 | 0.721 | 0.869 | 1 | 0.600 | 0.540 | 0.733 | 0.725 | 0.626 |
| CVIII | 0.299 | 0.381 | 0.290 | 0.315 | 0.343 | 0.430 | 0.274 | 1 | 0.284 | 0.352 | 0.396 | 0.524 |
| CIX | 0.483 | 0.393 | 0.388 | 0.389 | 0.438 | 0.426 | 0.394 | 0.453 | 1 | 0.777 | 0.424 | 0.324 |
| CX | 0.307 | 0.199 | 0.230 | 0.222 | 0.286 | 0.272 | 0.265 | 0.278 | 0.385 | 1 | 0.245 | 0.277 |
| CXI | 0.406 | 0.475 | 0.442 | 0.423 | 0.495 | 0.502 | 0.370 | 0.442 | 0.296 | 0.345 | 1 | 0.480 |
| CXII | 0.029 | 0.029 | 0.029 | 0.028 | 0.037 | 0.065 | 0.034 | 0.062 | 0.024 | 0.042 | 0.051 | 1 |
Table 3
Values that show the relationships between the chorotypes: overlap between pairs of chorotypes according to cardinal parameters of fuzzy union between chorotypes. The bold numbers show the highest value in each column.
| Chorotypes | Values of relationship between chorotypes | |||||||||||
| CI | CII | CIII | CIV | CV | CVI | CVII | CVIII | CIX | CX | CXI | CXII | |
| CI | 1 | 0.524 | 0.631 | 0.519 | 0.500 | 0.337 | 0.464 | 0.244 | 0.358 | 0.278 | 0.345 | 0.028 |
| CII | 0.524 | 1 | 0.618 | 0.496 | 0.406 | 0.320 | 0.345 | 0.320 | 0.259 | 0.159 | 0.409 | 0.028 |
| CIII | 0.631 | 0.618 | 1 | 0.528 | 0.515 | 0.338 | 0.388 | 0.228 | 0.257 | 0.19 | 0.373 | 0.028 |
| CIV | 0.519 | 0.496 | 0.528 | 1 | 0.430 | 0.293 | 0.335 | 0.250 | 0.255 | 0.18 | 0.348 | 0.027 |
| CV | 0.5 | 0.406 | 0.515 | 0.43 | 1 | 0.420 | 0.429 | 0.265 | 0.277 | 0.235 | 0.406 | 0.035 |
| CVI | 0.337 | 0.32 | 0.338 | 0.293 | 0.420 | 1 | 0.465 | 0.315 | 0.231 | 0.2 | 0.363 | 0.063 |
| CVII | 0.464 | 0.345 | 0.388 | 0.335 | 0.429 | 0.465 | 1 | 0.232 | 0.295 | 0.242 | 0.325 | 0.033 |
| CVIII | 0.244 | 0.32 | 0.228 | 0.25 | 0.265 | 0.315 | 0.232 | 1 | 0.212 | 0.184 | 0.264 | 0.059 |
| CIX | 0.358 | 0.259 | 0.257 | 0.255 | 0.277 | 0.231 | 0.295 | 0.212 | 1 | 0.347 | 0.211 | 0.023 |
| CX | 0.278 | 0.159 | 0.19 | 0.18 | 0.235 | 0.200 | 0.242 | 0.184 | 0.347 | 1 | 0.167 | 0.038 |
| CXI | 0.345 | 0.409 | 0.373 | 0.348 | 0.406 | 0.363 | 0.325 | 0.264 | 0.211 | 0.167 | 1 | 0.049 |
| CXII | 0.028 | 0.028 | 0.028 | 0.027 | 0.035 | 0.063 | 0.033 | 0.059 | 0.023 | 0.038 | 0.049 | 1 |
Of the 167 species analyzed, 30 did not belong to any chorotype. In other words, they were distributed independently from other species which led to no significant distribution similarity with other species (Real et al., 2003). According to Real, Guerrero, and Vargas (1992), species not included in a chorotype have a random and independent distribution. The endemic species of amphibians, insects, mammals, and plants we included, in general, have very restricted geographical distribution in the TVB, due to geographical and ecological barriers (Hernández & Gómez-Hinostrosa, 2011). The species also had few data points, which in some cases could affect the inclusion of these species in a pattern.
Chorotypes I, IV, VII, and X are located in the central and eastern parts of the TVB. Similar geographic distribution patterns in the central and eastern TVB have been documented in the literature by Escalante et al. (2007), who identified an area of endemism for mammals in the eastern TVB. Chorotypes I, IV, VIII, and X also coincide with other patterns, probably related to the mountainous systems of the central and eastern part of the province, which have been considered players in important evolutionary events (Escalante et al., 2004; Morrone & Escalante, 2016).
Other chorotypes —II, III, IV and XI— show a similar distribution pattern in the central TVB. The central TVB has been highly studied because important volcanoes of Mexico are located there, including Popocatépetl, Iztaccíhuatl and the Nevado de Toluca, which have influenced species distributions. In particular, the Popocatépetl and Iztaccíhuatl volcanoes are located southeast of Mexico City, forming the Sierra Nevada (Almeida et al., 2007). The chorotypes located in the central region of the TVB show an affinity with the Sierra Ajusco-Chichinautzin (chorotypes II, III, and V) and Sierra Nevada Popocatépetl-Iztaccíhuatl (chorotypes III and V). Our chorotypes are similar to the pattern of endemic species of lagomorphs and rodents identified by Fa and Morales (1991). This finding suggests that volcano peaks and surrounding areas are important in generating the particular environmental conditions that restrict the distribution of species of different taxonomic groups (Alcántara & Paniagua, 2007). For example, Carex hermanni is a species of plant that is associated with the subalpine pine forest in the Popocatépetl-Iztaccíhuatl National Park, its immediate surroundings, and the slopes of the Sierra Nevada in Mexico State in the central TVB (Cochrane, 1981). C. hermanni is also linked to saturated soils, and different floristic combinations according to humidity and topography (Almeida et al., 2007). Another example is Ambystoma leorae, asalamander restricted to mountain streams of the pine forest of the Sierra Nevada, which have specific oxygenation and water temperature conditions (Sunny et al., 2014). Chorotype V is also located in the central TVB, occupying part of the Nevado de Toluca, with potential biotic relationships between its species.
Chorotype VI is a biogeographic pattern that coincides with the “Meridional TVB” region identified by Navarro-Sigüenza et al. (2007). These authors consider the influence of the main elevations in the biogeographic patterns in the central and eastern TVB (including the Popocatépetl, Iztaccíhuatl, Nevado de Toluca, and Malinche volcanoes) that spans central Mexico from Puebla to western Jalisco. The species of Chorotype VI (amphibians, insects, mammals and plants), may be influenced by varied environments due to the transition between the Balsas basin and mountainous and sub-mountainous environments (Navarro-Sigüenza et al., 2007).
The most extensive biogeographic pattern was Chorotype VII, which interestingly, is not restricted to the TVB. This pattern coincides with the Paleoamerican distribution pattern identified in insects by Halffter and Morrone (2017). Those authors explain the pattern as an ecological diversification of the oldest taxa of the TVB as follows: 1) these clades originally evolved in Eurasia or Africa and dispersed to the Americas during the Cretaceous-Paleocene; 2) the dispersal of those taxa occurred before and after the formation of the Mexican Plateau; and 3) they are adapted to highly different climatic conditions. The species belonging to chorotype VII are distributed throughout the Mexican Plateau, TVB, Sierra Madre Oriental and Occidental, and some tropical lowlands, showing a pattern that includes both tropical and temperate zones (Halffter & Morrone, 2017).
Chorotype IX occupies the southern Sierra Madre Oriental province (Morrone et al., 2017). This chorotype is located in the central-eastern TVB, at the boundary between the Sierra Madre del Sur and northwestern Oaxaca State. Chorotype IX coincides with the area of endemism 14 identified by Estrada et al. (2012), located in the Oaxaca-Tehuacanense province (Ramírez-Pulido & Castro-Campillo, 1990). This chorotype represents the geobiotic complexity of the distribution area of the species with a highly restricted distribution. For example, Neotoma nelsoni is a species of rodent distributed in the Pico de Orizaba and Cofre de Perote National Parks (González-Ruiz et al., 2006). Another species, Gentiana perpusilla (order: Gentianales, family: Gentianaceae), has a distribution that is restricted to the highlands of the State of Veracruz (Villareal et al., 2009). Also, the beetle Heliscus eclipticus shows a distribution in sub-humid and humid tropical forests and mountain cloud forests of Oaxaca, Puebla, and Veracruz (Villegas-Guzmán et al., 2012). Liebherr (1992) pointed out that the geological changes of the TVB have influenced the evolutionary history of species distributed in central Mexico, from the state of Puebla southward to Guerrero, Oaxaca, and Chiapas, as in the genus Platynus (order: Coleoptera, family: Carabidae). These geological changes may be related to volcanic successions of the TVB since its origin in the Miocene (Ferrusquía-Villafranca, 2007).
Chorotype XII comprises a single midge species, A. niveoscotum, distributed in Jalisco (Zavortink, 1972). This chorotype coincides with the biogeographic pattern found by García-Trejo et al. (2004). These authors explained the pattern due to the junction between the Sierra Madre Occidental and Sierra Madre del Sur. According to Darsie (1996), A. niveoscotum has an affinity to both the highlands (Nearctic) and lowlands (Neotropical) because this species may find adequate conditions for their survival and reproduction in this geographic area.
The chorotypes with high species richness and overlap values are distributed in the central and eastern TVB. These areas have been shown to have high richness of plants and animals by other authors (Alcántara & Paniagua, 2007; Escalante et al., 2007; Fa & Morales, 1991; Flores-Villela, 1993; Gámez et al., 2012; Llorente-Bousquets & Martínez, 1993) due to their geographic position, wide altitudinal ranges, and volcanic nature (Alcántara & Paniagua, 2007). This is important, according to Birks (1987), because chorotypic delimitation could be used to prioritize conservation strategies, where 2 aspects should be considered: high values of chorological overlap of the endemic biotic elements and areas where there is a high number of species. In addition, we recommend that future studies perform a correlation test between environmental variables and chorotype distribution to explain the importance of abiotic factors in the chorotypes, as well as other studies about the importance of ecological interactions.
In general, there are few publications about chorotypes, their methods of analysis, and case studies. Here, we present the first work identifying chorotypes in the Transmexican Volcanic Belt using different taxa, which resulted in 12 chorotypes. We could identify biogeographic patterns through chorotypes using both data points and species distribution models; however, the number of data points and models was decisive for inferring biogeographic patterns using the Baroni-Urbani and Buser index. Our chorotypes coincided with previously identified biogeographical patterns, mainly areas of endemism. The highest chorological overlap and species richness in the TVB is located in the central and eastern parts of the region, showing non-random close relationships of the species with the geographic space, probably resulting from ecological and evolutionary processes. These chorotypes could be an initial step in an integrative biogeographic protocol of the biota of the TVB.
Acknowledgements
This research was carried out with the support of the Program UNAM-DGAPA-PAPIIT, Project IN217717. The original databases were provided and processed by A. M. Varela-Anaya, E. A. Noguera-Urbano, L. M. Ochoa-Ochoa, A. L. Gutiérrez-Velázquez, P. Reyes-Castillo (deceased), H. M. Hernández, C. Gómez-Hinostrosa, A. G. Navarro-Sigüenza, O. Téllez-Valdés, I. Arenas Hidalgo, C. Miguel-Talonia and G. Pinilla-Buitrago. Lynna Kiere reviewed the English writing of this manuscript. We thank to two anonymous reviewers for their helpful comments.
References
Álcantara, O., & Paniagua, M. (2007). Patrones de distribución y conservación de plantas endémicas. In I. Luna, J. Morrone, J., & D. Espinosa-Organista (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 421–438). Mexico City: UNAM.
Almeida-Leñero, L., Escamilla, M., Giménez-de Azcárate, J., González-Trápaga, A., & Cleef, A. (2007). Vegetación alpina de los volcanes Popocatépetl, Iztaccíhuatl y Nevado de Toluca. In I. Luna, J. Morrone, J., & D. Espinosa-Organista (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 179–198). Mexico City: UNAM.
Barbosa, A. M. , & Estrada, A. (2016). Calcular corotipos sin dividir en OGUs: una adaptación de los índices de similitud para su utilización directa sobre áreas de distribución. In J. G. Zotano, J. Arias-García, J. A. Olmedo-Cobo, & J. L. Serrano-Montes (Eds.), Avances en biogeografía: áreas de distribución: entre puentes y barreras (pp. 157–163). Granada, Spain: Universidad de Granada/ Tundra Ediciones.
Baroni-Urbani, C., & Buser, M. (1976). Similarity of binary data. Systematic Zoology, 25, 251–259. https://doi.org/10.
2307/2412493
Baroni-Urbani, C., Ruffo, S., & Vigna-Taglianti, A. (1978). Materiali per una biogeografía italiana fondata su alcuni di Coleotteri Cicindelidi, Carabidi e Crisomelidi. Memoire della Societa Entomologica Italiana, 56, 35–92.
Birks, H. J. B. (1987). Recent methodological developments in quantitative descriptive biogeography. Annnales Zoologici Fennici, 24, 165–177.
Buser, M. W., & Baroni-Urbani, C. (1982). A direct nondimensional clustering method for binary data. Biometrics, 38, 351–360. https://doi.org/10.2307/2530449
Cochrane, T. (1981). Carex hermannii (Cyperaceae), a new species from Mexico, with comments on related species at high altitudes in Middle America. Brittonia, 33, 225–232. https://doi.org/10.2307/2806329
Darsie, J. (1996). A survey and bibliography of the mosquito fauna of Mexico (Diptera: Culicidae). Journal of the American Mosquito Control Association, 12, 298–306.
Diniz-Filho, J. F, Jardim, L., Guedes, J. J., Meyer, L., Stropp, J., Frateles, L. E. et al. (2023). Macroecological links between the Linnean, Wallacean, and Darwinian shortfalls. Frontiers of Biogeography, 15, e59566. http://dx.doi.org/10.21425/F5
FBG59566
Elith, J., Graham, C. H., Anderson, R. P., Dudík, M., Ferrier, S., Guisan, A. et al. (2006). Novel methods improve prediction of species’ distributions from occurrence data. Ecography, 29, 129–151. https://doi.org/10.1111/j.2006.0906-7590.04596.x
Elith, J., & Leathwick, J. R. (2009) Species distribution models: ecological explanation and prediction across space and time. Annual Review of Ecology, Evolution and Systematics, 40, 677–697. https://doi.org/10.1146/annurev.ecolsys.110308.120159
Escalante, T. (2015). Modelos de distribución de especies de mamíferos y suculentas de la Faja Volcánica Transmexicana. Mexico City: Facultad de Ciencias, Universidad Nacional Autónoma de México/ Data base SNIB-CONABIO Mamíferos, project JM055.
Escalante, T., Rodríguez, G., Gámez, N., León-Paniagua, L., Barrera, O., & Sánchez-Cordero, V. (2007). Biogeografía y conservación de los mamíferos. In I. Luna, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 485–502). Mexico City: UNAM.
Escalante, T., Rodríguez, G., & Morrone, J. J. (2004). The diversification of Nearctic mammals in the Mexican transition zone. Biological Journal of the Linnean Society, 83, 327-339. https://doi.org/10.1111/j.1095-8312.2004.00386.x
Escalante, T., Varela-Anaya, A. M., Noguera-Urbano, E. A., Elguea-Manrique, L., Ochoa-Ochoa, L. M., Gutiérrez-Velázquez, A. L. et al. (2020). Evaluation of five taxa as surrogates for conservation priorization in the Transmexican Volcanic Belt, Mexico. Journal for Nature Conservation, 54, 125800. https://doi.org/10.1016/j.jnc.2020.125800
Estrada, Y. Q., Luna, R. A., & Escalante, T. (2012). Patrones de distribución de los mamíferos en la provincia Oaxaca-Tehuacanense. Therya, 3, 33–51. https://doi.org/10.12933/therya-12-55
Fa, J., & Morales, L. (1991). Mammals and protected areas in the Trans-Mexican Neovolcanic Belt. In M. A. Mares, & D. J. Schmidly (Eds.), Latin American Mammalogy, history, biodiversity and conservation (pp. 199–226). Oklahoma: University of Oklahoma Press.
Fattorini, S. (2016). A history of chorological categories. History and Philosophy of the Life Sciences, 38, 12. https://doi.org/10.1007/s40656-016-0114-1
Ferrusquía-Villafranca, I. (2007). Ensayo sobre la caracterización y significación biológica. In I. Luna, J. J. Morrone, & D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 7–23). Mexico City: UNAM.
Flores, T., Puerto, M., Barbosa, A. M., Real, R., & Gosalvez, R. (2004). Agrupación en corotipos de los anfibios de la provincia de Ciudad Real (España). Revista Española de Herpetología, 24, 38–49.
Flores-Villela, O. (1993). Herpetofauna of Mexico: distribution and endemism. In T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Biological diversity of Mexico: origins and distribution (pp. 253–279). New York: Oxford University Press.
Flores-Villela, O., Canseco-Márquez, L., & Ochoa-Ochoa, L. (2010). Geographic distribution and conservation of the herpetofauna of the highlands of Central Mexico. In L. D. Wilson, J. H. Townsend, & J. D. Johnson (Eds.), Conservation of Mesoamerican amphibians and reptiles (pp. 302–321). Utah, USA: Eagle Mountain Publishing Co.
Frey, J. (1992). Response of a mammalian faunal element to climatic changes. Journal of Mammalogy, 73, 43–50. https://doi.org/10.2307/1381864
Gámez, N., Escalante, T., Rodríguez-Tapia, G., Linaje, M., & Morrone. J. J. (2012). Caracterización biogeográfica de la Faja Volcánica Transmexicana y análisis de los patrones de distribución de su mastofauna. Revista Mexicana de Biodiversidad, 83, 258–272. http://dx.doi.org/10.22201/ib.20078706e.2012.1.786
García-Trejo, E., & Navarro-Sigüenza, A. (2004). Patrones biogeográficos de la riqueza de especies y el endemismo de la avifauna en el oeste de México. Acta Zoológica Mexicana, 20, 167–185. https://doi.org/10.21829/azm.2004.2022336
Gómez-González, S., Cavieres, L., Teneb, E., & Arroyo, J. (2004). Biogeographical analysis of species of the tribe Cytiseae (Fabaceae) in the Iberian Peninsula and Balearic Islands. Journal of Biogeography, 31, 1659–1671. https://doi.org/10.1111/j.1365-2699.2004.01091.x
González-Ruiz, N., Ramírez-Pulido, J., & Genoways, H. (2006). Geographic distribution, taxonomy and conservation status of Nelson´s woodrat (Neotoma nelsoni) in Mexico. Southwestern Naturalist, 51, 112–116. https://doi.org/10.
1894/0038-4909(2006)51[112:GDTACS]2.0.CO;2
Halffter, G., & Morrone, J. J. (2017). An analytical review of Halffter´s Mexican Transition Zone, and its relevance for evolutionary biogeography, ecology and biogeographical regionalitation. Zootaxa, 4226, 1–46. https://doi.org/10.
11646/ZOOTAXA.4226.1.1
Hernández, H., & Gómez-Hinostrosa, C. (2011). Mapping the cacti of Mexico. Mexico City: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Hernández, H., & Gómez-Hinostrosa, C. (2015). Mapping the cacti of Mexico: Part II. Mexico City: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Hernández, M., & Carrasco, G. (2007). Rasgos climáticos más importantes. In I. Luna, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 57–72). Mexico City, México: UNAM
Hijmans, R., Phillips, S., Leathwick, J., & Elith, J. (2017). Package dismo: species distribution modeling. Retrieved on October 17th, 2017 from http://r.adu.org.za/web/packages/dismo/dismo.pdf
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., & Ladle, R. J. (2015). Seven shortfalls that beset large-scale knowledge of biodiversity. Annual Review of Ecology, Evolution and Systematics, 46, 523–549. https://doi.org/10.1146/annurev-ecolsys-112414-054400
Jaccard, P. (1908). Nouvelles recherches sur la distribution florale. Bulletin de la Societé Vauldoise des Sciences Naturelles, 44, 223–270.
Jardine, N. (1972). Computational methods in the study of plant distributions. In D. H. Valentine (Eds.), Taxonomy, phytogeography and evolution (pp. 381–393). London: Academic Press.
Liebherr, J. (1992). Phylogeny and revision of the Platynus dega-
llieri species group (Coleoptera, Carabidae, Platynini). Bulletin of the American Museum of Natural History, 214, 1–115.
Llorente-Bousquets, J., & Martínez, A. (1993). Analysis of Mexican butterflies: Papilionidae (Lepidoptera, Papilionoidea). In T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Biological diversity of Mexico: origins and distribution (pp. 147–178). New York, USA: Oxford University Press.
Lomolino M. V. (2004). Conservation biogeography. In M. V. Lomolino, & L. R. Heaney (Eds.), Frontiers of biogeography: new directions in the geography of nature (pp. 293–296). Sunderland, Massachusetts: Sinauer.
Márquez, A. L., Real, R., Vargas, J. M., & Salvo, A. E. (1997). On identifying common distribution patterns and their causal factors: a probabilistic method applied to pteridophytes in the Iberian Peninsula. Journal of Biogeography, 24, 613–631. https://doi.org/10.1111/j.1365-2699.1997.tb00073.x
McCoy, E. D., Bell, S. S., & Walters, K. (1986) Identifying biotic boundaries along environmental gradients. Ecology, 67, 749–759. https://doi.org/10.2307/1937698
Morrone, J. J. (2014) On biotas and their names. Systematics and Biodiversity, 12, 386–392. https://doi.org/10.1080/14772000.2014.942717
Morrone, J. J., & Escalante, T. (2016) Introducción a la biogeografía. Mexico City: UNAM.
Morrone, J. J., Escalante, T., & Rodríguez-Tapia, G. (2017). Mexican biogeographic provinces: map and shapefiles. Zootaxa, 4277, 277–279. https://doi.org/10.11646/zootaxa.
4277.2.8
Mostacedo, B., & Fredericksen, T. (2000). Manual de métodos básicos de muestreo y análisis en ecología vegetal. Santa Cruz, Bolivia: BOLFOR.
Navarro-Sigüenza, A., Peterson, A., & Gordillo-Martínez, A. (2003). Museums working together: The atlas of the birds of Mexico. Bulletin of the British Ornithologists’ Club, 116, 207–225.
Navarro-Sigüenza, A. G., Lira-Noriega, A., Peterson, A. T., Oliveras de Ita, A. & Gordillo-Martínez, A. (2007). Diversidad, endemismo y conservación de las aves. In I. Luna, J. J. Morrone, & D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 461–483). Mexico City: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Universidad Nacional Autónoma de México.
Olivero, J., Hidalgo, R., Márquez, A. L., Barbosa, A. M., & Real, R. (2015). R-Forge. Retrieved on December 1st, 2018 from http://rmacoqui.r-forge.r-project.org/RMacoqui-manual.pdf
Olivero, J., Real, R., & Márquez, A. L. (2011). Fuzzy chorotypes as a conceptual tool to improve insight into biogeographic patterns. Systematic Biology, 60, 645–660. https://doi.org/10.1093/sysbio/syr026
Peterson, A., Navarro-Sigüenza, A., & Gordillo-Martínez, A. (2016). The development of ornithology in Mexico and the importance of access to scientific information. Archives of Natural History, 43, 294–304. https://doi.org/10.3366/anh.2016.0385
Peterson, A. T., Papeş, M., & Soberón, J. (2008). Rethinking receiver operating characteristic analysis applications in ecological niche modeling. Ecological Modelling, 213, 63–72. https://doi.org/10.1016/j.ecolmodel.2007.11.008
Phillips, S., Anderson, R. P., Dudík, M., Schapire, R. E., & Blair, M. E. (2017). Opening the black box: an open-source release of Maxent. Ecography, 40, 887–893. https://doi.org/10.1111/ecog.03049
QGIS Development Team (2016). QGIS Geographic Information System. Retrieved on September 11th, 2017 from http://qgis.osgeo.org
R Core Team (2017). Rstudio: integrated development for R.Rstudio. Boston. Retrieved on November 20th, 2017 from http://www.rstudio.com
Ramírez-Pulido, J., & Castro-Campillo, A. (1990). Atlas Nacional de México. Provincias Mastofaunísticas. 1:4000000 Map IV. 8.8 A. Mexico City, UNAM.
Real, R., Guerrero, J. C., Márquez, A. L., Olivero, J., & Vargas, J. M. (2003). Tipificación corológica de los micromamíferos. Graellsia, 59, 287–298. https://doi.org/10.3989/graellsia.
2003.v59.i2-3.247
Real, R., Guerrero, J. C., & Ramírez, J. M. (1992). Identificación de fronteras bióticas significativas para los anfibios en la cuenca hidrográfica del sur de España. Doñana, Acta Vertebrata, 19, 53–70.
Real, R., Guerrero, J. C., & Vargas, J. M. (1992). Análisis biogeográfico de clasificación de áreas y especies. Monografías Herpetológicas, Asociación Herpetológica Española, 2, 73–84.
Real, R., Márquez, A. L., Guerrero, J. C., Vargas, J. M., & Palomo, L. J. (1996). Modelos de distribución de los insectívoros en la Península Ibérica. Doñana, Acta Vertebrata, 23, 123–142.
Real, R., Olivero, J., & Vargas, J. M. (2008). Using chorotypes to deconstruct biogeographical and biodiversity patterns: the case of breeding waterbirds in Europe. Global Ecology and Biogeography, 17, 735–746. https://doi.org/
10.1111/j.1466-8238.2008.00411.x
Real, R., & Vargas, J. M. (1996). The probabilistic basis of Jaccard’s index of similarity, Systematic Biology, 45, 380–385. https://doi.org/10.1093/sysbio/45.3.380
Reyes-Castillo, P., & Morón-Ríos, M. (2005). Passalidae y Lucanidae (Coleoptera: Scarabaeoidae) de México. Data base SNIB-CONABIO, projects AA014 and K005-Passalidae. Mexico City: Instituto de Ecología A.C.
Rice, J., & Belland, R. (1982). A simulation study of moss floras using Jaccard´s coefficient of similarity. Journal of Biogeography, 9, 411-419. https://doi.org/10.2307/2844573
Ruggiero, A., & Ezcurra, C. (2003). Regiones y transiciones biogeográficas: complementariedad de los análisis en biogeografía histórica y ecológica. In J. J. Morrone, & J. Llorente-Bousquets (Eds.), Una perspectiva lationoame-
ricana de la biogeografía (pp. 141–154). Mexico City: Las prensas de Ciencias, UNAM.
Suárez-Mota, M., Téllez-Valdéz, O., Lira-Saade, R., & Villaseñor, J. (2013). Una regionalización de la Faja Volcánica Transmexicana con base en su riqueza florística. Botanical Sciences, 91, 93–95. https://doi.org/10.17129/botsci.405
Sunny, A., Monroy-Vilchis, O., Reyna-Valencia, C., & Zarco-González, M. (2014). Microhabitat types promote the
genetic structure of a micro-endemic and critically endan-
gered mole salamander (Ambystoma leorae) of Central Mexico. Plos One, 9, e103595. https://doi.org/10.1371/journal.pone.0103595
Téllez, O. (2017). Distribución potencial de las especies Pina-
ceae (Pinus) y Fagaceae (Quercus) de México. Data base SNIB-CONABIO-Quercus, project JM010. Mexico City: Conabio.
Vargas, J. M., & Real, R. (1997). Biogeografía de los anfibios y reptiles de la Península Ibérica. In J. M. Pleguezuelos, & J. P. Martínez-Rica (Eds.), Distribución y biogeografía de los anfibios y reptiles de España y Portugal (pp. 309–320). Granada, Spain: Universidad de Granada/ Asociación Herpetológica Española.
Villarreal-Quintanilla, J., Estrada-Castillón, A., & Jasso-de Rodríguez, D. (2009). El género Gentiana (Gentianaceae) en México. Polibotánica, 27, 1–16.
Villegas-Guzmán, G., Francke, O., Pérez, T., & Reyes-Castillo, P. (2012). Coadaptación entre los ácaros (Arachnida: Klinckowstroemiidae) y coleópteros Passalidae (Insecta: Coleoptera). Revista de Biología Tropical, 60, 599–609. https://doi.org/10.15517/RBT.V60I2.3941
Zavortink, T. (1972). Mosquito studies (Diptera, Culicidae) XXVIII: The New World species formerly placed in Aedes (Finlaya). Contributions of the American Entomological Institute, 28, 1–206.

Nuevos registros estatales de Bromeliaceae y Piperaceae en México
Pedro A. Aguilar-Rodríguez a, *, Beatríz del Socorro Bolívar-Cimé a, Miguel Ángel Pérez-Farrera b y M. Cristina MacSwiney G. c
a Universidad Veracruzana, Instituto de Investigaciones Forestales, Parque Ecológico “El Haya”, Carretera Antigua a Coatepec, 91070 Xalapa, Veracruz, México
b Universidad de Ciencias y Artes de Chiapas, Instituto de Ciencias Biologicas, Laboratorio de Ecología, Evolutiva, Herbario Eizi Matuda, Caleras Maciel, 29014 Tuxtla Gutiérrez, Chiapas, México
c Universidad Veracruzana, Centro de Investigaciones Tropicales, José María Morelos Núm. 44 y 45, Col. Centro, 91000 Xalapa, Veracruz, México
*Autor para correspondencia: pedroaguilarr@gmail.com (P.A. Aguilar-Rodríguez)
Recibido: 6 septiembre 2023; aceptado: 7 marzo 2024
Resumen
La flora de México está en constante actualización y las familias Bromeliaceae y Piperaceae están representadas en el país con numerosas especies, principalmente en los estados del sur. Sin embargo, las exploraciones botánicas han incrementado el número de especies reportadas para cada estado y algunas pueden encontrarse del estudio de material de herbario, de ejemplares mal identificados, o provenir de relictos de bosques cercanos a áreas urbanas. El objetivo de este trabajo es reportar nuevos registros de bromeliáceas y piperáceas en distintos estados de México, y presentar un mapa actualizado de su distribución. Entre 2018 y 2023, como parte de diferentes exploraciones botánicas, incluyendo áreas verdes periurbanas, se colectaron ejemplares y se identificaron con claves de identificación taxonómica y con expertos. Determinamos que eran nuevos aportes para las floras estatales y ampliaciones norteñas para la distribución conocida de esas especies, una de las cuales estaba presente en un remanente de bosque urbano. Los 4 registros nuevos corresponden a Pseudalcantarea macropetala, Tillandsia heterophylla, Werauhia nutans y Piper pseudoasperifolium en bosque mesófilo de montaña y vegetación secundaria, ydemuestran la importancia de continuar las exploraciones botánicas en diferentes tipos de vegetación, considerando también relictos de bosque en áreas urbanas.
Palabras clave: Áreas verdes urbanas; Bosque mesófilo de montaña; Pseudalcantarea; Piper; Tillandsia; Werauhia
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
New state records of Bromeliaceae and Piperaceae in Mexico
Abstract
The flora of Mexico is constantly updated, and the Bromeliaceae and Piperaceae families are represented in the country with numerous species, mainly in the southern states. However, botanical explorations have increased the species reported for each state, and some can be found by studying herbaria and misidentified specimens, or relict forests close to urban areas. This work aims to report new records of Bromeliaceae and Piperaceae for different Mexican states, an updated distribution map in Mexico. Between 2018 and 2023, as part of different botanical explorations, including peri-urban green areas, specimens were collected and identified using identification keys and experts’ help. We determined new contributions to state floras and northern extensions to the known distribution of these species, one of which was present in urban forest remnants. The four new records correspond to Pseudalcantarea macropetala, Tillandsia heterophylla, Werauhia nutans, and Piper pseudoasperifolium from montane cloud forests and secondary vegetation, demonstrating the importance of carrying out botanical explorations in different types of vegetation, also considering forest remnants in urban areas.
Keywords: Urban green areas; Montane cloud forest; Pseudalcantarea; Piper; Tillandsia; Werauhia
Introducción
México posee una alta diversidad florística con más de 23,300 especies, distribuidas en 297 familias, con Oaxaca, Chiapas y Veracruz como los estados con el mayor número de especies reportadas (Villaseñor, 2016). Las familias con el mayor número de especies en el país son Asteraceae (3,057 spp.) y Fabaceae (1,903 spp.), mientras que Bromeliaceae (450 spp., 2%) y Piperaceae (245 spp., 1%) albergan un menor número (Villaseñor, 2016). Muchas especies de ambas familias son típicas del bosque mesófilo de montaña (Espejo-Serna et al., 2021; Villaseñor, 2010). Bromeliaceae es casi completamente neotropical, con un solo taxón en África, y más de la mitad de las especies son epífitas, las cuales se distribuyen en distintos hábitats, desde xéricos hasta bosques húmedos, entre los 0 y 3,000 m snm (Benzing, 2000; Espejo-Serna et al., 2005; Zotz, 2013). Dentro de la familia, el género Pseudalcantarea (Mez) Pinzón et Barfuss está representado en México por sus únicas 3 especies reconocidas: Pseudalcantarea grandis (Schltdl.) Pinzón et Barfuss, P. macropetala (Wawra) Pinzón et Barfuss y P. viridiflora (Beer) Pinzón et Barfuss. Estas especies estaban incluidas dentro del género Tillandsia L. (Barfuss et al., 2016), mientras que los géneros Tillandsia y Werauhia J.R. Grant. están representados por 238 y 11 especies, respectivamente. En algunos estados como Hidalgo, San Luis Potosí y Tabasco, el número de Bromeliaceae registradas no superan las 60 especies y algunos géneros, por ejemplo, Tillandsia en San Luis Potosí (19 spp.) y Werauhia en Tabasco (1 sp.), están pobremente representados (Espejo-Serna et al., 2021).
En México, Pseudalcantarea macropetala es registrada para Chiapas, Oaxaca, Puebla y Veracruz (Espejo-Serna et al., 2021), Tillandsia heterophylla É. Morren para Hidalgo, Puebla y Veracruz, mientras que Werauhia nutans (L.B. Sm.) J.R. Grant solo es conocida de Chiapas, Oaxaca y Veracruz (Espejo-Serna et al., 2005, 2021). Por otro lado, de los 2 géneros de Piperaceae registrados en México, Piper posee el mayor número de especies (136 spp.) y Veracruz es el estado con más registros (89 spp.; Villaseñor, 2016). Piper es un género pantropical pero alcanza su mayor diversidad en la región neotropical y se distribuye en una amplia variedad de hábitats, desde los bosques de tierras bajas hasta los bosques montanos, mayormente entre los 0 y 2,500 m snm (Quijano-Abril et al., 2006). En México, Piper pseudoasperifolium C. DC. se distribuye hasta Costa Rica (Tebbs, 1993; Tropicos, 2022), se registra en Chiapas, Guerrero, Jalisco, Nayarit y Oaxaca (Villaseñor, 2016).
En el presente trabajo se reportan por primera vez las Bromeliaceae epífitas Pseudalcantarea macropetala para Hidalgo, Tillandsia heterophylla para San Luis Potosí y Werauhia nutans para Tabasco, y Piper pseudoasperifolium para Veracruz, también se presenta un mapa de la distribución de las 4 especies en México.
Materiales y métodos
Como parte de un taller de divulgación científica en Hidalgo (Tenango de Doria, Centro Ecoturístico “Agua Viva”, 17º21’51” N, 93º37’34” O), exploraciones botánicas en San Luis Potosí (Xilitla, camino a La Silleta, 21º26’20” N, 99º00’30” O) y Tabasco (Villa de Guadalupe, 17º21’51” N, 93º37’34” O), y dentro del proyecto “Funcionalidad socioecológica de áreas verdes urbanas neotropicales en Veracruz” (Jardín Botánico Francisco Javier Clavijero (19º30’53” N, 96º58’36” O), Xalapa y área natural protegida (ANP) La Martinica (19º34’20” N, 96º56’04” O), Banderilla, entre el 2018 y 2023, se colectaron varios especímenes de las familias Bromeliaceae y Piperaceae, entre ellas Pseudalcantarea macropetala, Piper pseudoasperifolium, Tillandsia heterophylla y Werauhia nutans. Si el ejemplar no se encontraba reproductivo, en el caso de las bromelias epífitas, se puso en cultivo en la localidad para su monitoreo hasta el desarrollo completo de la inflorescencia. El material colectado se procesó y se determinó usando claves de identificación taxonómica y monografías de ambos grupos (Espejo-Serna et al., 2005, 2021; Samain y Tebbs, 2020; Tebbs, 1993) y revisión de los herbarios CIB, HEM, MEXU y XAL (acrónimos de acuerdo a Thiers [2016]). Adicionalmente, se revisaron los trabajos de Tebbs (1993); Espejo-Serna et al. (2005, 2021) y para la distribución, se consultaron listados florísticos (Espejo-Serna y López-Ferrari 2004; Espejo-Serna et al., 2005, 2021; Villaseñor, 2016) y bases de datos, Portal de Datos Abiertos UNAM (UNAM, 2022) y Missouri Botanical Garden (TROPICOS, 2022).
Usando la información de un espécimen por estado (tabla 1), se elaboró un mapa de distribución de las 4 especies en México, Pseudalcantarea macropetala: P. A. Aguilar-Rodríguez PA001 (CITRO), P. A. Aguilar-Rodríguez et al. PA0022 (HEM), A. Espejo et al. 6700 (UAMIZ), J. Martínez Meléndez 1785 (HEM), F. Ventura A. 1061 (MEXU); Piper pseudoasperifolium: J. S. Miller et al. 2715 (MO), G. Flores F. y R. Ramírez R. 2514 (MO), R. Torres C. y A. Campos V. 10697 (MO), Calónico-Soto 8878 (MEXU), P. A. Aguilar-Rodríguez PA0025 (HEM); T. heterophylla: J. Ceja et al. 1869 (IEB, UAMIZ), A. Mendoza R. et al. 691 (UAMIZ), T. B. Croat 39637 (MO), M. A. Pérez-Farrera et al. 4019 (HEM); Werauhia nutans: E. Martínez S. y M. A. Soto A. 18654 (MEXU), P. Tenorio y T. Wendt 19335 (UAMIZ), P. A. Aguilar-Rodríguez et al. PA0014 (HEM), P. A. Aguilar-Rodríguez PA0012 (CITRO).
Todo el material colectado se etiquetó y se depositó en el herbario HEM. La identificación de Piper pseudoasperifolium fue corroborada por el especialista en la familia Piperaceae, Ricardo Callejas Posada, del Instituto de Biología, Universidad de Antioquia, Medellín, Colombia.
Resultados
Pseudalcantarea macropetala (Wawra) Pinzón et Barfuss. Fig. 1A.
Hierba epífita, raramente rupícola, arrosetada, de hasta 175 cm de alto, solitaria, con láminas acintadas, de entre 45 y 50 cm de largo, punctulado-lepidotas en el haz y envés, erectas a ascendentes. Inflorescencias terminales, erectas, compuestas, raramente simples, con hasta 7 espigas y un escapo de cerca de 80 cm de largo, cubierto por brácteas imbricadas. Cada espiga contiene hasta 20 flores, con disposición dística y actinomorfas, pétalos color verde claro en antesis, acintados y enrollados en el extremo sobre sí mismos, de hasta 12.3 cm de largo y los estambres subiguales. Cápsulas y semillas fusiformes, estas últimas con un apéndice plumoso blanco. La floración de esta especie ocurre de diciembre a abril, según la localidad, presenta antesis nocturna y sus flores son polinizadas por murciélagos (citada como Tillandsia macropetala; Aguilar-Rodríguez et al., 2014; Krömer et al., 2012). Es posible que se distribuya hasta Centroamérica (Krömer et al., 2012), pero en México, se distribuye en Chiapas, Hidalgo, Oaxaca, Puebla y Veracruz (fig. 2). Crece en bosque tropical subcaducifolio y bosque mesófilo de montaña, entre 1,200 y 2,500 m snm (Espejo-Serna et al., 2021).
Ejemplar examinado: México. Hidalgo, municipio Tenango de Doria, Centro Ecoturístico “Agua Viva”, 20°20’15.93” N, 98°15’29.38” O, 1,395 m, 29.X.2021, P. A. Aguilar-Rodríguez et al. PA0022 (HEM).
Tillandsia heterophylla É. Morren, Belgique Hort. 23: 138. 1873. Tipo: México, Veracruz, aux environs de Córdoba “Cordova”. O. Malzine s. n. (Holotipo: LG). Fig. 1B.
T. virginalis É. Morren, Belgique Hort. 30: 238-240. 1880, nom. illeg.
Hierba epífita arrosetada, glauca, pruinosa de hasta 150 cm de alto, solitaria, con láminas de las hojas acintadas de cerca de 30 a 40 cm de largo, de color verde o teñido de púrpura, punctulado-lepidotas en el haz y envés, acuminadas y erecto-extendidas al ápice. Inflorescencias terminales, erectas, compuestas, a veces simples, con hasta 16 espigas pruinosas y un escapo de hasta 80 cm, cubierto desde la base al ápice por las vainas de las brácteas. Las flores son tubular-campaniformes, con pétalos blancos y estambres más cortos que los pétalos. Cápsulas rostradas y semillas fusiformes, con un apéndice plumoso blanco. Su floración ocurre de febrero a julio, con antesis nocturna a brevemente diurna y sus flores son polinizadas por murciélagos, polillas, colibríes y abejas (Aguilar-Rodríguez et al., 2016; Espejo-Serna et al., 2005). Se le considera endémica de México y se distribuye en Hidalgo, Puebla, San Luis Potosí y Veracruz (fig. 2). Crece en bosque de Quercus y bosque mesófilo de montaña, entre 600 y 1,700 m snm (Espejo-Serna et al., 2005, 2021).

Figura 1. A, Pseudalcantarea macropetala con inflorescencia; B, Tillandsia heterophylla con inflorescencia en desarrollo; C, Werauhia nutans con inflorescencia en desarrollo; y D, Piper pseudoasperifolium con inflorescencia.
Ejemplar examinado: México. San Luis Potosí, municipio Xilitla, camino a La Silleta, 21°25’45” N, 99°00’38” O, 750 m, 31.VII.2021, M. A. Pérez-Farrera et al. 4019 (HEM).
Werauhia nutans (L.B. Sm.) J.R. Grant, Phytologia 79(3): 255. 1995. Fig. 1C.
Vriesea nutans L. B. Sm., Phytologia 7(4): 175. 1960. Tipo: Costa Rica, San José, road from Turrialba to Moravia, M. B. Foster 2727 (holotipo: US)
Hierba epífita, arrosetada, de hasta 60 cm de alto, solitaria pero frecuente que forme agrupaciones de varios individuos, con láminas de las hojas acintadas de cerca de 40 cm de largo, punctulado-lepidotas, glabrescentes en haz y envés, agudas a atenuadas en el ápice. Las inflorescencias son terminales con un escapo delgado, de hasta 3 mm de diámetro y de hasta 45 cm de largo, cubierto en toda su longitud por las vainas de las brácteas, las espigas alcanzan hasta 12.5 cm de largo con 5-9 flores con un arreglo dística y zigomorfas, brácteas florales quebradizas cuando están secas. Flores con pétalos blancos y estambres desiguales más corto que los pétalos. Cápsulas pardas oscuras, fusiforme, de hasta 3.3 cm de largo con semillas de hasta 4 mm de largo, con un apéndice plumoso. Su floración ocurre de octubre a diciembre, presenta antesis nocturna y se reproduce por autopolinización y clonación (Aguilar-Rodríguez et al., 2019; Espejo-Serna et al., 2005). Se distribuye desde México hasta Costa Rica. En México ha sido colectada en Oaxaca, Chiapas, Tabasco y Veracruz (fig. 2). La especie crece en bosque tropical perennifolio y bosque mesófilo de montaña, entre 100 y 1,100 m snm (Espejo-Serna et al., 2005, 2007, 2021).
Tabla 1
Sitios de colecta de ejemplares de Pseudalcantarea macropetala, Tillandsia heterophylla, Werauhia nutans y Piper pseudoasperifolium revisadas en el artículo y representadas en la figura 2; se incluyen las localidades de los nuevos registros estatales (en negritas). Abreviaturas de los estados: CHI (Chiapas), GUE (Guerrero), HID (Hidalgo), NAY (Nayarit), OAX (Oaxaca), PUE (Puebla), SLP (San Luis Potosí), TAB (Tabasco), VER (Veracruz).
| Estados | Especie (familia) | |||
| Pseudalcantarea macropetala (Bromeliaceae) | Tillandsia heterophylla (Bromeliaceae) | Werauhia nutans (Bromeliaceae) | Piper pseudoasperifolium (Piperaceae) | |
| CHI | J. Martínez Meléndez 1785 (HEM), 15°45’39” N 093°04’19” O | E. Martínez S. y M. A. Soto A. 18654 (MEXU), 16°57’15” N 091°35’49” O | J. S. Miller et al. 2715 (MO), 15°06’00” N 092°04’48” O | |
| GUE | Calónico-Soto 8878 (MEXU), 17°35’33” N 099°44’27” O | |||
| HID | P. A. Aguilar-Rodríguez et al. PA0022 (HEM), 20º20’15.93” N, 98º15’29.38” O | J. Ceja et al. 1869 (IEB, UAMIZ), 20°45’52” N 098°39’53” O | ||
| NAY | G. Flores F. y R. Ramírez R. 2514 (MO), 21°29’N 104°55’W | |||
| OAX | A. Campos V. y R. Torres C. 3614 (HEM, MEXU), 16°47’16” N 095°21’59” O | P. Tenorio y T. Wendt 19335 (UAMIZ), 17°08’ N 94°28’ O | R. Torres C. y A. Campos V. 10697 (MO), 16°57’00” N 096°13’00” O | |
| PUE | F. Ventura A. 1061 (MEXU), 19°49›20” N 097°23’51” O | A. Mendoza R. et al. 691 (UAMIZ), 20°01’58” N 097°31’07” O | ||
| SLP | M. A. Pérez-Farrera et al. 1056 (HEM), 21°25’45” N, 99°00’38” O | |||
| TAB | P. A. Aguilar-Rodríguez et al. PA0015 (HEM), 17º21’51’’ N, 93º37’34’’ W | |||
| VER | P. A. Aguilar-Rodríguez PA001 (CITRO), 19°31’12” N 096°59’17” O | T. B. Croat 39637 (MO), 19°09’36” N 096°56’24” O | P. A. Aguilar-Rodríguez PA0012 (CITRO) 18°32’03” N 095°08’18” O | P. A. Aguilar-Rodríguez et al. PA0025 (HEM), 19°35’23” N 096°57’01” O |
Ejemplar examinado: México. Tabasco, municipio Huimanguillo, Cerro de las Flores, Villa de Guadalupe, 17°21’51” N, 93°37’34” O, 1,024 m, 7.V.2018, P. A. Aguilar-Rodríguez et al. PA0014 (HEM).
Figura 1. A, Pseudalcantarea macropetala con inflorescencia; B, Tillandsia heterophylla con inflorescencia en desarrollo; C, Werauhia nutans con inflorescencia en desarrollo; y D, Piper pseudoasperifolium con inflorescencia.
Piper pseudoasperifolium C. DC., Prodr. 16(1): 318 (1869). Isotipo: México, Oaxaca, Franco s. n. (G-DC). Fig. 1D.
Arbusto de hasta 5 m de altura, con tallos y peciolos densamente pubescentes. Hojas ovado-lanceoladas a elíptico-lanceoladas, buliformes, glandulosas, con el haz escabroso y el envés densamente pubescente sobre los nervios. Inflorescencias con pedúnculos pubescentes, erectas y tienen menos de 10 cm de largo; los frutos son redondos y glabros, verde claro, de entre 3 y 6 cm de largo. Crece principalmente en bosque mesófilo de montaña, en matorrales y en pinares, entre 0 y 2,010 m snm. Se distribuye de México a Costa Rica (Callejas-Posada, 2020; Tebbs, 1993). Su floración ocurre todo el año (PA Aguilar-R., obs. pers.) y la información sobre su biología reproductiva es desconocida. En México esta especie solo había sido registrada para Chiapas, Guerrero, Jalisco, Nayarit y Oaxaca (fig. 2). Crece en bosque húmedos tropicales, entre 300 y 1,400 m snm (Callejas-Posada, 2020; Villaseñor, 2016).
Figura 2. Presencia en México de algunos ejemplares representativos para la distribución nacional de Pseudalcantarea macropetala cuadros en naranja), Tillandsia heterophylla (círculos verdes), Werauhia nutans (círculos negros) y Piper pseudoasperifolium (cuadros azules), en México. Las coordenadas de los ejemplares colectados se encuentran en la tabla 1.
Ejemplares examinados: México. Veracruz, municipio Banderilla, Área Natural Protegida, La Martinica, 19°35’23” N, 96°57’01” O, 1,543 m, 25.III.2023, P. A. Aguilar-Rodríguez PA0025 (HEM); municipio Xalapa, Jardín Botánico Francisco Javier Clavijero, 19°30’50” N, 96°56’38” O, 1,320 m snm, 25.III.2023, P. A. Aguilar-Rodríguez PA0023 (HEM).
Discusión
El hallazgo de estas 4 especies de plantas en estados con inventarios florísticos recientes (p.e., Tobías-Baeza et al., 2019; Torres-Colín et al., 2017; Vargas-Rueda et al., 2019; Villaseñor et al., 2022) demuestra la importancia de continuar realizando exploraciones y colectas en los diferentes tipos de vegetación de México, pero particularmente en el bosque mesófilo de montaña (solamente T. heterophylla fue colectada en un bosque de encino), uno de los tipos de vegetación en México con una alta diversidad florística (hasta 6,790 spp.; Villaseñor, 2010) y donde la mayoría de las especies reportadas en este estudio fueron encontradas, así como en los fragmentos boscosos urbanos.
Además, las Bromeliaceae Pseudalcantarea macropetala, para Hidalgo, Tillandsia heterophylla para San Luis Potosí, corresponden a los registros más norteños para estas especies con distribución exclusiva en México. Aunque probablemente la primera especie tenga una presencia en Centroamérica, aún no se han analizado ejemplares de herbario de Pseudalcantarea viridiflora, toda vez que hay ejemplares entremezclados de ambas especies en diferentes herbarios (PA Aguilar-R, obs. pers.).
Pseudalcantarea grandis (Schltdl.) Pinzón et Barfuss y P. viridiflora (Beer) Pinzón et Barfuss, son las otras 2 especies del género presentes en México, ambas también se encuentran en Hidalgo (Espejo-Serna et al., 2005, 2021). El registro de P. macropetala representa la tercera especie del género para el estado, mientras que el reporte de Tillandsia heterophylla para San Luis Potosí aumenta el número a 20 spp. dentro del género en el estado (Espejo-Serna et al., 2021). Anteriormente, T. heterophylla se había reportado solo para Hidalgo, Puebla y Veracruz (Espejo-Serna et al., 2005, 2021). El espécimen Reyes-García 6495 (MEXU, MO) colectado en Chiapas y determinado como T. heterophylla debe ser analizado para confirmar su determinación. La especie es abundante en los sitios donde se encuentra y parece seguir una distribución a través de la provincia biogeográfica de la Sierra Madre Oriental (sensu Morrone et al., 2002), por lo que, hipotetizamos, que al menos en el sur de Tamaulipas, pueda estar presente esta especie en hábitats boscosos.
Por otro lado, en este estudio se confirma la presencia de W. nutans para Tabasco, confirmando su presencia en otra localidad de la provincia biogeográfica Veracruzana (sensu Morrone et al., 2002) (tabla 1) y representa la tercera especie del género para el estado, ya que previamente se había reportado W. gladioliflora (H. Wendl.) J.R. Grant (Espejo-Serna et al., 2005, 2021) y W. maculata Espejo-Serna, López-Ferrari, Aguilar-Rodr., Diaz Jim. (Aguilar-Rodríguez et al., 2020).
El reporte de Piper pseudoasperifolium como nuevo registro para Veracruz eleva el número a 90 spp. del género Piper en el estado, lo cual representa 66% de las 136 spp. reportadas en México (Villaseñor, 2016). En la revisión de herbarios y bases de datos se pudo constatar que, a diferencia de otras especies de Piper (p.e., P. aduncum L., P. amalago L., P. hispidum Sw.), P. pseudoasperifolium ha sido poco recolectada en México, con menos de 17 especímenes registrados en Chiapas, 3 en Oaxaca, 2 en Nayarit y 1 en Guerrero, abarcando varias provincias biogeográficas con distintas características, como la del Balsas, Tierras bajas del Pacífico, Veracruzana y de la Sierra Madre del Sur (sensu Morrone et al., 2002). Esto sugiere que esta especie también tendrá presencia en Jalisco, Michoacán y quizá Colima, siendo así una especie con representación en las regiones neártica y neotropical. En Veracruz, esta especie se recolectó en el Jardín Botánico Francisco Javier Clavijero, en el municipio de Xalapa y en el Área Natural Protegida La Martinica, en Banderilla, como parte del proyecto “Funcionalidad socioecológica de áreas verdes urbanas neotropicales en Veracruz”. En ambos sitios, P. pseudoasperifolium crece abundante, tanto en la orilla del bosque, como en el sotobosque y simpátrica con otras especies del mismo género como P. auritum y P. lapathifolium (PA Aguilar-R pers. obs.), lo que sugiere una especie con una gran adaptabilidad a la perturbación antrópica y que crece en simpatría con otras especies morfológicamente muy similares.
Agradecimientos
A Pedro Díaz Jiménez, Melany Aguilar López, Mané Salinas Rodríguez, Diego A. Báez Ruiz, y Rocío Cárcamo Corona por su ayuda en campo y al procesar las muestras; a Ricardo Callejas-Posada por su valiosa ayuda en la identificación Piper. A Adolfo Espejo-Serna por su ayuda para la revisión de especímenes. Y a Mauricio Gerónimo Martínez-Martínez y Melany Aguilar López por la elaboración del mapa. Algunas salidas de campo fueron solventadas por parte del proyecto de Ciencia Básica del Conahcyt “Funcionalidad socioecológica de áreas verdes urbanas neotropicales” (64358).
Referencias
Aguilar-Rodríguez, P. A., Díaz-Jiménez, P., Espejo-Serna, A., López-Ferrari, A. R., Hentrich, H., Yovel, Y. et al. (2020). A new Werauhia (Tillandsioideae, Bromeliaceae) from Mexico with observations about its reproductive biology. Phytotaxa, 446, 128–134. https://doi.org/10.11646/phytotaxa.446.2.6
Aguilar-Rodríguez, P. A., Krömer, T., García-Franco, J. G. y MacSwiney G., M. C. (2016). From dusk till dawn: nocturnal and diurnal pollination in the epiphyte Tillandsia heterophylla (Bromeliaceae). Plant Biology, 18, 37–45. https://doi.org/10.1111/plb.12319
Aguilar-Rodríguez, P. A., MacSwiney G., M. C., Krömer, T., García-Franco, J. G., Knauer, A. y Kessler, M. (2014). First record of bat-pollination in the species-rich genus Tillandsia (Bromeliaceae). Annals of Botany, 113, 1047–1055. https://doi.org/10.1093/aob/mcu031
Aguilar-Rodríguez, P. A., Tschapka, M., García-Franco, J. G., Krömer, T. y MacSwiney G., M. C. (2019). Bromeliads going batty: pollinator partitioning among sympatric chiropterophilous Bromeliaceae. AoB Plants, 11, 1–19. https://doi.org/10.1093/aobpla/plz014
Barfuss, M. H. J., Till, W., Leme, E. M. C., Pinzón, J. P., Manzanares, J. M., Halbritter, H. et al. (2016). Taxonomic revision of Bromeliaceae subfam. Tillandsioideae based on a multi-
locus DNA sequence phylogeny and morphology. Phytotaxa, 279, 1–97. https://doi.org/10.11646/phytotaxa.279.1.1
Benzing, D. H. (2000). Bromeliaceae. Profile of an adaptive radiation. Cambridge, RU: Cambridge University Press.
Callejas-Posada, R. (2020). Piperaceae. En G. Davidse, C. Ulloa-Ulloa, H. M. Hernández-Macías y S. Knapp (Eds.), Flora Mesoamericana (pp. 1–590). Missouri Botanical Garden, St. Louis. Disponible en: http://www.udea.edu.co/wps/wcm/connect/udea/1f3edff1-8eef-4d0f-954a-4c77d5d4eb75/Piperaceae_flora_meso_compressed.pdf?MOD=AJPERESetCVID=obVwDyZ
Espejo-Serna, A. y López-Ferrari, A. R. (2004). Notas sobre la familia Bromeliaceae en el Valle de México. Acta Botanica Mexicana, 67, 49–57. https://doi.org/10.21829/abm67.2004.973
Espejo-Serna, A., López-Ferrari, A. R. y Ramírez-Morillo, I. (2005). Bromeliaceae. Flora de Veracruz. Fascículo 136. Xalapa: Instituto de Ecología, A.C.
Espejo-Serna, A., López-Ferrari, A. R., Martínez-Correa, N. y Pulido Esparza, V. A. (2007). Bromeliad flora of Oaxaca, Mexico: Richness and distribution. Acta Botanica Mexicana, 81, 71–147. https://doi.org/10.21829/abm81.2007.1025
Espejo-Serna, A., López-Ferrari, A. R., Mendoza-Ruiz, A., García-Cruz, J., Ceja-Romero, J. y Pérez-García, B. (2021). Mexican vascular epiphytes: richness and distribution. Phytotaxa, 503, 001–124. https://doi.org/10.11646/phyto
taxa.503.1.1
Krömer, T., Espejo-Serna, A., López-Ferreri, A. R., Ehlers, R. y Lautner, J. (2012). Taxonomic and nomenclatural status of the Mexican species in the Tillandsia viridiflora complex (Bromeliaceae). Acta Botanica Mexicana, 99, 1–20. https://doi.org/10.21829/abm99.2012.16
Morrone, J., Espinosa-Organista, D. y Llorente-Bousquets, J. (2002). Mexican biogeographic provinces: preliminary scheme, general characterizations, and synonymies. Acta Zoológica Mexicana, 85, 83–108. https://doi.org/10.21829/azm.2002.85851814
Quijano-Abril, M. A., Callejas-Posada, R. y Miranda-Esquivel, D. R. (2006). Areas of endemism and distribution patterns for Neotropical Piper species (Piperaceae). Journal of Biogeography, 33, 1266–1278. https://doi.org/10.1111/j.1365-2699.2006.01501.x
Samain, M. S. y Tebbs, M. C. (2020). Piperaceae. Flora del Bajío y de Regiones Adyacentes, 215, 1–62.
Tebbs, M. C. (1993). Revision of Piper in the new in the New World. 3. The taxonomy of Piper sections Lepiantes and Radula. Bulletin of the Natural History Museum of London, 23, 1-50.
Thiers, B. (2016) Index Herbariorum. A global directory of public herbaria and associated staff. New York Botanical Garden`s virtual herbarium. https://sweetgum.nybg.org/science/ih/
Tobías-Baeza, A., Salvador-Morales, P., Sánchez-Hernández, R., Ruiz-Acosta, S. C., Arrieta-Rivera, A. y Andrade-Prado, H. (2019). Composición florística y carbono en la vegetación arbórea de un área periurbana en Tabasco, México. Ecosistemas y Recursos Agropecuarios, 6, 369–376. https://doi.org/10.19136/era.a6n17.2009
Torres-Colín, R., Parra, J. G., de la Cruz, L. A., Ramírez, M. P., Gómez-Hinostrosa, C., Bárcenas, R. T. et al. (2017). Flora vascular del municipio de Guadalcázar y zonas adyacentes, San Luis Potosí, México. Revista Mexicana de Biodiversidad, 88, 524–554. https://doi.org/10.1016/j.rmb.2017.07.003
TROPICOS. (2022a). Missouri Botanical Garden. Recuperado el 10 de septiembre de 2022 de: https://www.tropicos.org/home
UNAM (Universidad Nacional Autónoma de México). (2022). Portal de Datos Abiertos UNAM. Recuperado el 01 de septiembre de 2022 de: https://datosabiertos.unam.mx/bio
diversidad/
Vargas-Rueda, A. F., Rivera-Hernández, J. E., Cházaro-Basáñez, M. J. y Alcántara-Salinas, G. (2019). Nuevos registros para la flora de Veracruz en el Parque Nacional Cañón del Río Blanco, México. Acta Botanica Mexicana, 126, e1429. https://doi.org/10.21829/abm126.2019.1429
Villaseñor, J. L. (2010). El bosque húmedo de montaña en México y sus plantas vasculares. Catálogo florístico taxonómico. Ciudad de México: Conabio/ UNAM.
Villaseñor, J. L. (2016). Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017
Villaseñor, J. L., Ortiz, E. y Sánchez-González, A. (2022). Riqueza y distribución de la flora vascular del estado de Hidalgo, México. Revista Mexicana de Biodiversidad, 93, e933920. https://doi.org/10.22201/ib.20078706e.2022.93.3920
Zotz, G. (2013). The systematic distribution of vascular epiphytes —a critical update. Botanical Journal of the Linnean Society, 171, 453–481. https://doi.org/10.1111/boj.12010
Influencia de la introducción de pastos no nativos en la riqueza de especies de los ensambles de aves en la región del Desierto Chihuahuense: un análisis temporal
Manuel Palomo-Morales a, b, *, Luis Enrique Sánchez-Ramos c, d, Luis Gerardo Herrera-Montalvo e, Adolfo G. Navarro-Sigüenza d, f y Pedro Luis Valverde b
a Universidad Autónoma Metropolitana, Doctorado en Ciencias Biológicas y de la Salud, Av. Ferrocarril San Rafael Atlixco, Núm. 186,
Col. Leyes de Reforma 1 A Sección, 09310 Ciudad de México, México
b Universidad Autónoma Metropolitana-Iztapalapa, Departamento de Biología, Av. Ferrocarril San Rafael Atlixco, Núm. 186, Col. Leyes de Reforma 1 A Sección, 09310 Ciudad de México, México
c Universidad Nacional Autónoma de México, Instituto de Geociencias, Blvd. Juriquilla 3001, La Mesa, 76230 Juriquilla, Querétaro, México
d Universidad Nacional Autónoma de México, Facultad de Ciencias, Museo de Zoología, Apartado postal 70-399, 04510 Ciudad de México, México
e Universidad Nacional Autónoma de México, Instituto de Biología, Estación de Biología Chamela, Carretera Federal Barra de Navidad-Puerto Vallarta Km 59, 48854 Chamela, Jalisco, México
f Universidad Nacional Autónoma de México, Unidad Multidisciplinaria de Docencia e Investigación, Facultad de Ciencias-Campus Juriquilla, Blvd. Juriquilla 3001, La Mesa, 76230 Juriquilla, Querétaro, México
*Autor para correspondencia: manuelpm.biol@gmail.com (M. Palomo-Morales)
Recibido: 25 junio 2024; aceptado: 15 agosto 2024
Resumen
Evaluamos la diversidad de pastos nativos, pastos no nativos y aves de pastizal en el Desierto Chihuahuense en un contexto histórico-ambiental de presión antropogénica en los periodos de 1930-1964, 1965-1981 y 1982-2019. Analizamos la riqueza regional, la diversidad beta y la composición de 41 especies de aves de pastizal, 149 especies de pastos nativos y 60 especies de pastos no nativos, así como la prevalencia de pastos nativos y su correlación con las aves de pastizal en cada periodo. Los resultados mostraron una reducción de la diversidad beta en los 3 ensambles a lo largo del tiempo, sin relaciones significativas entre el ensamble de aves y la prevalencia de pastos nativos en el último periodo. Esto sugiere que la distribución actual de las aves de pastizal es independiente del tipo de pasto a nivel regional. La expansión de pastos no nativos en el Desierto Chihuahuense, favorecida por políticas públicas a lo largo del tiempo, ha conformado un ensamble de pastizales mixtos, lo que actualmente no afecta la composición de aves de pastizal a escala regional. Sugerimos realizar evaluaciones locales para comprender mejor la relación entre las aves de pastizal y los distintos pastos presentes en la región.
Palabras clave: Diversidad beta; Presencia-ausencia; Ensamble de especies; Índice de prevalencia; NMDS
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Influence of the introduction of non-native grasses on the species richness of bird assemblages in the Chihuahuan Desert region: a temporal analysis
Abstract
We assessed the diversity of native grasses, non-native grasses, and grassland birds in the Chihuahuan Desert in a historical-environmental context of anthropogenic pressure during the periods 1930-1964, 1965-1981, and 1982-2019. We analyzed the regional richness, beta diversity, and composition of 41 grassland bird species, 149 native grass species, and 60 non-native grass species, as well as the prevalence of native grasses and their correlation with grassland birds in each period. The results showed a reduction in beta diversity in the 3 assemblages over time, with no significant relationships between bird assemblage and native grass prevalence in the last period. This suggests that the current distribution of grassland birds is independent of grass type at the regional level. The expansion of non-native grasses in the Chihuahuan Desert, favored by public policies over time, has formed an assemblage of mixed grasslands, which currently does not affect the composition of grassland birds at the regional level. We suggest conducting local assessments to better understand the relationship between grassland birds and the different grasses present in the region.
Keywords: Beta diversity; Presence-absence; Species assemblage; Prevalence rate; NMDS
Introducción
Las especies introducidas de animales y plantas alteran la composición y ecología de las comunidades biológicas, tanto local como regionalmente (Davis, 2003). En particular, las investigaciones sobre plantas introducidas e invasoras se han centrado en cuantificar y describir sus impactos a diversas escalas, desde poblaciones y especies, hasta comunidades y ecosistemas (Hejda et al., 2009; Pyšek et al., 2012). Con el tiempo, muchas especies de plantas introducidas se han expandido y pueden, potencialmente, acelerar la extirpación de poblaciones de especies nativas de forma localizada y, eventualmente, aumentar la homogeneidad biótica del hábitat, lo que reduce la diferenciación de las floras a nivel regional (Qian y Ricklefs, 2006).
Las especies de pastos (familia Poaceae) que han sido introducidas en diferentes regiones son el principal agente que ha perturbado los pastizales nativos de extensas regiones del mundo, como ha sucedido por ejemplo en las praderas de California, las Grandes Planicies del centro de los EUA, así como en varias regiones del centro de Australia, entre otras (Gibson, 2009). Los efectos de la invasión de pastos exóticos dependen en parte de la gravedad de cualquier cambio ambiental o del régimen de perturbación humana, como el pastoreo excesivo, la sequía, la frecuencia de incendios, el pisoteo del ganado, la fragmentación del hábitat y la cercanía con tierras agrícolas que favorecen su dispersión (Chaneton et al., 2002; Gibson, 2009; Hamilton, 1999; Weaver et al., 1996). Algunas de las consecuencias de las invasiones por estos pastos incluyen la simplificación de la estructura de la vegetación, la reducción de la biodiversidad al disminuir el hábitat preferente de muchas especies de vida silvestre, así como la alteración de los regímenes naturales de incendios y ciclo de nutrientes, entre otras (Wied
et al., 2020).
En Norteamérica, las regiones de pastizales naturales ocupan una importante porción de la superficie continental (Gibson, 2009). Se pueden encontrar áreas importantes de este tipo de vegetación desde Canadá hasta el centro de México (APCP, 2010), albergando una gran biodiversidad a lo largo de su extensión. En México este tipo de vegetación ocupa, aproximadamente, 118,320 km2 (Challenger, 1998), las áreas más importantes se encuentran en extensas zonas del norte, principalmente en el Desierto Chihuahuense (Desmond y Montoya, 2006). Existe también una gran diversidad de condiciones en las que los pastizales naturales se presentan en el país, como por ejemplo los pastizales submontanos del Eje Neovolcánico Transversal (dispersos en zonas como la sierra nevada del sistema Popocatépetl-Iztaccíhuatl, el nevado de Colima, y el volcán Ajusco), entre otros (Challenger y Soberón, 2009). Otras zonas de pastizal húmedo se pueden encontrar en áreas de selva tropical con distribución restringida en Tabasco y Campeche (Challenger, 1998). Sin embargo, también existe una considerable extensión de pastizales inducidos dispersa por el país derivado de actividades ganaderas desde hace varias décadas (Challenger y Soberón, 2009).
Ante la presencia cada vez mayor de pastizales inducidos, el sistema de pastizales nativos del Desierto Chihuahuense, pese a su fisonomía y estructura aparentemente simples, representa una región de gran importancia para la conservación de los pastizales semiáridos, por la considerable riqueza de especies vegetales y presencia de pastos endémicos (Challenger y Soberón, 2009; Desmond y Montoya, 2006). Además, la extensión de estos pastizales se ha reconocido como relevante para una gran diversidad de taxones animales, que incluyen tanto aves de pastizal residentes (y algunas endémicas; e.g., Spizella wortheni) como migratorias, que son compartidas con Canadá y EUA (Macías-Duarte et al., 2009). Factores como la deforestación, la fragmentación del hábitat y el reemplazo de las comunidades de pastos nativos por paisajes agrícolas, han contribuido en el deterioro a gran escala de los pastizales, siendo a la vez los responsables de la disminución de las poblaciones de aves de pastizal (Brennan y Kuvlesky, 2005). Adicionalmente, se puede considerar que las zonas semiáridas del norte de México son de las menos susceptibles a la invasión de plantas no nativas debido a un menor desarrollo urbano, en contraste con los enormes centros urbanos en el centro y sur de México (del Val et al., 2015). Dentro de esta región, la gran extensión de pastizales naturales ha sido ocupada por varias especies de pastos no nativos que se han establecido desde principios del siglo XX (Melgoza-Castillo et al., 2014; Valenzuela-Núñez et al., 2009). Las zonas de pastizales invadidas por gramíneas no nativas proveen una menor cantidad de hábitats disponibles y, por lo tanto, menos recursos en comparación con aquellas zonas de pasto nativo que soportan un mayor conjunto de aves de pastizal (George et al., 2013). Por lo tanto, se vuelve necesario mantener y restaurar las condiciones originales de los pastizales para evitar la reducción de las poblaciones de aves residentes y migratorias de pastizal (Macías-Duarte et al., 2017).
En México, la introducción y expansión de especies de pastos exóticos obedece, probablemente, a la aplicación de políticas públicas impulsadas para promover la producción cárnica (Challenger y Soberón, 2009). En la historia del desarrollo agropecuario de México se pueden distinguir 3 periodos principales que implican cambios radicales en las prácticas ganaderas y que, por consiguiente, guiaron la transformación de los pastizales naturales (Chauvet-Sánchez, 1999). El primero, de 1930 a 1964 se caracterizó por la sustitución de las importaciones ganaderas para incentivar el mercado nacional, los intentos de erradicación de la tuberculosis y la fiebre aftosa en el ganado, así como la consolidación de la medicina veterinaria en México (Cervantes-Sánchez y Román de Carlos, 2001; Chauvet-Sánchez, 1999). El segundo periodo refleja la consolidación del mercado ganadero de exportación de cárnicos de manera constante, lo que dio lugar al auge ganadero nacional entre 1965-1981 con la ganaderización de la agricultura caracterizado por la sobreexplotación y agotamiento de los pastizales (Chauvet-Sánchez, 1999). Posteriormente, la eliminación de las políticas proteccionistas y el incremento de importación de cárnicos en el inicio de las políticas neoliberales dieron lugar al tercer periodo considerando la decadencia ganadera de 1982 hasta la actualidad (Chauvet-Sánchez, 1999). Cabe mencionar que durante este periodo surgen políticas de manejo y conservación de pastizales en varios sitos del Desierto Chihuahuense, como consecuencia del auge de la ciencia de la ecología y una mayor preocupación por la conservación de los recursos naturales (Hoth, 2012). Además, el cambio de modelo económico posterior a la firma del Tratado de Libre Comercio de América del Norte (TLCAN) produjo una menor presión sobre el pastizal al reducir el tiempo de cría del ganado para su engorde en EUA y posterior retorno a nuestro país como productos cárnicos procesados (Carrera-Chávez et al., 2010; Chauvet-Sánchez, 1999).
Estas etapas en el país enmarcan el tiempo en que la presión antropogénica pudo ser relevante para favorecer la introducción y expansión de pastos no nativos dentro del Desierto Chihuahuense, sobre todo porque estas especies de pastos, una vez establecidas, se expandieron con el tiempo ampliando su área de distribución geográfica (Guo et al., 2006). Comprender la dinámica temporal de cambio en la biodiversidad vegetal sobre las especies nativas es crucial para las estrategias de conservación a una escala regional. Estos cambios se han abordado a través de análisis de la diversidad beta (Qian, 2008; Qian y Ricklefs, 2006), entendida como los cambios en la composición de especies en ámbitos espacial, temporal y ambiental (Calderón-Patrón y Moreno, 2019).
Para evaluar el efecto de las especies de gramíneas introducidas sobre la composición de especies nativas en sistemas de pastizal (Eskelinen y Harrison, 2015; Joner et al., 2021; Szentes et al., 2012), la diversidad beta puede valorarse a través de índices de similitud con análisis basado en 2 componentes: el recambio y el anidamiento (Baselga, 2010; Calderón-Patrón y Moreno, 2019). Ecológicamente, estos componentes pueden reflejar una selección de especies por el ambiente o por procesos de dispersión, así como una relación entre las dinámicas de pérdida o colonización de especies (Baselga, 2010). Por ejemplo, en los pastizales centrales de Norteamérica, la diversidad beta mostró cambios en la composición de especies de aves a lo largo de un gradiente de disponibilidad de pastizales, lo que refleja la pérdida del hábitat original en el espacio tras varios años de modificación antropogénica (Pavlacky et al., 2022). Por otro lado, también se ha descrito que una partición de la diversidad total entre tipos de pastizales de una región puede mostrar el comportamiento del recambio total de la composición de aves de pastizal (Żmihorski et al., 2016).
La diversidad beta ofrece una herramienta adecuada para medir la disimilitud en la composición de especies debido a factores como el arreglo espacial, las restricciones espaciales o históricas, así como el gradiente de riqueza de especies (Baselga, 2010). Esto permite explorar los patrones de diversidad beta a lo largo del tiempo (Almeida-Neto et al., 2011), por lo que resulta valioso para evaluar el efecto de la introducción de pastos no nativos sobre la diversidad de aves de pastizal en el Desierto Chihuahuense.
Partiendo del contexto histórico-ambiental de la región antes descrito, se espera en el presente estudio que el recambio composicional de pastos nativos por pastos no nativos influya en la pérdida de especies de aves de pastizal. El objetivo de este estudio fue analizar el efecto de la introducción de pastos no nativos en la riqueza de aves de pastizal en el Desierto Chihuahuense, durante los 3 periodos descritos (1930-1964, 1965-1981 y 1982-2019) con distintas prácticas agropecuarias con la finalidad de evaluar si las políticas económicas han tenido una influencia sobre la diversidad de la biota asociada a esos ecosistemas. Especialmente, se pretende analizar si el incremento de los cambios en la gestión agrícola a largo plazo ha propiciado cambios en la diversidad de aves de pastizal (Chamberlain, 2000; Rosenberg et al., 2019). De manera específica, se plantearon los siguientes objetivos particulares: 1) obtener la diversidad beta regional de los pastos nativos y no nativos, así como de aves de pastizal en la región; 2) evaluar si existen diferencias en la composición de especies de los ensambles de aves, pastos nativos y no nativos, entre los 3 periodos propuestos; 3) evaluar la relación de los componentes de la diversidad beta (pérdida/ganancia de especies y si las especies son únicas o compartidas) de pastos nativos y no nativos sobre la composición de aves de pastizal; 4) probar si existe una correlación entre la prevalencia de pastos nativos y las aves de pastizal. Los resultados de esta investigación aportarán un enfoque novedoso para entender la influencia del cambio composicional en los pastizales (nativos/no nativos) sobre la diversidad de aves, resultado de las actividades de manejo planteadas en los planes de desarrollo agropecuario mexicano en el último siglo.
Materiales y métodos
El área de estudio son los pastizales semiáridos que se extienden a lo largo del Desierto Chihuahuense en EUA y México, destacando que estos pastizales varían considerablemente en la composición de pastos nativos (González-Medrano, 2012). Además, en esta región se ha registrado la presencia de diversas especies de aves de pastizal residentes y migratorias (Levandoski y Panjabi, 2014; Ruvalcaba-Ortega y Panjabi, 2018; Vickery et al., 1999). La delimitación del área de estudio (fig. 1a) se estableció utilizando el sistema de información geográfica QGis 3.16, a partir de la unión de los polígonos correspondientes a las ecorregiones de la CCA (Comisión de Cooperación Ambiental) extraídas del mapa de la North American Terrestrial Ecoregions-Level III (Wiken et al., 2011): 1) Archipiélago Madrense, 2) Desierto Chihuahuense, 3) Planicies del Sur de Texas, 4) Pie de Monte Sierra Madre Occidental y 5) Altiplanicie Mexicana (fig. 1a). Estas ecorregiones fueron elegidas por la presencia de pastizales naturales y son consideradas como los pastizales cálidos de Norteamérica (Brown y Makings, 2014).
A partir del polígono del área de estudio, se construyó en QGis 3.16 una malla de celdas triangulares con una resolución geográfica de 1° de longitud por celda (aprox. 111.1 km2). La forma de las celdas fue elegida de entre varias alternativas, como cuadrícula (e.g., Rojas-Soto et al., 2003) o hexágonos (e.g., Sánchez-Ramos et al., 2018), optando por las celdas triangulares debido a que fueron las que mejor se ajustaron al área del polígono, y el nivel de resolución fue el óptimo para organizar los registros de especies para algunos de los análisis posteriores (fig. 1b).
Para obtener los registros de pastos nativos y no nativos (material suplementario: tabla 1S) se tomó como base el Catálogo de las gramíneas malezas nativas e introducidas de México (Melgoza-Castillo et al., 2014; Sánchez-Ken et al., 2012). Considerando a las especies presentes dentro del área del polígono, se seleccionaron 149 especies de pastos nativos y 60 especies de pastos no nativos. Para la nomenclatura taxonómica se siguió a The World Checklist of Vascular Plants(WCVP; Govaerts, 2022).
Para obtener los registros de las aves de pastizal de acuerdo con la literatura científica, se seleccionaron las especies que previamente han sido catalogadas como dependientes de este tipo de hábitat, ya sea por utilizar estos sitios como áreas reproductivas o importantes en sus rutas migratorias dentro del Desierto Chihuahuense (Levandoski y Panjabi, 2014; Ruvalcaba-Ortega y Panjabi, 2018; material suplementario: tabla 2S). En total, se obtuvieron los registros de 41 especies de aves (residentes y migratorias) asociadas a pastizales, que se determinaron siguiendo la nomenclatura de American Ornithological Society (AOS, Chesser et al., 2022).

Figura 1. a, Ecorregiones extraídas del mapa de North American Terrestrial Ecoregions —Level III (Wiken et al., 2011) con las que se definió el polígono del Desierto Chihuahuense (amarillo); b, rejilla de 1 minuto de arco (verde) sobre el área de estudio usada para realizar las matrices de presencia-ausencia.
Los datos primarios de presencia de las especies seleccionadas de aves, pastos nativos y no nativos, se extrajeron del explorador de registros de la Global Biodiversity Information Facility (GBIF, https://www.gbif.org), utilizando el polígono del área de estudio para delimitar espacialmente la consulta (los enlaces de descarga [DOI] de las consultas se encuentran en el material suplementario: tabla 1S). Se utilizó el intervalo de tiempo de 1930 a 2019, correspondiente a los 3 periodos del desarrollo agropecuario mexicano en el último siglo. Los datos de presencia disponibles permitieron contar con un registro histórico confiable del recambio espacial de las especies de la región. No fue posible establecer una base previa a este intervalo debido a la escasez de registros de pastos no nativos antes de 1930. Los registros obtenidos fueron reorganizados en 3 bases de datos (pastos nativos, pastos no nativos y aves de pastizal) construidas en un sistema de gestión de bases de datos (Microsoft Access®). En cada una de las bases de datos se realizó una depuración de las georreferencias repetidas y los registros mal georreferenciados con respecto al polígono, con el fin de eliminar las inconsistencias generadas por la captura de datos. Por último, se consideraron los intervalos de tiempo de 1930 a 1964, 1965 a 1981 y 1982 a 2019 para detectar los posibles cambios temporales en la composición de especies de aves, consecuencia de la introducción de especies de pastos no nativos.
Con la finalidad de evaluar la calidad del muestreo de los diferentes taxones, se generaron curvas de acumulación de las especies de aves, pastos nativos y pastos no nativos para cada periodo. Estas curvas representan el número acumulado de especies encontradas al aumentar el tamaño de muestra (e.g., el aumento del esfuerzo de muestreo en el tiempo para cada periodo). Los estimadores de las curvas de acumulación de especies por grupo taxonómico y periodo se obtuvieron a partir de las matrices de presencia-ausencia con el paquete EstimateS 9.1 (Colwell, 2013). Adicionalmente, se estimaron los estadísticos de Chao2 para evaluar la completitud del muestreo (Colwell, 2013).
Diversidad beta
Índices de disimilitud. Con los datos de presencia-ausencia, se exploraron los cambios en la composición de especies en las celdas durante los 3 periodos mediante el cálculo de la diversidad β de Sorensen (βsor aditivo) (Baselga, 2010). Esta métrica está compuesta por el recambio, medido por la diversidad β de Simpson (βsim), y por el anidamiento medido por la diversidad β anidada (βnes) (Baselga, 2010). El primer componente corresponde a cuántas especies de un sitio son reemplazadas por especies diferentes de otros sitios (valores de 0 = todas las especies son iguales y 1 = todas las especies son diferentes), mientras que el segundo componente se refiere a la pérdida gradual de especies de un sitio a otro (valores de 0 = pérdida total de especies y 1 = ganancia total de especies); es decir, un sitio es un subconjunto del otro (Baselga, 2010). Estos componentes se consideran un reflejo de los procesos de selección de especies por factores ambientales, así como una dinámica de pérdida o colonización de especies (Calderón-Patrón y Moreno, 2019; Vellend, 2010). Estos índices se calcularon en la paquetería “betapart” de R por medio de betapair a partir de las matrices de presencia-ausencia (Baselga et al., 2018). Con estos índices se midió la variación en la composición de especies de pastos nativos, pastos no nativos y aves de pastizal en cada uno de los 3 periodos (Baselga y Orme, 2012; Llanes-Quevedo et al., 2024).
Riqueza de aves de pastizal, pastos nativos y no nativos, y prevalencia de pastos nativos. Para evaluar las diferencias de la composición de especies de aves de pastizal y la composición de pastos nativos y no nativos entre los 3 periodos, se obtuvo la riqueza total de pastos nativos y no nativos por celda por periodo. Estas riquezas totales fueron utilizadas para calcular un índice de prevalencia de especies de pastos nativos (IPPN). Para cada celda por periodo, este índice sintetiza la riqueza de especies de pastos nativos y no nativos en una variable (adaptado de Legendre, 2019). El IPPN se calcula como: PN / (PN + PNN), donde PN es el número de especies de pastos nativos y PNN es el número de especies de pastos no nativos. Este índice varía de 0 (cuando todas las especies son pastos no nativos) a 1 (cuando todas las especies son pastos nativos). Las celdas sin registros de especies de pastos nativos o no nativos se eliminaron. Adicionalmente, para cada celda se obtuvo la riqueza total de aves de pastizal por periodo. Para evaluar las diferencias en la riqueza total de aves, pastos nativos, pastos no nativos, así como en el IPPN entre periodos, se utilizaron análisis de varianza de Kruskal-Wallis (KW). En cada análisis, el periodo con 3 niveles (1930-1964, 1965-1981 y 1982-2019) fue considerado como factor (Zar, 2010). Los análisis de KW se realizaron utilizando la función de kruskal.test() del paquete R (Kloke y McKean, 2015). En el caso de detectarse diferencias significativas, se realizaron pruebas “post-hoc” de Wilcoxon con la probabilidad ajustada de Bonferroni (α = 0.05/3 = 0.0166; Wright, 1992). Las posibles relaciones entre el IPPN y la riqueza total de aves de pastizal en cada uno de los 3 periodos, se analizaron con correlaciones de Spearman (rs) utilizando la función cor.test() del paquete R (Hollander y Wolfe, 1973). Estas variables fueron transformadas al arcoseno√ y log10+1, respectivamente (Zar, 2010). Adicionalmente, se visualizó y exploró la composición de cada conjunto de especies (i.e., aves de pastizal, pastos nativos y pastos no nativos) en los 3 periodos con análisis de escalamiento multidimensional no métrico (NMDS) con la función metaMDS() de la paquetería Vegan de R (Oksanen et al., 2013). Se utilizó la matriz transpuesta de presencia/ausencia (especies × sitios) de las especies de aves de pastizal, pastos nativos y pastos no nativos de cada uno de los 3 periodos con base en el coeficiente de distancia euclidiana (Palacio et al., 2020). La visualización por medio del análisis NMDS nos permite explorar y presentar, de manera más accesible, el efecto de los 3 periodos.
Resultados
El total de datos descargados que se obtuvieron para los 3 conjuntos de especies fue de 2,345,226 registros para aves de pastizal, 37,750 registros para pastos nativos y 8,815 para pastos no nativos. Al reorganizar, depurar, ajustar geográficamente y dividir los datos para cada uno de los 3 periodos correspondientes, se obtuvieron en total 328,809 registros de las 41 especies de aves de pastizal, 25,429 registros de las 149 especies de pastos nativos y 5,555 de las 60 especies de pastos no nativos. El número total de especies y conjunto de registros para cada uno de los periodos, así como la disposición espacial de los mismos, se puede consultar en el material suplementario (fig. 1S; tabla 3S). La mayor parte (93.33%) de los registros recolectados en GBIF correspondientes a las especies tanto de pastos nativos como no nativos, proceden de colecciones científicas y, en menor medida, de observaciones en campo o artículos de investigación (6.77%). Por el contrario, los registros de aves de pastizal proceden, en su mayor parte (97.16%), de observaciones de campo, seguido de investigaciones publicadas o de colecciones científicas (2.84%).
Se observaron patrones consistentes en la riqueza de especies en pastizales a lo largo de los 3 periodos analizados. En cada periodo, las curvas de acumulación indicaron que la mayor diversidad de especies se observó en pastos nativos, seguida de los pastos no nativos y las aves de pastizal (fig. 2). Los estimadores Chao2 respaldaron estos patrones con tamaños de muestra de diversidad distintos para cada conjunto. Para los pastos nativos, se estimó un registro de aproximadamente 94.7%, 90.4% y 99.8% de la riqueza total esperada en cada uno de los 3 periodos, respectivamente. Para pastos no nativos, las estimaciones fueron de 84.9%, 96.1%, y 96.9%, respectivamente. Para aves de pastizal, se estimó un registro de alrededor de 97.6% de la riqueza de especies en el primer periodo, mientras que, en los periodos siguientes, se estimó en 100% de la riqueza de especies, aunque esta estimación perfecta podría deberse a características particulares del estimador y al número fijo de especies a analizar.
El índice de disimilitud (βsor) mostró una tendencia en la disminución en los 3 ensambles a lo largo de los 3 periodos, lo que indica que aumentó la similitud entre las celdas que conforman el área de estudio para aves de pastizal, pastos nativos y no nativos (tabla 1). El índice de recambio (βsim) también disminuyó entre el primer periodo y el último, principalmente para las aves de pastizal (tabla 1). Por su parte, el índice de anidamiento (βsne) incrementó en todos los casos (tabla 1). Los resultados indican que, en la actualidad, las celdas comparten más especies entre sí y el recambio de especies ha disminuido para el último periodo.
Tabla 1
Índices de diversidad beta (βsor = βsim + βnes) obtenidos con beta.pair() de aves de pastizal, pastos nativos y pastos no nativos para cada periodo. x = Media y DE = desviación estándar.
| Periodo | Aves de pastizal | Pastos nativos | Pastos no nativos | ||||
| 1930-1964 | x | DE | x | DE | x | DE | |
| βsor | 0.74 | 0.21 | 0.83 | 0.16 | 0.81 | 0.23 | |
| βsim | 0.50 | 0.36 | 0.66 | 0.29 | 0.70 | 0.38 | |
| βsne | 0.24 | 0.27 | 0.16 | 0.22 | 0.12 | 0.20 | |
| 1965-1981 | x | DE | x | DE | x | DE | |
| βsor | 0.73 | 0.23 | 0.81 | 0.16 | 0.85 | 0.20 | |
| βsim | 0.40 | 0.39 | 0.64 | 0.28 | 0.69 | 0.38 | |
| βsne | 0.33 | 0.32 | 0.17 | 0.22 | 0.15 | 0.25 | |
| 1982-2019 | x | DE | x | DE | x | DE | |
| βsor | 0.35 | 0.21 | 0.74 | 0.18 | 0.77 | 0.19 | |
| βsim | 0.09 | 0.11 | 0.52 | 0.28 | 0.55 | 0.36 | |
| βsne | 0.26 | 0.23 | 0.23 | 0.23 | 0.22 | 0.27 |
Figura 2. Curvas de acumulación de especies de aves de pastizal (azul), pastos nativos (verde) y pastos no nativos (rojo) para los periodos de a) 1930-1964, b) 1965-1981 y c) 1982-2019.
Los análisis revelaron diferencias significativas de la riqueza de aves de pastizal (H = 196.24, g.l. = 2, p = 0.0001), pastos nativos (H = 35.78, g.l. = 2, p = 0.0001), pastos no nativos (H = 50.74, g.l. = 2, p = 0.0009) y el IPPN (H = 47.40, g.l. = 2, p = 0.0005) entre periodos (fig. 3). Estos hallazgos indican un efecto significativo a lo largo del tiempo en cada uno de los grupos taxonómicos evaluados, lo que refleja posibles cambios en la composición y estructura de las comunidades biológicas en respuesta a factores de manejo específicos o ambientales de cada período. La riqueza de aves de pastizal del periodo 1982-2019 fue significativamente mayor (p < 0.0001) con respecto a los periodos 1930-1964 y 1965-1981. Similarmente, la riqueza de pastos nativos y no nativos del periodo 1982-2019 fue significativamente mayor en comparación con aquella del periodo 1930-1964 (p = 0.0001) y 1965-1981 (p = 0.0013). Por otro el contrario, el IPPN del periodo 1982-2019 fue significativamente menor en comparación con el del periodo de 1930-1964 (p < 0.0001) y 1965-1981 (p = 0.0003).

Figura 3. Diagramas de caja de la riqueza de aves de pastizal, pastos nativos, pastos no nativos y el índice de prevalencia de pastos nativos (IPPN) para cada periodo. Periodos identificados con letras diferentes indican diferencias significativas (p ≤ 0.0166) con el resto a partir de pruebas “post-hoc” de Wilcoxon (ver detalles en Materiales y métodos).
Hubo correlaciones negativas débiles entre el IPPN y la riqueza de aves de pastizal en los periodos de 1930-1964 (rs = -0.1553, p = 0.0400) y 1965-1981 (rs = -0.1784, p = 0.0100). Sin embargo, no se encontró una correlación significativa entre ambas variables (rs = 0.0321, p = 0.6600) en el periodo de 1982-2019. La proyección de IPPN sobre la región muestra que durante el periodo de 1930-1964, el ensamble regional de pastos estaba conformado principalmente por pastos nativos, en contraste con una reducida prevalencia de pastos nativos para el periodo de 1982-2019 (fig. 4).
Finalmente, los NMDS revelaron una variación en la composición y riqueza regional del ensamble de especies tanto de aves como de pastos nativos y no nativos entre los periodos estudiados (fig. 5). Se observó una discontinuidad en la composición de especies de aves de pastizal a lo largo del tiempo, con una marcada contracción durante el periodo de 1965-1981 y una distribución más dispersa en el periodo de 1982-2019, indicando cambios abruptos en la estructura del ensamble (fig. 5a). En contraste, se observó un cambio gradual en la composición de especies de pastos nativos, con un incremento en la distribución del ensamble en varios sitios de la región con una posible contracción entre periodos (fig. 5b). Por último, se observó un marcado aumento en la composición del ensamble de pastos no nativos, especialmente notable durante el periodo de 1982-2019 (fig. 5c). Este patrón de cambio confirma la expansión significativa del ensamble de pastos no nativos en comparación con los periodos anteriores, en el mismo sentido que la proyección del IPPN para el último periodo (fig. 4). Estos resultados sugieren que el periodo de 1982-2019 muestra cambios en el ensamble de especies respecto a los otros periodos en términos del IPPN y la riqueza de especies. Sin embargo, esta tendencia no se mantuvo de manera consistente en el último periodo.
Discusión
Este estudio representa un acercamiento a escala regional sobre la influencia de los pastos no nativos en los pastizales del Desierto Chihuahuense, sugiriendo cambios en la composición general de las aves de pastizal, atribuibles al considerable cambio en la riqueza de especies y composición taxonómica de los pastos nativos influenciados por los procesos agropecuarios a lo largo del tiempo. Esto no involucra únicamente esta región, ya que debido a su conectividad, es fundamental para las aves migratorias provenientes de las praderas templadas y de pastos mixtos de las Grandes Llanuras Centrales de Norteamérica (Comer et al., 2018). Aunado a lo anterior, en esta región se han identificado procesos de diversificación y dispersión de diversos grupos de vertebrados terrestres y de plantas vasculares (Savage, 1982). En cuanto a las dinámicas ecológicas, estos hábitats también son importantes para diversas especies de animales, como el perrito de las praderas de cola negra (Cynomys ludovicianus), considerada especie clave en la dinámica de pastizales del Desierto Chihuahuense (Detling, 2013). Nuestro estudio aporta evidencia sobre cómo la implementación histórica de políticas públicas pudo modelar de forma positiva la diversidad beta de pastos no nativos y negativamente para los pastos nativos.
Los índices de disimilitud de diversidad βsor (tabla 1) revelaron que los pastos nativos y no nativos están caracterizados por un marcado reemplazo, que se explica por una ausencia de anidamiento a lo largo de los 3 periodos analizados. En cambio, las aves de pastizal cambian este patrón solo en el último periodo al aumentar el anidamiento. Este patrón sugiere que el impacto de las diferentes políticas de aprovechamiento de pastizales a lo largo del tiempo puede influir en la diversidad beta a nivel regional. El reemplazo de especies de pastos nativos y no nativos puede estar más vinculado a eventos de manejo que varían de manera diferencial en cada periodo (Chauvet-Sánchez, 1999; Hoth, 2012), además de otros procesos como los gradientes ambientales (Baselga, 2010).

Figura 4. Proyección del índice de prevalencia de pastos nativos (IPPN) sobre los sitios para cada periodo. La escala de colores corresponde a los valores de IPPN. Valores de 0 indican ensambles dominados completamente por pastos no nativos y 1 cuando dominan completamente los pastos nativos.
Por otro lado, los valores constantes de reemplazo en los 2 tipos de pastos a lo largo del tiempo, no necesariamente se asocian con procesos de homogeneización biótica, debido a la pérdida de especies de plantas nativas frente a las no nativas (Alignier y Baudry, 2016). Aunque esto puede ocurrir en un nivel alfa local, el nivel beta regional es imperceptible, como puede ser nuestro caso. Por ejemplo, se ha observado que los cambios en la diversidad taxonómica de pastizales a nivel alfa local se asocian con la presión por pastoreo, mientras que un nivel beta regional, la diversidad filogenética se asocia con gradientes ambientales, los cuales corresponden a procesos históricos y evolutivos (Wang et al., 2019). Aunque la diversidad filogenética no fue objeto de nuestro estudio, esta observación nos ayuda a entender por qué en nuestros conjuntos de especies no se logran apreciar cambios considerables a lo largo del tiempo, puesto que los periodos de estudio son relativamente cortos históricamente. En el caso de las aves de pastizal, el patrón de diversidad beta sugiere una homogenización de las comunidades, atribuible a la disminución de la disimilitud en el último periodo. Esto indica que las diferencias en la riqueza de especies entre los sitios también han disminuido, lo cual puede atribuirse al incremento del patrón de anidamiento a lo largo del tiempo detectado desde el periodo de 1965-1981. Estas evidencias pueden estar influenciadas por el incremento de la presión debido a la expansión de la ganadería a partir de 1965 (Chauvet-Sánchez, 1999; Hoth, 2012), ya que desde entonces existía un considerable sobrepastoreo de los pastizales del norte del país (CFAN, 1965).
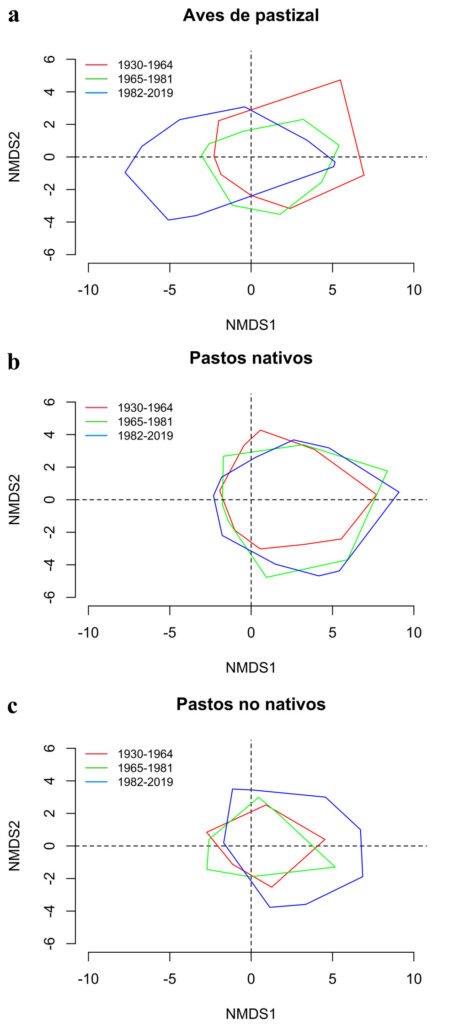
Figura 5. Análisis de escalamiento multidimensional no métrico (NMDS) de la composición de especies de a) aves de pastizal, b) pastos nativos y c) pastos no nativos. Los polígonos dentro de cada gráfico corresponden al espacio que ocupa la composición de especies en 2 dimensiones.
Periodo de 1930-1964
Nuestros resultados evidenciaron una mayor estabilidad en la riqueza estimada de aves de pastizal con respecto de los pastos nativos y no nativos en la región durante este periodo. Esto puede atribuirse en gran parte al amplio conocimiento taxonómico de las aves en México (Navarro-Sigüenza et al., 2014), pero también a que la selección de especies de aves de nuestro universo de análisis fue restringido y limitado a aquellas que dependen del pastizal para eventos clave de su ciclo de vida. Por otro lado, los pastos nativos tuvieron una mejor representación con respecto a los pastos no nativos. Al examinar la proyección del IPPN y los NMDS (figs. 4, 5b), es claro que la región estaba predominantemente conformada por ensambles de pastos nativos. La poca representación del ensamble de pastos no nativos pudo deberse a que algunas de las introducciones se dieron desde inicios del siglo XX, al ser originalmente introducidas en el suroeste de EUA (Herrera, 2001), por lo que su presencia pudo haberse pasado por alto en este periodo.
Se debe tener en cuenta que durante las décadas de 1930 y 1940, los esfuerzos gubernamentales estaban más centrados en establecer la tenencia de la tierra entre propiedad comunal y propiedad privada (González-Navarro, 1969), así como en recuperar los niveles de producción ganadera previos a la revolución de 1910 (de S. Lopes, 2008). La correlación significativa del IPPN y la riqueza de aves de pastizal, aunque baja y negativa, sugiere que el periodo en que se tiene la mayor prevalencia por parte de pastos nativos influyó poco sobre la riqueza de aves de pastizal del Desierto Chihuahuense. Se debe tener en cuenta que se introdujeron especies de pastos de manera directa en la región a partir de 1956 con la intención de mejorar la producción de forraje para el ganado por parte de la Oficina de Estudios Especiales del Gobierno de México (Ortega et al., 2013). Como incentivo adicional, durante este periodo se logró la consolidación de la práctica veterinaria pecuaria a nivel nacional con la erradicación de la fiebre aftosa en 1956 (Chauvet-Sánchez, 1999). Estos factores serían fundamentales para estimular la producción cárnica dentro de zonas de pastizales y serían la antesala de la expansión de pastos no nativos dentro del Desierto Chihuahuense.
Periodo de 1965-1981
La riqueza de especies estimada para el periodo 1965-1981 muestra que es cuando se detecta una mayor presencia de pastos no nativos en el Desierto Chihuahuense. Sin embargo, esto se refleja mínimamente en el IPPN (fig. 4) y en los análisis NMDS correspondientes a pastos no nativos. No obstante, se pudo observar que el ensamble de pastos en la región ya no está conformado únicamente por pastos nativos en todos los sitios (fig. 5b, c). Por su parte, el ensamble de aves de pastizal exhibe a nivel regional una contracción de su NMDS (fig. 5a), lo que implica una menor riqueza de aves de pastizal en varios sitios con respecto al periodo anterior.
Lo antes mencionado y la correlación negativa entre la riqueza de las aves de pastizal con el IPPN sugiere que durante el auge ganadero entre 1965 y 1981, se desencadenó un efecto que favoreció en algunos sitios la presencia de pastos no nativos, mientras que para las aves sucedió lo contrario. Esto coincide con lo observado en los pastizales centrales de EUA, donde la disminución de la diversidad de aves de tierras de cultivo se correlacionó con cambios significativos en las prácticas agrícolas entre 1966 y 1980 (Stanton et al., 2018). Además, por monitoreos estandarizados en gradientes de pastizal nativo en EUA (Wiens, 1973), se sabe que el grupo de aves de pastizal presentó la mayor pérdida poblacional atribuible al incremento de la agricultura y la urbanización en zonas de pastizal desde la década de 1970 (Rosenberg et al., 2019). Durante este periodo, varias zonas de pastizal sobrepastoreadas en el Desierto Chihuahuense presentaban erosión leve o avanzada, lo que provocó pérdida de hábitat (CFAN, 1965; Royo et al., 2005). En los últimos años de este periodo, comienzan a aparecer investigaciones que analizan el impacto de estas especies como malezas nocivas sobre el hábitat original (Espinosa-García y Villaseñor, 2017). Esto pudo ser una respuesta a la permisiva explotación de los pastizales durante la ganaderización de la agricultura en varias zonas de pastizal para la producción cárnica (Chauvet-Sánchez, 1999), incluido el Desierto Chihuahuense. Los pastos nativos parecen responder de manera diferente, ya que los NMDS (fig. 5b) muestran que con el tiempo se tiene una mejor representación del ensamble de especies al ir incrementado entre las 2 dimensiones, pese a que la producción cárnica durante el auge ganadero se mantuvo constante hasta la apertura comercial con el TLCAN en 1992 (Chauvet-Sánchez, 1999). Estos pueden ser efectos a largo plazo, atribuibles al auge ganadero (Chauvet-Sánchez, 1999), cuyo uso como recurso pudo haber sido generalizado y no exclusivo para el consumo del ganado.
Periodo de 1982-2019
Finalmente, la diversidad de especies observada en el periodo de 1982-2019 siguió la tendencia del periodo anterior siendo más alta en pastos nativos, seguida de pastos no nativos y aves de pastizal. Sin embargo, los pastos no nativos empiezan a alcanzar una estabilidad para el final del periodo, lo que puede ser resultado de la colaboración entre EUA y México para la conservación de los pastizales, así como del mejoramiento de las prácticas ganaderas dentro del Desierto Chihuahuense (Hoth, 2012). Pese a esto, la riqueza de pastos no nativos ha llegado a representar poco más de la tercera parte de la totalidad de especies de pastos que se pueden encontrar dentro del Desierto Chihuahuense.
Las curvas para los 3 periodos dentro de toda la región en general revelan el importante esfuerzo de registro taxonómico que se viene llevando desde principios del siglo XX, no solo en la región sino en todo territorio mexicano (Llorente-Bousquets y Ocegueda, 2008). Todas las pruebas “post-hoc” evidencian las discrepancias de este periodo con respecto a los anteriores en términos de riqueza de los 3 conjuntos de especies, así como del IPPN. No obstante, es importante considerar, sobre todo para las aves de pastizal, la mayor densidad de registros en la porción territorial norteamericana lo que pudo influir en que este periodo difiera en comparación con los anteriores. Sin embargo, la ausencia de correlación entre la riqueza de aves y el IPPN exhibe que la representación del ensamble de aves de pastizal no es una variable relacionada con el comportamiento del ensamble de pastos nativos. Esto sugiere la ausencia de un efecto sobre la riqueza de aves por la expansión de los pastos no nativos, aunque se ha detectado que los ensambles de aves presentan frecuentemente cambios en la abundancia relativa de las especies, pero no en la riqueza, en zonas homogenizadas por pastos no nativos (Harris et al., 2019), especialmente relacionados al reordenamiento de las abundancias y no al recambio en la riqueza de especies (Jones et al., 2017; Rosenberg et al., 2019).
La falta de correlación entre la riqueza de aves y el IPPN podría deberse a: 1) que las especies de aves tienen una mayor capacidad de persistir en cualquiera de las configuraciones de pastizal presentes dentro de la región (Ellis-Felege et al., 2013); 2) que su distribución es más amplia de la que abarca nuestra resolución, debido a que la región tiene conectividad con pastizales norteamericanos (Vickery et al., 1999) y 3) finalmente porque son un grupo biológico con alta capacidad de movilidad dentro de la región (Comer et al., 2018). La proyección del IPPN (fig. 4) y los NMDS correspondientes a pastos nativos y no nativos (fig. 5b, c) sugieren que el ensamble de pastos no nativos se encuentra en prácticamente los mismos sitios de pastizal nativo. Es posible que los pastos no nativos se hayan visto influenciados positivamente debido a que la constante degradación de los pastizales en la región por sobrepastoreo del periodo anterior, contribuyó a la expansión regional y que en parte, nuestros resultados son un reflejo de la enorme fragmentación del hábitat (Hoth, 2012).
Por otro lado, los esfuerzos de conservación en varias zonas de pastizal del Desierto Chihuahuense durante el periodo más reciente (APCP, 2010; Aguirre et al., 2007), en un inicio no fueron especialmente selectivos sobre las especies de pastos que conforman el hábitat, pudiendo contribuir al incremento en la riqueza de especies, tanto de pastos nativos como no nativos. En este sentido, una parte considerable del ensamble de pastos no nativos presentes en la región pudieron originarse de pastizales nativos degradados o bien de la deforestación de zonas con arbustos y árboles (Buisson et al., 2022). Por lo tanto, las especies de pastos no nativos se establecieron aleatoriamente en toda la región a partir de tierras agrícolas (Rzedowski y Calderón, 1990; Rzedowski et al., 1995). Esta expansión produjo ensambles de pastos más reducidos en cada sitio en comparación con zonas con pastos nativos (Flanders et al., 2006), pero que finalmente, en la actualidad se deben considerar como parte de la flora de la región (Brown y Makings, 2014).
Nuestros resultados sugieren que la introducción de especies de pastos no nativos no fue un evento único y que el aumento en la presencia de estas especies, con el paso del tiempo, fue en los mismos sitios en los que se detectaron los pastos nativos, lo que denota la necesidad de priorizar los esfuerzos de conservación selectivos para los pastos nativos. Además, se requiere analizar si la cobertura de otros tipos de hábitat, como el incremento de matorrales espinosos sobre la configuración de pastizales en el Desierto Chihuahuense, ha cambiado dentro de la región.
Nuestros resultados indican cambios en la diversidad beta de aves de pastizal, de pastos nativos y de pastos no nativos a nivel regional. Considerando la resolución espacial y temporal utilizada en este estudio, nuestros análisis sugieren que estos cambios pueden ser atribuibles a las diferentes políticas económicas de cada periodo. No obstante, se destaca la importancia de analizar a las especies de pastos no nativos en un nivel de diversidad alfa, con énfasis en una posible respuesta de los ensambles de aves de pastizal, posiblemente asociada a las particularidades de cada comunidad. También subrayamos la necesidad de identificar sitios prioritarios para la gestión y conservación selectiva de pastos nativos en zonas de pastizal con el objetivo de mitigar posibles alteraciones en el ensamble de aves de pastizal en la región.
Agradecimientos
El presente artículo forma parte de los requisitos para la obtención del grado de Doctor de MP-M en el programa de posgrado de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana, quien cuenta con una beca del Conahcyt (CVU 718731). Agradecemos el apoyo financiero del programa PAPIIT-UNAM IN214621 (a AGN-S) y Proyecto UAM 143.05.27 (a PLV). A Alejandro Gordillo, Alexander Llanes, Ronald Fernández, Reinhard Matadamas, Rodolfo Flores, Itzel Estrada, José Zazueta, Carlos Lara y dos revisores anónimos, por su apoyo logístico y valiosos comentarios durante el desarrollo de esta investigación. LES-R agradece a DGAPA-UNAM por la beca posdoctoral.
Referencias
Aguirre, C., Hoth, J. y Lafón, A. (Eds.). (2007). Estrategia para la Conservación de Pastizales del Desierto Chihuahuense (ECOPAD). Repórte técnico. https://doi.org/10.13140/RG.2.
2.36081.74089
Alignier, A. y Baudry, J. (2016). Is plant temporal beta diversity of field margins related to changes in management practices? Acta Oecologica, 75, 1–7. http://dx.doi.org/10.1016/j.actao.
2016.06.008
Almeida-Neto, M., Frensel D. M. B. y Ulrich, W. (2011). Rethinking the relationship between nestedness and beta diversity: a comment on Baselga (2010). Global Ecology and Biogeography, 21, 772–777. https://doi.org/10.1111/j.
1466-8238.2011.00709.x
APCP (Áreas Prioritarias de Conservación Pastizal). (2010). Comisión para Cooperación Ambiental (CCA). http://www.cec.org/es/atlas-ambiental-de-america-del-norte/areas-pri
oritarias-de-conservacion-pastizales-2010/
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143. https://doi.org/10.1111/j.1466-82
38.2009.00490.x
Baselga, A. y Orme, C. D. L. (2012). betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Baselga, A., Orme, D., Villeger, S., De Bortoli, J., Leprieur, F., Logez, M. et al. (2018). Package ‘betapart’: Partitioning Beta Diversity into Turnover and Nestedness Components. Ver 1.5. 1. CRAN.
Brennan, L. A. y Kuvlesky Jr., W. P. (2005). North American grassland birds: an unfolding conservation crisis? The Journal of Wildlife Management, 69, 1–13. https://doi.org/10.2193/0022-541X(2005)069<0001:NAGBAU>2.0.CO;2
Brown, D. E. y Makings, E. (2014). Desert plants. Tucson:The University of Arizona for the Boyce Thompson Arboretum.
Buisson, E., Archibald, S., Fidelis, A. y Suding, K. N. (2022). Ancient grasslands guide ambitious goals in grassland restoration. Science, 377, 594–598. https://doi.org/10.1126/science.abo4605
Calderón-Patrón, J. M. y Moreno, C. E. (2019). Diversidad beta basada en índices de disimilitud: Su partición en componentes de recambio y diferencias en riqueza. En C. E. Moreno (Ed.), La biodiversidad en un mundo cambiante: fundamentos teóricos y metodológicos para su estudio (pp. 203–222). Ciudad de México: Universidad Autónoma del Estado de Hidalgo/ Libermex.
Guo, B., Cortázar-Martínez, A. y Ayala-Garay, A. V. (2010). Competitividad de la ganadería bovina de carne en México. En B. A. Cavallotti-Vázquez, C. F. Marcof-Álvarez y B. Ramírez-Valverde (Eds.), Los grandes retos para la ganadería: hambre, pobreza y crisis ambiental. (pp. 3–14). Estado de México: Universidad Autónoma Chapingo. México.
Cervantes-Sánchez, J. M. y Román de Carlos, A. M. (2001). Consecuencias de la epizootia de la fiebre aftosa en la medicina veterinaria y la zootecnia mexicanas (1946–1955). Imagen Veterinaria, 1, 17–20.
CFAN (Consejo de Fomento Agropecuario del Norte de México). (1965). Estudio integral preliminar sobre la ganadería de la zona norte de la República Mexicana. Tomo IV. Ciudad de México: Consejo de Fomento Agropecuario del Norte de México/ COPARMEX.
Challenger, A. (1998). Utilización y conservación de los ecosistemas terrestres de México: pasado, presente y futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Instituto de Biología, UNAM/ Agrupación Sierra Madre. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Challenger, A. y Soberón, J. (2009). Los ecosistemas terrestres. En J. Soberón, G. Halffter y J. Llorente-Bousquets (Eds.), Capital natural de México, Vol. 1. Conocimiento actual de la biodiversidad (pp. 88–105). Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Chamberlain, D. E., Fuller, R. J., Bunce, R. G., Duckworth, J. C., y Shrubb, M. (2000). Changes in the abundance of farmland birds in relation to the timing of agricultural intensification in England and Wales. Journal of Applied Ecology, 37, 771–788. https://doi.org/10.1046/j.1365-2664.2000.00548.x
Chaneton, E. J., Perelman, S. B., Omacini, M. y León, R. J. (2002). Grazing, environmental heterogeneity, and alien plant invasions in temperate Pampa grasslands. Biological Invasions, 4, 7–24.
Chauvet-Sánchez, M. (1999). La ganadería bovina de carne en México: del auge a la crisis. México D.F.: Universidad Autónoma Metropolitana.
Chesser, R. T., Billerman, S. M., Burns, K. J., Cicero, J. C., Dunn, L., Hernández-Baños, B. E. et al. (2022). Check-list of North American birds. American Ornithological Society. Recuperado 19 diciembre, 2022 de: https://checklist.americanornithology.org/taxa/
Colwell, R. K. (2013). Estimates: statistical estimation of species richness and shared species from samples. Version 9. User’s Guide and Application.
Comer, P. J., Hak, J. C., Kindscher, K., Muldavin, E. y Singhurst, J. (2018). Continent-scale landscape conservation design for temperate grasslands of the Great Plains and Chihuahuan Desert. Natural Areas Journal, 38, 196–211. https://doi.org/10.3375/043.038.0209
Davis, M. A. (2003). Biotic globalization: does competition from introduced species threaten biodiversity? Bioscience, 53, 481–489. https://doi.org/10.1641/0006-3568(2003)053[0481:
BGDCFI]2.0.CO;2
del Val, E., Balvanera, P., Castellarini, F., Espinosa-García, F. J., Murguía, M. y Pacheco, C. (2015). Identifying areas of high invasion risk: a general model and an application to Mexico. Revista Mexicana de Biodiversidad, 86, 208–216. https://doi.org/10.7550/rmb.44743
Desmond, M. y Montoya, J. A. (2006). Status and distribution of Chihuahuan Desert grasslands in the United States and Mexico. En X. Basurto y D. Hadley (Eds.), Grasslands ecosystems, endangered species, and sustainable ranching in the Mexico-US borderlands: Conference proceedings. RMRS-P-40 (pp. 17–25). Fort Collins, CO: US Department of Agriculture, Forest Service, Rocky Mountain Research Station.
Detling, J. K. (2013). Do prairie dog compete with livestock? En J. Hoogland (Ed.), Conservation of the black-tailed prairie dog: saving North America’s western grasslands (pp. 65–88). Washington D.C.: Island Press.
Ellis-Felege, S. N., Dixon, C. S. y Wilson, S. D. (2013). Impacts and management of invasive cool-season grasses in the Northern Great Plains: challenges and opportunities for wildlife. Wildlife Society Bulletin, 37, 510–516. https://doi.org/10.1002/wsb.321
Eskelinen, A. y Harrison, S. (2015). Erosion of beta diversity under interacting global change impacts in a semi-arid grassland. Journal of Ecology, 103, 397–407. https://doi.org/10.1111/1365-2745.12360
Espinosa-García, F. J. y Villaseñor, J. L. (2017). Biodiversity, distribution, ecology and management of non-native weeds in Mexico: a review. Revista Mexicana de Biodiversidad, 88, 76–96. https://doi.org/10.1016/j.rmb.2017.10.010
Flanders, A. A., Kuvlesky Jr, W. P., Ruthven III, D. C., Zaiglin, R. E., Bingham, R. L., Fulbright, T. E. et al. (2006). Effects of invasive exotic grasses on south Texas rangeland breeding birds. The Auk, 123, 171–182. https://doi.org/10.1093/auk/
123.1.171
George, A. D., O’Connell, T. J., Hickman, K. R. y Leslie Jr, D. M. (2013). Food availability in exotic grasslands: a potential mechanism for depauperate breeding assemblages. The Wilson Journal of Ornithology, 125, 526–533. https://doi.org/10.1676/13-003.1
Gibson, D. J. (2009). Grasses and grassland ecology. Nueva York: Oxford University Press.
González-Medrano, F. (2012). Las zonas áridas y semiáridas de México y su vegetación. México D.F.: Instituto Nacional de Ecología.
González-Navarro, M. (1969). La tenencia de la tierra en México. Cahiers du monde hispanique et luso-brésilien, 12, 115–134.
Govaerts, R. (2022). The World Checklist of Vascular Plants (WCVP). En O. Bánki, Y. Roskov, M. Döring, G. Ower, L. Vandepitte, D. Hobern et al. (Eds.), Catalogue of Life Checklist (10.0). Kew: The Royal Botanic Gardens. https://doi.org/10.48580/dfqt-4nz
Guo, Q., Qian, H., Ricklefs, R. E. y Xi, W. (2006). Distributions of exotic plants in eastern Asia and North America. Ecology Letters, 9, 827–834. https://doi.org/10.1111/j.1461-0248.2006.
00938.x
Hamilton, J. G., Holzapfel, C. y Mahall, B. E. (1999). Coexistence and interference between a native perennial grass and non-native annual grasses in California. Oecologia, 121, 518–526. https://doi.org/10.1007/s004420050958
Harris, M. A., Greve, M., Voysey, M. D. y Jamison, S. L. (2019). Changes in bird assemblages because of vegetation homogenisation in communal livestock systems. Koedoe: African Protected Area Conservation and Science, 61, 1–18. https://doi.org/10.4102/koedoe.v61i1.1543
Hejda, M., Pyšek, P. y Jarošík, V. (2009). Impact of invasive plants on the species richness, diversity and composition of invaded communities. Journal of Ecology, 97, 393–403. https://doi.org/10.1111/j.1365-2745.2009.01480.x
Herrera, Y. (2001). Las gramíneas de Durango. Durango, México: Instituto Politécnico Nacional/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Editorial Filo de Agua.
Hollander, M. y Wolfe, D. A. (1973). Nonparametric statistical methods. New York: John Wiley and Sons.
Hoth, J. (2012). Buenas prácticas ganaderas en México. Montreal: Comisión para la Cooperación Ambiental de América del Norte (CCA).
Joner, F., Giehl, E. L. y Pillar, V. D. (2021). Functional and taxonomic alpha and beta diversity responses to burning grasslands in southern Brazil. Journal of Vegetation Science, 32, e13060. https://doi.org/10.1111/jvs.13060
Jones, S. K., Ripplinger, J. y Collins, S. L. (2017). Species reordering, not changes in richness, drives long-term dynamics in grassland communities. Ecology Letters, 20, 1556–1565. https://doi.org/10.1111/ele.12864
Kloke, J., McKean, J. W. y McKean, J. W. (2015). Nonparametric statistical methods using R. Boca Raton: CRC Press.
Legendre, P. (2019). A temporal beta-diversity index to identify sites that have changed in exceptional ways in space–time surveys. Ecology and Evolution, 9, 3500–3514. https://doi.org/10.1002/ece3.4984
Levandoski, G. y Panjabi, A. (2014). Las aves de pastizal. En Conabio (Ed.), La biodiversidad en Chihuahua: estudio de estado (pp. 128–134). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Llanes-Quevedo, A., Sánchez-Ramos, L. E. y Navarro-Sigüenza, A. G. (2024). Patrones históricos y actuales de diversidad y relaciones biogeográficas de la avifauna residente de los bosques tropicales de México. Revista Mexicana de Biodiversidad, 95, e955341. https://doi.org/10.22201/ib.2007
8706e.2024.95.5341
Llorente-Bousquets, J. y Ocegueda, S. (2008). Estado del conocimiento de la biota. En Conabio (Ed.), Capital natural de México, Vol. I. Conocimiento actual de la biodiversidad (pp. 283–322). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Macías-Duarte, A., Montoya, A. B., Méndez-González, C. E., Rodríguez-Salazar, J. R., Hunt, W. G. y Krannitz, P. G. (2009). Factors influencing habitat use by migratory grassland birds in the state of Chihuahua, Mexico. The Auk, 126,
896–905. https://doi.org/10.1525/auk.2009.08251
Macías-Duarte, A., Panjabi, A. O., Strasser, E. H., Levandoski, G. J., Ruvalcaba-Ortega, I., Doherty, P. F. et al. (2017). Winter survival of North American grassland birds is driven by weather and grassland condition in the Chihuahuan Desert. Journal of Field Ornithology, 88, 374–386. https://doi.org/10.1111/jofo.12226
Melgoza-Castillo, A., Balandrán Valladares, M. I., Mata-González, R. y Pinedo Álvarez, C. (2014). Biología del pasto rosado Melinis repens (Willd.) e implicaciones para su aprovechamiento o control: Revisión. Revista Mexicana de Ciencias Pecuarias, 5, 429–442.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Townsend-Peterson, A., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85 (Suplem.), S476–S495. https://doi.org/10.7550/rmb.41882
Ortega, S. J. A., Ibarra-Flores, F. A., Melgoza, A., González-Valenzuela, E. A., Martin-Rivera, M. H., Ávila-Curiel, J. M. et al. (2013). Exotic grasses and wildlife in northern Mexico. Wildlife Society Bulletin, 37, 537–545. https://doi.org/10.1002/wsb.325
Palacio, F. X., Apodaca, M. J. y Crisci, J. V. (2020). Análisis multivariado para datos biológicos: teoría y su aplicación utilizando el lenguaje R. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara.
Pavlacky Jr, D. C., Green, A. W., George, T. L., Iovanna, R., Bartuszevige, A. M., Correll, M. D. et al. (2022). Landscape-scale conservation mitigates the biodiversity loss of grassland birds. Ecological Applications, 32, e2548. https://doi.org/10.1002/eap.2548
Pyšek, P., Jarošík, V., Hulme, P. E., Pergl, J., Hejda, M., Schaffner, U. et al. (2012). A global assessment of invasive plant impacts on resident species, communities and ecosystems: the interaction of impact measures, invading species’ traits and environment. Global Change Biology, 18, 1725–1737. https://doi.org/10.1111/j.1365-2486.2011.02636.x
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2022). Vegan. Community Ecology Package: Ordination, Diversity and Dissimilarities. 3.4.
Qian, H. y Ricklefs, R. E. (2006). The role of exotic species in homogenizing the North American flora. Ecology Letters, 9, 1293–1298. https://doi.org/10.1111/j.1461-0248.
2006.00982.x
Qian, H. (2008). A latitudinal gradient of beta diversity for exotic vascular plant species in North America. Diversity and Distributions, 14, 556–560. https://doi.org/10.1111/j.1472-
4642.2008.00466.x
Rojas-Soto, O. R., Alcántara-Ayala, O. y Navarro-Sigüenza, A. G. (2003). Regionalization of the avifauna of the Baja California Peninsula, Mexico: a parsimony analysis of endemicity and distributional modelling approach. Journal of Biogeography, 30, 449–461. https://doi.org/10.1046/j.1365-
2699.2003.00836.x
Rosenberg, K. V., Dokter, A. M., Blancher, P. J., Sauer, J. R., Smith, A. C., Smith, P. A. et al. (2019). Decline of the North American avifauna. Science, 366, 120–124. https://doi.org/
10.1126/science.aaw1313
Royo, M., Melgoza, A., Santos, J. S., Carrillo, R., Jurado, P., Gutiérrez, R. et al. (2005). La salud de los pastizales medianos en los estados de Chihuahua y Zacatecas. II Simposio Internacional de Manejo de Pastizales. Memorias. Zacatecas, México.
Ruvalcaba-Ortega I. y Panjabi, A. O. (2018). Aves de pastizal del Desierto Chihuahuense. En Conabio (Ed.), La biodiversidad en Coahuila. Estudio de Estado, vol. II. (pp. 375–384). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Coahuila de Zaragoza.
Rzedowski, J. y Calderón, de R. G. (1990). Nota sobre el elemento africano en la flora adventicia de México. Acta Botanica Mexicana, 12, 21–24. https://doi.org/10.21829/abm12.1990.602
Rzedowski, J., Calderón, de R. G. y Galván, R. (1995). Los pastizales calcífilos del estado de Guanajuato. Flora del Bajío y de Regiones Adyacentes. Fascículo Complementario IX. Pátzcuaro, Mich.: Instituto de Ecología, A.C. – Centro Regional del Bajío.
de S. Lopes, M. A. (2008). Revolución y ganadería en el norte de México. Historia Mexicana, 57, 863–910. https://www.jstor.org/stable/25139806
Sánchez-Ken, J. G., Zita-Padilla, G. A. y Mendoza-Cruz, M. (2012). Catálogo de las gramíneas malezas nativas e introducidas de México. México D.F.: Conacofi.
Sánchez-Ramos, L. E., Gordillo-Martínez, A., Gutiérrez-Arellano, C. R., Kobelkowsky-Vidrio, T., Ríos-Muñoz, C. A. y Navarro-Sigüenza, A. G. (2018). Bird diversity patterns in the Nuclear Central American Highlands: a conservation priority in the Northern Neotropics. Tropical Conservation Science, 11, 1940082918819073. https://doi.org/10.1177/1940082918819073
Savage, J. M. (1982). The enigma of the Central American herpetofauna: dispersals or vicariance? Annals of the Missouri Botanical Garden Press, 69, 464–547. https://doi.org/10.2307/2399082
Stanton, R. L., Morrissey, C. A. y Clark, R. G. (2018). Analysis of trends and agricultural drivers of farmland bird declines in North America: A review. Agriculture, Ecosystems & Environment, 254, 244–254. https://doi.org/10.1016/j.agee.
2017.11.028
Szentes, S., Sutyinszki, Z., Szabó, G., Zimmermann, Z., Házi, J., Wichmann, B. et al. (2012). Grazed Pannonian grassland beta-diversity changes due to C4 yellow bluestem. Central European Journal of Biology, 7, 1055–1065.
Valenzuela-Núñez, L. M., Mojica-Guerrero, A. S., González-Barrios, J. L. y Trucíos-Caciano, R. (2009). Evolución del matorral en el sur del Área Natural Protegida Sierra de Lobos, Guanajuato. Tecnociencia Chihuahua, 3, 131–137.
Vellend, M. (2010). Conceptual synthesis in community ecology. The Quarterly Review of Biology, 85, 183–206. https://doi.org/10.1086/652373
Vickery, P. D., Tubaro, P. L., Cardoso-da Silva, J. M., Peterjohn, B. G., Herkert, J. R. y Cavalcanti, R. B. (1999). Conservation of grassland birds in the Western Hemisphere. Studies in Avian Biology, 19, 2–26.
Wang, Y., Wang, J., Chen, C., Li, J. y Chu, J. (2019). Grazing plays an important role in structuring alpha and beta components of taxonomic, functional, and phylogenetic diversity in semiarid sandy land of northern China. Global Ecology and Conservation, 20, e00790. https://doi.org/10.1016/j.gecco.
2019.e00790
Weaver, T., Payson, E. M. y Gustafson, D. L. (1996). Prairie ecology —the shortgrass prairie. En F. B. Samson y F. L. Knopf (Ed.), Prairie Conservation. Washington D.C.: Island Press.
Wied, J. P., Perotto-Baldivieso, H. L., Conkey, A. A., Brennan, L. A. y Mata, J. M. (2020). Invasive grasses in South Texas rangelands: historical perspectives and future directions. Invasive Plant Science and Management, 13, 41–58.
Wiens, J. A. (1973). Pattern and process in grassland bird communities. Ecological Monographs, 43, 237–270. https://doi.org/10.2307/1942196
Wiken, E., Jiménez-Nava, F. y Griffith, G. (2011). North American terrestrial ecoregions —Level III. Montreal, Canada: Commission for Environmental Cooperation.
Wright, S. P. (1992). Adjusted p-values for simultaneous inference. Biometrics, 48, 1005–1013. https://doi.org/10.2307/2532694
Zar, J. H. (2010). Biostatistical analysis. Upper Saddle River, New Jersey: Pearson Education Inc.
Żmihorski, M., Pärt, T., Gustafson, T. y Berg, Å. (2016). Effects of water level and grassland management on alpha and beta diversity of birds in restored wetlands. Journal of Applied Ecology, 53, 587–595. https://doi.org/10.1111/1365-2664.12588
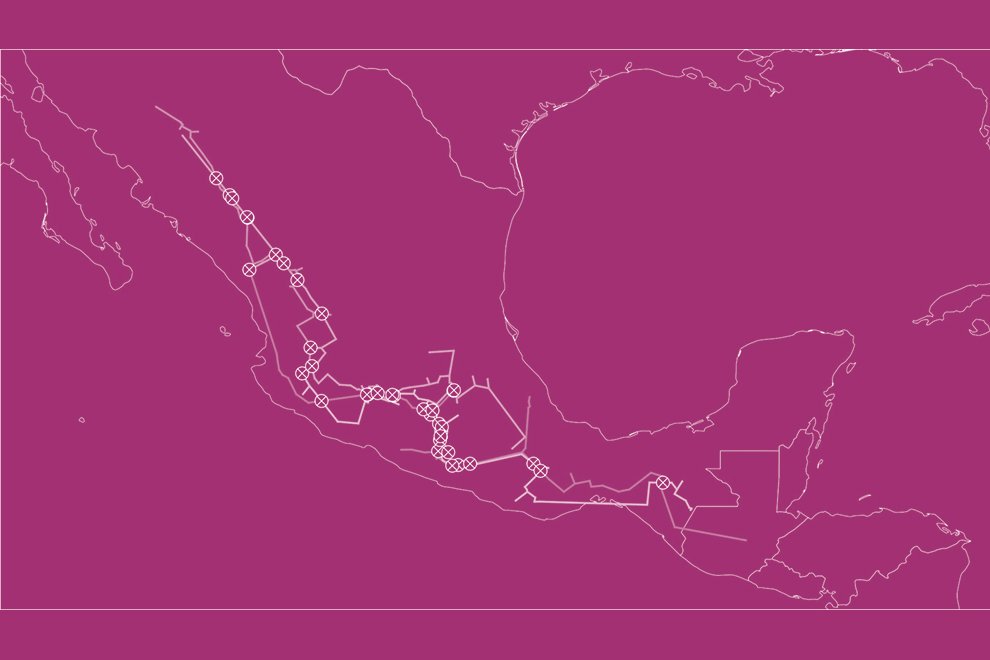
Panbiotracks: software for track analysis
Carlos Fernando Castillo-García a, b, Juan J. Morrone c, Isaías Hazarmabeth Salgado-Ugarte a, David Espinosa a, *
a Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Zaragoza, Batalla del 5 de mayo s/n, Ejército de Oriente Zona Peñón, Iztapalapa, 09230 Ciudad de México, Mexico
b Universidad Nacional Autónoma de México, Posgrado en Ciencias Biológicas, Unidad de Posgrado, Edificio D, 1er. Piso, Circuito de Posgrados, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, Mexico
c Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Biología Evolutiva, Museo de Zoología “Alfonso L. Herrera”, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, Mexico
*Corresponding author: despinos@unam.mx (D. Espinosa)
Received: 22 January 2024; accepted: 25 February 2025
Abstract
A software program for undertaking track analysis named Panbiotracks is introduced. It aims to solve various issues that currently are present in similar software packages. Panbiotracks is intended: 1) to be a fast, accurate, and reliable tool to generate individual tracks, generalized tracks and panbiogeographical nodes; 2) to solve the dependency on old and obsolete software that other packages have; and 3) to be a free and open source program that can be used in a variety of environments and that can be updated, modified, and improved continuously.
Keywords: Panbiogeography; Track analysis; Python; Software; Systematics
Panbiotracks: programa para análisis de trazos
Resumen
Se presenta un programa para llevar a cabo el análisis de trazos llamado Panbiotracks. Su objetivo es resolver varios problemas que están presentes en paquetes de software similares. Panbiotracks intenta: 1) ser una herramienta rápida, precisa y confiable para generar trazos individuales, trazos generalizados y nodos panbiogeográficos; 2) resolver la dependencia en software anticuado y obsoleto que tienen otros paquetes; y 3) ser un programa libre y de código abierto que pueda ser utilizado en una variedad de entornos y que puede ser actualizado, modificado y mejorado continuamente.
Palabras clave: Panbiogeografía; Análisis de trazos; Python; Software; Sistemática
Introduction
Biological evolution is closely linked to geological history. In the second half of the past century, León Croizat developed a new theoretical approach that he called “panbiogeography”. According to panbiogeography, the geographical distribution of taxa is mainly influenced by geological changes that lead to vicariance processes, where geographical barriers are the main cause of biota fragmentation, which in turn leads to speciation (Morrone, 2015).
Track analysis is panbiogeography’s primary methodological tool (Craw, 1988; Morrone, 2015). It is based on the spatial congruence between tracks, which are geometrical representations of taxon distribution. The 3 components of track analysis are individual tracks, generalized tracks, and panbiogeographical nodes (Morrone, 2015; Page, 1987). An individual track (Fig. 1a-d) is the basic unit of a panbiogeographical analysis, and is defined as an open, non-cyclic graph, also known as a minimum spanning tree (MST), whose vertices represent the geographical locations of the taxon, and the edges are the shortest paths that connect each of them. Mathematically speaking, it is a graph with n localities that are connected through n-1 edges, and whose total length is the shortest possible (Page, 1987). It can be thought of as a graphical representation of the main coordinates of a taxon in space. The basic method to draw an individual track consists of selecting a random locality and linking it to the nearest one using a straight line, then connecting both to another one, also the nearest, and repeating these steps until all the localities are connected, but without any loop between any of them. The most straightforward way to automate this is by building an adjacency matrix to find the edges, then saving the track to a file. However, some difficulty arises when measuring the distances between points, because this needs to be done considering the shape of the earth. There are multiple methods to do this, which are explained with more detail in the Algorithms subsection.
A generalized track (Fig. 1e) is a graph built from the statistically significant superposition between 2 or more individual tracks from different taxa, and it represents the history of ancestral biotas that were fragmented in the past (Craw, 1988; Morrone, 2015). However, there isn’t a formalized implementation of this concept, resulting in multiple methods that can be used to quantify it, like Parsimony Analysis of Endemicity (PAE) (Morrone, 2014; Rosen, 1988), Track Compatibility Analysis (Craw, 1988, 1989), or geometrical methods. A major issue is the difficulty of automating the process to find the generalized tracks, since the superposition between individual tracks cannot be calculated easily. Some programs, like MartiTracks (Echeverría-Londoño & Miranda-Esquivel, 2011), have approached the problem from a purely geometrical standpoint, using distances between segments to decide whether they are congruent with each other or not, but the results have not been satisfactory (Ferrari et al., 2013). The software Trazos2004 (Rojas-Parra, 2007) also uses a geometrical method, where the program finds the intersections between individual tracks and builds a generalized track from those intersections. This method does not follow the formal definition of a generalized track, since it considers only the superpositions between tracks and ignores those cases where 2 segments may be very close to each other, but without overlapping, which could also be considered as spatial congruence (Zunino & Zullini, 2003; Morrone, 2015). Even then, this method is fast and can be used to get an overall congruence approximation, since in many cases the generalized tracks obtained will reflect a general degree of similarity between individual tracks. To differentiate this approach from others, we opted to refer to the generalized tracks obtained by this method as “internal generalized tracks” (IGT).
A panbiogeographical node (Fig. 1f), marked by the superposition between the terminal segments of 2 or more generalized tracks, indicates the location of a complex area of tectonic or biotic convergence (Craw, 1988; Morrone, 2015); however, this concept may have multiple interpretations. Heads (2004) mentions that a node might represent the location of endemism, high diversity, distribution boundaries, areas of disjunction and “anomalous” absences, but also states that there are more meanings to it than these. One problem arises from the existing ways to quantify a node. As mentioned, a node is located at the ends of a generalized track, or more specifically, where 2 terminal vertices (those that are connected only to another vertex) from different generalized tracks overlap. However, other authors had considered the intersections between individual tracks, or the intersections between non-terminal segments of 2 or more generalized tracks, as nodes (Grehan, 2001; Henderson, 1989). Morrone (2015) mentions that, to avoid confusion, the former might be called “individual nodes” and the latter “generalized nodes”. In this regard, panbiogeographical nodes can be considered as a subset of generalized nodes, since the latter accounts for all the intersections between generalized tracks, while the former takes into account only those that occur at the terminal segments of generalized tracks. This means that a tool that finds generalized nodes can be used to find panbiogeographical nodes, if only those that fulfill the proper definition will be counted. Out of the 3 concepts, nodes have received the least attention from a computational point of view, possibly because the process to limit the search of the intersections between tracks to only those that happen at the terminal segments has not been properly explored.
Figure 1. Panbiogeography’s main components. a-d) Individual tracks; e) generalized tracks; f) panbiogeographical node. Maps by CF Castillo-García.
The usefulness of panbiogeography and track analysis has been questioned many times, mainly regarding its ability to generate meaningful results about the evolution of species through space and time (Seberg, 1986; Waters et al., 2013). Others have criticized how track analysis is done, like the criteria used for track orientation (Seberg, 1986), or the lack of a true quantitative process to obtain generalized tracks and nodes (Ferrari et al., 2013). However, many studies have used the panbiogeographical method to identify distributional patterns of many taxa, like mammals (Escalante et al., 2018; Florentin et al., 2016), mollusks (Aguilar-Estrada & Morrone, 2022; López et al., 2022), plants (García-Díaz et al., 2023; Puga-Jiménez et al., 2013), birds (Beauchamp, 1989), fungi (González-Ávila et al., 2017), arthropods (Maya-Martínez et al., 2011), and fossil taxa (Gallo et al., 2013; Hernández-Cisneros & Vélez-Juarbe, 2021). The ability to detect ancestral biotas through generalized tracks and nodes has been mentioned by other researchers and panbiogeography has also been considered useful from other points of view, such as searching for areas of biological complexity like areas of endemism and priority conservation areas (Craw et al., 1999; Escalante et al., 2018; Miguel-Talonia & Escalante, 2013; Morrone, 2015). Because of this, we consider that the development and improvement of new methods and tools for track analysis are important and should be continued.
In recent times, several software packages have been published to automate track analysis using different algorithms and programming languages to calculate both the MSTs and the superposition between tracks and nodes. Some of them, like Trazos2004 (Rojas-Parra, 2007), Croizat (Cavalcanti, 2009), and fossil (Vavrek, 2011), use Prim’s algorithm (Sedgewick & Wayne, 2011). PASSaGE (Rosenberg & Anderson, 2011) uses its own algorithm, while SAM (Rangel et al., 2010) and MartiTracks (Echeverría-Londoño & Miranda-Esquivel, 2011) do not specify which algorithm they use. A list of the aforementioned software packages and the algorithms used by each is presented in Table 1. These programs, however, suffer from one or various of several issues: lack of documentation about what internal methods or algorithms they use, lack of accuracy in their results (Escalante et al., 2017, 2018), dependency on obsolete and unsupported software, difficulty in obtaining or reviewing their source code to improve or modify it, and lack of support for different operating systems other than Microsoft Windows and, sometimes, Apple macOS.
Table 1
Comparison between different software packages for performing track analysis and their algorithms.
| Program | Algorithms used | Measuring distance method | Platform |
| Croizat | Prim (1957), Bron and Kerbosch (1973), Wormwald (1984) | Not specified | Windows, macOS, Linux |
| Fossil | Not specified | Not specified | Independent |
| MartiTracks | Proprietary | Not specified | Windows, Linux |
| PASSaGE | Proprietary | Proprietary | Windows, macOS, Linux |
| SAM | Not specified | Not specified | Windows |
| Trazos2004 | Prim (1957) | Bessel formulae | Windows |
Panbiotracks
Panbiotracks is a Python program for track analysis that aims to overcome some of the issues mentioned above, namely the accuracy of results, dependency on obsolete software, analysis speed, and portability between operating systems. Panbiotracks addresses these issues in the following manner: 1) Accuracy and speed, by using an improved set of functions, Panbiotracks generates results in a shorter time and in more accurately than its predecessors. Moreover, since its code is smaller and is based on modern tool kits, it can be updated and improved faster than other solutions. 2) Dependency on obsolete software, since Panbiotracks uses modern releases of the Python programming language and its code is constantly reviewed to ensure that it can be used with newer versions, it is guaranteed that it will not be made obsolete in the short term. Additionally, its code can be ported to future versions of Python more easily. 3) Portability and compatibility, releases of Panbiotracks are published currently for the Windows and Linux operating systems, and a version for macOS is planned. Moreover, its source code is available publicly, which allows anyone to download it and build their own executable.
Technical information
Panbiotracks is programmed in the Python programming language version 3. It consists of one main command-line executable that can be configured at runtime to do different analyses by passing a flag that enables a particular function. Current functions are: -m I flag, generates individual tracks from a list of taxon names and localities, established by their geographical coordinates (latitude and longitude), and saves them to an ESRI shape file (SHP); -m P flag, generates an internal generalized track (IGT) from a set of individual tracks. It identifies the intersections between individual tracks and it marks the associated coordinates, then builds a new track based on those coordinates and saves it to an ESRI shape file (SHP); -m N flag, locates and identifies “generalized nodes”, which result from the intersections between 2 or more IGTs and saves them to an ESRI shape file (SHP).
Panbiotracks can be downloaded from its GitHub repository and its source code is freely available and licensed under the GNU General Public License version 3: https://github.com/cfnnmcg/panbiotracks
Algorithms
The first component of a track analysis is the individual track, which, according to Page (1987), is defined as a minimum spanning tree (MST) with n vertices and n-1 edges, that does not contain any loop, and whose total length (the sum of all of the lengths of its edges) is not greater than the length of any other graph built from the same vertices (Sedgewick & Wayne, 2011). To build an individual track, the starting point are presence records from the taxa to be evaluated, which will be treated as the vertices of the MST. To create the MST, Panbiotracks builds an adjacency matrix to save the list of the nodes and the connections between them, with as many rows and columns as there are localities in the input file. In an adjacency matrix, each row and column crossing represents a node, and the cells or intersections between them are the graph’s edges. In each cell there can be a numeric value indicating whether there is a connection between nodes or not. Since an MST is a weighted graph, that is, a graph whose edges have a length value, presences are coded with the length of each edge, while absences are coded with a zero (Table 2).
Table 2
Example of an adjacency matrix used by Panbiotracks to represent a MST.
| 1 | 2 | 3 | 4 | 5 | |
| 1 | 0 | 66.827884 | 450.588278 | 467.852057 | 67.569065 |
| 2 | 66.827884 | 0 | 486.027102 | 499.716705 | 1.152371 |
| 3 | 450.588278 | 486.027102 | 0 | 33.259944 | 487.176345 |
| 4 | 467.852057 | 499.716705 | 33.259944 | 0 | 500.858559 |
| 5 | 67.569065 | 1.152371 | 487.176345 | 500.858559 | 0 |
Since Earth is not a 2-dimensional plane but a spheroid, it is necessary to devise a method to calculate the correct minimal distances between localities. Several approximations have been used by many authors. Rojas-Parra (2007) used Bessel’s trigonometric formulae, which are somewhat similar to the haversine formula (Brummelen, 2013) in that they both calculate the distance between 2 points located over a sphere. In the software PASSaGE (Rosenberg & Anderson, 2011), the authors used a formula to measure the great circle distance over the earth’s surface. However, since the shape of our planet is not a perfect sphere, these methods can lead to inaccurate results. To address this issue, Panbiotracks makes use of Vincenty’s formulae (Vincenty, 1975), which take into account Earth’s spheroid shape, providing a more accurate distance measurement between points. Using this method, Panbiotracks calculates the distance in kilometers between each pair of localities and stores the result in the corresponding cell. To build properly the MST there are numerous algorithms; Prim’s (Prim, 1957) and Kruskal’s (Kruskal, 1956) algorithms are the most used (Graham & Hell, 1985). Panbiotracks uses Prim’s algorithm to build the MST from the adjacency matrix, where a random vertex is selected, then the program checks the distance between it and the others. The shortest distance is selected and the associated vertex added to a temporal matrix. The software then repeats the process until there are no remaining vertices. Finally, a function is used to draw the track from this matrix of vertices and distances and save it to a SHP file.
To build an internal generalized track (IGT), Panbiotracks starts from a set of individual tracks belonging to different taxa and, upon loading the files, the software removes any rows with duplicate data, based on the combination of the taxon name and its coordinates. This is done to ensure that no duplicate points are present. Then, it uses a function where each individual track is compared with all the others to assess if there is any overlapping point between them. An overlap is considered positive when any segment or segments from the first individual track superimpose with any other segment from the second individual track. When this happens, the program stores the point or points where the overlap take place, as well as their coordinates, in a list, then repeats the process for each of the other individual tracks until no more overlapping points are found. If a segment from one track coincides in its totality with another segment from another track, then their starting and ending vertices and the associated coordinates are added to the list. This list is then processed with the same algorithm as with the individual tracks, where the shortest distance between vertices is calculated, then a MST is built from that data and the IGT is saved to a SHP file.
To detect generalized nodes, Panbiotracks uses a modified version of the method used for the IGTs. First, it loads a set of 2 or more IGTs or generalized tracks into memory. A function to compare each track with all the others to find any intersecting point between them is used. This function will detect any overlapping points between segments and will store them and their coordinates in a list. Then another function is used to transform this set of points into a multi-point geometry. This geometry is then saved to a SHP file.
Input and output data
Panbiotracks is programmed with ease of use in mind, so its operation is straightforward. The initial input data needed to do a track analysis is a list of taxa and localities contained within a comma-separated (CSV) file that is loaded to Panbiotracks using the individual tracks flag. This file must have 3 columns: species, lat, and lon, with the taxon name, its latitude, and its longitude, respectively:
species,lat,lon
taxon_A,19.432637,-99.133205
taxon_A,19.1498,-99.0275
taxon_B,20.676215,-103.346979
taxon_B,21.00498,-102.9752
taxon_C,25.671798,-100.309384
taxon_C,24.61789,-98.762498
For IGT generation and node identification, the input data are SHP files containing tracks. The output data for all 3 functions are SHP files as well, containing MultiLineString data in the case of individual tracks and IGTs, and MultiPoint data in the case of nodes. Panbiotracks has been tested with CSV files containing thousands of records, with minimal memory impact and generating the corresponding individual tracks in less than 60 seconds. When computing IGTs or nodes, running time escalated according to the number of input files being evaluated, since the program needs to assess each possible combination of tracks.
Example analysis
To demonstrate the capabilities and use of Panbiotracks, an example analysis is presented. Detailed instructions and explanations about running and using the software can be found in the project’s documentation, available at the GitHub repository. For this example, occurrence data from the Global Biodiversity Information System (GBIF) were used, corresponding to several species of pine (genus Pinus) and oak (genus Quercus), mainly from the Mexican mountain ranges (GBIF.org, 2016a, 2016b), and totaling over 3 thousand records. These data were saved to a file named pinus_quercus_simplified.csv and formatted according to the example specified in the previous section. The following code block shows a sample of this file and its format:
species,lat,lon
Pinus_douglasiana,
20.358329999999999,-104.058329999999998
Pinus_douglasiana,
19.391670000000001,-103.325000000000003
Pinus_douglasiana,
24.074999999999999,-106.091669999999993
Pinus_herrerae,
18.800280000000001,-102.771109999999993
Pinus_herrerae,
16.191669999999998,-96.541669999999996
Pinus_herrerae,
16.263330000000000,-96.593329999999995
Quercus_crassifolia,
19.588110000000000,-99.404280000000000
Quercus_crassifolia,
19.823329999999999,-99.519999999999996
Quercus_crassifolia,
19.445830000000001,-101.346390000000000
Quercus_candicans,
19.228330000000000,-101.030000000000001
Quercus_candicans,
19.866109999999999,-97.700000000000003
Quercus_candicans,
19.844439999999999,-97.579719999999995
Quercus_laxa,
23.949439999999999,-105.064170000000004
Quercus_laxa,
22.533860000000001,-103.760930000000002
Quercus_laxa,
20.957500000000000,-99.336939999999998
…
Individual tracks
The CSV file is loaded into Panbiotracks using the following command, assuming that it is in the same directory as the program:
panbiotracks -m I -i ./pinus_quercus_simplified.csv -o ./pinus_quercus/
Where panbiotracks is the name of the executable program. Option -m I configures the individual tracks function. The -i flag defines the name of the input file and where it is located, and the -o flag defines the path where the individual tracks file or files will be saved. Panbiotracks generated a separate SHP file for each of the taxon names contained in the CSV file (Fig. 2). These files can be projected by any GIS software, like QGIS (Fig. 3).
Internal Generalized Tracks
To generate the IGTs, the individual tracks were first grouped based on their geographical proximity and record density (where the majority of records from a given species was located). For this example, we focused on 4 groups (Table 3), 2 from each genus, mainly located in the Sierra Madre Occidental (SMOcc), the Sierra Madre del Sur (SMS), and the Eje Volcánico Transversal (EVT). Pinus groups covered mainly the SMS and the SMOcc (Fig. 4), while Quercus groups spanned across the SMS, the EVT, and the SMOcc (Fig. 5). For each group, IGTs were built using a command similar to the following:
panbiotracks -m P -i ./pinus_quercus/Quercus_castanea.shp ./pinus_quercus/Quercus_crassifolia.shp ./pinus_quercus/Quercus_deserticola.shp ./pinus_quercus/Quercus_laxa.shp ./pinus_quercus/Quercus_subspathulata.shp -o ./pinus_quercus/igt/quercus_30_pac_smocc-evt.shp
Option -m P configures the program to build IGTs. The individual tracks files needed are defined after the -i flag and must be separated by spaces. After analyzing the individual tracks, Panbiotracks will save the IGT to the output file name defined after the -o flag. Please note that, unlike the command for individual tracks, the name defined here is not the name of the directory where you want to save the IGT, but the name of the file itself. This process is repeated for each IGT that needs to be done. As with the individual tracks, the SHP files of the IGTs can be projected in QGIS or other GIS software (Fig. 6).
Table 3
Table of the species used in the example analysis and their grouping.
| Genus | Group | Species |
| Pinus | SMS | P. devoniana, P. lawsonii, P. maximinoi, P. oocarpa, P. pringlei, P. rzedowskii |
| SMOcc | P. durangensis, P. engelmannii, P. jaliscana, P. leiophylla, P. lumholtzii, P. luzmariae, P. maximartinezii, P. praetermissa | |
| Quercus | SMOcc-EVT | Q. castanea, Q. crassifolia, Q. deserticola, Q. laxa, Q. subspathulata |
| SMOcc-SMS-EVT | Q. candicans, Q. elliptica, Q. insignis, Q. scytophylla, Q. urbani |
Generalized nodes
The 4 sets of individual tracks gave 4 IGTs, which were then loaded into Panbiotracks to find the generalized nodes between them. The syntax follows the same logic as the previous cases:
panbiotracks -m N -i ./pinus_quercus/igt/pinus_30_pac_smocc-sms.shp ./pinus_quercus/igt/quercus_30_pac_smocc-evt.shp ./pinus_quercus/igt/quercus_30_pac_smocc-sms-evt.shp -o ./pinus_quercus/gn/pinus30-smocc-sms_quercus30-smocc-evt-smocc-sms-evt
Where -m N configures the program to find generalized nodes. The rules to add the input and output files are the same as with the IGTs. In this case, each input path and file name (pinus_30_pac_smocc-sms.shp, quercus_30_pac_smocc-evt.shp, quercus_30_pac_smocc-sms-evt.shp) corresponds to an IGT and is separated from the others by a space, whereas the output file name is defined after the -o flag. As with the IGTs, the name corresponds to the actual file and not a directory. Panbiotracks will generate a single SHP file with all the generalized nodes in it (Fig. 7).
Figure 2. Individual tracks files generated by Panbiotracks.
Conclusions and future developments
Though many software tools exist for assisting panbiogeography’s track analysis, most of them are difficult to use, difficult to distribute, rely on outdated software or are outdated themselves, lack precision in their algorithms or results, their results are difficult to reproduce, or their development has been halted for more than a decade in some cases. Panbiotracks aims to solve those problems by using efficient algorithms in constant optimization, by developing methods that are fast and precise, and by using a modern software stack that is extensible, easy to implement, and potent.
Panbiotracks’ algorithm for building individual tracks is faster and, thanks to its use of Vincenty’s formulae, more precise. In tests with CSV files with more than 3 thousand records, Panbiotracks generated the corresponding individual tracks in less than thirty seconds. When compared with other programs, like Trazos2004 (Rojas-Parra, 2007), the tracks generated with Panbiotracks were more precise, meaning that the distances between their vertices were more accurately calculated, and they did not have issues in their construction of loops (closed segments within a track), problems that have been observed with Trazos2004.
Figure 3. Individual tracks generated by Panbiotracks. Top, individual tracks from Pinus data; bottom, individual tracks from Quercus data. Maps by CF Castillo-García.
As mentioned, the algorithm for generating IGTs finds any intersection between pair of tracks to get a list of vertices from which the IGT will be built. This same algorithm is used to find the generalized nodes within IGTs. This method has various advantages, like its speed and straightforward approach. An IGT is a type of generalized track that only takes into account “true” connections, that is, intersections between individual tracks. From this point of view, it can be said that an IGT is a form of generalized track with the least ambiguity, since an overlap can be identified without any uncertainty. Considering this, a tool that can identify and generate these features is very valuable and useful.
There are, however, some pending issues regarding the IGTs and the method to identify nodes. If we consider the formal definition of a generalized track, it is necessary to add improvements to the method used and allow the program to consider other degrees of congruence between individual tracks besides the direct superposition. For example, with the current method, segments of individual tracks that are very close to each other but that do not intersect, will not be marked as part of the generalized track. This can lead to the dismissal of areas where 2 or more taxa share a similar evolutionary path, which can be represented by a generalized track, but since they do not overlap, the program does not consider their congruence. An example of this can be seen in Figure 4a, where the 2 westernmost segments are almost parallel, but the algorithm does not count them for the IGT (Fig. 6a). A potential solution is to add an option to define a buffer or area of influence around the individual tracks, and use that to compute the generalized track, but this method requires more testing to be implemented properly. There are other methods that are currently being researched for their inclusion in Panbiotracks. One is the Fréchet distance, which measures the degree of similarity between curves (Alt & Godau, 1995; Aronov et al., 2006). Another is the Hausdorff distance, which measures the distance of 2 subsets of a metric space (Bai et al., 2011; van Kreveld et al., 2022). Both concepts can potentially be used to detect and build generalized tracks with more accuracy than with present methods.
Figure 4. Groups of individual tracks from Pinus data: a) SMS group; b) SMOcc group. Maps by CF Castillo-García.
It also should be noted that Panbiotracks currently does not automatically separate the ITs that will be used for the IGTs. Because of this, it is strongly advised to first use methods like PAE-PCE (Luna-Vega et al., 1999, 2000) or NDM/NVDM (Goloboff, 2005) to segregate those ITs that are useful for building an IGT. These methods have been used to identify areas of endemism (García-Barros et al., 2002; Santiago-Alvarado et al., 2022), but they can also be used to define sets of species whose ITs are related enough to form an IGT.
The formal definition of a panbiogeographical node indicates that it is present only at the intersection of 2 or more endpoint vertices from 2 or more generalized tracks, that is, those vertices located at the periphery of the MST that only have one edge connecting them to another node (Henderson, 1989; Morrone, 2015). Since Panbiotracks takes into account all the intersections between generalized tracks, it does not quite follow this definition. However, as mentioned before, the generalized nodes can be seen as a set of which the panbiogeographical nodes are a part. As such, it is necessary to develop an improved algorithm that can filter and locate only the desired localities. This also applies for those cases where 2 terminal segments from different IGTs do not overlap. Under certain circumstances, a panbiogeographical node can be said to be present at a given location, but the IGTs might not overlap and, consequently, the software will not consider this area as a node. In Fig. 6, for example, the area towards the northwest of the map, where there are terminal ends of the IGTs, might be considered a node, but the program does not mark it. To solve this, a similar solution to that of the IGTs may be useful: define a buffer and evaluate the degree of overlap not between tracks, but between these buffers.
Figure 5. Groups of individual tracks from Quercus data: a) SMOcc-EVT; b) SMOcc-SMS-EVT. Maps by CF Castillo-García.
Automating track analysis and other methods in biogeography is essential and of utmost importance to the future of this field of knowledge. With the introduction of faster computer systems and programming languages specialized in data manipulation and analysis, like Python and Julia, it is necessary to develop new algorithms and improve existing ones. Moreover, another issue of great importance is to ensure that the software can be updated and improved and not let it become obsolete or dependent on outdated systems and software.
Figure 6. Generalized tracks identified from the ITs: a) IGT from the Pinus SMS group; b) IGT from the Pinus SMOcc group; c) IGT from the Quercus SMOcc-EVT group; d) IGT from the Quercus SMOcc-SMS-EVT group. Maps by CF Castillo-García.
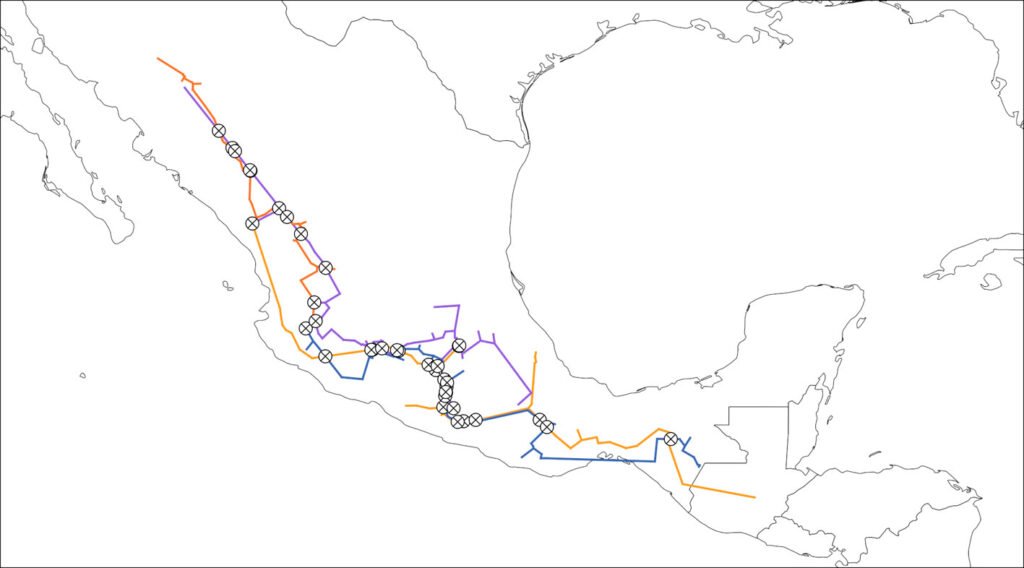
Figure 7. Generalized nodes identified from the intersections from all 4 groups. Map by CF Castillo-García.
Acknowledgments
This paper serves as a fulfillment of CFC-G for obtaining a M.Sc. degree in the Posgrado en Ciencias Biológicas, UNAM. We thank to the Secretaría de Ciencia, Humanidades, Tecnología e Innovación (Secihti) for the support of this research through a graduate scholarship (No. 1178796) to CFC-G. This work was funded by the project IN215321 (DGAPA-PAPIIT).
References
Aguilar-Estrada, L. G., & Morrone, J. J. (2022). Distributional patterns of Vetigastropoda (Mollusca) all over the world: a track analysis. Zoological Journal of the Linnean Society, 196, 442–452. https://doi.org/10.1093/zoolinnean/zlac004
Alt, H., & Godau, M. (1995). Computing the Fréchet distance between two polygonal curves. International Journal of Computational Geometry & Applications, 5, 75–91. https://doi.org/10.1142/S0218195995000064
Aronov, B., Har-Peled, S., Knauer, C., Wang, Y., & Wenk, C. (2006). Fréchet distance for curves, revisited. In Y. Azar, & T. Erlebach (Eds.), Algorithms – ESA 2006 (pp. 52–63). Springer. https://doi.org/10.1007/11841036_8
Bai, Y. B., Yong, J. H., Liu, C. Y., Liu, X. M., & Meng, Y. (2011). Polyline approach for approximating Hausdorff distance between planar free-form curves. Computer-Aided Design, 43, 687–698. https://doi.org/10.1016/j.cad.2011.02.008
Beauchamp, A. J. (1989). Panbiogeography and rails of the genus Gallirallus. New Zealand Journal of Zoology, 16, 763–772. https://doi.org/10.1080/03014223.1989.10422933
Bron, C., & Kerbosch, J. (1973). Algorithm 457: Finding all cliques of an undirected graph. Communications of the ACM, 16, 575–577. https://doi.org/10.1145/362342.362367
Brummelen, G. V. (2013). Heavenly mathematics: the forgotten art of spherical trigonometry. Princeton, NJ: Princeton University Press.
Cavalcanti, M. J. (2009). Croizat: a software package for quantitative analysis in panbiogeography. Biogeografía, 4, 4–6.
Craw, R. (1988). Continuing the synthesis between panbiogeography, phylogenetic systematics and geology as illustrated by empirical studies on the biogeography of New Zealand and the Chatham Islands. Systematic Biology, 37, 291–310. https://doi.org/10.1093/sysbio/37.3.291
Craw, R. (1989). New Zealand biogeography: a panbiogeographic approach. New Zealand Journal of Zoology, 16, 527–547. https://doi.org/10.1080/03014223.1989.10422921
Craw, R., Grehan, J., & Heads, M. (1999). Panbiogeography: tracking the history of life. Oxford, UK: Oxford University Press.
Echeverría-Londoño, S., & Miranda-Esquivel, D. R. (2011). MartiTracks: a geometrical approach for identifying geographical patterns of distribution. Plos One, 6, e18460. https://doi.org/10.1371/journal.pone.0018460
Escalante, T., Noguera-Urbano, E. A., & Corona, W. (2018). Track analysis of the Nearctic region: identifying complex areas with mammals. Journal of Zoological Systematics and Evolutionary Research, 56, 466–477. https://doi.org/
10.1111/jzs.12211
Escalante, T., Noguera-Urbano, E. A., Pimentel, B., & Aguado-Bautista, O. (2017). Methodological issues in modern track analysis. Evolutionary Biology, 44, 284–293. https://doi.org/10.1007/s11692-016-9401-8
Ferrari, A., Barão, K. R., & Simões, F. L. (2013). Quantitative panbiogeography: Was the congruence problem solved? Systematics and Biodiversity, 11, 285–302. https://doi.org/10.1080/14772000.2013.834488
Florentin, J. E., Arana, M. D., & Salas, R. M. (2016). Panbiogeographic analysis of Galianthe subgenus Ebelia (Rubiaceae). Rodriguésia, 67, 437–444. https://doi.org/10.
1590/2175-7860201667214
Gallo, V., Avilla, L. S., Pereira, R. C. L., & Absolon, B. A. (2013). Distributional patterns of herbivore megamammals during the Late Pleistocene of South America. Anais Da Academia Brasileira de Ciências, 85, 533–546. https://doi.org/10.1590/S0001-37652013000200005
García-Barros, E., Gurrea, P., Luciáñez, M. J., Cano, J. M., Munguira, M. L., Moreno, J. C. et al. (2002). Parsimony analysis of endemicity and its application to animal and plant geographical distributions in the Ibero-Balearic region (western Mediterranean). Journal of Biogeography, 29, 109–124. https://doi.org/10.1046/j.1365-2699.2002.00653.x
García-Díaz, R. F., Valdez-Hernández, E. F., Martínez-Cárdenas, L., Díaz-Nájera, F., & Ayvar-Serna, S. (2023). Diversity and distribution of Andean tubers: an agrogeographic analysis. Investigaciones y Estudios – UNA, 14, 59–70. https://doi.org/10.57201/IEUNA2313312
GBIF.org. (2016a). GBIF occurrence download. The Global Biodiversity Information Facility. https://doi.org/10.15468/DL.DGUZHT
GBIF.org. (2016b). GBIF occurrence download. The Global Biodiversity Information Facility. https://doi.org/10.15468/DL.ORDDD1
Goloboff, P. (2005). NDM/VNDM (Versión 2.5). Programs for identification of areas of endemism. Programs and documentation available at: http://www.zmuc.dk/public/phylogeny/endemism
González-Ávila, A., Contreras-Medina, R., Espinosa, D., & Luna-Vega, I. (2017). Track analysis of the order Gomphales (Fungi: Basidiomycota) in Mexico. Phytotaxa, 316, 22. https://doi.org/10.11646/phytotaxa.316.1.2
Graham, R. L., & Hell, P. (1985). On the history of the minimum spanning tree problem. Annals of the History of Computing, 7, 43–57. https://doi.org/10.1109/MAHC.1985.10011
Grehan, J. (2001). Biogeography and evolution of the Galapagos: Integration of the biological and geological evidence. Biological Journal of the Linnean Society, 74, 267–287. https://doi.org/10.1111/j.1095-8312.2001.tb01392.x
Heads, M. (2004). What is a node? Journal of Biogeography, 31, 1883–1891. https://doi.org/10.1111/j.1365-2699.2004.01201.x
Henderson, I. M. (1989). Quantitative panbiogeography: an investigation into concepts and methods. New Zealand Journal of Zoology, 16, 495–510. https://doi.org/10.1080/03014223.1989.10422918
Hernández-Cisneros, A. E., & Vélez-Juarbe, J. (2021). Palaeobiogeography of the North Pacific toothed mysticetes (Cetacea, Aetiocetidae): a key to Oligocene cetacean distributional patterns. Palaeontology, 64, 51–61. https://doi.org/10.1111/pala.12507
Kruskal, J. B. (1956). On the shortest spanning subtree of a graph and the traveling salesman problem. Proceedings of the American Mathematical Society, 7, 48–50. https://community.ams.org/journals/proc/1956-007-01/S0002-9939-1956-0078686-7/S0002-9939-1956-0078686-7.pdf
López, B., Naranjo-García, E., & Mejía, O. (2022). Diversity patterns of Mexican land and freshwater snails: a spatiotemporal approach. Revista Mexicana de Biodiversidad, 93, e933966. https://doi.org/10.22201/ib.20078706e.2022.93.3966
Luna-Vega, I., Alcántara-Ayala, O., Espinosa-Organista, D., & Morrone, J. J. (1999). Historical relationships of the Mexican cloud forests: A preliminary vicariance model applying Parsimony Analysis of Endemicity to vascular plant taxa. Journal of Biogeography, 26, 1299–1305. https://doi.org/10.1046/j.1365-2699.1999.00361.x
Luna-Vega, I., Alcántara-Ayala, O., Morrone, J. J., & Espinosa, D. (2000). Track analysis and conservation priorities in the cloud forests of Hidalgo, Mexico. Diversity and Distributions, 6, 137–143. https://doi.org/10.1046/j.1472-4642.2000.00079.x
Maya-Martínez, A., Schmitter-Soto, J. J., & Pozo, C. (2011). Panbiogeography of the Yucatán Peninsula based on Charaxinae (Lepidoptera: Nymphalidae). Florida Entomologist, 94, 527–533. https://doi.org/10.1653/024.094.0317
Miguel-Talonia, C., & Escalante, T. (2013). Los nodos: el aporte de la panbiogeografía al entendimiento de la biodiversidad. Biogeografía, 6, 30–42.
Morrone, J. J. (2014). Parsimony analysis of endemicity (PAE) revisited. Journal of Biogeography, 41, 842–854. https://
doi.org/10.1111/jbi.12251
Morrone, J. J. (2015). Track analysis beyond panbiogeography. Journal of Biogeography, 42, 413–425. https://doi.org/10.
1111/jbi.12467
Page, R. D. M. (1987). Graphs and generalized tracks: quantifying Croizat’s panbiogeography. Systematic Zoology, 36, 1. https://doi.org/10.2307/2413304
Prim, R. C. (1957). Shortest connection networks and some generalizations. The Bell System Technical Journal, 36, 1389–1401. https://doi.org/10.1002/j.1538-7305.1957.tb01515.x
Puga-Jiménez, A. L., Andrés-Hernández, A. R., Carrillo-Ruiz, H., Espinosa, D., & Rivas-Arancibia, S. P. (2013). Patrones de distribución del género Zanthoxylum L. (Rutaceae) en México. Revista Mexicana de Biodiversidad, 84, 1179–1188. https://doi.org/10.7550/rmb.32047
Rangel, T. F., Diniz-Filho, J. A. F., & Bini, L. M. (2010). SAM: A comprehensive application for Spatial Analysis in Macroecology. Ecography, 33, 46–50. https://doi.org/10.1111/j.1600-0587.2009.06299.x
Rojas-Parra, C. A. (2007). Una herramienta automatizada para realizar análisis panbiogeográficos. Biogeografía, 1, 31–33.
Rosen, B. R. (1988). From fossils to earth history: applied historical biogeography. In A. A. Myers, & P. S. Giller (Eds.), Analytical biogeography: an integrated approach to the study of animal and plant distributions (pp. 437–481). Netherlands: Springer. https://doi.org/10.1007/978-94-009-1199-4_17
Rosenberg, M. S., & Anderson, C. D. (2011). PASSaGE: Pattern Analysis, Spatial Statistics and Geographic Exegesis. Version 2. Methods in Ecology and Evolution, 2, 229–232. https://doi.org/10.1111/j.2041-210X.2010.00081.x
Santiago-Alvarado, M., Luna-Vega, I., Rivas, G., & Espinosa, D. (2022). Effect of cell size and thresholds in NDM/NVDM methods on recognizing areas of endemism. Zootaxa, 5134, 1–33. https://doi.org/10.11646/zootaxa.5134.1.1
Seberg, O. (1986). A critique of the theory and methods of panbiogeography. Systematic Zoology, 35, 369–380. https://doi.org/10.2307/2413388
Sedgewick, R., & Wayne, K. (2011). Algorithms (4th ed). Boston, Massachusetts: Addison-Wesley Professional.
van Kreveld, M., Miltzow, T., Ophelders, T., Sonke, W., & Vermeulen, J. L. (2022). Between shapes, using the Hausdorff distance. Computational Geometry, 100, 101817. https://doi.org/10.1016/j.comgeo.2021.101817
Vavrek, M. J. (2011). Fossil: palaeoecological and palaeogeographical analysis tools. Palaeontologia Electronica, 14, 16.
Vincenty, T. (1975). Direct and inverse solutions of geodesics on the ellipsoid with application of nested equations. Survey Review, 23, 88–93. https://doi.org/10.1179/sre.1975.23.176.88
Waters, J. M., Trewick, S. A., Paterson, A. M., Spencer, H. G., Kennedy, M., Craw, D. et al. (2013). Biogeography off the tracks. Systematic Biology, 62, 494–498. https://doi.org/10.1093/sysbio/syt013
Wormald, N. C. (1984). Generating random regular graphs. Journal of Algorithms, 5, 247–280. https://doi.org/10.1016/
0196-6774(84)90030-0
Zunino, M., & Zullini, A. (2003). Biogeografía: la dimensión espacial de la evolución (Vol. 259). Ciudad de México: Fondo de Cultura Económica.

Notas científicas
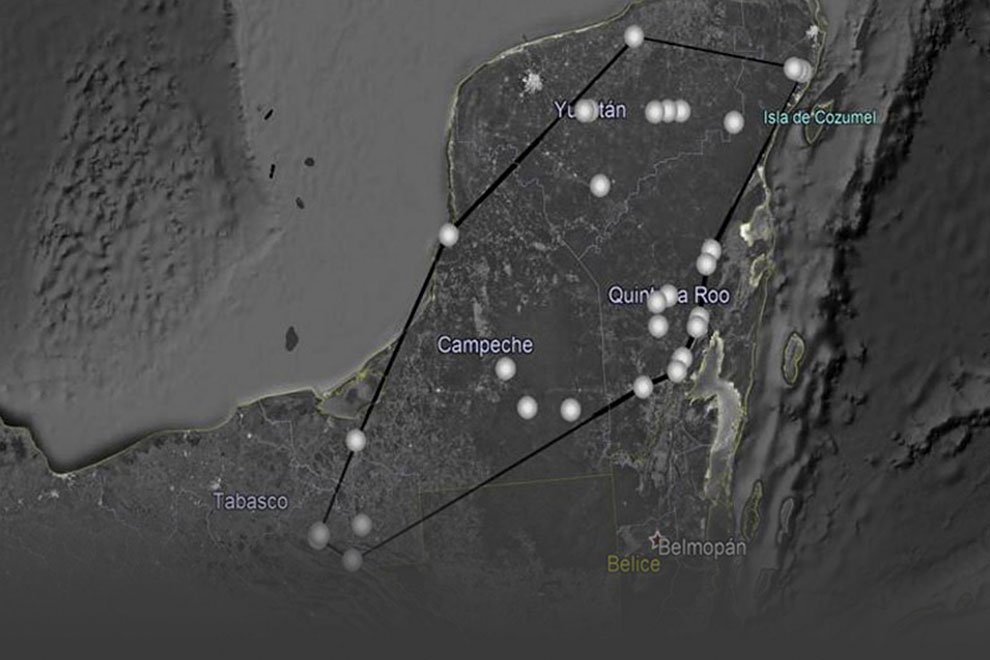

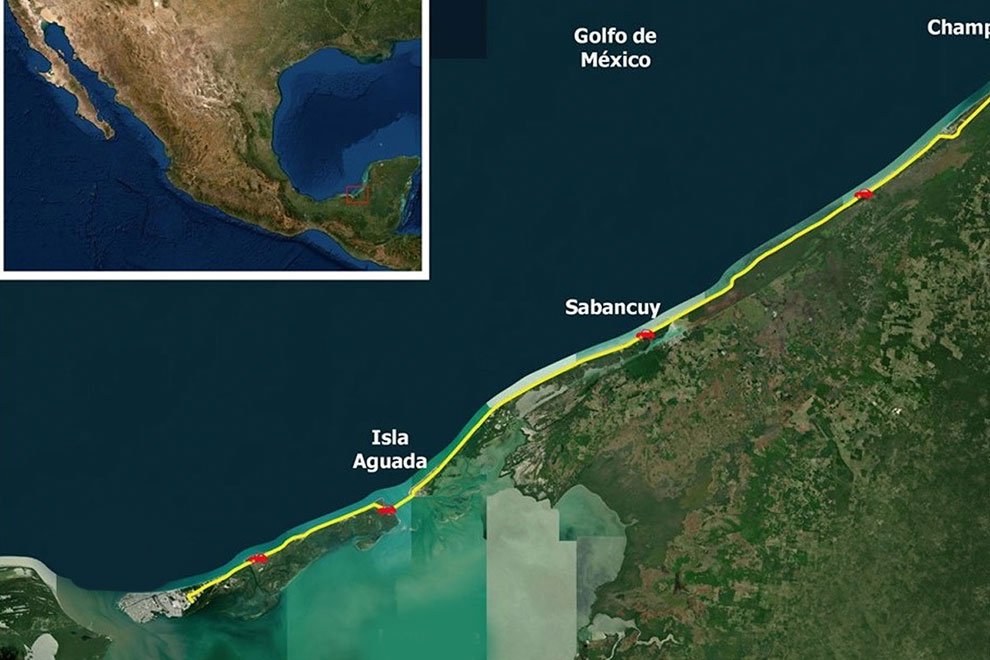


Notas científicas




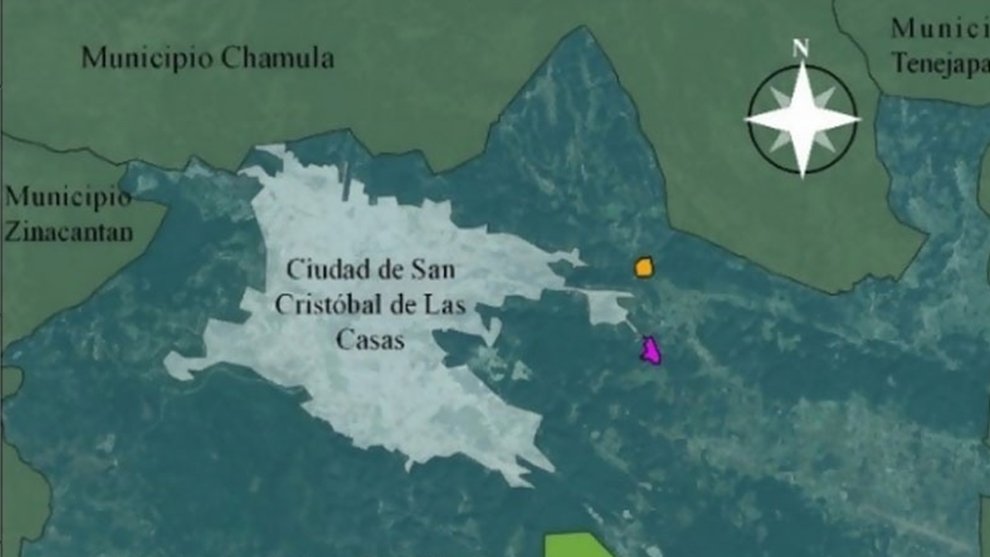


Morfología de racimos, frutos y semillas de Attalea moorei en el Huallaga Central, Perú
Diego Alonso Sinti-Pinedo a, b, E. Hanz Rodríguez-Cabrera a, Ires Paula A. Miranda c, Jenny Rojas-Fox d, Kember Mejía a, Juana Elizabeth Vásquez-Vásquez b y Ángel Martín R. del Castillo a, *
a Instituto de Investigaciones de la Amazonia Peruana – San Martín, Laboratorio de Botánica Aplicada Jean-Christophe Pintaud, Jr. Belén Torres de Tello 135, Morales, 22202 Tarapoto, Perú
b Universidad Peruana Unión, Facultad de Ingeniería y Arquitectura, Escuela de Ingeniería Ambiental, Jr. Los Mártires 340, Morales, 22202 Tarapoto, Perú
c Instituto Nacional de Pesquisas da Amazônia, Av. André Araújo 2936, 69067 Manaos, Amazonas, Brasil
d Universidad Nacional Mayor de San Marcos, Museo de Historia Natural, Av. Gral. Antonio Álvarez de Arenales 1256, Jesús María, 15072 Lima, Perú
*Autor para correspondencia: arodriguez@iiap.gob.pe (Á.M.R. del Castillo)
Recibido: 8 junio 2023; aceptado: 5 marzo, 2024
Resumen
Las especies del género Attalea no cuentan con estudios suficientes sobre variabilidad morfológica en la Amazonía occidental. El objetivo del presente estudio fue describir y determinar la variabilidad morfológica de los racimos, frutos y semillas de Attalea moorei de 3 poblaciones de bosques estacionalmente secos de la cuenca central del río Huallaga, Perú. Se evaluaron 20 características de interés que fueron analizadas y comparadas por medio de las pruebas de Anova y Kruskal-Wallis, se visualizaron gráficamente mediante el análisis de componentes principales y se estimó la asociación de las características a través del análisis de Spearman. De las 20 características, 16 presentaron diferencias significativas. El PCA demostró la alta variación de los caracteres y la variabilidad entre las poblaciones, donde Lamas fue la más diferenciada con racimos y semillas de mayores dimensiones, mientras que las de Pucacaca y San Pedro presentaron frutos de mayor tamaño y peso. Las correlaciones relevantes se dieron entre el número de frutos/peso del racimo (0.857), peso del fruto/longitud del fruto (0.824) y diámetro de semilla/longitud de semilla (0.358), las cuales podrían tener un potencial para la producción de biocombustibles y la extracción de aceites.
Palabras clave: Amazonía occidental; Bosque estacionalmente seco; Caracterización; Shapaja; Variabilidad
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Morphology of racemes, fruits and seeds of Attalea moorei in the Central Huallaga, Peru
Abstract
The species of the genus Attalea do not have sufficient studies on morphological variability in the Western Amazonía. The aim of this study was to describe and determine the morphological variability of racemes, fruits and seeds of Attalea moorei of 3 populations of seasonally dry forests of the central basin of the Huallaga River, Peru. We evaluated 20 characteristics of interest that were analyzed and compared using the ANOVA and Kruskal-Wallis tests; they were graphically visualized by the principal component analysis and the association of characteristics was estimated through Spearman’s analysis. Of the 20 characteristics, 16 showed significant differences. The PCA showed a high variation of characteristics and variability between populations, where Lamas was the most differentiated with racimes and seeds of greater dimensions, while Pucacaca and San Pedro presented fruits of greater size and weight. The most relevant correlations were between the number of fruits/weight of the racime (0.857), weight of the fruit/length of the fruit (0.824) and seed diameter/seed length (0.358), which could have a potential for the production of biofuel and in the extraction of oils.
Keywords: Western Amazon; Seasonally dry forest; Characterization; Shapaja; Variability
Introducción
La familia Arecaceae comprende 2,600 especies en 181 géneros distribuidas en las regiones tropicales y subtropicales. El 90% de las especies están bien adaptadas al bosque húmedo tropical (Baker y Dransfield, 2016; Barfod et al., 2011; Couvreur et al., 2011), y algunos grupos como Attalea, Butia, Coccothrinax, Copernicia, Sabal y Syagrus se han adaptado a ecosistemas con algún nivel de aridez (Cássia-Silva et al., 2019; Salm et al., 2005). En Sudamérica, aproximadamente 130 especies crecen en ambientes caracterizados por un estrés hídrico temporal o permanente (Mejía et al., 2014).
La subtribu Attaleinae es un grupo de palmeras uniformes respecto a sus características vegetativas y considerablemente polimórfica en sus estructuras reproductivas (Higuti et al., 1994). Entre los 8 grupos de esta subtribu, el género Attalea es uno de los más notables en el neotrópico y se distribuye desde las dunas de arena costera, bosques premontanos y montanos, bosques tropicales secos tipo sabana, bosques estacionalmente secos, matorrales costeros tropicales, hasta bosques tropicales muy húmedos (Mejía et al., 2014; Pintaud et al., 2008). Son frecuentes en la vegetación secundaria y los bosques estacionalmente inundados, en pantanos y diversos ecosistemas (Miranda y Rabelo, 2008; Miranda et al., 2003; Moraes y Zenteno-Ruiz, 2017).
El género Attalea cuenta con 56 especies distribuidas en América del Sur, de las cuales 16 se encuentran en la Amazonía occidental (Pintaud, 2008; Del-Castillo et al., 2018). Al igual que el resto de las palmeras, las especies de Attalea poseen gran importancia económica y cultural para las comunidades locales (Albán et al., 2008; Balslev et al., 2008). El aceite de las semillas se utiliza en la producción de cosméticos y medicamentos contra la hepatitis; las hojas de algunas especies son utilizadas en ceremonias religiosas y el techado de las viviendas rurales; ciertos frutos se emplean en la producción de etanol y azúcar, y algunas semillas se usan para la producción de aceite de palma (Anderson et al., 1991; Balslev et al., 2008; Galeano y Bernal, 2010).
La Amazonía peruana viene pasando por un proceso acelerado de cambio en la cobertura de los bosques causado por la expansión agrícola y las actividades extractivistas (Gárate-Quispe et al., 2021; Nicolau et al., 2019). En esta región, Attalea moorei (Glassman) Zona es conocida bajo el nombre de “shapaja” (Del-Castillo et al., 2018; Pintaud et al., 2016), siendo una palmera de hasta 15 m que está adaptada a bosques estacionalmente secos, matorrales secos, bosques secos interandinos, bosques de terraza altas y zonas perturbadas (Ferreira, 2005; Glassman, 1999; Mejía et al., 2014; Del-Castillo et al., 2018).
Las comunidades rurales conservan a la shapaja para dar sombra al ganado en los pastizales; utilizan el tronco como poste de las casas; las hojas también sirven para la construcción de techos y ocasionalmente con fines decorativos, cuando son tiernas se emplean para la confección de diferentes utensilios; la bráctea peduncular se utiliza como batea; los frutos maduros se recolectan para el consumo crudo o asado; las semillas se consumen crudas o cocidas, además de que de ellas se extraen aceites con fines medicinales y para su aplicación en el cabello (Balslev et al., 2008; Paniagua et al., 2014a, b; Paniagua, Bussmann, Vega et al., 2014; como Attalea phalerata Mart. ex Spreng.). Asimismo, las semillas de esta especie presentan altas concentraciones de ácidos grasos saturados (ácido láurico y mirístico), que pueden ser impulsados como una alternativa en los pueblos amazónicos para el aprovechamiento en la industria de aceites con fines medicinales, cosméticos y como biocombustible (Dávila et al., 2011; Miranda, 2014; Sotero et al., 2010).
La caracterización de racimos, frutos y semillas es una herramienta importante que facilita información para detectar la variabilidad entre poblaciones, ayuda a corroborar los rasgos fenotípicos relacionados con los factores ambientales (Gonçalves et al., 2013; Matos et al., 2017; Neto y Ferreira, 2014) y permite establecer planes de conservación y manejo mediante técnicas adecuadas para posteriores cultivos comerciales (Dionisio et al., 2018; Sanjinez-Argandoña y Chuba, 2011). Los datos biométricos de los frutos sirven de bioindicadores y se utilizan para la predicción del rendimiento de la palmera. Se considera que los frutos más grandes poseen capas del pericarpo más gruesas, una mayor cantidad de semillas o semillas más grandes, lo que los hace más adecuados para la explotación como materia prima (Vanderlei et al., 2019).
La finalidad de esta investigación fue describir las características morfológicas de los racimos, frutos y semillas de A. moorei que crecen en los bosques estacionalmente secos de la cuenca central del río Huallaga, en la región San Martín (Perú), y determinar la variabilidad interpoblacional para la selección de características útiles para el aprovechamiento sostenible, aplicar planes de manejo, que en última instancia, puedan contribuir a reducir la deforestación.
Materiales y métodos
La zona de estudio está ubicada en la cuenca central del río Huallaga, en la Amazonía peruana. Las recolecciones se realizaron en las subcuencas que pertenecen a los siguientes distritos: Lamas (6°24’4” S, 76°32’35” O, 689 m snm), que se ubica en las laderas del margen derecho del río Mayo y donde predominan los bosques secos tropicales (300-600 m), bosques húmedos subtropicales (600-1,200 m), y fragmentos de bosques secundarios como consecuencia del abandono de chacras y áreas deforestadas (Schellerup et al., 2001); Pucacaca (6°50’56” S, 76°27’47” O, 356 m snm), que se encuentra sobre bosques estacionalmente secos de la cuenca del río Pucacaca y presenta una cobertura vegetal de bosque de montaña (300-800 m) con pendientes de 25-50%, estando amenazado por el cultivo de maíz amarillo que abastecen a plantas agroindustriales de la zona (RDE N° 004-2019-MINAGRI-SERFOR, 2019); San Pedro de Cumbaza (6°25’25” S, 76°24’2” O, 442 m snm), que se encuentra atravesado por el río Cumbaza y se caracteriza por suelos derivados de material calcáreo relativamente fértiles en bosques secos tropicales, bosques transicionales y bosques húmedos premontanos tropicales, los cuales están siendo reemplazados por hábitats fragmentados y por chacras con fines agrícolas y ganaderos (Goresam y Pehcbm, 2010) (fig. 1). Las localidades fueron elegidas por la presencia de conspicuos rodales de A. moorei denominados “shapajales”, los cuales están atravesando un proceso de cambio de nicho ecológico y se están adaptando al bosque tropical estacionalmente seco (BTES) (Mejía et al., 2014).
La recolección de las infrutescencias se hizo de manera aleatoria por conveniencia, considerando una distancia de 10 m entre los individuos. Se recolectó un racimo por palmera, obteniendo 5 racimos por cada localidad, siendo un total de 15. De cada infrutescencia, se escogieron aleatoriamente 20 frutos y semillas entre la parte basal, medial y apical que estuvieran en buen estado.
Para la evaluación morfológica se seleccionaron 20 características de la guía elaborada para el género Attalea de J.C. Pintaud (com. pers.), relacionados a las estructuras del racimo, fruto y semilla (tabla 1). Para efectuar las mediciones se emplearon una cinta métrica y un vernier digital, y para el peso, se empleó una balanza romana y una balanza electrónica.
Los datos se analizaron a través del uso de estadística descriptiva para obtener la media, la desviación estándar, mínimo y máximo, y el coeficiente de variación. Las 20 características medidas fueron sometidas a pruebas de normalidad de Shapiro-Wilk (racimos: n = 15) (Alcudia-Aguilar et al., 2016) y Kolmogorov-Smirnov (frutos y semillas: n = 300) (Araújo y Lopes, 2012). La homogeneidad de varianza fue analizada mediante la prueba de Levene (da Cunha et al., 2020).
Para comparar la variabilidad de las características entre las poblaciones se empleó la prueba de Anova (Pérez-Vásquez et al., 2015), para datos con distribución normal. En caso contrario, se empleó la prueba de Kruskal-Wallis para datos sin distribución normal (Costa et al., 2009). En los análisis se utilizó un nivel de confianza del 95% (α = 0.05). La variación de las características, la variabilidad de las poblaciones y el comportamiento de los datos fueron proyectados mediante el análisis de componentes principales (PCA) (Aspajo et al., 2008). Finalmente, se empleó el análisis de correlación de Spearman para estimar la relación entre las características (Jiménez-Morera y García, 2020). Los análisis estadísticos fueron realizados a través del programa RStudio ver. 2021.09.0+351 (RStudio Team, 2021).
Resultados
Los racimos evaluados de A. moorei presentan una longitud de bráctea peduncular sin punta de 110-180 cm, espesor de bráctea peduncular 2.07-2.59 cm, longitud de la punta 21-39 cm; el pedúnculo presenta una longitud de 31-104 cm; el raquis tiene una longitud de 48-86 cm; número de raquillas 201-377; peso del racimo 36.94-58.51 kg; número de frutos 223-392 (fig. 2).

Figura 1. Localidades de recolección de las muestras de A. moorei.
Tabla 1
Características evaluadas de los racimos, frutos y semillas de A. moorei (basado en Pintaud, com.pers.).
| Núm. | Órgano | Característica | Abreviatura |
| 1 | Profilo peduncular | Longitud sin la punta apical (cm) | LBr |
| 2 | Espesor (cm) | EBr | |
| 3 | Longitud de la punta (cm) | LPBr | |
| 4 | Pedúnculo | Longitud (cm) | LPe |
| 5 | Raquis | Longitud (cm) | LRaq |
| 6 | Raquillas | Número total (n) | NRaq |
| 7 | Racimo | Pesto total (kg) | PRac |
| 8 | Número de frutos (n) | NFr | |
| 9 | Exocarpo | Espesor (mm) | EEx |
| 10 | Mesocarpo | Espesor (mm) | EMe |
| 11 | Endocarpo | Longitud (cm) | LEn |
| 12 | Diámetro (cm) | DEn | |
| 13 | Espesor de las fibras (mm) | EFEn | |
| 14 | Fruto | Longitud (cm) | LFr |
| 15 | Diámetro (cm) | DFr | |
| 16 | Peso (g) | PFr | |
| 17 | Semilla | Número de semillas por fruto (n) | NSem |
| 18 | Peso medio (g) | PMSem | |
| 29 | Longitud (cm) | LSem | |
| 20 | Diámetro medial (mm) | DSem |

Figura 2. Racimos de A. moorei. Se observa que los frutos se compactan entre sí.

Figura 3. Frutos variables de A. moorei. Los frutos son angulados, pequeños o alargados.
Los frutos son drupas alargadas y anguladas debido a su compactación durante su crecimiento (fig. 3); el espesor del exocarpo es de 1.01-2.10 mm; espesor del mesocarpo 1.41-3.77 mm; longitud del endocarpo 5.52-7.29 cm y diámetro de 2.70-5.1 cm, espesor de las fibras del endocarpo 1.91-2.89 mm; longitud del fruto 7.98-10.98 cm y diámetro de 3.48-4.52 cm, peso del fruto de 79.79-212.28 g; número de semillas por fruto 2-5, longitud de la semilla de 1.02-4.42 cm y diámetro de 3.01-8.27 mm, peso de la semilla 1.06-5.48 g (fig. 4).

Figura 4. Corte transversal de los frutos. Se observa un mesocarpo parenquimatoso seco, un endocarpo duro con pequeños grupos de fibras dispuestas alrededor de las semillas.
La media, la desviación estándar, mínimo y máximo, y el coeficiente de variación de las características evaluadas en los 15 racimos de A. moorei son mostradas en la tabla 2. La mayor variación se observó en Pucacaca para las características de longitud de bráctea peduncular (LBr) (21.64%) y longitud de la bráctea peduncular (LPe) (34.81%). La comparación de medias entre localidades demuestra diferencia significativa (p < 0.05) en el espesor de la bráctea peduncular (EBr), longitud de la punta de la bráctea peduncular (LPBr), longitud del pedúnculo (LPe), número de raquillas (NRaq), peso del racimo (PRac) y número de frutos (NFr).
En la tabla 3 se muestran los valores de la media, la desviación estándar, mínimo y máximo, y el coeficiente de variación de las características evaluadas en 300 frutos de A. moorei. La mayor variación se observó en el espesor del exocarpo (EEx) para Pucacaca (25.39%) y San Pedro (20.42%). La comparación de medias demuestra que todas las características de los frutos presentaron diferencias significativas (p < 0.05).
Tabla 2
Datos comparativos de características evaluadas para 15 racimos de A. moorei.
| Característica | Lamas | Pucacaca | San Pedro | Comparación | ||||||
| x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | ||
| LBr | 153 + 15.15 | 135-172 | 9.90 | 130.6 + 28.26 | 110-180 | 21.64 | 142.4 + 10.33 | 125-151 | 7.26 | 0.187 |
| EBr | 2.46 + 0.15 | 2.23-2.59 | 5.90 | 2.27 + 0.11 | 2.18-2.46 | 4.93 | 2.24 + 0.14 | 2.07-2.45 | 6.14 | 0.043* |
| LPBr | 37.6 + 1.52 | 35-39 | 4.03 | 29.8 + 6.3 | 21-38 | 21.14 | 31.2 + 2.95 | 27-34 | 9.45 | 0.020* |
| LPe | 50.8 + 1.64 | 49-53 | 3.23 | 72.4 + 25.21 | 31-97 | 34.81 | 95.4 + 5.64 | 90-104 | 5.91 | 0.0018** |
| LRaq | 68.4 + 12.42 | 50-82 | 18.16 | 62.4 + 13.54 | 53-86 | 21.7 | 52.2 + 3.49 | 48-57 | 6.69 | 0.077 |
| NRaq | 355 + 13.4 | 342-377 | 3.77 | 257.4 + 53.97 | 210-316 | 20.97 | 291.4 + 24.42 | 259-315 | 8.38 | 0.003** |
| PRac | 55.83 + 2.25 | 53.92-58.51 | 4.04 | 42.90 + 7.86 | 36-94-55.96 | 18.33 | 48.29 + 5.3 | 40.23-54.45 | 10.98 | 0.044* |
| NFr | 372.8 + 15.25 | 357-392 | 4.09 | 256.8 + 45.05 | 223-330 | 17.54 | 312.6 + 25.28 | 279-334 | 8.09 | 0.0002*** |
* = p < 0.05; ** = p < 0.01; *** = p < 0.001.
Tabla 3
Datos comparativos de características evaluadas para 300 frutos de A. moorei.
| Característica | Lamas | Pucacaca | San Pedro | Comparación | ||||||
| x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | ||
| EEx | 1.66 + 0.18 | 1.22-1.98 | 10.67 | 1.23 + 0.31 | 1.04-2.1 | 25.39 | 1.42 + 0.29 | 1.01-1.97 | 20.42 | 2.2 e-16*** |
| EMe | 1.85 + 0.36 | 1.41-2.4 | 19.20 | 2.88 + 0.48 | 1.95-3.76 | 16.79 | 2.96 + 0.48 | 1.95-3.77 | 16.15 | 2.2 e-16*** |
| LEn | 6.35 + 0.27 | 5.52-6.9 | 4.29 | 6.77 + 0.25 | 6.09-7.29 | 3.76 | 6.77 + 0.32 | 6.3-7.2 | 4.70 | 2.2 e-16*** |
| DEn | 3.53 + 0.20 | 2.87-3.95 | 5.79 | 3.32 + 0.31 | 2.7-3.94 | 9.42 | 3.56 + 0.43 | 2.8-5.1 | 11.96 | 2.137 e-6*** |
| EFEn | 2.53 + 0.23 | 1.91-2.89 | 8.92 | 2.35 + 0.22 | 2.02-2.87 | 9.24 | 2.43 + 0.3 | 1.92-2.89 | 12.24 | 3.141 e-6*** |
| LFr | 8.91 + 0.54 | 7.98-10.18 | 6.06 | 9.44 + 0.63 | 8.14-10.98 | 6.7 | 9.49 + 0.68 | 8.16-10.71 | 7.12 | 1.684 e-11*** |
| DFr | 3.89 + 0.21 | 3.48-4.47 | 5.38 | 4.01 + 0.28 | 3.48-4.52 | 6.89 | 4.01 + 0.25 | 3.53-4.5 | 6.32 | 0.001** |
| PFr | 149.79 + 18.71 | 114.12-188.19 | 12.49 | 166.95 + 20.72 | 116.53-212.28 | 12.41 | 154.56 + 29.44 | 79.79-209.26 | 19.04 | 1.181 e-6*** |
** = p < 0.01; *** = p < 0.001.
Tabla 4
Datos comparativos de características evaluadas para 300 semillas de A. moorei.
| Característica | Lamas | Pucacaca | San Pedro | Comparación | ||||||
| x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | x + DS | mín.-máx. | CV (%) | ||
| PMSem | 2.66 + 0.78 | 1.22-4.92 | 29.44 | 2.7 + 0.77 | 1.06 – 5.12 | 28.58 | 2.74 + 0.76 | 1.45-5.48 | 27.93 | 0.886 |
| LSem | 3.53 + 0.51 | 1.02-4.42 | 14.50 | 3.03 + 0.13 | 2.81-3.3 | 4.23 | 3.02 + 0.15 | 2.09-3.39 | 4.81 | 2.2 e-16*** |
| DSem | 6.18 + 0.75 | 3.01-8.08 | 12.13 | 5.42 + 0.86 | 3.07-8.27 | 15.81 | 5.05 + 0.77 | 3.89-6.88 | 15.21 | 2.2 e-16*** |
| NSem | 3.76 + 0.88 | 2-5 | 23.34 | 3.86 + 0.88 | 2-5 | 22.70 | 3.85 + 0.82 | 2-5 | 21.33 | 0.590 |
** = p < 0.01; *** = p < 0.001.
Tabla 5
Varianza y 2 primeros componentes para establecer los vectores de las características de los racimos.
| Característica | PC1 | PC2 |
| LBr | -0.295 | 0.484 |
| EBr | -0.360 | 0.484 |
| LPBr | -0.360 | 0.411 |
| LPe | 0.250 | -0.183 |
| LRaq | -0.308 | -0.195 |
| NRaq | -0.417 | -0.299 |
| PRac | -0.375 | -0.427 |
| NFr | -0.426 | 0.313 |
| % de la varianza | 51.24% | 19.33% |
| % acumulada | 51.24% | 70.57% |
Los valores de la media, la desviación estándar, mínimo y máximo, y el coeficiente de variación de las características evaluadas en 300 semillas de A. moorei se muestran en la tabla 4. La mayor variación se observó en el peso medio de las semillas (PMSem) para Lamas (29.44%) y San Pedro (27.93%). La comparación de medias determinó que la longitud (LSem) y diámetro de la semilla (DSem) presentaron diferencias significativas (p < 0.05).
El PCA de los racimos resumió 70.57% de la varianza (tabla 5). Se observa una alta variación en todas las características, a excepción de la longitud del pedúnculo (LPe). Se encontró que San Pedro y Pucacaca presentaron los valores más bajos por la posición contraria de sus puntos respecto a la dirección de las flechas, siendo esta última la de mayor variación. También se encontró que Lamas presentó los valores más altos en sus características debido a la asociación de sus puntos con las flechas (fig. 5).

Figura 5. Análisis de componentes principales, variación de las características y de las poblaciones según los racimos de A. moorei.
Tabla 6
Varianza y 2 primeros componentes para establecer los vectores de las características de los frutos.
| Característica | PC1 | PC2 |
| EEx | -0.297 | -0.188 |
| EMe | 0.393 | 0.271 |
| LEn | 0.420 | 0.171 |
| DEn | -0.295 | 0.550 |
| EFEn | -0.162 | -0.121 |
| LFr | 0.469 | 0.086 |
| DFr | 0.017 | 0.674 |
| PFr | 0.497 | -0.289 |
| % de la varianza | 32.88% | 18.21% |
| % acumulada | 32.88% | 51.09% |
El PCA de los frutos resumió 51.09% de la varianza (tabla 6). Se observa una alta variación en todas las características, menos en espesor del exocarpo (EEx) y el espesor de las fibras del endocarpo (EFEn). Pucacaca y San Pedro presentaron los valores más altos en las características de diámetro del fruto (DFr), espesor del mesocarpo (EMe), longitud del endocarpo (LEn), longitud del fruto (LFr) y peso del fruto (PFr). Mientras que Lamas presenta los valores más altos para las características del espesor del exocarpo (EEx) y espesor de las fibras del endocarpo (EFE). Asimismo, se observa la variabilidad en las localidades, teniendo a San Pedro como la de mayor variación, y a Lamas como la de menor variación (fig. 6).

Figura 6. Análisis de componentes principales, variación de las características y de las poblaciones según los frutos de A. moorei.
El PCA de las semillas resumió 59.38% de la varianza (tabla 7). Se demostró una alta variación en el diámetro de la semilla (DSem) y la longitud de esta (LSem), siendo Lamas la que presenta los valores más altos para estas características. Asimismo, se observó que existe una variabilidad similar entre las 3 localidades (fig. 7).

Figura 7. Análisis de componentes principales, variación de las características y de las poblaciones según las semillas de A. moorei.
Los valores obtenidos de la correlación de Spearman para los racimos (tabla 8), indicó la asociación directa y significativa entre el espesor de profilo (EBr)/longitud de la bráctea peduncular (LBr) (0.617), longitud de la punta de profilo (LPBr)/longitud de profilo (LBr) (0.638), longitud de la punta de la bráctea peduncular (LPBr)/espesor de la bráctea peduncular (EBr) (0.681), longitud de la punta de la bráctea peduncular (LPBr)/número de raquillas (NRaq) (0.560), longitud de la punta de la bráctea peduncular (LPBr)/número de frutos (NFr) (0.575), peso del racimo (PRac)/número de raquillas (NRaq) (0.720), número de frutos (NFr)/número de raquillas (NRaq) (0.874) y número de frutos (NFr)/peso del racimo (PRac) (0.857).
Los valores obtenidos de la correlación de Spearman para los frutos (tabla 9), mostraron asociaciones significativas directas e inversas. Las relaciones directas más altas se dieron entre el peso del fruto (PFr)/longitud del fruto (LFr) (0.824) y longitud del fruto (LFr)/longitud del endocarpo (LEn) (0.485). Mientras que las relaciones inversas más altas se dieron entre peso del fruto (PFr)/diámetro del endocarpo (Den) (-0.491) y espesor del exocarpo (EEx)/espesor del mesocarpo (EMe) (-0.334).
Tabla 8
Correlación de Spearman para las características de los racimos de A. moorei.
| LBr | EBr | LPBr | LPe | LRaq | NRaq | PRac | NFr | |
| LBr | 1 | |||||||
| EBr | 0.617* | 1 | ||||||
| LPBr | 0.638* | 0.681** | 1 | |||||
| LPe | -0.086 | -0.245 | -0.423 | 1 | ||||
| LRaq | 0.050 | 0.389 | 0.220 | -0.302 | 1 | |||
| NRaq | 0.181 | 0.309 | 0.560* | -0.497 | 0.470 | 1 | ||
| PRac | 0.286 | 0.177 | 0.346 | -0.130 | 0.451 | 0.720** | 1 | |
| NFr | 0.315 | 0.391 | 0.575* | -0.248 | 0.390 | 0.874*** | 0.857*** | 1 |
* = p < 0.05; ** = p < 0.01; *** = p < 0.001
Tabla 9
Correlación de Spearman para las características de los frutos de A. moorei.
| EEx | EMe | LEn | DEn | EFEn | LFr | DFr | PFr | |
| EEx | 1 | |||||||
| EMe | -0.334*** | 1 | ||||||
| LEn | -0.195*** | 0.405*** | 1 | |||||
| DEn | 0.198*** | -0.245*** | -0.168** | 1 | ||||
| EFEn | 0.162** | -0.232*** | -0.108 | 0.065 | 1 | |||
| LFr | -0.182** | 0.270*** | 0.485*** | -0.076 | -0.023 | 1 | ||
| DFr | -0.109 | 0.172** | 0.064 | 0.451*** | -0.050 | 0.130* | 1 | |
| PFr | -0.180** | 0.205*** | 0.390*** | -0.491*** | -0.049 | 0.824*** | -0.092 | 1 |
* = p < 0.05; ** = p < 0.01; *** = p < 0.001
Tabla 10
Correlación de Spearman para las características de las semillas de A. moorei.
| PMSem | LSem | DSem | NSem | |
| PMSem | 1 | |||
| LSem | 0.0007 | 1 | ||
| DSem | 0.029 | 0.358*** | 1 | |
| NSem | -0.013 | -0.017 | -0.045 | 1 |
* = p < 0.05; ** = p < 0.01; *** = p < 0.001
Los valores obtenidos de la correlación de Spearman para las semillas (tabla 10) indicaron una asociación directa significativa dada entre el diámetro de la semilla (DSem)/longitud de la semilla (LSem) (0.358).
Discusión
Las infrutescencias del género Attalea crecen entre las hojas, con pedúnculos que pueden ser cortos o largos y están cubiertos por una bráctea peduncular persistente, leñosa, muy gruesa, surcada y grande, que termina en una punta larga. Los frutos son grandes, mayores de 2.99 cm, de forma elipsoide u ovoide, rematados con una punta prominente, presentan mesocarpo fibroso, el endocarpo es grueso y duro, con una a varias semillas homogéneas, siendo la condición común de 2 o 3 (De Nevers, 1987; Galeano y Bernal, 2010; Glassman, 1999; Henderson, 2020; Henderson et al., 1995; Moraes, 2020). En el estudio, A. moorei incluye muchas de las características mencionadas anteriormente, tales como una bráctea peduncular grande, leñosa, gruesa y surcada. Los frutos son grandes pero angulados, el mesocarpo fibroso, endocarpo duro y grueso con fibras que están agrupadas alrededor de las semillas, como lo indicaron también Pintaud et al. (2016). En tal sentido, el apéndice muestra la comparación de las características descritas de los racimos, frutos y semillas de nuestro estudio con otras especies del género Attalea.
En los racimos de A. moorei, la alta variabilidad se corrobora por la diferencia significativa de 6 características (p < 0.05). Asimismo, en otros estudios de caracterización, los racimos de otras palmeras también muestran diferencias fenotípicas y una alta variabilidad, como se ha encontrado para A. bassleriana (Burret) Zona (Rodríguez-Cabrera et al., 2023), A. huebneri (Burret) Zona (Macedo, 2015), A. maripa (Aubl.) Mart. (Carvalho et al., 2007), Mauritia flexuosa L. f. (Freitas et al., 2011), Phytelephas macrocarpa Ruiz et Pav. (Neto y Ferreira, 2014) y Syagrus sancona H. Karst. (Lima y Ferreira, 2017). Por otro lado, el PCA demuestra que San Pedro y Pucacaca presentan los valores más bajos, siendo esta última población la de mayor variabilidad. Estos valores bajos podrían deberse a que ambos lugares de muestreo se encuentran en predios con bosques mejor conservados y manejados, siendo zonas menos intervenidas en comparación con Lamas que se encuentra sobre un área de mayor fragmentación. Este resultado es similar a la caracterización de racimos de P. macrocarpa, donde los racimos presentan tamaños menores en un fragmento de bosque primario y características homogéneas, y de mayor tamaño cuando provienen de un fragmento de bosque secundario, debido a que no se encuentran en competencia con otras especies de plantas por la exposición a la luz y la absorción de nutrientes (Neto y Ferreira, 2014).
La alta variabilidad de los frutos de A. moorei se confirma por la diferencia de todas sus características, de manera que las distintas procedencias demuestran las disimilitudes fenotípicas de los frutos en relación a la variabilidad genética y los factores ambientales (Botezelli et al., 2000), como en este estudio. Otros trabajos de caracterización de frutos de palmeras como: A. bassleriana (Rodríguez-Cabrera et al., 2023), A. huebneri (Macedo, 2015), A. maripa (Carvalho et al., 2007; Matos et al., 2009, 2017; Zuffo et al., 2016), Astrocaryum aculeatum G. Mey (Dionisio et al., 2018), M. flexuosa (Freitas et al., 2011), Oenocarpus bataua Mart. (Felizardo et al., 2015; González et al., 2014), P. macrocarpa (Neto y Ferreira, 2014) y S. sancona (Lima y Ferreira, 2017), también indican las diferencias y una alta variabilidad en sus características debido a las diferentes procedencias de las muestras. En lo que respecta al PCA, se observa una mayor variabilidad y características de mayor tamaño en los frutos de Pucacaca y San Pedro, lo que demuestra ser todo lo contrario con las características encontradas en los racimos. Esta alta variabilidad también se observa en el tamaño de los frutos de Attalea speciosa Mart., donde Mitja et al. (2008) indican que estas diferencias son rasgos que están relacionado con los individuos que se encuentran en estado silvestre.
Para el caso de las semillas de A. moorei, se verifica la variabilidad por la diferencia de las características relacionadas con la longitud y el diámetro. De igual manera, estudios realizados en la caracterización de semillas de especies como: A. bassleriana (Rodríguez-Cabrera et al., 2023), A. huebneri (Macedo, 2015), A. maripa (Carvalho et al., 2007; Matos et al., 2009; Zuffo et al., 2016), A. aculeatum (Dionisio et al., 2018), O. bataua (Felizardo et al., 2015; González et al., 2014), P. macrocarpa (Neto y Ferreira, 2014), Syagrus oleracea (Mart.) Becc. (Azevedo et al., 2014) y S. sancona (Lima y Ferreira, 2017), demuestran ser variables respecto a las características del tamaño. Por otra parte, en el PCA se observa que las semillas de las 3 localidades poseen una alta variación debido al tamaño de cluster que forman. Esta variación puede estar asociada con los pisos altitudinales, donde Lamas se encuentra por encima de Pucacaca y San Pedro, y las diferentes condiciones climáticas relacionadas a los tipos de bosque y a los tipos de suelos donde crece A. moorei. Mitja et al. (2008) también afirman que la mayor variabilidad de las semillas de A. speciosa está relacionada con los factores climáticos y el tipo de suelo, además se trata de una especie que todavía no se encuentra domesticada (Azevedo et al., 2014), como el caso de A. moorei.
La correlación de caracteres son un soporte para el reconocimiento de parámetros de interés botánico-agronómico que ayudan en la identificación de la variabilidad y la selección indirecta de racimos, frutos y semillas, para estudios de viabilidad económica y para el manejo sostenible de las especies vegetales (Kahn y de Granville, 1992; Moreira et al., 2016). Por eso en esta contribución, las correlaciones de importancia para los racimos se dan entre las características de número de raquillas (NRaq), número de frutos (NFr) y peso del racimo (PRac), lo que nos permitiría relacionar de manera indirecta que, a mayor número de raquillas, habrá mayor número de frutos y mayor peso del racimo. En los frutos, la correlación de importancia se da entre el peso (PFr) y la longitud del fruto (LFr), esto se debe a que los frutos se alargan al compactarse entre sí y esto difiere de las especies de A. bassleriana (Rodríguez-Cabrera et al., 2023), A. huebneri (Macedo, 2015) y A. maripa (Matos et al., 2009; Zuffo et al., 2016), que presentan más libertad para crecer en diámetro. En el caso de las semillas, la correlación de importancia se encuentra entre el diámetro (DSem) y la longitud de la semilla (LSem), que podrían ser indicadores valiosos para la selección indirecta de individuos con semillas de mayor tamaño.
En síntesis, en el presente estudio se describieron las características de los racimos, frutos y semillas de A. moorei en los BTES que fueron comparados con las características de otras especies de Attalea. Se determinó la variabilidad entre las poblaciones por la diferencia de 16 características, donde se reconoció a Lamas como la población que presentó los valores más altos para los racimos y semillas, mientras que Pucacaca y San Pedro presentaron frutos de mayor tamaño y peso. Asimismo, las características que pueden ser útiles para la selección indirecta de estos órganos reproductivos fueron: número de raquillas, número de frutos, peso del racimo, peso y longitud de los frutos, diámetro y longitud de las semillas. Estas características podrían ser potencialmente útiles para el aprovechamiento en la producción de biocombustible y en la extracción de aceites, como se sugieren en otros estudios relacionados con las especies de A. maripa (Matos et al., 2009, 2017; Zuffo et al., 2016) y A. speciosa (Mitja et al., 2008; Vanderlei et al., 2019).
Agradecimientos
A Wildoro Huansi por permitir el ingreso y ejecución de la investigación en el predio ubicado en el distrito de San Pedro de Cumbaza; a Pablo Escudero y la Asociación Bosques del Futuro Ojos de Agua (ABOFOA) por permitir el acceso a la concesión para conservación localizada en el distrito de Pucacaca, y a Wilmer Estela y Agroindustrias Horizonte Verde por permitir el ingreso al fundo Limoncillo, distrito de Lamas. También agradecemos a Ani Cruz, Alejandra Romero y Jer Saavedra, quienes ayudaron en la recolección del material biológico en las localidades de muestreo.
Apéndice. Comparación de las características de racimos, frutos y semillas de A. moorei contra otras especies de Attalea.
| Característica | A. moorei | A. moorei (Moraes, 2020) | A. moorei (Glassman, 1999) | A. phalerata (Glassman, 1999; Miranda et al., 2001) | A. cephalotus Poeppig ex Martius (Henderson, 2020) | A. huebneri (Glassman, 1999; Macedo, 2015) | A. bassleriana (Rodríguez-Cabrera et al., 2023) | A. maripa (Carvalho et al., 2007; Matos et al., 2009, 2017; Passos et al., 2014; Zuffo et al., 2016) |
| Racimos | ||||||||
| LBr + LPBr | 131-219 cm | ~100 cm | ~120 cm | ~89 cm | 125-164 cm | ~206 cm | ~311 cm | ~54-105 cm |
| EBr | 2.07-2.59 cm | 2.0-2.5 cm | 2.0-3 cm | ~50 cm | – | 2.5-4 cm | 0.52-1.25 cm | ~1.2 cm |
| LPe | 31-104 cm | ~50 cm | ~73 cm | ~50 cm | 54 – 100 cm | 120-150 cm | 83.6-189 cm | – |
| LRaq | 48-86 cm | ~40 cm | 33-40 cm | 39 cm | – | 52-56 cm | 74.8-122 cm | – |
| NRaq | 210-377 | numerosas | numerosas | numerosas | 430 | 179-256 | 84-159 | – |
| PRac | 36.94-58.51kg | – | – | – | – | – | 17.21-73.66 kg | 9.12-66.10 kg |
| NFr | 223-392 | – | – | – | – | 267-352 | 100-247 | 754-4571 |
| Disposición de los frutos | alargados y angulados por compactación | angulados por compactación | redondeados o angulados por compactación | – | alargados y angulados por compactación | no compactados | no compactados | – |
| Frutos | ||||||||
| EEx | 1.01-2.1 mm | 1-2 mm | 1-2 mm | ~2 mm | – | 1-3.8 mm | 1.96-7.20 mm | – |
| EMe | 1.41-3.77 mm | 2-4 mm | 2-4 mm | ~2 mm | – | 1-7 mm | 1.22-6.98 mm | – |
| LEn | 5.52-7.29 cm | – | – | – | – | 3.8-8.9 cm | 5.46-8.49 cm | – |
| DEn | 2.7-5.1 cm | – | – | – | – | 2.65-4.3 cm | 3.66-5.91 cm | – |
| EFEn | 1.91-2.89 mm | – | – | – | – | – | 2.33-17.28 mm | – |
| LFr | 7.98-10.98 cm | 8-11 cm | 8.0-10.2 cm | 5-8.4 cm | 6.36-11.06 cm | 7.04-9.56 cm | 7.18-11.95 cm | 2.59-6.8 cm |
| DFr | 3.48-4.52 cm | 3.5-4 cm | 3.5-4.0 cm | 3.0-4.5 cm | 3.01-5.30 cm | 3.3-5.56 cm | 4.24-7.45 cm | 1.47-5.75 cm |
| PFr | 79.79-212.28 g | – | – | – | – | – | 130.41-309.40 g | 4.32-37.66 g |
| Semillas | ||||||||
| PMSem | 1.06-5.48 g | – | – | – | – | – | 0.94-4.27 g | 0.64-21.66 g |
| LSem | 1.02-4.42 cm | 4.5-6 cm | 4.5-6.0 cm | 3.0-3.3 cm | – | 4.38-4.9 cm | 2.26-4.88 cm | 3.64-7.73 cm |
| DSem | 3.01-8.27 mm | 6-8 mm | 6-8 mm | 8-10 mm | – | 7.0-11.5 mm | 8.98-18.57 mm | 16.0-22.6 mm |
| NSem | 2-5 | 3-5 | 3-5 | 2-4 | 1-4 | 1-6 | 1-3 | 1-4 |
Referencias
Albán, J., Millán, B. y Kahn, F. (2008). Situación actual de la investigación etnobotánica sobre palmeras de Perú. Revista Peruana de Biología, 15, 133–142. https://doi.org/10.15381/rpb.v15i3.3344
Alcudia-Aguilar, A., van der Wal, H., Suárez-Sánchez, J., Álvarez-Solis, D. y Tovilla-Hernández, C. (2016). Salinidad, composición botánica y crecimiento de especies frutales en huertos familiares de Tabasco, México. Ecosistemas y Recursos Agropecuarios, 4, 1–12. https://doi.org/10.19136/era.a4n10.691
Anderson, A. B., May, P. H. y Balick, M. J. (1991). The subsidy from nature: palm forests, peasantry, and development on an Amazon frontier. New York: Columbia University Press.
Araújo, F. R. y Lopes, M. A. (2012). Diversity of use and local knowledge of palms (Arecaceae) in eastern Amazonia. Biodiversity and Conservation, 21, 487–501. https://doi.org/
10.1007/s10531-011-0195-9
Aspajo, F., Rodríguez, Á., Corazón-Guivin, M., Freitas, L., Del-Castillo, D., Castro, D. et al. (2008). Caracterización fenotípica de los frutos de Mauritia flexuosa L. f. (Arecaceae) “aguaje”, de nueve comunidades del Datem del Marañón – Región Loreto, Amazonia peruana. Folia Amazónica, 4, 75–82. https://doi.org/10.24841/fa.v17i1-2.270
Azevedo, K. E. X., Cardoso, A. P. M., Pereira, M. D., Pinheiro, P. R. y Severiano, R. L. (2014). Aspectos da biometria de sementes de Syagrus oleracea (Mart.) Becc. (Arecaceae). VIII Simpósio Brasileiro de Pós-Graduaçao em Ciências Florestais. http://dx.doi.org/10.12702/VIII.SimposFloresta.2014.190-630-1
Baker, W. J. y Dransfield, J. (2016). Beyond Genera Palmarum: progress and prospect in palm systematics. Botanical Journal of the Linnean Society, 182, 207–233. https://doi.org/10.1111/boj.12401
Balslev, H., Grandez, C., Paniagua-Zambrana, N. Y., Møller, A. L. y Hansen, S. L. (2008). Palmas (Arecaceae) útiles en los alrededores de Iquitos, Amazonia Peruana. Revista Peruana de Biología, 15, 121–132. https://doi.org/10.15381/rpb.v15i3.3343
Barfod, A. S., Hagen, M. y Borchsenius, F. (2011). Twenty-five years of progress in understanding pollination mechanisms in palms (Arecaceae). Annals of Botany, 108, 1503–1516. https://doi.org/0.1093/aob/mcr192
Botezelli, L., Davide, A. C. y Malavasi, M. M. (2000). Características dos frutos e sementes de quatro procedências de Dipteryx alata Vogel (Baru). CERNE, 6, 9–18.
Carvalho, A. L., Ferreira, E. J. L., Nascimento, J. y Regiani, A. M. (2007). Aspectos da Biometria dos Cachos, Frutos e Sementes da Palmeira Najá (Maximiliana maripa (Aublet) Drude) na Região Leste do Estado do Acre. Revista Brasileira de Biociências, 5, 228–230.
Cássia-Silva, C., Freitas, C. G., Alves, D. M. C. C., Bacon, C. D. y Collevati, R. G. (2019). Niche conservatism drives a global discrepancy in palm species richness between seasonally dry and moist habitats. Global Ecology and Biogeography, 28, 814–825. https://doi.org/10.1111/geb.12895
Costa, J. R., Mitja, D. y Fontes, J. R. A. (2009). Bancos de sementes de plantas daninhas em cultivos de mandioca na Amazônia Central. Planta Daninha, 27, 665–671. https://doi.org/10.1590/s0100-83582009000400004
Couvreur, T. L. P., Forest, F. y Baker, W. J. (2011). Origin and global diversification patterns of tropical rain forests: inferences from a complete genus-level phylogeny of palms. BMC Biology, 9, 1–12. https://doi.org/10.1186/1741-7007-9-44
Dávila, E. J., Merino, C., Mejía, K., García, D. E., Sauvain, M. y Sotero, V. E. (2011). Caracterización química de tres palmeras del género Attalea. Revista de La Sociedad Química del Perú, 77, 218–224.
Dionisio, L. F. S., Smiderle, O. J., Gomes, J. P., Santos, R. L., Leão, F. M. y Bardales-Lozano, R. M. (2018). Caracterización de frutos y semillas de Astrocaryum aculeatum G. Mey. en la Amazonia septentrional, Roraima – Brasil. Revista de Ciências Agrárias, 61, 1–7. http://dx.doi.org/10.22491/rca.2018.2338
Da Cunha, I. R. G., Ribeiro, L. M., Mercadante-Simões, M. O., Pajehú, L. F., Lopes, P. S. N. y Pimenta, M. A. S. (2020). Ontogenesis and responses to shading of Attalea vitrivir (Arecaceae) eophyll. Flora, 272, 1–10. https://doi.org/10.1016/j.flora.2020.151693
De Nevers, G. C. (1987). The genus Attalea (Palmae) in Panama. Annals of the Missouri Botanical Garden, 74, 505–510. https://doi.org/10.2307/2399318
Del-Castillo, Á. M. C., Mejía, K., Rojas-Fox, J., Moraes, R. M., Sánchez-Márquez, M. y Pintaud, J. C. (2018). Diversidad de especies de Attalea (Arecaceae) en el Perú. Tarapoto, Perú: Instituto de Investigaciones de la Amazonia Peruana/ Universidad Mayor de San Andrés/ Institut de Recherche pour le Développement.
Felizardo, S. A., Freitas, A. D. D., Marques, N. de S. y Bezerra, D. A. (2015). Características biométricas de frutos e sementes de Oenocarpus bataua Mart. com procedência de Almeirim, Pará. Revista Verde de Agroecologia e Desenvolvimento Sustentável, 10, 09–15. http://dx.doi.org/10.18378/rvads.v10
i5.3672
Ferreira, E. L. (2005). Manual das palmeiras do Acre, Brasil. Río Branco, Brasil: Instituto Nacional de Pesquisas/ Universidade Federal do Acre.
Freitas, L., Ochoa, M. y Del-Castillo, D. (2011). Variabilidad morfométrica de las estructuras reproductivas del aguaje Mauritia flexuosa L. f. en tres poblaciones naturales de la Amazonía peruana. Folia Amazónica, 20, 101–109. https://doi.org/10.24841/fa.v20i1-2.358
Galeano, G. y Bernal, R. (2010). Palmas de Colombia. Guía de campo. Bogotá, Colombia: Instituto de Ciencias Naturales Nacional, Universidad Nacional de Colombia.
Gárate-Quispe, J. S., Canahuire-Robles, R., Surco-Huacachi, O. y Alarcón-Aguirre, G. (2021). Desarrollo estructural y composición florística arbórea en áreas afectadas por minería aurífera en la Amazonía peruana: a 20 años de su reforestación. Revista Mexicana de Biodiversidad, 92, e923437. https://doi.org/10.22201/ib.20078706e.2021.92.3437
Glassman, S. F. (1999). A Taxonomic treatment of the Palm Subtribe Attaleinae (Tribe Cocoeae). Chicago: University of Illinois Press. https://doi.org/10.5962/bhl.title.49920
Gonçalves, L. G. V., Andrade, F. R., Junior, B. H. M., Schossler, T. R., Lenza, E. y Marimon, B. S. (2013). Biometria de frutos e sementes de mangaba (Hancornia speciosa Gomes) em vegetação natural na região leste de Mato Grosso, Brasil. Revista de Ciências Agrárias, 36, 31–40. https://doi.org/10.19084/rca.16280
González, A., Mejía, K. y Torres, G. (2014). Caracterización morfológica de frutos de Oenocarpus bataua C. Martius “ungurahui”. Folia Amazónica, 23, 191–138. https://doi.org/
10.24841/fa.v23i2.18
Goresam (Gobierno Regional de San Martín) y Pehcbm (Proyecto Especial Huallaga Central y Bajo Mayo). (2010). Propuesta de mesozonificación ecológica económica subcuenca del Cumbaza. Tarapoto: Sistema Nacional de Información Ambiental – Ministerio del Ambiente.
Henderson, A. (2020). A revision of Attalea (Arecaceae, Arecoideae, Cocoseae, Attaleinae). Phytotaxa, 444, 1–76. https://doi.org/10.11646/phytotaxa.444.1.1
Henderson, A., Galeano, G. y Bernal, R. (1995). Field guide to the palms of the Americas. Princeton, NJ: Princeton University Press. https://doi.org/10.2307/j.ctvcszzzd
Higuti, K. O., Graziano, T. T. y Demattê, M. E. S. P. (1994). Morphological characterization of palms (Arecaceae) of Attaleinae Subtribe from the Collection of Experimental Nursery of FCAV-UNESP. Acta Horticulturae, 360, 35–40. https://doi.org/10.17660/ActaHortic.1994.360.4
Jiménez-Morera, I. y García, N. (2020). Phenology, biometrics and fruits production of Attalea nucifera (Arecaceae) in Colombia. Acta Biológica Colombiana, 25, 104–111. https://doi.org/10.15446/abc.v25n1.77701
Kahn, F. y de Granville, J.-J. (1992).Palms and forest management in Amazonia. En F. Kahn y J. J. de Granville (Eds.), Palms in forest ecosystems of Amazonia. (pp. 155–167). https://doi.org/10.1007/978-3-642-76852-1
Lima, P. R. F. y Ferreira, E. J. L. (2017). Biometría de cachos, frutos e sementes e germinacão de jaciarana (Syagrus sancona H. Karsten. Arecaceae). Enciclopédia Biosfera, 14, 267–278. https://doi.org/10.18677/EnciBio_2017A25
Macedo, N. L. (2015). Caracterización morfológica y ecológica de dos poblaciones de Attaleahuebneri, en la cuenca baja del río Ucayali, Loreto – Perú (Tesis). Facultad de Ciencias Forestales. Universidad Nacional de la Amazonia Peruana. Iquitos, Perú.
Matos, A. K., Rosa, L. S., Pires, H. C. G., Cabral, B. S., Vieira, T. A. y Silva, V. M. (2017). Morfotipos de frutos e morfologia de plântulas de Attalea maripa (Aubl.) Mart. Ciência Florestal, 27, 819–829. https://doi.org/10.5902/1980509828632
Matos, A. K., Rosa, L. S., Silva, R., Pires, H., Balieiro, E. y Vieira, T. (2009). Morfometría de Cachos, Frutos e Sementes de Attalea maripa (Aubl.) Mart: uma espécie nativa da Amazônia com potencial para produção de biodiesel.
Revista Brasileira de Agroecología, 4, 1285–1289.
Mejía, K., Pintaud, J. C., Del-Castillo, Á. M. R., Santa Cruz, L., Rojas-Fox, J., Jiménez, V. et al. (2014). Del bosque húmedo al bosque seco: adaptabilidad de las palmeras al cambio climático. En S. Gonzáles, J. J. Vacher y A. Grégoire (Eds.), El Perú frente al cambio climático: resultados de investigaciones franco-peruanas (pp. 101–111). Lima: Institut de Recherche pour le Développement.
Miranda, I. P. de A. 2014. Recursos agroenergéticos a partir de palmeiras nativas para a agricultura familiar na Amazônia brasileira. En M. V. A. Finco y R. Bailis (Eds.), Agroenergia e Stakeholders na Amazônia Legal Brasileira (pp. 107–117) Rio de Janeiro: Publit.
Miranda, I. P. A., Guillaumet, J. L., Barbosa, E. M., Rodrigues, M. R. L. y Silva, M. F. F. (2003). Ecossistemas Florestais em Áreas Manejadas na Amazônia. Manaus, Amazonas, Brazil: INPA/ IRD/ MPEG/ Embrapa/ PPG7.
Miranda, I. P. A. y Rabelo, A. (2008). Guia de identificação das palmeiras de Porto Trombetas (Pará). Manaus, Amazonas, Brazil: MRN/ EDUA/ INPA.
Miranda, I. P. A., Rabelo, A., Bueno, C. R., Barbosa, E. M. y Ribeiro, M. N. S. (2001). Frutos de palmeiras da Amazônia. Manaus: Ministério da Ciência e Tecnologia, Instituto Nacional de Pesquisas da Amazônia.
Mitja, D., Silva-Sousa, J. C., Melo, S. L. y Chaib, H. F. (2008). Biometria dos Frutos e Sementes de babaçu, Natividade-to. IX Simpósio Nacional Cerrado e II Simposio Internacional Savanas Tropicais. 12 al 17 de octubre de 2008. Embrapa, Brasília.
Moraes, R., M. (2020). Flora de palmeras de Bolivia, 2a Ed. Herbario Nacional de Bolivia, Instituto de Ecología, Universidad Mayor de San Andrés, Plural Editores.
Moraes, R., M. y Zenteno-Ruiz, F. S. (2017). El género Attalea (Arecaceae) de Bolivia: afinidades con sistemas ecológicos regionales. Revista Peruana de Biología, 24, 273–282. https://doi.org/10.15381/rpb.v24i3.13913
Moreira, W. K. O., Oliveira, S. S., Reis, J., Paraense, L. R. C., Guimarães, A. T. y da Silva, R. T. L. (2016). Análise de correlação em frutos de pupunha (Bactris gasipaes Kunth). Global Science and Technology, 9, 106–115.
Neto, V. C. D. y Ferreira, E. J. L. (2014). Biometria de cachos, frutos e sementes da palmeira jarina (Phytelephas macrocarpa Ruiz & Pavon) oriundos de fragmentos florestais primários e secundarios do leste do Acre. Enciclopédia Biosfera, 10, 2765–2775.
Nicolau, A., Herndon, K., Flores-Anderson, A. y Griffin, R. (2019). A spatial pattern analysis of forest loss in the Madre de Dios region, Peru. Environmental Research Letters, 14, 124045. https://doi.org/10.1088/1748-9326/ab57c3
Paniagua, N. Y., Bussmann, R. W. y Macía, M. J. (2014a). El bosque sí tiene valor: el uso de palmeras en las comunidades campesinas e indígenas de la región de Inambari, Madre de Dios, Perú. Ethnobotany Research and Applications, 13, 1–81.
Paniagua, N. Y., Bussmann, R. W. y Macía, M. J. (2014b). El conocimiento de nuestros ancestros: los Ese Eja y su uso de palmeras, Madre de Dios, Perú. Ethnobotany Research and Applications, 13, 1–94.
Paniagua, N. Y., Bussmann, R. W., Vega, C., Téllez, C. y Macía, M. J. (2014c). Nuestro conocimiento y uso de las palmeras: una herencia para nuestros hijos. Comunidades Llaquash, San Martín, Perú. Ethnobotany Research and Applications, 13, 1–105.
Passos, M. A. B., Duarte, O. R. y Yuyama, K. (2014). Morphometric Characterization of Attalea maripa (Arecaceae) from Roraima State, Brazil. Journal of Agricultural Science, 6, 115-125. https://doi.org/10.5539/jas.v6n12p115
Pérez-Vásquez, N. S., Arias-Ríos, J. y Quirós-Rodríguez, J.A. (2015). Variación espacio-temporal de plantas vasculares acuáticas en el complejo cenagoso del bajo Sinú, Córdoba, Colombia. Acta Biológica Colombiana, 20, 155–165. https://doi.org/10.15446/abc.v20n3.45380
Pintaud, J. C. (2008). An overview of the taxonomy of Attalea (Arecaceae). Revista Peruana de Biología, 15, 55–63. https://doi.org/10.15381/rpb.v15i3.2968
Pintaud, J. C., Galeano, G., Balslev, H., Bernal, R., Borchsenius, F., Ferreira, E. et al. (2008). Las palmeras de América del Sur: Diversidad, distribución e historia Evolutiva. Revista Peruana de Biología, 15, 5–28. https://doi.org/10.15381/rpb.v15i3.2662
Pintaud, J. C., Del-Castillo, Á. M. R., Ferreira, E. J. L., Moraes, R. M. y Mejía, K. (2016). Towards a Revision of Attalea in Western Amazonia. Palms, 60, 57–77.
RDE (Resolución de Dirección Ejecutiva) N° 004-2019-MINA
GRI-SERFOR. (2019). Ecosistemas que se incorporan a la Lista Sectorial de Ecosistemas Frágiles. Disponible en: https://cdn.www.gob.pe/uploads/document/file/1235545/RDE_N__0004-2019-MINAGRI-SERFOR-DE001A050-120200814-3205787-m1h56f.pdf
Rodríguez-Cabrera, E. H., Moraes R., M., Rojas-Fox, J., Grandez, C., Mejía, K. y del Castillo, Á. M. R. (2023). Morfología y biometría de racimos, frutos y semillas de Attalea bassleriana en Alto Amazonas, Perú. Biota Colombiana, 24, e1107. https://doi.org/10.21068/2539200X.1107
RStudio Team (2021). RStudio: integrated development for R. RStudio, PBC, Boston, MA URL: http://www.rstudio.com/
Salm, R., Jalles-Fliho, E. y Schuck-Paim, C. (2005). A model for the importance of large arborescent palms in the dynamics of seasonally-dry amazonian forests. Biota Neotropica, 5, 151–156. https://doi.org/10.1590/S1676-06032005000300011
Sanjinez-Argandoña, E. J. y Chuba, C. A. M. (2011). Caracterização biométrica, física e química de frutos da palmeira bocaiuva Acrocomia aculeata (Jacq) Lodd. Revista Brasileira de Fruticultura, 33, 1023–1028. https://doi.org/10.1590/s0100-29452011000300040
Schellerup, I., Achútegui, E., Quipuscoa, V., Fjeldsa, J. y Samamé, M. C. (2001). Wayko-Lamas, la gente y la biodiversidad. Cusco:
Centro para la Investigación sobre la Diversidad Cultural y Biológica de los Bosques Pluviales Andinos (DIVA).
Sotero, V., Merino, C., Dávila, E., Mejía, K., Vela, J. y García, D. (2010). Caracterización de la fracción insaponificable y estabilidad del aceite de tres palmeras del género Attalea. Folia Amazónica, 19, 33–40. https://doi.org//10.24841/fa.v19i1-2.341
Vanderlei, R. S., Silva, J. V. y Moura, F. B. P. (2019). Biometry and non-destructive allometric model for estimating babassu (Attalea speciosa) fruit volume and densities. Revista Ouricuri, 9, 1–10. http://doi.org/10.29327/ouricuri.9.2-1
Zuffo, A. M., Gesteira, G. S., Zufo, J. M., Andrade, F. R., Soares, I. O., Zambiazzi, E. V. et al. (2016). Caracterização biométrica de frutos e sementes de mirindiba (Buchenavia tomentosa Eichler) e de inajá (Attalea maripa [Aubl.] Mart.) na região sul do Piauí, Brasil. Revista de Ciências Agrárias, 39, 331–340. https://doi.org/10.19084/rca15152

Altitudinal distribution, diversity, and conservation of pines and oaks in the Monarch Butterfly Biosphere Reserve, Mexico
Altagracia Guerrero-Marmolejo a, c, Diego R. Pérez-Salicrup a, *, Miguel Martínez-Ramos a, M. Isabel Ramírez b
a Universidad Nacional Autónoma de México, Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Antigua Carretera a Pátzcuaro No. 8701, Exhacienda de San José de la Huerta, 58190 Morelia, Michoacán, Mexico
b Universidad Nacional Autónoma de México, Centro de Investigaciones en Geografía Ambiental, Antigua Carretera a Pátzcuaro No. 8701, Ex-Hacienda de San José de la Huerta, 58190 Morelia, Michoacán, Mexico
c Universidad Nacional Autónoma de México, Posgrado en Ciencias Biológicas, Edificio A, 1º piso, Circuito de Posgrados, Ciudad Universitaria, 04510 Ciudad de México, Mexico
*Corresponding author: diego@cieco.unam.mx (D.R. Pérez-Salicrup)
Received: 5 September 2023; accepted: 5 November 2024
Abstract
Pinus and Quercus species face anthropogenic disturbances that affect their structure and distribution. Understanding the distribution patterns of these species is crucial for establishing appropriate management practices to conserve their diversity and the ecosystem services they provide. The aim of this study was to analyze pine and oak species’ distribution, dominance, and diversity patterns along an altitudinal gradient in the Monarch Butterfly Biosphere Reserve. We established 6 elevation transects (2,250 – 3,300 m asl) with 32 points every 150 m. At each site, 25 pine and oak trees located between 0 and 60 m from a central coordinate, with a diameter at breast height ≥ 10 cm, were recorded. Distribution patterns, dominance, and alpha and beta diversity were analyzed. The least abundant species were the most geographically restricted. Pinus pseudostrobus and Quercus laurina were the most dominant species. Alpha diversity was not associated with elevation, nor did it show a defined distribution pattern. Beta diversity was associated with elevation at the highest and lowest elevations, forming an inverted hump. These patterns may be the result of human activities, such as logging and agriculture, which have altered natural patterns of diversity and distribution.
Keywords: Distribution; Dominance; Forest management strategies; Tropical montane forests
© 2025 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Distribución altitudinal, diversidad y conservación de los pinos y los encinos en la Reserva de la Biosfera Mariposa Monarca, México
Resumen
Las especies de Pinus y Quercus son sometidas a actividades antropogénicas que afectan la estructura y distribución de sus poblaciones. Comprender sus patrones de distribución es crucial para establecer prácticas de manejo que permitan conservar su diversidad y los servicios ecosistémicos que proporcionan. Nuestro objetivo fue analizar los patrones de distribución y diversidad de especies de pino y encino a lo largo de un gradiente altitudinal en la Reserva de la Biosfera Mariposa Monarca. Trazamos 6 transectos altitudinales (2,250 – 3,300 m snm), donde establecimos 32 puntos de muestreo cada 150 m. En cada punto registramos 25 pinos y encinos ubicados entre 0 y 60 m de una coordenada central, con diámetros a la altura del pecho ≥ 10 cm. Analizamos los patrones de distribución, dominancia y diversidad alfa y beta. Las especies menos abundantes presentaron distribuciones restringidas. Pinus pseudostrobus y Quercus laurina mostraron alta dominancia. La altitud no influyó en la diversidad alfa. La diversidad beta fue explicada por la altitud en los puntos más altos y bajos, formando una joroba invertida. Estos patrones podrían ser consecuencia de actividades antropogénicas como la extracción forestal y agricultura, las cuales han alterado los patrones de diversidad y distribución natural.
Palabras clave: Distribución; Dominancia; Estrategias manejo forestal; Bosques tropicales montanos
Introduction
Pinus (pine) and Quercus (oak) are 2 of the most ecologically and economically important genera in the mountainous regions of Mexico (Galicia et al., 2018). However, in Mexico, pine-oak forests experience constant anthropogenic activities that reduce and modify their populations (Galicia et al., 2015, 2018; Rzedowski, 2006), even in areas dedicated to conservation, such as natural reserves (Champo-Jiménez et al., 2012). Natural patterns of species distribution and diversity in mountainous areas are determined by environmental factors associated with altitudinal gradients (Callaway et al., 2002; Fontana et al., 2020; Rahbek, 2005; Whittaker, 1967). Therefore, analyzing the distribution patterns and diversity of pine-oak species along altitudinal gradients helps us understand the biotic (e.g., competition and predation) and abiotic (e.g., temperature and moisture) environmental factors associated with the altitudinal gradient that influence the processes that determine these patterns (McCain & Grytnes, 2010). This information is essential for the implementation of management strategies (e.g., restoration, forestry extraction) to ensure the long-term maintenance of these species (Martin et al., 2021; Ohdo & Takahashi, 2020).
In montane forests, where the pines and oaks are distributed, environmental conditions and resource availability vary across altitudinal gradients (Whittaker, 1956; Zhou et al., 2019). Temperature decreases and relative humidity increases at higher elevations (Barry, 2008). Slope orientation also influences these variables, as south-facing slopes receive more solar radiation in the Northern Hemisphere, making them relatively more xeric than north-facing slopes (González-Tagle et al., 2008). These different conditions determine the distribution of tree species and tree diversity across elevational gradients (Brambach et al., 2017; Martin et al., 2021; Toledo-Garibaldi & Williams-Linera, 2014; Whittaker, 1956).
In montane forests, elevation also affects alpha diversity (species richness at the local scale). Two contrasting patterns have been proposed. First, a hump-shaped pattern in which species diversity peaks in the middle parts of the elevation gradient, and second, a monotonic decline in which species diversity decreases with increasing elevation (Rahbek, 2005). In addition, the elevation gradient also influences patterns of beta diversity; these patterns include a change or substitution of species along the elevation gradient, and nesting, in which species are added or lost but not replaced (Baselga & Orme, 2012). In some Mountain environments, dissimilarity increases with elevation gradient, while in others it decreases with elevation (Fontana et al., 2020; Sabatini et al., 2017; Wang et al., 2002). However, alpha and beta diversity patterns along elevation gradients have been little evaluated in tropical montane forests dominated by pine and oak species in central Mexico.
Pine and oak forests are among the most vulnerable environments to the effects of global warming (Galicia et al., 2015). With increasing temperatures, the distribution and diversity of pines and oaks will be affected (Alfaro-Reyna et al., 2019), especially in montane areas. Therefore, it is essential to document the actual distribution patterns of species and their diversity, especially those with high ecological and economic relevance, such as pines and oaks (Galicia & Zarco-Arista, 2014). This information is essential for projecting the potential future distribution of species as global temperatures increase (Villers-Ruiz & Trejo-Vázquez, 1997). These data will also allow us to predict which species will be most vulnerable to such changes. Furthermore, this information is useful for improving management and conservation strategies at the local scale, especially in areas of high conservation importance where forest exploitation also occurs, as in the case of the Monarch Butterfly Biosphere Reserve (MBBR) located in the states of Mexico and Michoacán, Mexico.
The MBBR is an area of extreme importance for the conservation of the winter migration of Danaus plexippus L. (Monarch butterflies) from eastern Canada and the USA to Mexico. Conservation of this phenomenon is linked to the integrity of the tree community, particularly the Abies religiosa (Kunth) Schltdl. & Cham., trees on which these insects perch. The forests of the MBBR are also crucial for conservation due to the high biodiversity they contain, with approximately 694 plant species recorded in the core zone (Cornejo-Tenorio & Ibarra-Manríquez, 2017). Given that this Natural Protected Area has already been created, it should serve to preserve the pine and oak species present in the MBBR, as well as the environmental services they provide to the inhabitants of the region.
Within the MBBR, the highest number of oak species grow at elevations below 3,000 m, mainly in the buffer zone, where most legal and illegal human activities take place (Cornejo-Tenorio & Ibarra-Manríquez, 2017). These activities include logging and land use conversion to agriculture (Champo-Jiménez et al., 2012; Navarrete et al., 2011; Vidal et al., 2014). Recently, avocado plantations have been detected also at lower elevations (Sáenz-Ceja & Pérez-Salicrup, 2021). In the MBBR, most tree studies focus on Abies religiosa (Kunth) Schltdl. & Cham, the monarch butterfly host species, and Pinus pseudostrobus Lindl., the most economically important species in the zone (Gómez-Pineda et al., 2020; Sáenz-Ceja & Pérez-Salicrup, 2020). However, few studies have analyzed the distribution patterns and diversity of the remaining pine and oak species.
The main objective of this study was to document the distribution of pines and oaks in the MBBR along an elevation gradient from 2,250 to 3,300 m. In particular, we evaluated patterns of distribution, dominance, and alpha and beta diversity of pine and oak species. We expected to find alpha diversity patterns associated with elevation and a well-defined species turnover along the elevation gradient, with oaks dominating at lower elevations and pines at higher elevations.
Materials and methods
We conducted this study in the Monarch Butterfly Biosphere Reserve (MBBR), located between Estado de México and Michoacán, Mexico (19°44’27” and 19°18’32” N, 100°22’26” and 100°09’07” W). The MBBR covers 5.63 × 103 ha, divided into 3 core zones (with a total area of 1.36 × 103 ha) and 2 buffer zones (with a total area of 4.27 × 103 ha; Conanp, 2001; Fig. 1). Seventy-seven percent of the MBBR area consists of mountains and hills, while the rest consists of small valleys. Eighty percent of the area belongs to 59 ejidos (a form of communal land ownership) and 13 indigenous communities, while the rest belongs to the federal or state governments (Conanp, 2001).
Elevations in the MBBR range from 2,030 to 3,640 m. Annual precipitation ranges from 800 to 1,500 m, while the mean annual temperature varies from 8 to 22 °C. It is a mountainous system where steep slopes, the altitudinal gradient, and the different slope orientations create microclimatic differences in humidity and precipitation (Carlón-Allende et al., 2015; Conanp, 2001; Giménez-de Azcárate et al., 2003).
Using satellite imagery from Google Earth, we identified the locations where 6 altitudinal transects of continuous forest cover could be established. These transects were located in the larger southern portion of the MBBR (Chincua-Campanario-Cerro Pelón corridor). We omitted Cerro Altamirano, a separate part of the MBBR, because it does not have a wide elevation gradient with continuous forest cover. Three transects were placed on north-facing slopes and 3 on south-facing slopes. Of these 6 transects, 2 were located in the southern area of the reserve, 2 in the central area, and 2 in the northern area, then, 32 circular points were established every 150 m within each transect, covering an elevation range from 2,250 to 3,300 m (Sáenz-Ceja & Pérez-Salicrup, 2019). At lower and higher elevations, the forest cover is very discontinuous, and not all transects reached the maximum or minimum elevation levels; therefore, the number of points in each transect ranges from 5 to 7.
At each point, a standardized sample of 25 trees of the dominant genera in the area (Pinus and Quercus) with diameter at breast height (DBH; 1.3 m) ≥ 10 cm located between 0 and 60 m from the central coordinate was selected. To estimate the area of each circular plot, we used the distance from the central coordinate to the furthest measured tree as the radius of the circle. These distances ranged from 12 to 60 m. In the field, we confirmed that the points were covered by natural pine and oak stands and were not forest plantations or agricultural fields. We identified all tree species in the field, except for some oak individuals for which we collected botanical samples. We then identified them in the laboratory of Ecología y Manejo de Recursos Forestales, UNAM, and with the help of experts in the vegetation of the MBBR.
To evaluate the dominance of pine and oak species along the altitudinal gradient, we used abundance rank-curves, for which we estimated the percentage of proportional abundance of each species (Magurran, 2004). To assess whether altitudinal gradient and slope orientation influence oak and pine density and basal area, we performed second-order Generalized Linear Models (GLMs) with gamma distributions using the MASS package (Venables & Ripley, 2002) in the open-source R software 4.3.2 (R Core Team, 2023).

Figure 1. The dotted grey line represents the most part of the Monarch Butterfly Biosphere Reserve (the Chincua-Campanario-Cerro Pelón block), excluding Cerro Altamirano. Polygons with dashed black lines represent the core zones of the MBBR. Black circular dots indicate the location of sampling points along the altitudinal gradient. Map by M.I. Ramírez.
To conduct diversity analyses, we first ensured that the sampling effort at each point was adequate by estimating sample coverage with upper and lower 95% confidence intervals to validate the alpha diversity comparisons we made (Chao & Jost, 2012: Chao et al., 2020, 2023). With this standardized approach, it is possible to quantify, estimate, and compare richness between communities, even if the sampling points are of different sizes (Chao et al., 2020, 2023; Moreno, et al., 2011). We then estimated alpha diversity at points of elevation and slope orientation as a function of species abundance distribution. We used Hill’s numbers (Hsieh et al., 2016; MacArthur, 1972), which analyze 3 orders of diversity. The first order (q0) estimates species richness or the number of species per unit area; the second order (q1; equivalent to the exponential of Shannon’s diversity index) estimates the number of common species; the third order (q2; equivalent to the inverse of Simpson’s diversity index) counts the number of dominant species. To perform this analysis, we used the iNEXT package (Hsieh et al., 2016). We conducted an analysis to determine if the area of the sampling point influenced the species diversity recorded. We estimated alpha diversity per hectare and determined its correlation with altitudinal gradient and slope orientation. We also analyzed whether the altitudinal gradient explained the order of diversity (q0, q1, q2). For all these analyses, we used second-order generalized linear models (GLMs) with gamma distributions (Venables & Ripley, 2002) in the open-source R software 4.3.2 (R Core Team, 2023). Next, we computed the average dissimilitude, turnover, and nesting of species along the altitudinal gradient to estimate beta diversity using the Jaccard index for every sampling plot. The standardized number of individuals recorded across the elevation gradient allows us to compare sampling sites even if we have different areas. Finally, we evaluated whether the elevation influences the average species turnover and nesting through a first and second-order linear model. We used the open-source R software (version 4.3.2) program to perform all analyses.
Results
Pine and oak species abundance and distribution. We measured 749 individuals on 10.4 ha; 466 individuals belonged to the genus Pinus, 423 individuals (91%) were Pinus pseudostrobus and the rest of the pine species had only 9% of the individuals (Table 1). The remaining 283 individuals belonged to the genus Quercus; 155 were Quercus laurina Bonpl, the rest 128 were from the other 4 species (Table 1). The individuals belonged to 10 species, 5 in each genus. Pinus pseudostrobus and Quercus laurina had the largest distribution ranges, the highest number of individuals, and the largest basal area (Fig. 2a, b). We recorded P. pseudostrubus and Q. laurina at most points along the altitudinal gradient and on the northern and southern slopes. Q. laurina showed the highest density values at 2,850 m. Pinus herrerae Martínez and Pinus leiophylla Schiede ex Schltdl. & Cham showed disjunct ranges, being absent at most elevations of the altitudinal gradient. Similarly, Pinus montezumae Lamb. was recorded at the lowest (2,250) and highest (3,330) elevations, but not at the intermediate elevations (Fig. 2a). Two pine species, P. leiophylla, and P. montezumae, were recorded only on south-facing slopes (Table 1). We did not find clear patterns of pine and oak being associated with a particular elevation range.
No single species was present across the entire elevation gradient, but 4 oak species had few individuals at almost all elevation points (Fig. 3). Pinus pseudostrobus was the dominant species (with the highest mean relative abundance),across most of the altitudinal gradient, except at the extremes, followed by Quercus laurina. The lowest altitudinal points (2,250 m) were dominated by the genus Quercus and the highest (3,300 m) by P. montezumae. Although Pinus dominated along the gradient, we found more oak species than pine species at most elevations (Fig. 3). The density of individuals was not associated with the elevation gradient (F2, 29 = 2.4, p > 0.05), nor with the orientation of the slopes (F1, 30 = 0.29, p > 0.05). Basal area was associated with the altitudinal gradient, showing a lower basal area at the extremes of the altitudinal gradient (2,250 and 3,300 m; F2, 31 = 3.95, p = 0.03).
Alpha diversity. According to the sample coverage analysis, the samples in the plots were equally complete, with values above 90% (Appendix). The species richness per ha did not differ significantly between the northern and southern slopes (F1, 30 = 0.25, p > 0.05). On the other hand, none of the diversity orders analyzed (q0, q1, q2) showed a defined distribution pattern, either hump-shaped or with a monotonic decrease (Fig. 4a, b). Diversity orders q0 (F1, 29 = 0. 46, p > 0.05) and q1 (F1, 29 = 0.16, p > 0.05) were not explained by altitudinal gradient. However, order q2, which focuses on dominant species, was associated with the altitudinal gradient (F1, 29 = 0.56, p = 0.001), showing higher dominance at higher and lower altitudinal points (Fig. 4a). The area of the sampled point did not influence the diversity patterns found (F1, 28 = 0.02, p > 0.05).
Table 1
Number of individuals of each pine and oak species recorded on the north and south slopes of the MBBR.
| Species | Northern slope | Southern slope | Total |
| Pinus pseudostrobus Lindl. | 176 | 247 | 423 |
| Pinus montezumae Lamb. | 0 | 19 | 19 |
| Pinus herrerae Martínez | 11 | 1 | 12 |
| Pinus leiophylla Schiede ex Schltdl. & Cham. | 0 | 5 | 5 |
| Pinus teocote Schied. ex Schltdl. & Cham. | 1 | 6 | 7 |
| Quercus laurina Bonpl. | 70 | 85 | 155 |
| Quercus obtusata Bonpl. | 32 | 13 | 45 |
| Quercus crassifolia Bonpl. | 18 | 14 | 32 |
| Quercus laeta Liebm. | 8 | 23 | 31 |
| Quercus rugosa Née | 12 | 8 | 20 |
| Total | 328 | 421 | 749 |
Beta diversity. Pine and oak species did not show a pattern of increasing or decreasing species turnover across the elevation gradient. The pattern found was more similar to an inverted hump. The average floristic dissimilarity between sites was moderate 0.50 ± 0.27 (x̅ ± SE), and the model showed a quadratic effect of elevation explaining 65% of the residual variance (F5.2 = 7.77, p = 0.02; Fig. 5a). On average, the dissimilarity between sites due to species turnover was 0.32 (se = 0.1), and the elevation gradient explained 62% of this variance (F5.2 = 13, p = 0.01; Fig. 5b). The highest mean values of turnover occurred at the lowest elevation point, 2,250 m (0.56), and at the highest elevation zone, 3,300 m (0.76), with the lowest mean values at the 3,000 m point (0.33). Beta diversity associated with nesting was 0.18 (se = 0.1), and elevation explained 50% of the residual variance (F5.2 = 7.88, p = 0.03; Fig. 5c).

Figure 2. Abundance and distribution of pine and oak species in the MBBR: a, mean density of pine and oak species at different elevation points; b, mean basal area/ha of pine and oak species across the elevation gradient. No error bars are shown for species recorded in only one plot.
Discussion
Distribution patterns and alpha diversity of pines and oaks in the MBBR were not associated with the elevation gradient. The results suggest that the distribution and diversity of most of these species in the study area were not determined by environmental factors related to the elevation gradient (e.g., relative humidity and temperature). In other studies, conducted with pines and oaks in Michoacán and in Oaxaca, Mexico (Martin et al., 2021; Maza-Villalobos et al., 2014), pine and oak species diversity showed a clear pattern of distribution and alpha diversity associated with the altitudinal gradient. We consider that it is necessary to carry out more research in the MBBR to determine if the lack of association between the distribution patterns and diversity of pine and oak species with the environmental factors associated with the altitudinal gradient is related to anthropogenic disturbances (Champo-Jiménez et al., 2012; Navarrete et al., 2011).

Figure 3. Rank-abundance curves based on the percentage of mean relative abundance of pine and oak across the altitudinal gradient in the MBBR, Mexico. P. pse = Pinus pseudostrobus, P. teo = Pinus teocote, P. mon = Pinus montezumae, P. lei = Pinus leiophylla, Q. lau = Quercus laurina, Q. lae = Quercus laeta, Q. obt = Quercus obtusata, Q. rug = Quercus rugosa, Q. cra = Quercus crassifolia.
Pines and oak dominance and distribution. In the MBBR, the most dominant (abundant) species along the altitudinal gradient and between the northern and southern slopes was P. pseudostrobus. It should be taken into account that this species is the most commonly used in reforestation programs (Vicente, 2020), which could also favor its current high dominance. For example, between 2001 and 2012, the MBBR experienced an episode of massive illegal logging that affected approximately 2179 hectares of forest. Through intensive reforestation, a large part of the affected tree cover in the area has been restored (Ramírez et al., 2019; Vidal et al., 2014). These reforestations have used the most economically relevant species in the area and the species where the monarch butterfly roosts A. religiosa and P. pseudostrobus (Conanp, 2001; Vicente, 2020). These biases may have influenced the reduction of populations of less common pine species.
In contrast to P. pseudostrobus, we found that the less abundant pine species (subdominant), P. montezumae, P. herrerae, P. leiophylla, and P. teocote, have restricted distributions with few individuals. These species are widely distributed at the national level (Herrera-Hernández & Escobar, 2021), and large populations of P. herrerae have been recorded in regions surrounding the MBBR (Cornejo-Oviedo et al., 2004). There is also evidence that P. montezuame has very similar distributional niches to P. pseudostrobus in the Neovolcanic system of central Mexico, where the MBBR is located (Manzanilla-Quiñones et al., 2018). However, based on our results, populations of these subdominant less abundant pine species may be at risk of local extinction.

Figure 4. a, Species diversity at different altitudinal positions in the MBBR; b, species diversity at the different points and in the north- and south-facing slopes. q0 corresponds to the total number of species, q1 to the number of common species, and q2 to the number of dominant species. The sampling coverage was acceptable in the 32 points studied.
Although oak species richness was higher than pine species richness, oak species had fewer individuals at most points along the altitudinal gradient. The most dominant oak species was Quercus laurina, which has a wide altitudinal and distributional range in Mexico (Valencia, 2004). This higher diversity of oak species along the altitudinal gradient may be associated with the fact that oak wood is not as commercialized as pine wood in the MBBR and in Mexico (Semarnat, 2018), and in turn, may not be as heavily harvested as species of the genus Pinus. Most oak species in the MBBR, and Mexico, are used for firewood or charcoal, but they have several other non-timber-associated usages, which may promote their conservation (Luna-José et al., 2003).
We did not find an association between the density of individuals and the orientation of the slope, but we found 2 pine species distributed only on south-facing slopes, P. leiophylla and P. montezumae. This slope receives more solar radiation (González-Tagle et al., 2008). Due to the low number of individuals that we recorded for both species, we cannot conclude that both are naturally distributed only on slopes with southern orientation. It could be that their populations have been eliminated from the northern slopes by anthropogenic activities.
Pine and oak alpha diversity. Patterns of alpha diversity were not associated with the altitudinal gradient. We expected to find either one of the most commonly reported patterns, i.e., monotonic decreasing or hump-shaped (McCain & Grytnes, 2010; Rahbek, 2005). Therefore, in the area, variables associated with elevation (e.g., temperature and moisture) do not determine species alpha diversity patterns. Again, past human disturbances may be shaping these tree communities.
According to the list of tree species recorded in Michoacán by Cué-Bär et al. (2006), the MBBR harbors considerable oak species richness, with 12 species reported, representing about one third of the 35 oak species recorded for the entire state of Michoacán. In our study, we recorded only 5 of these 12 oak species. The lack of representation of the remaining 7 oak species could be because we did not sample in Cerro Altamirano, a detached part of the reserve located 27.4 km north of the main part of the reserve. We also did not sample at Cerro Pelón, located to the south of the MBBR, because the vegetation elevation gradient at this last site did not meet the sampling criteria for this study due to the lack of contiguous forest cover. The missing species include Q. candicans, Q. castanea, Q. crassipes, Q. desertícola, Q. glabrescens, Q. greggii, and Q. martinezii. The lack of representation of these oak species in our sample may indicate that they are located within sites with special conditions or that their current densities are very low.

Figure 5. Beta diversity of pines and oaks across the elevation gradient in the MBBR: a, species dissimilarity including species turnover and nesting; b) dissimilarity associated with species turnover only across the elevation gradient; c) dissimilarity associated with species nesting only across the elevation gradient.
Similarly, 7 pine species have been reported in the MBBR (Cornejo-Tenorio & Ibarra-Manríquez 2017; Marlès et al., 2015). Of the 5 pine species we recorded, P. teocote, P. montezumae, and P. herrerae had not been documented in the MBBR in previous studies (Cornejo-Tenorio & Ibarra-Manríquez, 2017). This may be because we sampled in the buffer zone of the reserve, where we recorded P. teocote and P. herrerae, and not only in the core zone where Cornejo-Tenorio & Ibarra-Manríquez (2017) conducted their study. We did not record 2 pine species previously reported in the MBBR, Pinus hartwegii (Cornejo-Tenorio & Ibarra-Manríquez, 2017) and P. devoniana (Marlès et al., 2015). The former species is distributed at elevations above 3000 m and was collected at Cerro Pelón, where we did not sample. The latter is distributed at elevations below 2,400 m, so its abundance may be very low at the elevations included in this study. Nevertheless, half of the pine species recorded in the state of Michoacán (15 spp.; Cué-Bär et al., 2006) have been reported to occur in the MBBR. As we suggested for the oak species not present in our sample, it is possible that these pine species are found in low-density sites of the MBBR under specific microsite conditions. It is important to note that current forest management strategies focus on reforestation and protection of economically important species (e.g., Pinus pseudostrobus), which could affect the distribution of the remaining species.
The richness of pine and oak species in this study was comparable to other studies that have evaluated the distribution and diversity of these genera in mountainous areas of Mexico. For example, we recorded species richness similar to that reported by Zavala et al. (2007) for a temperate forest in the Chiapas highlands of southern Mexico. The authors recorded 6 pine and 6 oak species along an altitudinal gradient of 1,100 m (1,500 to 2,600 m). However, they considered lower elevations than those we analyzed (< 2,250 m). In another study conducted in the Cuitzeo Lake basin in Michoacán, Mexico, closer to the MBBR, Aguilar-Romero et al. (2016) recorded 9 oak species in an altitudinal gradient from 1,768 to 3,428 m. The higher diversity of oaks in the Cuitzeo Lake basin compared to the MBBR could be explained by the fact that the former study covered a larger area (402,600 ha) and a wider altitudinal range than our study, including plots at lower elevations where oaks are dominant. Similarly, in a study conducted in Oaxaca, Mexico by Martin et al. (2021) on a 900 m gradient (2,300-3,200 m) in a managed area of 9,554 ha, the authors recorded 10 oak and 8 pine species. Although the MBBR is subject to constant anthropogenic disturbance, the area still supports a high diversity of pine and oak species.
Pine and oak beta diversity. Although we found that species dissimilarity was associated with the altitudinal gradient, it did not present an increasing or decreasing pattern along the altitudinal gradient as found in other studies (Nanda et al., 2021; Fontana et al., 2020; Sabatini et al., 2017; Wang et al., 2002). The most significant dissimilarity between sites was caused by the different species present at the lowest and highest points of the altitudinal gradient, with less dissimilarity at intermediate elevations, forming an inverted hump. This pattern of dissimilarity may be due to the high dominance of Pinus pseudostrobus and Quercus laurina at intermediate points and their low density at the extremes of the elevational gradient.
According to Socolar et al. (2016), when dissimilarity occurs due to species turnover, diversity can be conserved by maintaining landscape heterogeneity and conserving as much area as possible. In the case of the MBBR, dissimilarity is produced by both species turnover and nesting, so in order to preserve the biodiversity of the area, it is essential to conserve both the most diverse sites and the most distant sites where the greatest floristic turnover occurs.
Considering the conservation importance of the MBBR and the fact that most of the pine and oak species have restricted distributions with few individuals, it is necessary to re-direct the management and conservation strategies applied in the area. MBBR management plans do not consider the distribution and diversity patterns of plant species in the area because there is little information on these patterns. Without adequate planning, activities carried out in the biosphere reserve could affect the diversity and distribution of pine and oak species, resulting in the local extinction of less abundant (subdominant) species.
To protect and maintain the biodiversity found in the MBBR, it is essential that reforestation and management strategies not only focus on tree species that host the monarch butterfly (A. religiosa) or the most economically important pine species, such as P. pseudostrobus. It is also essential to consider sensitive species and other species that are also of high ecological, economic, and cultural importance. In particular, management strategies must assess the vulnerability of populations of subdominant pine and oak species in the area and design their management strategies on this basis. Maintaining the integrity of ecosystems is essential to sustain all the processes and ecosystem services they provide. For example, inventories of species and their abundance must be made to protect those with limited distribution and low densities. Forest plantations with different species are also needed to reduce the pressure of logging in natural forests (Ghazoul et al., 2019). These strategies must focus on sustainable development, seeking to ensure a stable economy and the well-being of the inhabitants of the MBBR, as well as protecting the biodiversity of ecosystems and the ecosystem services they provide.
Furthermore, it is necessary to determine the disturbance regimes occurring in the area, their dynamics, and their influence on the recruitment and regeneration processes of the different pine and oak species. For example, to preserve the natural dynamics of these ecosystems, anthropogenic disturbances should ideally simulate natural disturbances (North & Keeton, 2008). Finally, the lack of a well-defined distribution pattern and the alpha and beta diversity associated with elevation make it difficult to predict how species will respond to altered disturbance regimes in the future due to climate change.
Limitations and suggestions. Our study focused on 2 dominant genera in the vegetation of the MBBR, excluding other species, including A. religiosa. The distribution of that species has been evaluated in other recent studies (see Sáenz-Ceja & Pérez-Salicrup, 2020). The analysis was carried out at a local scale, which makes it difficult to determine whether the distribution and diversity patterns observed are inherent to subtropical montane forests or are exclusive to the MBBR, related to the forest management strategies implemented there. The lack of available information on the distribution patterns of pine and oak in Mexico has made it difficult for us to compare our results with other studies and, therefore, to draw solid conclusions about our findings. We believe it is essential to study the distribution patterns of pine and oak at the local and regional levels in other areas of the country to better understand their distribution in mountainous areas. Likewise, it is imperative to analyze the recruitment patterns of the subdominant species of the MBBR to assess their conservation status in the area.
In the MBBR, the distribution patterns and alpha diversity of pines and oaks did not show a well-defined pattern associated with the altitudinal gradient. These results suggest that variables associated with elevation (e.g., humidity and temperature) do not determine the distribution patterns and alpha diversity of the communities of these genera along the altitudinal gradient in the area. Anthropogenic factors, such as deforestation and inadequate reforestation strategies, must be evaluated in future studies because they are overriding the effect of evolutionary and biogeographic processes on the distribution of these species. In the area, P. pseudostrobus and Q. laurina were the dominant and most abundant species. The remaining pine and oak species showed restricted distributions with poorly defined patterns of species turnover. Activities such as logging, agricultural activities, and poor forest management may also influence the high dominance of P. pseudostrobus and the low density and restricted distribution patterns of the subdominant pine species.
Floristic dissimilarity is mainly due to species turnover, and although it is associated with the elevational gradient, it did not show an increase or decrease pattern as we expected, but rather a pattern in the form of an inverted hump, with more floristic dissimilarity at the extremes of the elevational gradient. The lack of well-defined species shifts along the elevational gradient makes it difficult for future studies to predict how species turnover will occur under the effects of climate change.
Acknowledgments
We are grateful to M.G. Cornejo-Tenorio and J.E. Sáenz-Ceja for their help in identifying the oak and pine species, to M.T. Oropeza-Sánchez for his help with the statistical analyses, to the people from the MBBR ejidos. To R. Ortiz-Mendoza and my colleagues from the Ecology and Forest Resources Laboratory of IIES for their support in the field. We thank Alternare AC for allowing us to use their facilities to carry out the fieldwork. We thank the support of Posgrado en Ciencias Biológicas, UNAM, as this work is part of the AGM doctoral dissertation. We appreciate the financial and logistical support of the Universidad Nacional Autónoma de México (UNAM) Project PAPIIT IN214820 and IN209716, the scholarship of the National Council of Humanities, Sciences and Technologies (Conahcyt), the Complementary Supports Program for Indigenous Women 2018 (Conahcyt).
Appendix. Sampling coverage analysis showed that sampling was equally complete at all points, with values exceeding 90%.

References
Aguilar-Romero, R., García-Oliva, F., Pineda-García, F., Torres, I., Peña-Vega, E., Ghilardi, A. et al. (2016). Patterns of distribution of nine Quercus species along an environmental gradient in a fragmented landscape in central Mexico. Botanical Sciences, 94, 471–482. https://doi.org/10.17129/botsci.620
Alfaro-Reyna, T., Martínez-Vilalta, J., & Retana, J. (2019). Regeneration patterns in Mexican pine-oak forests.
Forest Ecosystems, 6, 50. https://doi.org/10.1186/s40663-019-0209-8
Barry, R. (2008). Mountain weather and climate (3rd Ed.). Boulder, Colorado: Cambridge University Press. https://doi.org/10.1017/CBO9780511754753
Baselga, A., & Orme, C. D. L. (2012). Betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Brambach, F., Leuschner, C., Tjoa, A., & Culmsee, H. (2017). Diversity, endemism, and composition of tropical mountain forest communities in Sulawesi, Indonesia, in relation to elevation and soil properties. Perspectives in Plant Ecology, Evolution and Systematics, 27, 68–79. https://doi.org/10.1016/j.ppees.2017.06.003
Callaway, R. M., Brooker, R. W., Choler, P., Kikvidze, Z., Lortie, C. J., Michalet, R. et al. (2002). Positive interactions among alpine plants increase with stress. Nature, 417, 844–848. https://doi.org/10.1038/nature00812
Carlón-Allende, T., Mendoza, M. E., Villanueva-Díaz, J., & Pérez-Salicrup, D. R. (2016). Análisis espacial del paisaje como base para muestreos dendrocronológicos: El caso de la Reserva de la Biosfera Mariposa Monarca, México. Madera y Bosques, 21, 11–22. https://doi.org/10.21829/myb.2015.212442
Champo-Jiménez, O., Valderrama-Landeros, L., & España-Boquera, M. L. (2012). Pérdida de cobertura forestal en la Reserva de la Biósfera Mariposa Monarca, Michoacán, México (2006-2010). Revista Chapingo Serie Ciencias Forestales y del Ambiente, 18, 143–157. https://doi.org/10.5154/r.rchscfa.2010.09.074
Chao, A., & Jost, L. (2012). Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 93, 2533–2547. https://doi.org/
10.2307/41739612
Chao, A., Kubota, Y., Zelený, D., Chiu, C. H., Li, C. F., Kusumoto, B. et al. (2020). Quantifying sample completeness and comparing diversities among assemblages. Ecological Research, 35, 292–314. https://doi.org/10.1111/1440-1703.12102
Chao, A., Thorn, S., Chiu, C. H., Moyes, F., Hu, K. H., Chazdon, R. L. et al. (2023). Rarefaction and extrapolation with beta diversity under a framework of H ill numbers: the iNEXT. beta3D standardization. Ecological Monographs, 93, e1588. https://doi.org/10.1002/ecm.1588
Conanp (Comisión Nacional de Áreas Naturales Protegidas) (2001). Programa de manejo de la Reserva de la Biosfera Mariposa Monarca. Comisión Nacional de Áreas Naturales Protegidas. Ciudad de México: Conanp.
Cornejo-Oviedo, E., Valencia-Manzo, S., & Flores-López, C. (2004). Índice de sitio para Pinus herrerae Martínez en Cd. Hidalgo, Michoacán. Revista Fitotecnia Mexicana, 27, 77–80. https://doi.org/10.35196/rfm.2004.Especial_1.77
Cornejo-Tenorio, G., & Ibarra-Manríquez, G. (2017). Flora of the core zones of the Monarch Butterfly Biosphere Reserve, Mexico: composition, geographical affinities and beta diversity. Botanical Sciences, 95, 103-129. https://doi.org/10.17129/botsci.803
Cué-Bär, E. M., Villaseñor, J. L., Arredondo-Amezcua, L., Cornejo-Tenorio, G., & Ibarra-Manríquez, G. (2006). La flora arbórea de Michoacán, México. Boletín de La Sociedad Botánica de México, 78, 47–81. https://doi.org/10.17129/botsci.1721
Fontana, V., Guariento, E., Hilpold, A., Niedrist, G., Steinwandter, M., Spitale, D. et al. (2020). Species richness and beta diversity patterns of multiple taxa along an elevational gradient in pastured grasslands in the European Alps. Scientific Reports, 10, 12516. https://doi.org/10.1038/s41598-020-69569-9
Galicia, L., Chávez-Vergara, B. M., Kolb, M., Jasso-Flores, R. I., Rodríguez-Bustos, L. A., Solís, L. E. et al. (2018). Perspectives of the socioecological approach in the preservation, utilization and the payment of environmental services of the temperate forests of Mexico. Madera y Bosques, 24, 1–18. https://doi.org/10.21829/myb.2018.2421443
Galicia, L., Potvin, C., & Messier, C. (2015). Maintaining the high diversity of pine and oak species in mexican temperate forests: A new management approach combining functional zoning and ecosystem adaptability. Canadian Journal of Forest Research, 45, 1358–1368. https://doi.org/10.1139/cjfr-2014-0561
Galicia, L., & Zarco-Arista, A. E. (2014). Multiple ecosystem services, possible trade-offs and synergies in a temperate forest ecosystem in Mexico: A review. International Journal of Biodiversity Science. Ecosystem Services and Management, 10, 275–288. https://doi.org/10.1080/21513732.2014.973907
Ghazoul, J., Bugalho, M., & Keenan, R. (2019). Plantations take economic pressure off natural forests. Nature, 570, 307–308. https://doi.org/10.1038/d41586-019-01878-0
Giménez-de Azcárate, J., Ramírez, M. I., & Pinto, M. (2003). Las comunidades vegetales de la Sierra de Angangueo (estados de Michoacán y México, México): clasificación, composición y distribución. Lazaroa, 24, 87–111. https://doi.org/10.5209/LAZAROA.10053
Gómez-Pineda, E., Sáenz-Romero, C., Ortega-Rodríguez, J. M., Blanco-García, A., Madrigal-Sánchez, X., Lindig-Cisneros, R. et al. (2020). Suitable climatic habitat changes for Mexican conifers along altitudinal gradients under climatic change scenarios. Ecological Applications, 30, e02041. https://doi.org/10.1002/eap.2041
González-Tagle, M. A., Schwendenmann, L., Pérez, J. J., & Schulz, R. (2008). Forest structure and woody plant species composition along a fire chronosequence in mixed pine–oak forest in the Sierra Madre Oriental, Northeast Mexico. Forest Ecology and Management, 256, 161–167. https://doi.org/10.1016/j.foreco.2008.04.021
Herrera-Hernández, R., & Escobar, A. S. (2021). Pinus montezumae Lambert (Pinaceae). In Rodríguez-Trejo, D. A. (Coord.). Semillas de especies forestales (pp. 201–207). División de Ciencias Forestales, Universidad Autónoma Chapingo. Chapingo, Estado de México.
Hsieh, T. C., Ma, K. H., & Chao, A. (2016). iNEXT: An R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7, 1451–1456. https://doi.org/10.1111/2041-210X.12613
Luna-José, A. D., Montalvo-Espinosa, L., & Rendón-Aguilar, B. (2003). Los usos no leñosos de los encinos en México. Boletín de la Sociedad Botánica de México, 72, 107–117. https://doi.org/10.17129/botsci.1671
MacArthur, R. H. (1972). Geographical ecology: patterns in the distribution of species. Princeton NJ: Princeton University Press. https://doi.org/10.2307/1934352
Magurran, A. E. (2004). Measuring biological diversity. Oxford: Blackwell Publishing.
Manzanilla-Quiñones, U., Delgado-Valerio, P., Hernández-Ramos, J., Molina-Sánchez, A., García-Magaña, J. J., & Rocha-Granados, M. D. C. (2018). Similaridad del nicho ecológico de Pinus montezumae y P. pseudostrobus (Pinaceae) en México: implicaciones para la selección de áreas productoras de semillas y de conservación. Acta Botanica Mexicana, 126, e1398. https://doi.org/10.21829/abm126.2019.1398
Marlès, M. J., Valor, I. T., Claramunt, L. B., Pérez-Salicrup, D. R., Maneja, Z. R., Sánchez M. S. et al. (2015). Análisis dendroclimático de Pinus pseudostrobus y Pinus devoniana en los municipios de Áporo y Zitácuaro (Michoacán), Reserva de la Biósfera de la Mariposa Monarca. Investigaciones Geográficas, 2015, 19–32. https://doi.org/10.14350/rig.43338
Martin, M. P., Peters, C. M., Asbjornsen, H., & Ashton, M. S. (2021). Diversity and niche differentiation of a mixed pine-oak forest in the Sierra Norte, Oaxaca, Mexico. Ecosphere, 12, e03475. https://doi.org/10.1002/ecs2.3475
Maza-Villalobos, S., Macedo-Santana, F., Rodríguez-Velázquez, J., Oyama, K., & Martínez-Ramos, M. (2014). Variación de la estructura y composición de comunidades de árboles y arbustos entre tipos de vegetación en la Cuenca de Cuitzeo, Michoacán. Botanical Sciences, 92, 243–258. https://doi.org/10.17129/botsci.104
McCain, C. M., & Grytnes, J. (2010). Elevational Gradients in Species Richness. In Encyclopedia of Life Sciences. Chichester: John Wiley & Sons. https://doi.org/10.1002/97
80470015902.a0022548
Moreno, C. E., Barragán, F., Pineda, E., & Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249–1261. https://doi.org/10.22201/ib.20078706e.2011.4.745
Nanda, S. A., Haq, M., Singh, S. P., Reshi, Z. A., Rawal, R. S., Kumar, D. et al. (2021). Species richness and β-diversity patterns of macrolichens along elevation gradients across the Himalayan Arc. Scientific Reports, 11, 20155. https://doi.org/10.1038/s41598-021-99675-1
Navarrete, J. L., Ramírez, M. I., & Pérez-Salicrup, D. R. (2011). Logging within protected areas: Spatial evaluation of the monarch butterfly biosphere reserve, Mexico. Forest Ecology and Management, 262, 646–654. https://doi.org/10.1016/j.foreco.2011.04.033
North, M. P., & Keeton, W. S. (2008). Emulating natural disturbance regimes: an emerging approach for sustainable forest management. In R. Lafortezza, J. Chen, G. Sanesi, & T. Crow (Eds.), Landscape ecology: sustainable management of forest landscapes (pp. 341–372). The Netherlands: Verlag Press.
Ohdo, T., & Takahashi, K. (2020). Plant species richness and community assembly along gradients of elevation and soil nitrogen availability. AoB Plants, 12, 1–10. https://doi.org/10.1093/AOBPLA/PLAA014
R Core Team (2023). R: A language and environment for statistical computing. Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/
Rahbek, C. (2005). The role of spatial scale and the perception of large-scale species-richness patterns. Ecology Letters, 8, 224–239. https://doi.org/10.1111/j.1461-0248.2004.00701.x
Ramírez, M. I., López-Sánchez, J., & Barrasa, S. (2019). Mapa de vegetación y cubiertas del suelo, 2018. Reserva de la Biosfera Mariposa Monarca. Serie Cartográfica Monarca, Volumen II. Morelia: CIGA-UNAM.
Rzedowski, J., (2006). Vegetación de México. Edición digital. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. https://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMxPort.pdf
Sabatini, F. M., Jiménez-Alfaro, B., Burrascano, S., Lora, A., & Chytrý, M. (2017). Beta-diversity of central european forests decreases along an elevational gradient due to the variation in local community assembly processes. Ecography, 41, 1038–1048. https://doi.org/10.1111/ecog.02809
Sáenz-Ceja, J. E., & Pérez-Salicrup, D. R. (2019). Dendrochronological reconstruction of fire history in coniferous forests in the Monarch Butterfly Biosphere Reserve, Mexico. Fire Ecology, 15, 18. https://doi.org/10.1186/s42408-019-0034-z
Sáenz-Ceja, J. E., & Pérez-Salicrup, D. R. (2020). Modification of fire regimes inferred from the age structure of two conifer species in a Tropical Montane Forest. Forests, 11, 1193. https://doi.org/10.3390/f11111193
Sáenz-Ceja, J. E., & Pérez-Salicrup, D. R. (2021). Avocado cover expansion in the Monarch Butterfly Biosphere Reserve, Central Mexico. Conservation, 1, 299–310. https://doi.org/10.3390/conservation1040023
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2018). Anuario estadístico de la producción forestal 2018. Ciudad de México: Secretaría de Medio Ambiente y Recursos Naturales.
Socolar, J. B., Gilroy, J. J., Kunin, W. E., & Edwards, D. P. (2016). How should beta-diversity inform biodiversity conservation? Trends in Ecology and Evolution, 31, 67–80. https://doi.org/10.1016/j.tree.2015.11.005
Toledo-Garibaldi, M., & Williams-Linera, G. (2014). Tree diversity patterns in successive vegetation types along an elevation gradient in the Mountains of Eastern Mexico. Ecological Research, 29, 1097–1104. https://doi.org/10.1007/s11284-014-1196-4
Valencia, S. (2004). Diversidad del género Quercus (Fagaceae) en México. Botanical Sciences, 75, 33–53. https://doi.org/10.17129/botsci.1692
Venables, W. N., & Ripley, B. D. (2002) Modern applied statistics with S. Fourth edition. New York: Springer.
Vicente, H. J. C. (2020). Monitoreo de restauración activa y pasiva en un sitio perturbado dentro de la zona núcleo de la Reserva de la Biosfera Mariposa Monarca (Tesis de maestría). Posgrado en Ciencias Biológicas. Facultad de Biología. Universidad Michoacána San Nicolás de Hidalgo. Michoacán, México.
Vidal, O., López-García, J., & Rendón-Salinas, E. (2014). Trends in deforestation and forest degradation after a decade of monitoring in the Monarch Butterfly Biosphere Reserve in Mexico. Conservation Biology, 28, 177–186. https://doi.org/10.1111/cobi.12138
Villers-Ruiz, L., & Trejo-Vázquez, I. (1997). Assessment of the vulnerability of forest ecosystems to climate change in Mexico. Climate Research, 9, 87–93. https://doi.org/10.3354/cr009087
Wang, G., Zhou, G., Yang, L., & Li, Z. (2002). Distribution, species diversity and life-form spectra of plant communities along an altitudinal gradient in the northern slopes of Qilianshan Mountains, Gansu, China. Plant Ecology, 165, 169–181. https://doi.org/10.1023/A:1022236115186
Whittaker, R. H. (1956). Vegetation of the Great Smoky Mountains. Ecological Monographs, 26, 1–80. https://doi.org/10.2307/1943577
Whittaker, R. H. (1967). Gradient analysis of vegetation. Biological Reviews, 42, 207–264. https://doi.org/10.1111/j.1469-185X.1967.tb01419.x
Zavala, M. A., Galindo-Jaimes, L., & González-Espinosa, M. (2007). Models of regional and local stand composition and dynamics of pine-oak forests in the central highlands of Chiapas (Mexico): theoretical and management implications. In Biodiversity loss and conservation in fragmented forest landscapes: the forests of montane Mexico and temperate South America (pp. 223–243). Newton Oxford, England, United Kingdom: CAB International https://doi.org/10.1079/9781845932619.0223
Zhou, Y., Ochola, A. C., Njogu, A. W., Boru, B. H., Mwachala, G., Hu, G. et al. (2019). The species richness pattern of vascular plants along a tropical elevational gradient and the test of elevational Rapoport’s rule depend on different life-forms and phytogeographic affinities. Ecology and Evolution, 9, 4495–4503. https://doi.org/10.1002/ece3.5027


